血清HBeAg阳性慢性乙型肝炎患者接受核苷(酸)类似物治疗疗效和检测血清HBV RNA的意义
吕高燕 王春娟
慢性乙型肝炎病毒(HBV)感染仍然是影响全球约2.57亿人的重大健康负担,每年导致大约88.7万人死亡,主要死于肝硬化和肝细胞癌[1]。持续的HBV复制是与HBV相关的肝病的重要危险因素[2]。因而,核苷(酸)类似物联合聚乙二醇干扰素在目前的临床工作中常用于治疗符合治疗指征的慢性乙型肝炎(chronic hepatitis B, CHB)患者[3]。血清中病毒载量在很大程度上代表病情的严重性,HBV DNA是监测当前已被批准的抗病毒治疗策略疗效的最广泛使用的标志物[4]。近年来,血清HBV RNA已被应用于预测聚乙二醇干扰素的治疗效果[5]。血清HBV RNA的早期动态变化为HBeAg阳性CHB患者提供了良好的预测HBeAg血清转阴的能力[6]。目前使用接受核苷(酸)类似物过程中血清HBV RNA变化以及血清HBV RNA用于预测核苷(酸)类似物和聚乙二醇干扰素治疗效果的研究还十分有限。本研究观察使用核苷(酸)类似物的HBeAg阳性CHB患者的疗效,并分析CHB患者在长期接受核苷(酸)类似物治疗过程中血清HBV RNA的变化,找出其相关因素。
资料与方法
一、研究对象
选取2018年3月—2021年1月期间山东省文登整骨医院收治的HBeAg阳性CHB患者58例,其中男性40例,女性18例,年龄20~68岁,平均年龄(29.3±7.4)岁。慢性乙肝诊断标准为:①血清HBsAg检测结果为阳性持续半年或以上;②HBeAg检测结果阳性;③血清HBV DNA检测结果阳性;④ALT反复或持续处于异常水平;⑤肝脏病理学检查有明显炎症。排除标准为:①合并甲型或丙型肝炎病毒感染;②合并酒精性肝炎;③沟通障碍、依从性较差者;④合并HIV感染;⑤肝细胞癌或肝移植史;⑥肝脏存在严重的血管发育畸形;⑦恶病质,例如严重黄疸、腹水、肝性脑病等。此次研究为一项前瞻性研究,经我院伦理审查委员会审查并批准,所有患者均已签署纸质知情同意书。
二、研究方法
整理入组人员临床资料。从标准病历中搜集患者的病史,包括姓名、性别以及年龄等。入组的患者使用核苷(酸)类似物连续治疗24个月。采用Cobas ISE600型全自动生化分析仪(Roche公司,瑞士)检测血生化指标。采用热启动荧光PCR核心试剂盒(Thermo Fisher公司,美国)和7500型实时荧光定量PCR仪(Sysmex公司,日本)定量检测HBV DNA和HBV RNA。采用β-actin作为管家基因,正义链5′-GGGACCTGACTGACTACCTC-3′,反义链5′-TCA-TACTCCTGCTTGCTGAT-3′,产物大小541 bp,由吉玛公司(上海,中国)设计、合成。采用酶联免疫吸附试验(ELISA)试剂盒(Abcam公司,美国,批号ab68610)检测血清HBsAg、HBsAb、HBeAg、HBeAb和HBcAb。快速病毒学应答的定义为:连续9个月血清HBV DNA为阴性。
三、统计学方法
结 果
一、入组患者基线特征
总人数58例,男性40例(69.0%),ALT基线水平为(168.3±134.6)U/L,ALT≥5倍参考值上限患者13例(22.4%),HBV DNA水平8.4(5.1, 10.6),HBsAg基线水平(4.34± 0.5)log10IU/mL,快速病毒学应答率为60.3%。
二、治疗前后临床特征比较
比较可知,治疗后患者总胆红素水平、ALT水平、HBV DNA水平和HBV RNA水平显著低于治疗前患者,血清HBV DNA阴性率和血清HBV RNA阴性率显著高于治疗前患者,差异具有统计学意义(P<0.05,见表1)。
表1 治疗前后临床特征[%, (±s), M(P25, P75)]比较
三、血清ALT和HBV RNA对快速病毒学应答的预测价值
ALT、HBV RNA单独预测快速病毒学应答的AUC分别为0.629、0.831,最佳截断值分别为≥142、≥1.9,灵敏度分别为59.0%、82.0%,特异度分别为72.1%、80.0%,阳性预测值分别为74.8%、86.6%,阴性预测值分别为58.2%、83.0%(见表2、图1)。
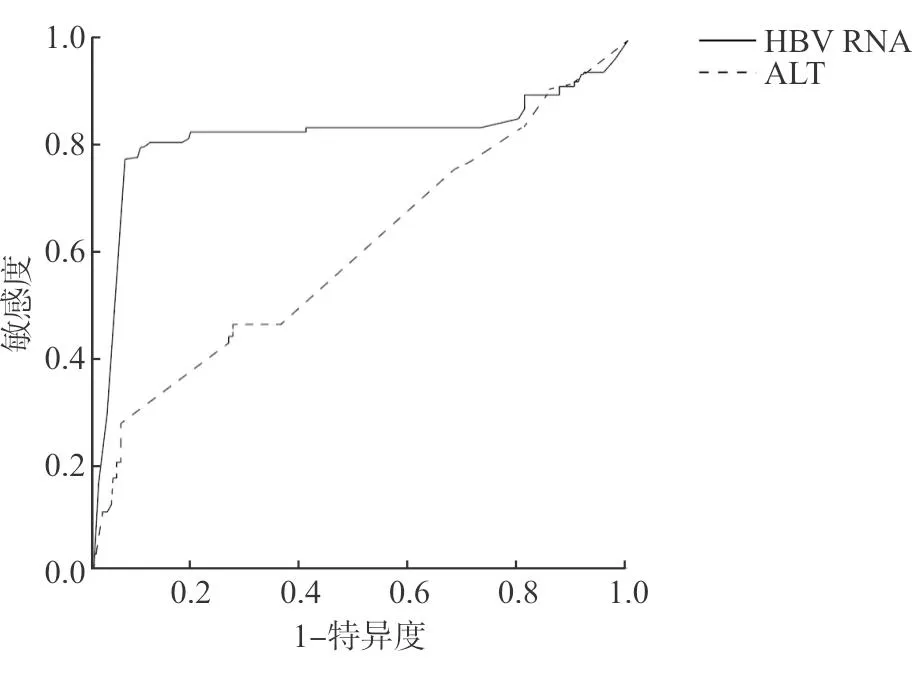
图1 血清ALT、HBV RNA水平预测快速病毒学应答的ROC曲线
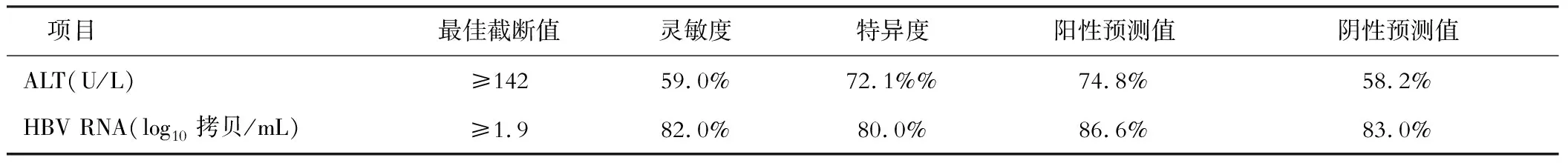
表2 血清ALT和HBV RNA对快速病毒学应答的预测价值
讨 论
血清HBV RNA是一种新兴的生物标志物,对于CHB病情和治疗结果具有很好的监测价值[7]。本研究观察到,血清HBV RNA在核苷(酸)类似物治疗后显著下降,并且对于核苷(酸)类似物的疗效评估具有良好的预测价值,其机制可能与血清HBV DNA下降有很大区别。已有多项研究报道,在CHB患者的长期治疗中,血清HBV RNA水平可持续高于血清HBV DNA水平,并且当血清HBV DNA转阴时,也出现了血清HBV RNA的转阴[8]。本研究中,患者血清HBV RNA阴转率为70.7%,明显低于HBV DNA阴转率的94.8%。这些发现可以用核苷(酸)类似物的抗病毒机制和HBV的生命周期来解释。作为HBV聚合酶的抑制剂,核苷(酸)类似物通过阻断前基因组RNA(pregenome RNA, PgRNA)到松弛的环状DNA的反转录来实现对HBV的抑制。因此,核苷(酸)类似物治疗不能直接影响血清HBV pgRNA水平,而是由于肝内外HBV DNA水平的显著下降而导致血清HBV pgRNA水平的迟缓下降,这些DNA可以循环到cccDNA池中,以维持HBV DNA的复制活性[9]。
核苷(酸)类似物治疗期间血清HBV RNA下降的机制目前尚不完全清楚。有研究指出,血清HBV RNA的下降是双相的,即第一阶段下降较快,而第二阶段下降较慢[10]。这可能意味着这两个阶段血清HBV RNA下降的机制不同。我们的假设是,第一阶段血清HBV RNA的下降很大程度上是由于有效地抑制了HBV DNA。这种作用不仅阻断cccDNA的再循环途径,而且通过对未感染细胞的从头感染而阻止cccDNA的形成,从而直接减少了肝内cccDNA的拷贝数。在第二阶段,血清HBV RNA的缓慢持续的下降可能反映出:①肝内残留的rcDNA进一步减少(可能优先转运回肝细胞核以补充cccDNA池,而不是胞吐到外周血中;②感染肝细胞池的大小缓慢缩小(这可能是由免疫细胞溶解、肝细胞分裂或细胞死亡引起的)[11]。在核苷(酸)类似物治疗期间,在第二阶段能够快速实现血清HBV RNA转阴的患者,HBeAg血清转阴的比例明显更高。这一研究表明,血清HBV RNA的下降可能与抗HBV免疫反应有关[12]。此外,血清中HBV RNA的极低水平可能与cccDNA沉默有关。需要来自基础研究的证据来支持这些假设。在核苷(酸)类似物治疗的两个阶段中,快速病毒学应答是唯一与血清HBV RNA动力学相关的独立因素。在核苷(酸)类似物治疗的第一阶段,实现快速病毒学应答患者的血清HBV RNA下降幅度更大可用核苷(酸)类似物治疗下的HBV生命周期来解释。然而,出乎意料的是,在核苷(酸)类似物治疗的第二阶段,快速病毒学应答也与血清HBV RNA的较大下降独立相关。根据对第二时相血清HBV RNA下降的假说,这种现象可能与抗HBV免疫应答有关。HBeAg血清转阴是抗HBV治疗过程中血清学反应的指标之一[13],反映了宿主对HBV的相对活跃的免疫系统。与另一项研究类似,35例快速病毒学应答患者在核苷(酸)类似物治疗期间HBeAg血清转阴的比例明显更高,这可能解释了快速病毒学应答与血清HBV RNA在第二阶段迅速下降的关系[14]。据报道,抗病毒治疗结束时,血清HBV RNA与治疗后的临床复发显著相关。因此,血清HBV RNA转阴可能是一个新的和有价值的治疗终点[15]。
我们的研究有两个主要优势。首先,我们确定了在核苷(酸)类似物治疗过程中与血清HBV RNA变化相关的宿主和病毒因素,这可能为临床上对CHB患者的治疗提供确切的证据。其次,前瞻性的、特征良好的队列和全面的数据收集增加了我们结果的可靠性。尽管如此,我们的研究也有一些局限性。首先,由于目前还没有HBV RNA定量的国际标准,比较不同的引物或不同的研究小组对血清HBV RNA的定量水平是不合适的。其次,本研究的患者为HBeAg阳性,因此本研究结论不适用于HBeAg阴性患者。
综上所述,核苷(酸)类似物对于血清HBeAg阳性CHB患者具有良好的疗效,血清HBV RNA是快速病毒学应答的良好预测指标。
利益冲突声明:所有作者均声明不存在利益冲突。

