7 个匍匐翦股颖抗褐斑病的初步比较及生理响应
张雅晰,孙建苗,王逍冬,董康挺,刘 畅,王丽宏,李会彬,孙鑫博
(1.河北农业大学 农学院/河北省作物生长调控重点实验室,河北 保定 071000;2.河北农业大学 植物保护学院/华北作物改良与调控国家重点实验室,河北 保定 071000)
草坪草是世界范围内重要的农业和经济作物品种,被广泛应用于建筑、园林绿化、运动场和休闲场地的草坪。草坪可以减少土壤侵蚀,吸附灰尘、净化空气,调节温度,为人们提供更安全的运动场和更舒适的生活环境。匍匐翦股颖(Agrostis stoloniferaL.)是禾本科的多年生草坪草,是一种重要的优质冷季型草坪。它颜色浓绿,叶片细腻,绿期长,可耐低修剪,形成的草坪景观优美,常应用于高尔夫球场和园林绿化中的高质量草坪[1]。
草坪病害严重影响了草坪的生产和管理,降低草坪的经济价值和观赏效果。目前,主要是利用化学杀菌剂等手段来防治和减轻草坪病害[2],而化学杀菌剂的长期使用会带来很多问题,例如可能会产生新的有抗药性的病菌菌株,生态环境受到污染等。因此,抗病新品种的筛选和选育已成为病害防治的重要方向。
褐斑病是分布最广的草坪病害之一,几乎所有的草坪草品种都会受到侵害[3]。它是由立枯丝核菌(Rhizoctonia solani)引起的一种土传性真菌病害。特别是在夏季时,对冷季型草特别是匍匐翦股颖等危害最为严重,不仅会损伤草坪,而且会引起植株短时间大量死亡,造成经济损失。发病初期叶片叶鞘上有褐色的病斑,后期叶片腐烂。发病时草坪上会出现蛙眼状的病斑。
本试验选用草坪建植中常用的7 种匍匐翦股颖品种作为试验材料,在褐斑病菌侵染处理下,研究其生理响应情况,综合进行抗病性比较,为后续匍匐翦股颖抗病机制的研究以及抗病新品种的培育奠定基础。
1 材料和方法
1.1 试验材料
供试的7 个品种匍匐翦股颖品种为:‘A4’(Penn-A4)‘A-1’(PennA-1)‘007’‘光芒’(Guangmang)‘宣言’(Xuanyan)‘朝阳’(Sun Rise)‘佳美’(Jiamei)。草种均购于布莱特草业公司。使用的病原菌褐斑病立枯丝核菌(Rhizoctonia solani),购自中国科学院菌种保存中心。
1.2 试验方法
1.2.1 植物材料 将供试种子用无菌水冲洗浸泡,使用2%的次氯酸钠浸泡消毒20 min 后无菌水冲洗数次,通风处自然阴干。
将营养土、蛭石按体积比1∶3 混合,在高压灭菌锅中灭菌,冷却浇水后装入直径为10 cm,高度为 8 cm 的花盆中。将不同品种的匍匐翦股颖种子分别均匀撒播在花盆中,放置于光照16 h/d、23 ℃,黑暗8 h/d、20 ℃恒温培养室培养。定期浇水、施肥、修剪,用于后续试验。
1.2.2 接菌物制备 在PDA 培养基平板上接入立枯丝核菌,封口膜密封后,倒置于光照 14 h/d、28 ℃,黑暗10 h/d、25 ℃的恒温培养箱中,培养 5~7 d。接菌物的制备参考Perl-Treves[4]的接种方法,略有改动:取500 g 麦粒,加水煮至麦粒开裂没有硬芯,晾干水分后分装于250 mL 锥形瓶中,不超过瓶体积的1/2,盖封口膜后隔夜灭菌3 次,冷却后取立枯丝核菌 PDA 生长物,接入麦粒锥形瓶中,放在恒温培养箱中培养。经常摇晃瓶身使菌丝均匀生长侵入麦粒至麦粒长满菌丝时,将麦粒在托盘中在通风处自然阴干后打碎成粉末,保存于 4 ℃ 冰箱备用。
1.2.3 植株接菌 在每个花盆中接种0.3 g接菌物,给植物叶片均匀湿润后,在叶片上均匀撒病原菌谷物粉末,套袋保湿,将花盆放置在盛有4 cm 水的托盘中,光照14 h/d、30 ℃,黑暗10 h/d、25 ℃培养室培养。
1.3 测定指标与方法
试验设计及病情情况统计参考Man Zhou 等[5]的研究,采用霍斯福尔/巴雷特量表[6]对病害的严重程度进行统计。
根据预试验情况并参考陈海波[7]的研究,在0、3、9 和14 d 进行取样,每个指标取3 个重复。用液氮冷冻锡纸包裹的样品,后放于-80 ℃冰箱保存,后续进行生理指标的测定。生理指标测定参考表1的方法。

表1 植物生理指标测定方法[8]Table 1 Methods for determination of plant physiological indexes
1.4 数据处理
使用Microsoft Excel 2010 进行数据整理及图表绘制。使用SPSS 17.0 软件进行数据分析,采用单因素方差分析的方法,并利用多重比较对差异显著性进行分析。
采用主成分分析的方法进行抗病性综合评价,使用隶属函数值法将原始数据进行标准化处理,将标准化的数据进行主成分分析,综合反映7 种匍匐翦股颖的抗病特性。
2 结果与分析
2.1 病情评价
参考Man Zhou[5]等的研究,进行接菌和病情评价。采用霍斯福尔/巴雷特量表对感染叶片14 d时的病变程度进行估测统计,对病斑的发展进行评分。如图1 所示,在14 d 时‘A4’和‘佳美’的病斑呈现褐色,病变范围和程度明显大于其他品种,病叶也较多。‘A-1’‘宣言’和‘007’病斑较小,周围叶片病叶较多,呈现浅褐色。‘朝阳’和‘光芒’病变程度显著小于其他品种,叶片呈现枯黄状态。

图1 7 种匍匐翦股颖对立枯丝核菌的响应Fig.1 Response of 7 species of Agrostis stolonifera to rhizoctonia cumulus
2.2 不同品种匍匐翦股颖在病原菌胁迫下叶绿素含量变化
不同匍匐翦股颖在病原菌胁迫下叶绿素含量的差异如图2 所示。

图2 病原菌胁迫下匍匐翦股颖叶绿素含量Fig.2 Chlorophyll content of Agrostis stolonifera under pathogen stress
从整体来看,随着接菌天数增加,7 个品种匍匐翦股颖的叶绿素含量总体呈现下降趋势。其中在侵染3 d 时,‘A-1’‘007’和‘光芒’的叶绿素含量较接菌前有所上升,可能是由于叶片受到病原菌菌丝的入侵,失水较快从而导致叶绿素含量上升。其中‘007’在3 d 与0 d 时叶绿素含量差异显著(P<0.05),而‘A-1’和‘光芒’的叶绿素含量差异不显著(P>0.05)。其余4 个品种‘A4’‘宣言’‘佳美’和‘朝阳’均呈现下降趋势且差异显著(P<0.05),降幅依次为45.46%、51.51%、57.23%、51.32%。
2.3 不同品种匍匐翦股颖在病原菌胁迫下丙二醛含量变化
丙二醛 (Malondialdehyde, MDA)含量的高低表现出细胞膜质过氧化程度,可以间接反映草坪草在胁迫中受伤害程度[8]。丙二醛含量的变化如图3 所示,从总体来看,7 个品种匍匐翦股颖的MDA 含量随侵染时间的增加而逐渐升高。在侵染的9 d 时,‘A4’‘007’‘朝阳’和‘光芒’叶片中的MDA含量达到峰值,且有显著差异(P<0.05),与0 d时相比,升幅分别为40.71%、61.76%、78.01%、74.97%。之后含量下降,其中‘朝阳’的下降幅度较小,且与9 d 时差异不显著(P>0.05)。而‘A-1’‘宣言’和‘佳美’在14 d 时达到峰值,增幅分别为73.33%、35.78%、29.30%且差异显著(P<0.05)。其中‘朝阳’的增幅最大,受到了较强的氧化胁迫,细胞损伤也较为严重。
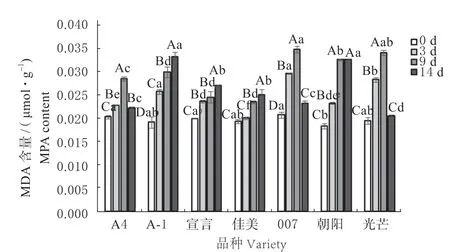
图3 病原菌胁迫下匍匐翦股颖丙二醛含量Fig.3 MDA content of Agrostis stolonifera under pathogen stress
2.4 不同品种匍匐翦股颖在病原菌胁迫下可溶性糖和可溶性蛋白含量变化
可溶性糖(Soluble Sugar, SS)是植物体内一种重要的渗透调节物质,含量的变化也可以反映出匍匐翦股颖在病原菌胁迫下的抗性差异[8],见图4。
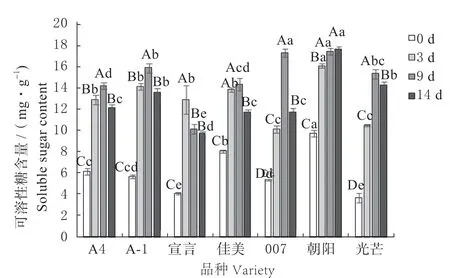
图4 病原菌病原菌胁迫下匍匐翦股颖可溶性糖含量Fig.4 Soluble sugar content of Agrostis stolonifera under pathogen stress
除‘朝阳’外其他6 个品种匍匐翦股颖叶片的可溶性糖含量,随侵染时间增加均呈现先升高后降低的趋势,大部分品种在病菌侵染前期快速积累,后期积累缓慢;而‘007’在前期和后期均有较大强度的积累。其中‘宣言’在3 d 时可溶性糖含量最大,增加了216.39%。其他5 个品种可溶性糖含量在9 d 时含量达到最大值,且均与0 d 时差异显著(P<0.05)。增幅最大的是‘光芒’,增加了318.18%;最小的是‘佳美’,增幅为78.42%。‘朝阳’叶片中可溶性糖含量呈现逐渐升高的趋势,在14 d 时有最大值,与0 d 时差异显著(P<0.05)。
可溶性蛋白(Soluble Protein,SP)是植物体内重要的渗透调节物质和营养成分,是细胞生命和生物膜的保护物质[8]。由图5 可以看出,7 种匍匐翦股颖的叶片中可溶性蛋白含量‘007’和‘朝阳’随侵染时间的增加,呈现先升高后降低的趋势。‘007’在3 d 时含量升高达到顶峰之后下降,降幅为61.79%。‘朝阳’在9 d 时含量达到顶峰后下降,降幅为65.97%。而‘A4’‘A-1’‘宣言’‘佳美’和‘光芒’均呈现下降趋势,降幅分别为77.05%、63.63%、71.24%、57.90%、70.69%,且与0 d 差异显著(P<0.05)。在14 d 时,‘A4’与0 d 相比下降77.05%,降幅最大;‘佳美’下降幅度最小,为57.90%。

图5 病原菌病原菌胁迫下匍匐翦股颖可溶性蛋白含量Fig.5 Soluble protein content of Agrostis stolonifera under pathogen stress
2.5 不同品种匍匐翦股颖在病原菌胁迫下游离脯氨酸含量变化
在逆境条件下,植物体内的脯氨酸(Proline,Pro)含量显著增加,在一定程度上反映了植物的抗逆性[8]。如图6 所示,7 个品种在未受到外界环境胁迫时,叶片中含有的 Pro 含量较低,且无明显差异。在侵染前期有升高,但大部分品种与3 d 时相比无明显变化。在9 d 时,脯氨酸含量急剧上升,说明受到病原菌胁迫后未维持细胞稳定性,产生了较多Pro。14 d 时除‘007’和‘光芒’外,其他品种脯氨酸含量下降,且与0 d 有显著差异(P<0.05)。

图6 病原菌病原菌胁迫下匍匐翦股颖游离脯氨酸含量Fig.6 Pro content of Agrostis stolonifera under pathogen stress
2.6 不同品种匍匐翦股颖在病原菌胁迫下抗性相关酶变化
由图7 可以看出,7 个匍匐翦股颖品种的SOD活性随病原菌胁迫天数的增加均呈现不同情况的上升。其中‘A4’表现为持续上升趋势,14 d 时增幅为29.85%。其他6 个品种为先上升后下降的趋势,‘A-1’‘007’‘朝阳’和‘光芒’的SOD 活性在9 d 时达到顶峰,增幅分别为31.16%、30.67%、40.51%、23.56%,之后活性下降。‘A-1’和‘光芒’14 d 时虽然SOD 活性下降,但与9 d 时差异不显著(P>0.05);而‘007’和‘朝阳’14 d 显著下降(P<0.05)。‘宣言’和‘佳美’在3 d 时SOD 活性达到峰值,增幅分别为28.79%、24.26%。
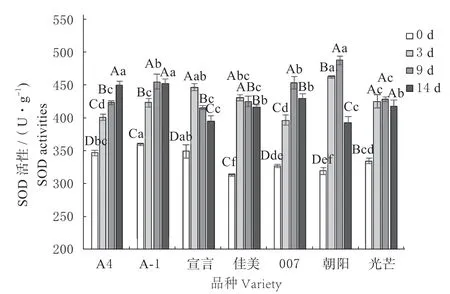
图7 病原菌胁迫下匍匐翦股颖 SOD 活性Fig.7 SOD activities of Agrostis stolonifera under pathogen stress
7 个匍匐翦股颖品种的CAT 活性随病原菌侵染时间的增加呈现出先上升后下降的趋势(图8),CAT 酶的活性显著增高,说明了植物可提高自身调节能力以适应受到的病害胁迫。CAT 酶可以清除植物代谢中产生的H2O2,避免细胞受到H2O2氧化而受到损伤。其中,‘A4’‘A-1’‘宣言’和‘朝阳‘在9 d 时达到峰值且与0 d 时差异显著(P<0.05),增 幅 分 别 为331.73%、264.48%、343.28% 和268.17%。‘佳美’‘007’和‘光芒’在3 d 时达到峰值,增幅依次为244.10%、376.86%、334.55%。在14 d 时,‘朝阳’和‘光芒’的CAT 活性与0 d 相比没有显著差异(P>0.05);其他5 种均有显著提高(P<0.05)。
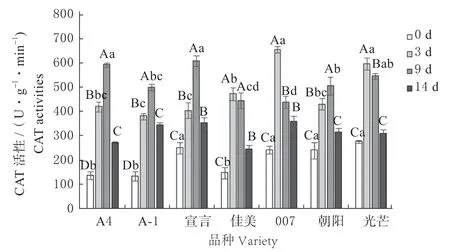
图8 病原菌胁迫下匍匐翦股颖CAT 活性Fig.8 CAT activities of Agrostis stolonifera under pathogen stress
7 种匍匐翦股颖的 POD 活性随病原菌侵染时间的增加均总体呈现上升趋势(图9)。在0 d 没有病原菌胁迫时,7 种匍匐翦股颖的POD 活性相近,没有显著差异。侵染前期3 d 时,POD 活性略有上升,但与0 d 时均没有显著差异(P>0.05)。‘A4’‘A-1’‘007’‘朝阳’和‘光芒’呈现直线上升趋势,14 d 时有达到最大活性,增幅依次为79.89%、71.63%、99.82%、63.54%、126.12%。‘宣言’和‘佳美’呈现先上升后下降的趋势,POD 活性在9 d 时活性达到峰值,增幅为60.70%和84.11%。

图9 病原菌胁迫下匍匐翦股颖 POD 活性Fig.9 POD activities of Agrostis stolonifera under pathogen stress
7 种匍匐翦股颖的APX 的活性如图10 所示,随病原菌胁迫天数的增加呈现出先上升后下降的趋势。其中‘A4’‘A-1’‘佳美’和‘007’在3 d 时有最 大 值,‘A4’‘A-1’与0 d 时 差 异 显 著(P<0.05),‘佳美’和‘007’与0 d 时无显著差异(P>0.05),他们的增幅分别为50.31%、58.78%、5.62%、12.15%,而‘宣言’‘朝阳’和‘光芒’在9 d 达到峰值,增幅为78.01%、5.53%、179.11%。其中‘宣言’和‘光芒’与0 d 时差异显著(P<0.05),‘朝阳’与0 d 时差异不显著(P>0.05)。
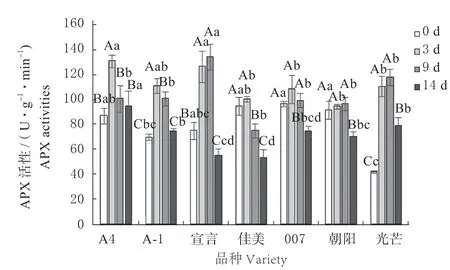
图10 病原菌胁迫下匍匐翦股颖 APX 活性Fig.10 APX activities of Agrostis stolonifera under pathogen stress
2.7 不同品种匍匐翦股颖在病原菌胁迫下过氧化氢含量变化
7 种匍匐翦股颖叶片中的过氧化氢含量从总体来看(图11),呈现出下降的趋势。除‘宣言’和‘佳美’之外,其他5 个品种在9 d 时出现最低值,‘A4’‘A-1’‘007’‘朝阳’和‘光芒’降幅分别为34.26%、57.38%、38.00%、47.35%、28.77%,与0 d 相比显著(P<0.05)下降。‘宣言’和‘佳美’在14 d 时有最小值,且与0 d 时差异显著(P<0.05),降幅为29.92%、38.45%。

图11 病原菌胁迫下匍匐翦股颖过氧化氢含量Fig.11 H2O2 content of Agrostis stolonifera under pathogen stress
2.8 抗病性综合评价
主成分分析法广泛应用于多样本、多指标的综合分析。主成分分析的目的是克服指标间的信息重叠和相关性,在保证信息损失最小的情况下,实现对多个变量的最佳综合化简,即降低较大变量空间的维数[9-10]。
对14 d 内各抗性生理指标的原始数据进行数据降维,之后利用隶属函数法计算得分,将7 个品种10 个生理指标转化为4 个主成分,其中μn 为降维后的第n 个指标的隶属函数值,之后计算得分D 值,进行品种抗病性的排序(见表2)。抗病性排序为光芒>A-1 >007 >A4 >朝阳>宣言>佳美。

表2 7 种匍匐翦股颖抗病性综合评价Table2 Comprehensive evaluation of seven Agrostis stolonifera materials under pathogen stress
3 讨论
3.1 不同匍匐翦股颖品种接种立枯丝核菌后的叶绿素变化
叶绿素是植物中进行光合作用的色素。叶绿素的含量越高叶片的光合作用越强,积累的有机物质就越多,抗性也随之增强。崔秀敏[11]等在对34 个不同生态型不结球白菜品种对黑斑病的抗性研究中发现,叶绿素含量的高低与植物的抗病性呈正相关。陈臻[12]等研究发现,在未发病的叶片中叶绿素含量与发病率呈现极显著负相关,在感染枯叶病后,草坪草叶绿素含量显著下降,其中抗病品种的叶绿素含量下降幅度小于感病品种。本研究中未发病叶片叶绿素含量各品种没有较大差异,但在病菌侵染后抗病品种的叶绿素含量下降幅度小于易感病品种,这与陈臻研究的试验结果一致。
3.2 不同匍匐翦股颖品种接种立枯丝核菌后的质膜渗透调节物质变化
可溶性糖、可溶性蛋白和游离脯氨酸在植物细胞中起着渗透调节的作用。前人研究表明,脯氨酸的积累与渗透调节能力呈显著正相关[13]。高宁馨等[14]在不同抗性的油菜品种接菌的试验中发现,所有油菜品种接种病菌发病后Pro 含量都上升,且抗病品种Pro 明显高于感病品种。本试验中不同品种匍匐翦股颖接种病菌后Pro 含量都在前期缓慢上升,后期急剧上升。但抗病品种与感病品种的含量上升幅度没有太大差异。
可溶性糖是参与细胞内渗透压调节的重要物质,高宁馨等[14]在不同油菜品种对菌核病抗性差异的研究中也发现,低抗病性的品种叶片中可溶性糖含量显著升高,而高抗病品种在接种后变化较小;并且抵抗病品种中可溶性糖含量持续高于高抗病品种。本研究中,抗病品种‘光芒’的可溶性糖含量的变化幅度显著高于易感品种佳美的变化幅度,这与前人研究一致。
可溶性蛋白也是重要的营养物质渗透调节物质,对细胞膜起到保护作用。张笑宇[15]的研究发现马铃薯在接种黑痣病后,可溶性糖含量与抗病性无显著相关性,可溶性蛋白含量越低越抗病。而本试验结果发现随着病原菌的入侵,7 种匍匐翦股颖叶片中的可溶性蛋白含量呈现下降趋势,可溶性蛋白含量与抗病性没有显著相关性。推测这可能是不同植物对抗病害时体内响应情况不同导致的。
3.3 不同匍匐翦股颖品种接种立枯丝核菌后的质膜过氧化物变化
植物在受到病原菌入侵时,产生非亲和作用的过敏反应,会导致植物膜脂过氧化,细胞膜透性增加[16-17]。MDA 是膜脂过氧化的最终产物,膜脂过氧化会使膜的结构和功能受到伤害,MDA 含量可以反映植物受到伤害的程度[18]。葛秀春等[19]在水稻与稻瘟病菌相互作用的研究中发现,水稻感病后MDA 含量显著上升,且与品种抗性呈现负相关,这与本研究结果一致,抗病品种的增加幅度大于感病品种。本研究中‘A4’‘光芒’和‘007’的MDA含量呈现先上升后下降的趋势,表明可能与其自身的恢复能力相关,在侵染后期利用自身的调节,缓解了膜脂的过氧化,减轻了细胞膜的损伤。
过氧化氢是活性氧(ROS)的一种,在中低浓度下,植物中的H2O2可以抑制菌丝生长,参与细胞壁木质化,诱导植物保护激素合成,并引发植物过敏反应。如果细胞中H2O2的产生速率大于或远远超过身体去除H2O2的速率,则H2O2浓度过高,导致氧化损伤[20]。在前人的研究中表明[21],随着病原菌侵染时间叶片中H2O2浓度呈上升趋势;但在本试验中呈现先下降后上升的趋势,前期呈现下降趋势可能是因为CAT 酶活性的增强,使H2O2被氧化分解。
3.4 不同匍匐翦股颖品种接种立枯丝核菌后的抗氧化酶类变化
SOD 和CAT 是植物体内重要的活性氧清除剂,可以清除自由基,保护细胞膜系统[22]。POD 是植物体内广泛存在的一种氧化还原酶,参与多种防护反应,主要可催化木质素和植保素合成。李捷等[23]在研究中发现枸杞接种尖孢镰孢菌后,CAT 活性上升,抗病性较高品种的SOD 和POD 活性增加量高于抗病性较低的品种。徐鹏飞等[24]在研究中发现,大豆接种疫霉根腐病菌后,抗病大豆比易感大豆的SOD 活性增加量大。韩珊等[25]在对板栗不同抗性品种叶片栗疫菌毒素Cp-处理后的研究结果中发现,中抗病品种CAT 和APX 活性变化幅度大于感病品种。赵庆芳等[26]发现黄芪在接种尖孢镰孢菌后,叶片中SOD,CAT 和POD 活性均呈现出先升高后降低的变化规律。这些研究结果均与本试验结果一致。本试验中,在立枯丝核菌侵染匍匐翦股颖后,抗病品种SOD、CAT、POD、APX 4 种酶的活性增加幅度大,而易感品种SOD 活性在前期增加速度快,增幅较小,CAT、POD、APX 增幅小于抗病品种,说明对病菌的入侵更为敏感,但是防御能力弱。不能有效清除ROS,后期ROS 的浓度上升,酶的结构受到破坏,酶活力降低。
在前人[27-28]的研究中发现了在以水杨酸(Salicylic acid,SA)为主的系统获得性抗病性(Systemic Acquired Resistance,SAR)诱导的抗病机制中,SA 通过提高SOD 活性来加速超氧阴离子向H2O 的转化,从而提高H2O2的浓度;而在诱导性系统性抗病(Induced Systemic Resistance,ISR)机制在诱导植物抗病的过程中,植物体增强了CAT的活性,将高浓度的H2O2转化为低浓度的H2O2,从而维持植物体内活性氧的平衡。本研究结果显示,在接菌处理后,匍匐翦股颖CAT 酶活性呈先上升后下降的趋势,符合ISR 抗病机制,由此本研究初步认为匍匐翦股颖是通过诱导性系统性抗病机制来响应褐斑病抗性的。
4 结论与展望
综上所述,7 种常用匍匐翦股颖品种对褐斑病病原菌立枯丝核菌的抗病性依次为:光芒>A-1 >007 >A4 >朝阳>宣言>佳美;在病原菌胁迫时,匍匐翦股颖细胞中渗透调节物质的积累和抗氧化酶系统在植物抗病中起到重要的作用;初步判断了匍匐翦股颖受到病原菌侵染后,通过诱导性系统性抗病机制来响应褐斑病,为后续匍匐翦股颖抗病免疫响应的研究及抗病基因挖掘奠定了一定基础。草类植物病害是限制草坪业、草牧业生产和发展的主要因素之一,抗病品种的开发利用是防治病害最经济、最有效、最环保的途径;从现有品种中选育高抗性品种是抗病育种的关键环节,对我国农业的可持续发展具有重要作用。在后续抗病育种中,还需要进一步明确抗病蛋白识别病原菌信号激发免疫的分子机制,进行抗病基因的挖掘与分离,结合分子育种手段加快草类植物抗病品种的选育,实现草类植物持久抗性。

