经皮椎体成形术后再发邻近椎体骨折的治疗
鲍小明,张小平,郭卫东,董 鑫,廖 博,任 坤
经皮椎体成形术(PVP)是骨质疏松性椎体骨折的有效治疗方法,但术后常发生邻近椎体骨折[1-2],考虑是椎体注入骨水泥后刚度增加,使负荷转移至邻近椎体所致。潜在疾病进展、骨水泥注入量过大、机体活动增加等都可能是导致PVP术后再发邻近椎体骨折的因素,但具体原因尚存争议[3]。 本研究回顾性分析2016年1月~2019年12月我科43例PVP术后再发邻近椎体骨折的患者资料,探讨二次PVP及抗骨质疏松治疗的效果,报道如下。
1 材料与方法
1.1 病例资料本组43例(46椎),男11例,女32例,年龄65~82(69.8±4.05)岁。均为首次PVP术后再发邻近椎体骨折。再发骨折椎体分布:T62椎,T82椎,T94椎,T104椎,T118椎,T128椎,L18椎,L27椎,L33椎。术前X线片显示椎体高度降低伴楔形变,MRI检查显示伤椎水肿高信号。患者入院后常规补充钙剂。首次PVP至本次骨折时间3~12(8.02±2.30)个月。
1.2 治疗方法患者俯卧位。C臂机透视明确伤椎并标记进针点为椎弓根投影外上2 cm处。1%利多卡因局部浸润麻醉进针点及椎弓根周围组织。做长约5 mm的切口,穿刺针沿椎弓根入路穿刺至骨折椎体前中1/3区域,更换穿刺针套管建立工作通道,侧位透视下沿工作通道将骨水泥缓慢注入椎体,注射过程中密切监测患者心率、血压变化,当椎体后1/4处有骨水泥弥散或有任何渗漏征象时立即停止注射。观察患者生命体征平稳且骨水泥凝固后拔除穿刺针套管,清洁切口,无菌辅料覆盖。术后继续补充钙剂,同时行唑来膦酸抗骨质疏松治疗。术后2 h内患者严格卧床,之后可行床上自主翻身、双下肢自主等长收缩锻炼。术后24 h佩带支具床上间断坐起并开始无负重行走锻炼。术后2~3 d患者出院。
1.3 观察指标骨水泥注入量及渗漏情况,骨折愈合时间,并发症发生情况,疼痛VAS评分,日常自理生活能力(ADL)评分。
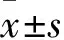
2 结果
患者均获得随访,时间6~15(6.21±2.35)个月。骨水泥注入量3~6(4.5±0.8) ml/椎。骨折均愈合,时间5~8(6.31±1.24)个月。术中2例发生骨水泥椎间盘渗漏,因影像学未见异常,故均未做特殊处理;术后无切口感染、神经损伤、骨水泥松动、椎体塌陷及骨折等并发症发生。疼痛VAS评分及ADL评分:术后1 d、3个月均优于术前(P<0.05);术后3个月均优于术后1 d(P<0.05);见表1。末次随访时患者胸背部疼痛均明显缓解,局部压痛及叩击痛均阴性,可自主行走且步态正常。
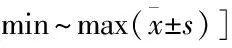
表1 手术前后疼痛VAS评分、ADL评分比较[n=43,分,
典型病例见图1~6。
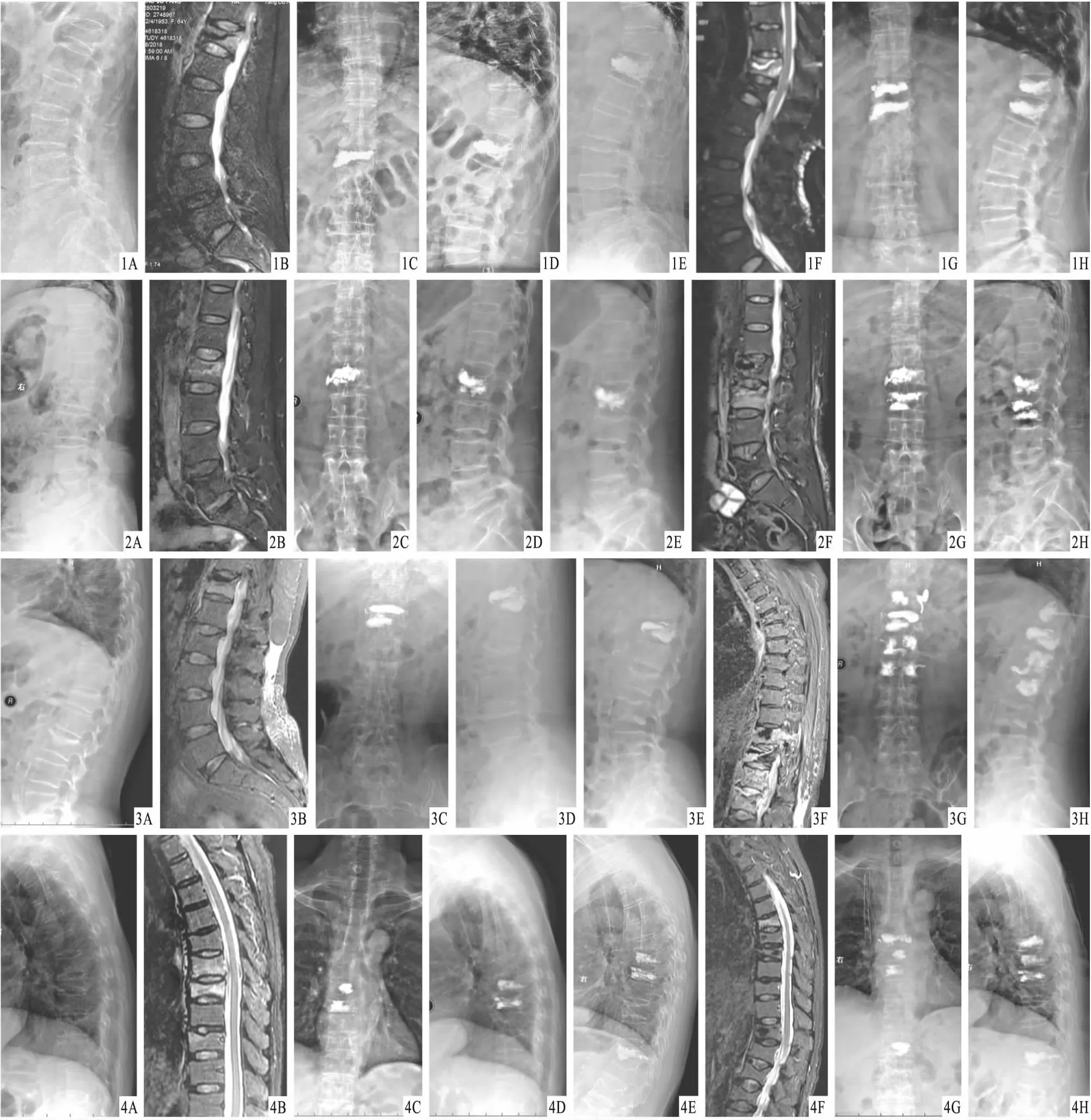
图1 患者,女,66岁,T12椎体骨质疏松性骨折行PVP治疗,术后12个月T11椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示T12椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后12个月X线片及MRI,显示T11椎体骨质疏松性骨折;G.再次PVP术后2 d X线片,显示骨水泥分布良好;H.再次PVP术后3个月X线片,显示骨水泥分布良好 图2 患者,女,66岁,L2椎体骨质疏松性骨折行PVP治疗,术后7个月L3椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示L2椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后7个月X线片及MRI,显示L3椎体骨质疏松性骨折;G.再次PVP术后2 d X线片,显示骨水泥分布良好;H.再次PVP术后3个月X线片,显示骨水泥分布良好 图3 患者,男,68岁,T12椎体骨质疏松性骨折行PVP治疗,术后9个月T11、L1,2椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示T12椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后9个月X线片及MRI,显示T11、L1,2椎体骨质疏松性骨折;G.再次PVP术后X线片,显示T11椎体针道骨水泥渗漏,L1椎体下缘骨水泥渗漏;H.再次PVP术后3个月X线片,显示骨水泥分布良好 图4 患者,女,66岁,T7,8椎体骨质疏松性骨折行PVP治疗,术后9个月T6椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示T7,8椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后9个月X线片及MRI,显示T6椎体骨质疏松性骨折;G.再次PVP术后2 d X线片,显示骨水泥分布良好;H.再次PVP术后3个月X线片,显示骨水泥分布良好
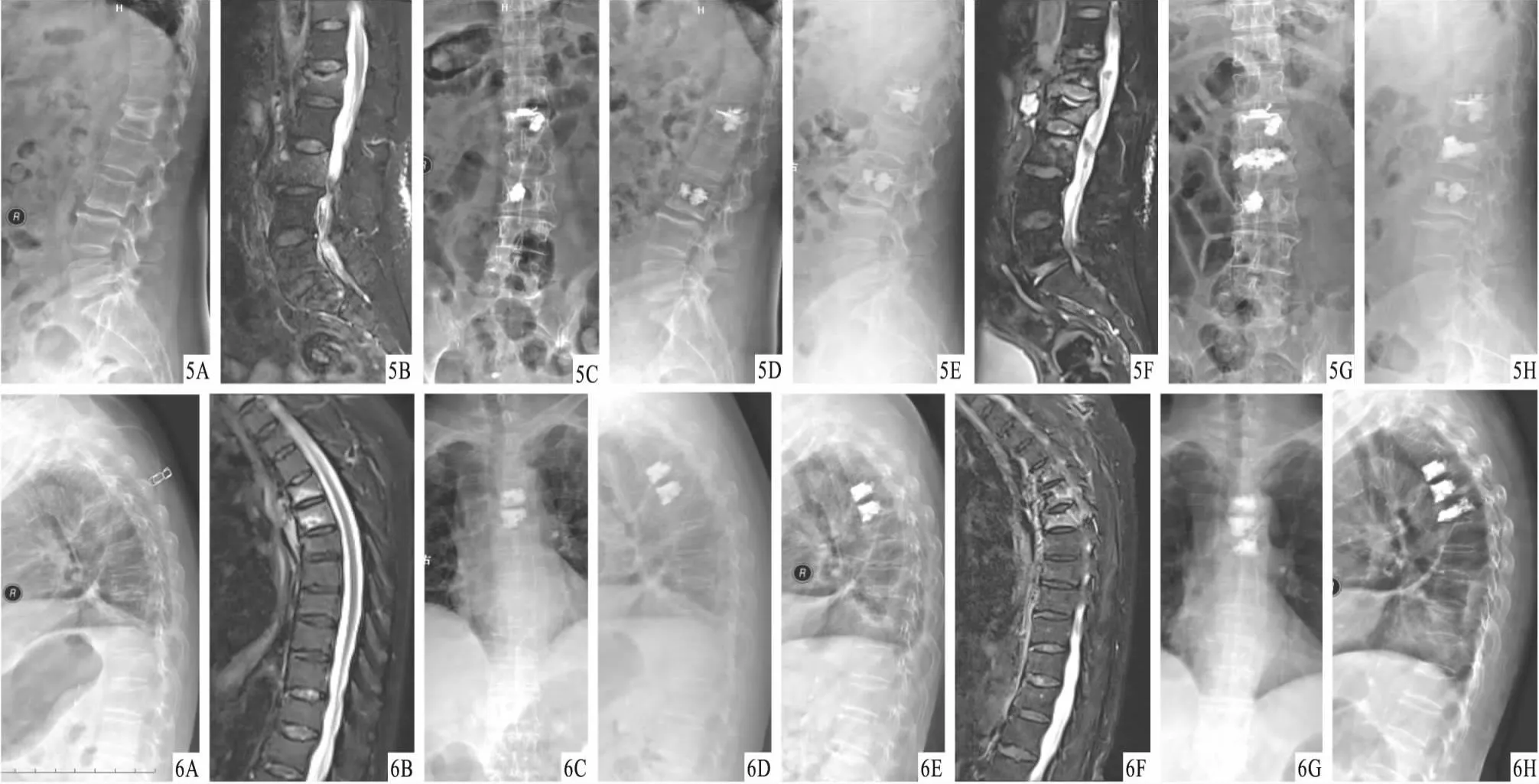
图5 患者,女,78岁,L1,3椎体骨质疏松性骨折行PVP治疗,术后8个月L2椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示L1,3椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后8个月X线片及MRI,显示L2椎体骨质疏松性骨折;G.再次PVP术后2 d X线片,显示骨水泥分布良好;H.再次PVP术后3个月X线片,显示骨水泥分布良好 图6 患者,女,81岁,T4,5椎体骨质疏松性骨折行PVP治疗,术后7个月T6椎体骨质疏松性骨折,再次行PVP治疗 A、B.首次PVP术前X线片及MRI,显示T4,5椎体骨质疏松性骨折,椎体高度降低;C.术后X线片,显示骨水泥分布均匀;D.术后6个月X线片,显示骨水泥分布可;E、F.术后7个月X线片及MRI,显示T6椎体骨质疏松性骨折;G.再次PVP术后2 d X线片,显示骨水泥分布良好;H.再次PVP术后3个月X线片,显示骨水泥分布良好
3 讨论
3.1 PVP治疗骨质疏松性椎体骨折的疗效及并发症骨质疏松症是由多种因素引起的慢性、隐匿性、进行性疾病[4-6]。Warden et al[7]研究证实,绝经后妇女雌激素丢失会通过增加破骨细胞活性而改变骨代谢,导致骨吸收大于骨形成。这种骨稳态失衡增加了骨脆性[8],使骨质疏松致椎体骨折的可能性女性是同龄男性的3~4倍[9]。PVP是一种治疗骨质疏松性椎体骨折的微创方法,不仅操作简便,而且有良好的镇痛效果[10-11]。但PVP术后再发邻近椎体骨折是其主要并发症。文献[12]报道,2 202例行PVP治疗的患者术后再发邻近椎体骨折的发生率为16.43%。脊柱生物力学研究[13]表明,增强型椎体刚度比正常脊柱松质骨刚度大36倍,这使得脊柱关节局部柔韧性降低,PVP术后邻近椎间盘压力和负重的增加以及邻近椎体的骨质疏松均可导致再发椎体骨折。
3.2 PVP术后再发邻近椎体骨折的危险因素及治疗研究[1,14]显示,骨质疏松程度是PVP术后再发邻近椎体骨折的重要危险因素。另一项研究[15]显示,女性、严重骨质疏松是PVP术后再发邻近椎体骨折的高危因素。骨质疏松发生后,单纯依靠患者自身的调节机制很难逆转骨质疏松的进展[4],但骨质疏松药物可有效延缓骨丢失及降低再骨折的发生率[16-18]。本研究对PVP术后再发邻近椎体骨折患者均行二次PVP治疗,术后均给予抗骨质疏松治疗,骨折均愈合,时间5~8(6.31±1.24)个月。疼痛VAS评分及ADL评分:术后1 d、3个月均优于术前(P<0.05);术后3个月均优于术后1 d(P<0.05)。末次随访时患者胸背部疼痛均明显缓解,局部压痛及叩击痛均阴性,可自主行走且步态正常。
综上所述,PVP术后再发邻近椎体骨折行二次PVP及抗骨质疏松治疗,可显著缓解疼痛、提升患者日常生活能力,临床疗效满意。

