盐碱胁迫对棉花叶片蛋白质组的影响及差异性分析
郭家鑫 叶 扬 郭慧娟 闵 伟
石河子大学农学院, 新疆石河子 832000
棉花是制作纺织品的天然纤维作物, 也是重要的油料作物[1]。棉花的耐盐阈值虽然很高, 常常作为盐碱地的先驱作物[2], 但其生长依然受到盐碱胁迫的限制。自20世纪80年代以来, 新疆逐渐成为中国乃至世界上最重要的优质高产棉花产区之一[3-4]。但同时新疆土地盐渍化问题也十分严重, 盐碱地面积占到耕地总面积的37.72%[5], 给当地的棉花生产带来严重不利影响。随着世界人口的迅速增加, 对纤维和生物能源的需求逐渐增大, 必须将盐碱和次生盐碱区的作物产量提高40%才能满足这一缺口[6-7]。因此, 开展棉花耐盐碱机制研究, 对于提高棉花耐盐碱性和充分利用丰富的盐碱地资源提供有力的理论支持, 对大力发展棉花生产有着重要的意义。
盐碱胁迫是限制作物生长的重要非生物胁迫之一, 会导致渗透胁迫、离子毒害以及氧化损伤[8-9]。当植物处于盐碱胁迫下时, 它们首先依靠复杂的转导途径来感知盐胁迫刺激。植物的信号通路包括激素通路(脱落酸、茉莉酸和乙烯)、IP3信号通路和Ca2+信号通路, 这些信号通路相互关联, 将应激信号传递给基因调节器[10]。为了适应盐碱胁迫, 作物需要复杂的代谢重排和多种代谢途径之间的相互作用[11-12],例如渗透调节、离子稳态以及抗氧化防御系统等耐受机制[13], 然而这些机制的运作会使作物对能量的需求显著增加[14-15]。光合作用是将光转化为化学能的基本生化过程之一, 对环境压力十分敏感[16], 盐碱胁迫会导致叶绿素生物合成中光合蛋白积累减少[17]。植物叶片的净光合速率通常随着盐胁迫强度的增加而降低[18-19]。植物遭受盐碱胁迫最明显的症状是诱导叶片黄化和发育迟缓, 这与金属离子和磷的沉淀以及组织中离子平衡和pH稳态的失衡有关[20-21]。理论上讲, 增强光合作用和氧化还原产生能量的过程将有助于提高作物的耐盐性[22]。但是关于盐碱胁迫对作物呼吸的影响还存在争议, 盐碱胁迫使得呼吸增强或减弱[23], 然而增强呼吸会消耗大量的碳, 就导致参与新生组织的碳减少[24-26]。
虽然人们对棉花的耐盐碱性进行了深入研究,但是盐碱胁迫对棉花蛋白组的影响及其差异性尚未完全明晰。因此, 本研究以棉花为试验材料, 采用TMT标记定量技术, 探究盐碱胁迫对棉花叶片光合作用、碳水化合物转化酶活性以及蛋白组的影响,阐明盐碱胁迫下棉花的耐受机制, 探索棉花幼苗响应盐碱胁迫的分子机制, 为盐碱胁迫下棉花的特异蛋白以及相关基因功能的进一步研究奠定基础。本研究为耐盐棉花育种和不同盐碱地的棉花栽培提供一定的理论基础。
1 材料与方法
1.1 试验材料
土柱试验于2022年在石河子大学农学院试验站温室进行(44°18′52″N, 86°3′23″E)。供试土壤采自石河子大学农学院试验站, 土壤类型为灌耕灰漠土,质地为壤土。土壤基础理化性质如下: 有机质14.5 g kg–1, 全氮1.2 g kg–1, 速效磷11.6 mg kg–1, 速效钾255 mg kg–1。供试作物为棉花品种为‘鲁棉研24号’。
1.2 试验设计
通过向供试土壤中添加NaCl和Na2CO3+NaHCO3, 将本试验设置3种盐碱胁迫类型, 分别为: (1) 对照-非盐碱土壤(CK); (2) NaCl盐土(CS);(3) Na2CO3+NaHCO3碱土(AS), 每个处理重复3次。
在试验开始前, 将供试土壤自然风干, 碾碎后过2 mm筛。将NaCl和Na2CO3+NaHCO3(重量比1∶1)溶液加入供试土壤至饱和状态(对照加同体积去离子水), 放置1个月使土壤达到平衡, 至此形成供试盐渍土。再将处理后土壤风干, 碾碎后过筛, 取样测定含盐量, 电导率, pH值。具体试验处理及土壤盐碱类型和盐碱化程度见表1。
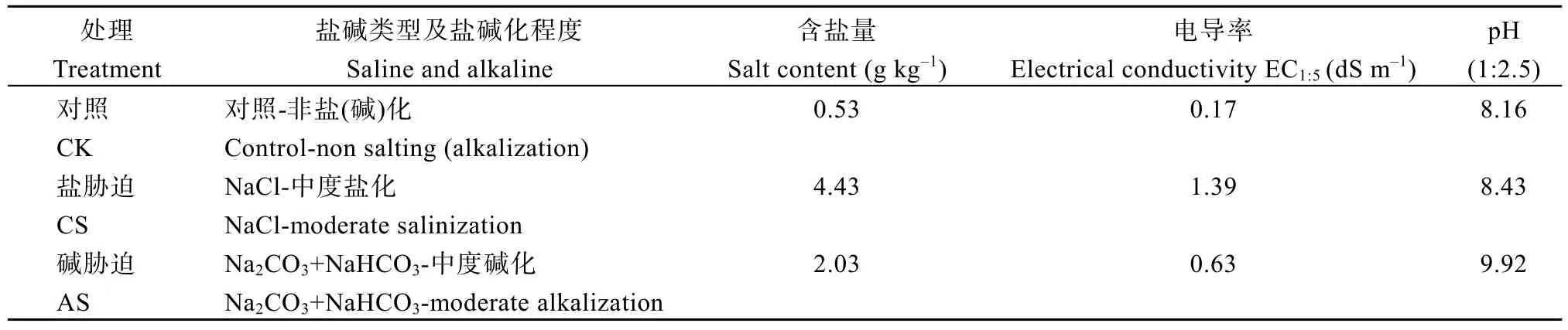
表1 不同处理土壤盐碱类型和盐碱化程度Table 1 Type and degree of salinity and alkalinity in soil under different treatments
棉花土柱模拟试验用高60 cm, 直径35 cm的圆柱容器, 底部密封; 按容重1.25 g cm–3分层装土50 cm, 每10 cm一层, 每个土柱装风干土60 kg。灌水方式为滴灌, 毛管平铺在土柱上方, 滴头固定在土柱顶中心位置, 每个土柱由1个滴头供水, 灌水量2.5 L pot–1。2020年4月10日播种, 每个土柱播种20株,采用干播湿出, 幼苗生长至2片真叶时, 每个土柱定植6株棉花。为了保证充足的水分供应, 试验期间采用滴灌的方式定期补充水分, 使土壤含水量保持在田间持水量的60%~80%。试验在播种后60 d结束。
1.3 样品采集
在棉花苗期采集样品, 每个处理各取3株具有代表性的棉花植株, 分成根、茎、叶三部分, 部分叶片样品用液氮冷冻干燥后用植物粉碎机(Scientz-48,北京同元聚物科技有限公司)研磨成粉末, 并保存在–80℃冰箱中备用。
1.4 测定方法
1.4.1 生物量的测定 棉花根、茎、叶, 在105℃下杀青30 min, 之后在70℃下烘干至恒重, 称其干物质量。
1.4.2 光合指标测定 选取棉花叶片倒三叶, 采用型号为LI-COR 6400植物光合测定仪(美国LI-COR公司生产)在下午14:00—14:30, 测定净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conguctance,Gs)、蒸腾速率(Transpiration rate,Tr)和胞间CO2浓度(Intercellular CO2concentration,Ci)。采用乙醇浸提法[27]测定叶绿素含量。
1.4.3 酶活性的测定 选取棉花叶片倒三叶测定酶酶活性。己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、柠檬酸合酶(CS)、苹果酸脱氢酶(MDH)、谷氨酸脱氢酶(GLDH)和谷草转氨酶(AST)使用检测试剂盒测定(上海源桔生物科技中心)。
1.4.4 蛋白提取 取0.4 g棉花叶片倒三叶样品至2 mL EP管中, 加入800 μL酚提取液混匀, 混匀低温研磨4 min; 加入800 μL Tris-平衡酚试剂; 反应40 min, 每 5 min震摇1次; 5000×g, 4℃离心10 min; 转移上清至新的EP管中; 加入4倍体积甲醇-乙酸铵,–20℃沉淀过夜; 14,000×g, 4℃离心10 min, 收集沉淀; 加入500 μL甲醇清洗, 14,000×g, 4℃离心10 min,去除上清, 重复本步骤一次; 加入500 μL丙酮清洗,14,000 ×g, 4℃离心 10 min, 去除上清; 待丙酮挥发干, 加入500 μL RIPA裂解液复溶, 打散沉淀, 静置1 h; 14,000 ×g, 4℃离心 10 min, 取上清。
1.4.5 蛋白质检测 每个样品取2 μg总肽, 经nano-UPLC液相系统EASY-nLC1200进行分离后联用配备纳升离子源的质谱仪(Q Exactive HFX)进行数据采集。色谱分离采用100 μID ×15 cm反相色谱柱(Reprosil-Pur 120 C18-AQ, 1.9 μm, Dr. Maisch)进行。流动相采用乙腈-水-甲酸体系, 其中流动相A为0.1%甲酸-98%水溶液(乙腈为2%), B相为0.1%甲酸-80%乙腈溶液(水为20%)。色谱柱以100%的A相平衡后, 样品由自动进样器直接上样到色谱柱, 再经色谱柱梯度分离, 流速300 nL min–1, 梯度时长90 min。流动相B比例: 2%~5%持续2 min, 5%~22%持续68 min, 22%~45%持续16 min, 45%~95%持续2 min,95%持续2 min。
1.5 数据处理
采用Microsoft Excel 2016软件处理数据, 使用SPSS 17.0软件进行统计分析, 差异显著性检验采用Duncan’s法(P<0.05)。基于基因本体(GO)富集分析(http://www.geneontology.org/)进行差异表达蛋白的功能分类。使用京都基因和基因组百科全书(KEGG)数据库(https://www.genome.jp/kegg/)对差异表达蛋白进行了途径富集分析。
2 结果与分析
2.1 盐胁迫和碱胁迫对棉花生物量的影响
盐碱胁迫显著降低棉花生物量(表2)。与CK相比, CS叶、茎、根和总生物量分别显著降低49.4%、59.7%、37.9%和51.1%; AS叶、茎、根和总生物量分别显著降低48.2%、60.2%、39.1%和50.9%。
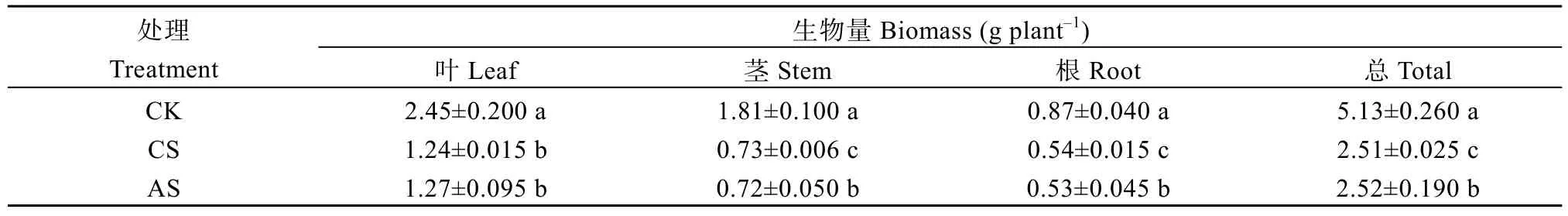
表2 盐胁迫和碱胁迫对棉花生物量的影响Table 2 Effects of salt stress and alkali stress on cotton biomass
2.2 不同盐碱胁迫对棉花光合作用的影响
盐胁迫显著抑制了棉花光合作用, 而碱胁迫对棉花光合作用无显著影响(图1)。与CK相比, CS的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率分别显著降低57.2%、70.8%、22.8%和70.2%; AS叶的净光合速率、气孔导度和胞间CO2浓度分别增加2.1%、9.7%和3.6%, 蒸腾速率降低3.6%, 但不显著。盐胁迫显著降低棉花叶片叶绿素含量, 但是碱胁迫对棉花叶片叶绿素含量无显著影响。与CK相比, CS的叶绿素a和叶绿素b含量分别显著降低54.2%和53.0%; AS叶绿素a和叶绿素b含量无显著变化。

图1 盐胁迫和碱胁迫对棉花光合作用的影响Fig. 1 Effects of salt stress and alkali stress on cotton photosynthesis
2.3 棉花叶片中差异表达蛋白的筛选与鉴定
在蛋白组数据主成分分析中, 前2个主成分分别解释了26.5%和22.5%的差异(图2)。同一处理的样本聚到一起, 样本的重复性较好, 且各处理间区分度较大, 盐胁迫、碱胁迫与对照存在显著差异。
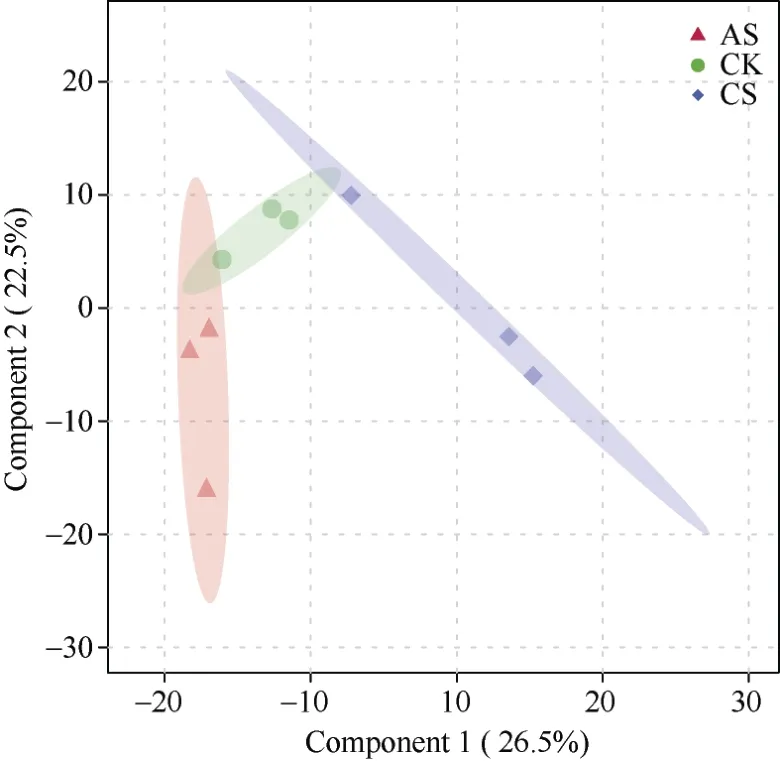
图2 盐胁迫和碱胁迫下棉花叶片中表达蛋白的主坐标分析Fig. 2 Principal coordinate analysis of protein expression in cotton leaves under salt and alkali stresses
由图3可知, 在CS中共检测到4706种蛋白质,其中206种蛋白质上调, 252种蛋白质下调, 4248种蛋白质无显著变化; 在AS中共检测到4706种蛋白质, 其中133种蛋白质上调, 107种蛋白质下调, 4466种蛋白质无显著变化。
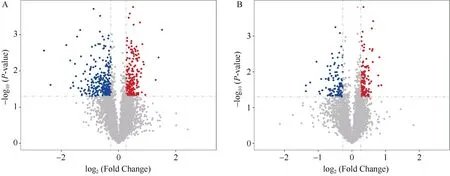
图3 棉花叶片中表达蛋白火山图Fig. 3 Volcanic graph of proteins expressed in cotton leaves
2.4 差异表达蛋白的GO注释富集分析
对差异表达蛋白进行GO功能注释(图4)发现,盐胁迫下, 在细胞组分中多数差异表达蛋白注释的条目为细胞、细胞组分、细胞内和细胞外, 在分子功能中多数差异表达蛋白注释的条目为RNA结合、裂解酶活性、异构酶活性和mRNA结合, 在生物过程中多数差异表达蛋白注释的条目为有机氮化合物生物合成过程、氧乙酸代谢过程、有机酸代谢过程和羧酸代谢过程(图4-A)。碱胁迫下, 在细胞组分中多数差异表达蛋白注释的条目为胞内液、细胞器、细胞内细胞器和细胞质, 在分子功能中多数差异表达蛋白注释的条目为RNA结合、结构分子活性、核糖体结构成分和翻译因子活性以及RNA结合, 在生物过程中多数差异表达蛋白注释的条目为细胞生物合成过程、有机物生物合成过程、有机氮化合物生物合成过程和细胞酰胺代谢过程(图4-B)。
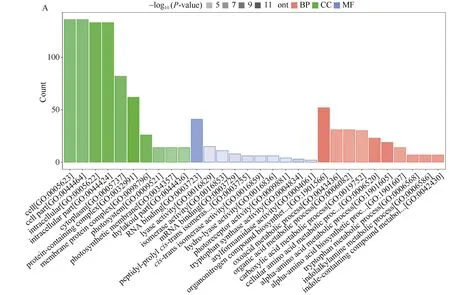
(图4)
2.5 差异表达蛋白的KEGG注释富集分析
通过对差异表达蛋白显著富集的代谢通路进行分析, 可以了解哪些通路在不同盐碱胁迫下发生了显著改变(图5)。前10条显著富集的KEGG通路如图所示, 盐胁迫下分别为: 苯并氮杂类生物合成、光合作用、mRNA监控途径、剪接体、核糖体、苯丙氨酸、酪氨酸和色氨酸生物合成、萜类骨架生物合成、产热、氨基酸生物合成和化学致癌-活性氧物种(图5-A)。碱胁迫下分别为: 苯并氮杂类生物合成、缬氨酸、亮氨酸和异亮氨酸生物合成、核糖体、单萜生物合成、苯丙醇生物合成、硒化合物代谢、萜类骨架生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成、泛酸和CoA生物合成和氨基酸的生物合成(图5-B)。
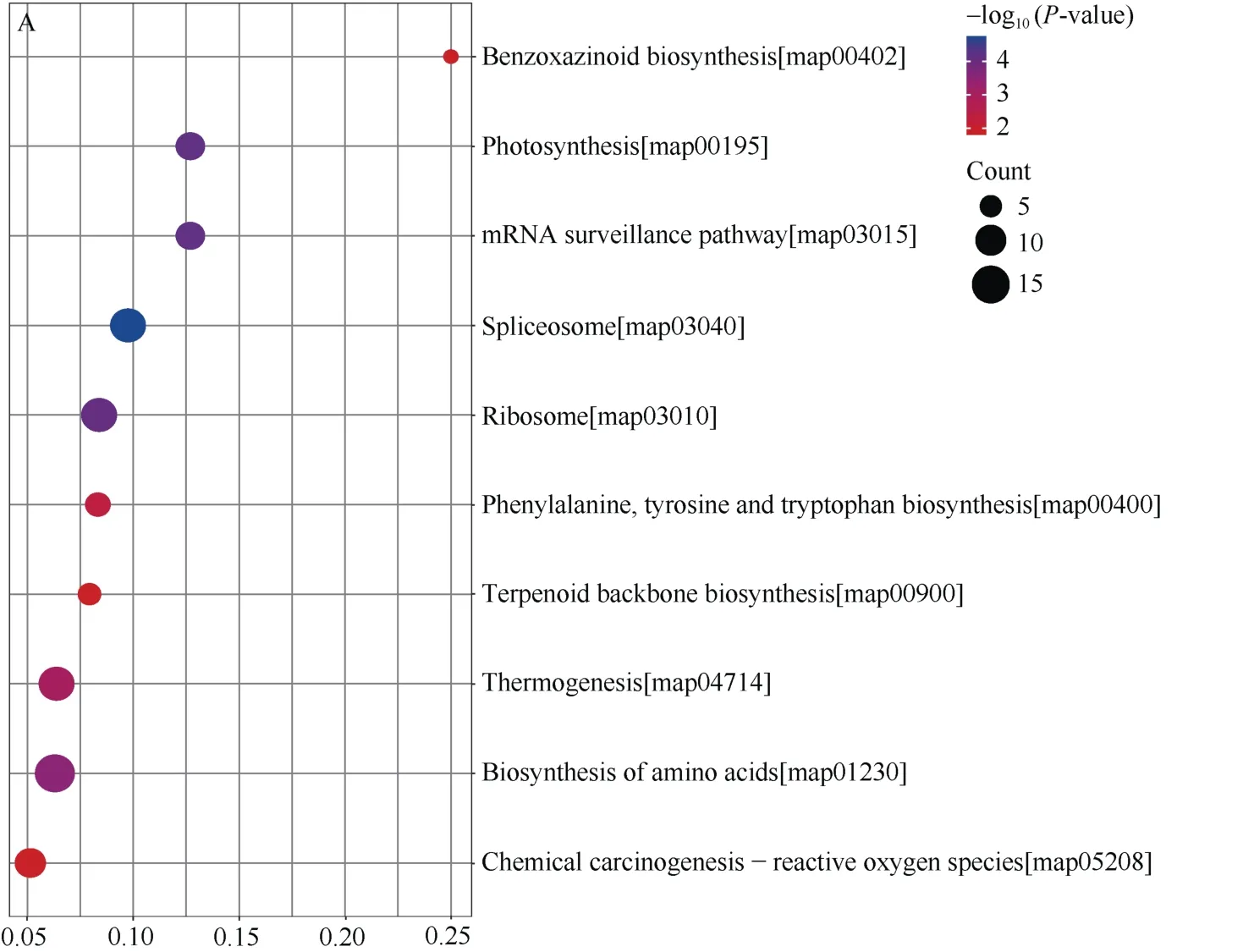
(图5)
2.5.1 盐碱胁迫对碳固定和能量代谢的影响 通过分析KGEE富集通路中的差异表达蛋白, 我们发现光合作用中petB、petF、psaD、psaF、psbA、psbB、psbC和psbO共8个蛋白在盐胁迫下表达减少, 而PsbS在碱胁迫下表达增加(图6)。CS叶片中己糖激酶、磷酸果糖激酶、丙酮酸激酶、柠檬酸合酶、谷氨酸脱氢酶和谷草转氨酶活性分别显著增加13.8%、14.4%、4.7%、4.5%、36.6%和12.9%; AS叶片中己糖激酶、磷酸果糖激酶、丙酮酸激酶、苹果酸脱氢酶、柠檬酸合酶、谷氨酸脱氢酶和谷草转氨酶活性分别显著增加4.8%、38.8%、15.1%、4.3%、3.4%、15.2%和21.1%。同样在蛋白组数据中也筛选出相关蛋白, 且其变化趋势与酶活性基本相同。
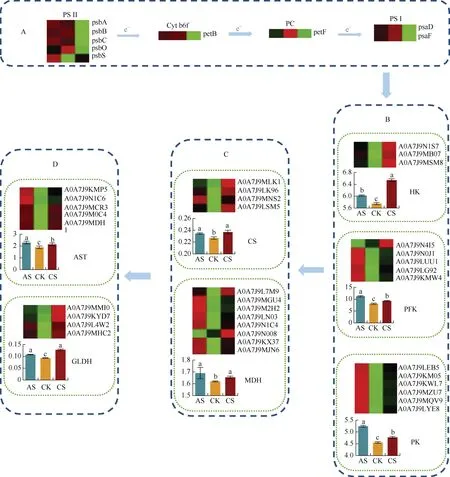
图6 盐胁迫和碱胁迫对棉花光合作用和碳转化蛋白的影响Fig. 6 Effects of salt stress and alkali stress on photosynthesis and carbon transforming protein in cotton
不同盐碱胁迫对棉花叶片能量代谢的影响如表3所示, 在CS处理下, A0A7J9KP33、A0A7J9MR64和A0A7J9M5F7等19个差异表达蛋白在2-氧代羧酸代谢和氧化磷酸化等5条能量代谢途径中显著富集, 其中15个差异表达蛋白上调, 4个差异表达蛋白下调; 在AS处理下, A0A7J9KP33、A0A7J9M6Q9和A0A7J9L982等9个差异表达蛋白在2-氧代羧酸代谢和脂肪酸代谢等4条能量代谢途径显著富集, 其中6个差异表达蛋白上调, 3个差异表达蛋白下调。

表3 盐胁迫和碱胁迫对棉花叶片能量代谢的影响Table 3 Effects of salt stress and alkali stress on energy metabolism of cotton leaves
2.5.2 盐碱胁迫对氨基酸代谢的影响 盐碱胁迫下氨基酸代谢途径都显著富集(表4)。盐胁迫下A0A7J9LV20、A0A7J9KNK6和A0A7J9N2J2等20个差异表达蛋白在苯丙氨酸、酪氨酸和色氨酸生物合成以及甘氨酸、丝氨酸和苏氨酸代谢等6条氨基酸代谢途径中显著富集, 其中13个差异表达蛋白上调, 7个差异表达蛋白下调; 在AS处理下,A0A7J9KP33、A0A7J9M6Q9和A0A7J9L982等17个DEPs在缬氨酸、亮氨酸和异亮氨酸生物合成以及苯丙氨酸、酪氨酸和色氨酸生物合成等5条氨基酸代谢途径显著富集, 其中11个差异表达蛋白上调,6个差异表达蛋白下调。
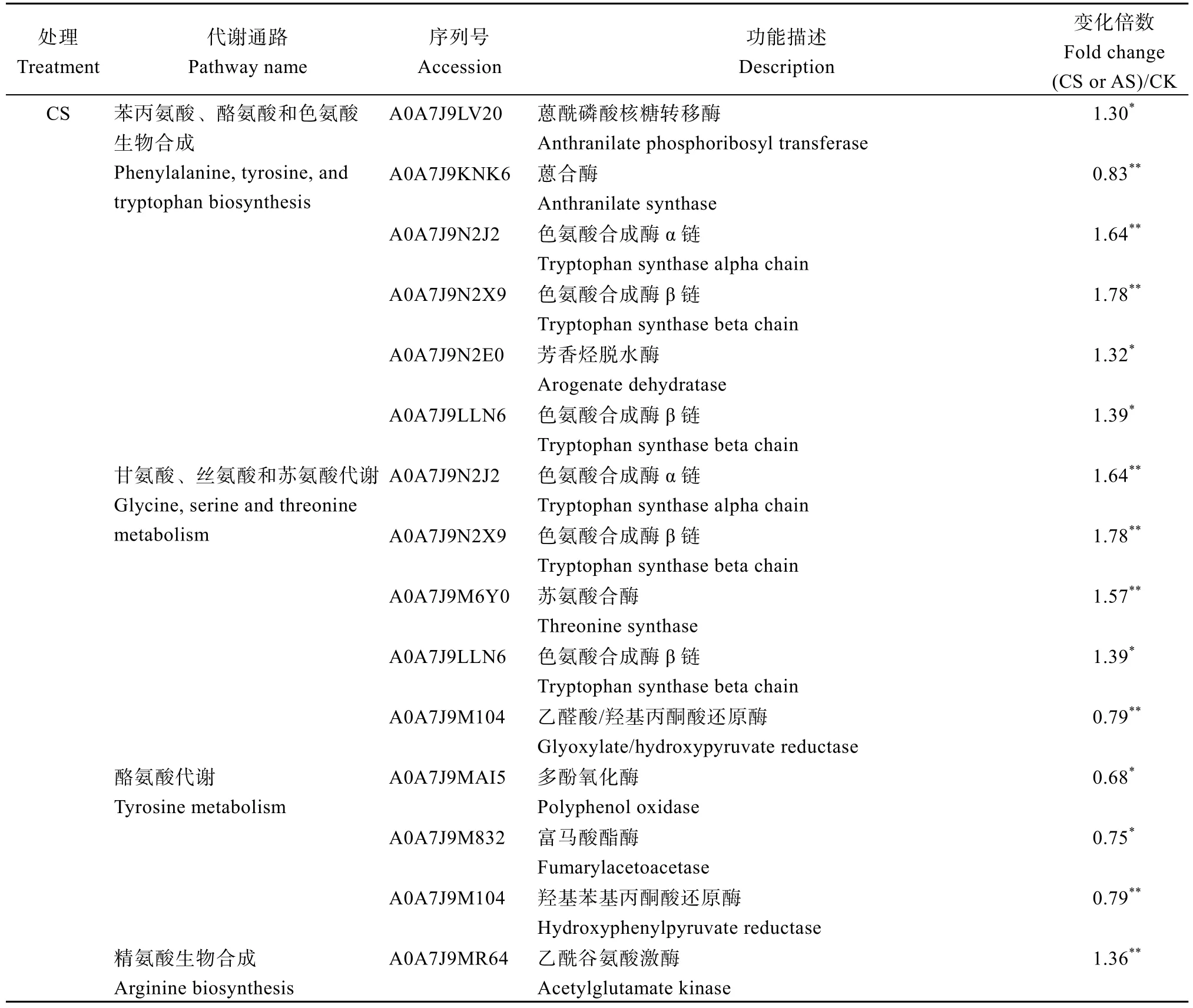
表4 盐胁迫和碱胁迫对棉花叶片氨基酸代谢的影响Table 4 Effects of salt stress and alkali stress on amino acid metabolism in cotton leaves
2.5.3 盐碱胁迫对蛋白代谢的影响 盐胁迫显著影响棉花的蛋白代谢(图7)。在翻译过程中鉴定出A0A7J9LL71、A0A7J9KLS8和A0A7J9L4K0等17种下调的差异表达蛋白, A0A7J9L9A3、A0A7J9MWW3和A0A7J9KLG5等7种上调的差异表达蛋白。在复制和修复过程中鉴定出A0A7J9MXY4、A0A7J9NCX9和A0A7J9L4L7三种下调的差异表达蛋白。在转录过程中鉴定出A0A7J9MIT1、A0A7J9M695和A0A7J9MD18等14种下调的差异表达蛋白,A0A7J9MWW3和A0A7J9NCB8两种上调的差异表达蛋白, 在折叠、分类和降解过程中鉴定出A0A7J9MGF0、A0A7J9KSZ2和A0A7J9NCX9等4种下调的DEPs, A0A7J9MJ25、A0A7J9M3Z4和A0A7J9LI11等9种上调的差异表达蛋白。
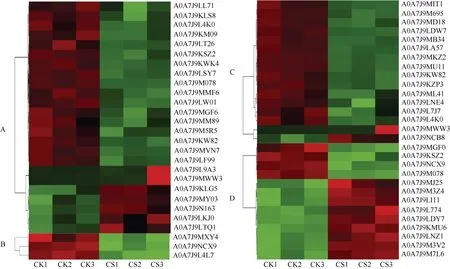
图7 盐胁迫对蛋白代谢的影响Fig. 7 Effect of salt stress on protein metabolism
碱胁迫下, 在转录过程中鉴定出A0A7J9MB34、A0A7J9MKZ2和A0A7J9LPI7等4种下调的差异表达蛋白, 只鉴定出A0A7J9MB34上调。在折叠、分类和降解过程中只鉴定出A0A7J9KVF5、A0A7J9LPI7和A0A7J9MAQ0等4种下调的差异表达蛋白。在翻译过程中鉴定出A0A7J9N9C7、A0A7J9M8X9和A0A7J9LZC0等5种下调的差异表达蛋白, A0A7J9KSH5、A0A7J9L5N4和A0A7J9MB54等14种上调的差异表达蛋白(图8)。
2.5.4 盐碱胁迫对棉花叶片信号传导的影响 盐碱胁迫对棉花叶片信号传导的影响如表5所示。CS处理富集了AMPK信号通路和MAPK信号通路等5条信号传导途径, AS只富集了植物激素信号转导和mTOR信号通路两条信号传导途径。在CS处理下,AMPK信号通路中A0A7J9L324和A0A7J9MBY1蛋白显著上调, mTOR信号通路中A0A7J9LJA3和A0A7J9MBY1蛋白显著上调, 在其他3条信号传导途径中都筛选出2个差异表达蛋白(1个上调, 1个下调)。在AS处理下, 植物激素信号转导中筛选出A0A7J9LIK5和A0A7J9MIA1两个显著上调的蛋白,mTOR信号通路中筛选出A0A7J9LJA3和A0A7J9MBY1两个显著上调的蛋白。
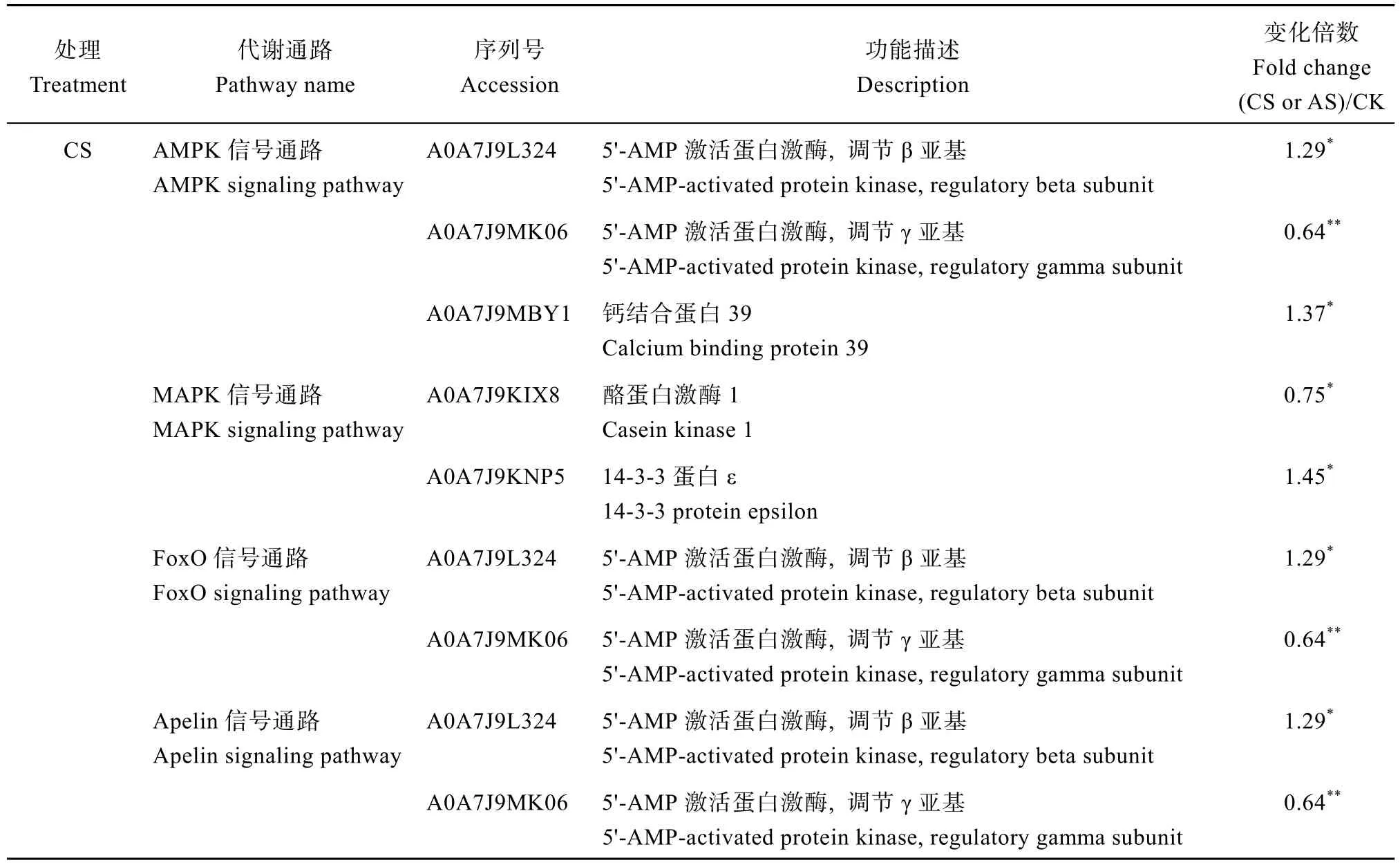
表5 盐胁迫和碱胁迫对棉花叶片信号传导的影响Table 5 Effects of salt stress and alkali stress on signal transduction in cotton leaves
3 讨论
盐碱胁迫严重抑制作物生长发育, 为了抵御盐碱胁迫, 植物进化出离子稳态、渗透调节、信号传导和复杂代谢过程等机制[9]。为进一步探讨棉花适应盐碱胁迫的机制, 我们从蛋白质组学的角度进行分析。结果显示, 盐胁迫和碱胁迫下分别有458和240种蛋白质表达发生显著改变。但是从亚细胞定位分析来看, 盐碱胁迫对棉花的影响差异不显著,变化最明显的位置均为细胞核和细胞质。对蛋白质进行同源分类后发现, 盐胁迫和碱胁迫下大多数差异表达蛋白参与翻译后修饰、蛋白质周转、伴侣, 翻译、核糖体结构和生物发生, 氨基酸运输和代谢以及信号转导机制, 而参与能源生产和转换的蛋白为盐胁迫特有, 参与脂质运输和代谢的蛋白为碱胁迫特有。通过KEGG分析我们发现关键蛋白主要参与糖类代谢, 蛋白质修饰, 氨基酸代谢, TCA循环, 细胞壁合成, 尽管叶片中有一些相同的通路参与耐盐和耐碱胁迫, 但它们可能在同一代谢途径中触发不同的蛋白质, 下面将进一步讨论这些盐反应蛋白的分子功能和主要代谢途径。
3.1 盐胁迫和碱胁迫对棉花叶片光合作用的影响
盐碱胁迫显著抑制了棉花生长, 生物量存在不同程度的降低。光合作用是将光能转化为化学能增加生物量的重要生化过程[16]。盐胁迫显著抑制了棉花的光合作用, 而碱胁迫对光合作用无抑制作用甚至还有促进光合作用的趋势, 但大多数研究认为碱胁迫会抑制光合作用[28-29]。叶绿体是进行光合作用的重要场所, 通过对差异表达蛋白进行亚细胞定位分析发现, 盐胁迫下叶绿体和叶绿体膜中发现77个差异表达蛋白, 碱胁迫下发现了50个, 同样在KEGG分析中发现光合作用是盐胁迫下变化最大的代谢通路之一。结果显示, 属于析氧复合物的psbA、psbB、psbC和psbO在盐胁迫下表达显著减少, 而OEC是PSII蛋白复合体重要的组成部分[30], 这将严重限制棉花叶片的光捕获过程, 但有研究显示盐胁迫对OEC活性并没有显著影响[31]。同时psaD和psaF表达的减少可能会降低棉花对光的利用效率[32],petB和petF的下调减少了电子转移, 影响了ATP和NADPH的形成[33]。这无疑是盐胁迫抑制光合作用的重要原因, 但碱胁迫下与光和作用相关的蛋白并没有显著降低表达, 反而PsbS表达增加。这说明碱胁迫下棉花生物量降低并不是因为光合产物减少,而是因为光合产物用于自身组织生产的比例减少,转而行使其他功能。
3.2 盐胁迫和碱胁迫对棉花叶片碳水化合物和能量代谢的影响
植物的生长发育和应对胁迫需要大量能量[34-35]。碳水化合物和能量代谢对于植物耐盐碱胁迫的反应至关重要, 因为它们可以快速调整代谢过程, 为植物提供足够的能量来应对胁迫[36-38]。己糖激酶、磷酸果糖激酶和丙酮酸激酶是糖酵解过程中的限速酶,盐碱胁迫都显著增加了上述酶的活性, 这表明糖代谢过程在盐碱胁迫下都显著增强, 为棉花提供更多的能量和其他代谢途径的底物。大多数研究都认为糖代谢被是不同非生物胁迫下的共同反应, 对于植物适应环境胁迫起着至关重要的作用[39-40]。另一方面, 丙酮酸激酶表达增加促进了草酰乙酸和苹果酸的转化积累, 同样有研究显示碱胁迫显著促进丙酮酸激酶的上调[41]。TCA循环为氨基酸生物合成和能量代谢提供了必需的前体, 并且在响应非生物应激源方面也起着关键作用[42]。研究发现, 盐碱胁迫促进了参与TCA循环的柠檬酸合酶和苹果酸脱氢酶活性。柠檬酸合酶是TCA循环中的第一个限速酶, 它活性的提高促进了草酰乙酸和乙酰辅酶A缩合产生柠檬酸和用于ATP生产的CoA。苹果酸脱氢酶催化苹果酸和草酰乙酸之间可逆的相互转化, 能够将苹果酸脱氢转化为草酰乙酸或将草酰乙酸还原成苹果酸, 但主要趋向于苹果酸的合成[43-44], 苹果酸作为TCA循环的中间产物为作物生长发育提供能量, 对于提高作物耐盐性具有重要作用。除此之外我们发现盐胁迫下氧化磷酸化、2-氧羧酸代谢和脂肪酸代谢等提供能量的代谢过程显著富集。在氧化磷酸化代谢中ATP合酶亚单位γ (A0A7J9LUR9)等8个蛋白显著表达, 促进了ATP的形成。在2-氧羧酸代谢中乙酰羟基酸还原异构酶(A0A7J9KP33)等3个蛋白显著上调, 脂肪酸代谢中β-酮酰基-[酰基载体蛋白]合酶I(A0A7J9M364)等3个蛋白表达上调。呼吸作用的增强会消耗大量的碳, 就导致参与新生组织的碳减少[45]。但是淀粉和蔗糖代谢被抑制, 磷酸蔗糖合酶表达下降, 这就导致棉花生产蔗糖的能力降低。碱胁迫下棉花的能量代谢虽然发生富集, 但并没有表现出强化还是减弱, 只有丁酸代谢和硫代谢表现出明显的增强。所以盐胁迫下棉花呼吸消耗有机物的量大于碱胁迫。之前我们的研究表明, 碱胁迫下,棉花根系中有机酸明显积累, 因此光合产物可能运往根部合成有机酸[46]。
3.3 盐胁迫和碱胁迫对棉花叶片氨基酸的生物合成和代谢的影响
氨基酸生物合成和新陈代谢对于植物生长, 发育和对应激源的反应至关重要[47]。结果显示, 谷草转氨酶和谷氨酸脱氢酶在盐碱胁迫下的活性显著增加, 利用糖酵解和柠檬酸循环提供的碳骨架酮酸为两大氨基酸家族提供了充足的谷氨酸和天冬氨酸。一方面氨基酸作为重要的相容溶质, 增强氨基酸的合成对棉花渗透调节和维持细胞膜稳定性具有重要作用[48]。此外, 氨基酸可作为抗氧化剂清除植物细胞中的自由基, 从而促进耐盐植物在盐胁迫下的生长[21]。氨基酸还在某些代谢途径中充当最终代谢物的中间体, 以及参与多种代谢途径和其他生理和生化途径的调节, 从而影响植物中的许多生理过程[49]。盐胁迫和碱胁迫都促进了苯丙氨酸、酪氨酸和色氨酸的合成。苯丙氨酸、酪氨酸和色氨酸是蛋白质合成的重要组成部分, 位于许多生长激素和次级代谢物的上游, 对于抵抗盐碱胁迫具有重要作用[50]。酪氨酸也是许多具有不同生理作用的特殊代谢物的前体, 例如非蛋白质氨基酸、引诱剂和防御化合物[51]。色氨酸是合成大量生物活性分子中必不可少的氨基酸, 在植物生长发育和胁迫反应的调控中起着举足轻重的作用[52]。虽然盐碱胁迫都促进了苯丙氨酸、酪氨酸和色氨酸生物合成来, 但是其影响的蛋白却不尽相同。盐胁迫和碱胁迫都是因为蒽醌磷酸核糖基转移酶(A0A7J9LV20)、色氨酸合酶(A0A7J9N2J2)和精氨酸脱水酶的表达增加, 但是精氨酸脱水酶似乎有点不同, 盐胁迫是精氨酸脱水酶(A0A7J9N2E0)而碱胁迫是精氨酸脱水酶(A0A7J9MCV6)。除此之外, 盐胁迫还促进了精氨酸的生物合成, 碱胁迫促进了缬氨酸、亮氨酸、异亮氨酸的合成。精氨酸合成多胺, 参与植物对胁迫的反应[53], 异亮氨酸作为渗透调节因子在植物逆境抵抗中起着关键作用, 在能量不足的情况下, 异亮氨酸分解代谢会直接进入三羧酸循环[54]。氨基酸作为生命活动的基础物质,保证氨基酸合成和代谢的正常进行是保证作物生存的基础, 因此氨基酸代谢和合成在盐碱胁迫下都得到了促进, 也是光和作用产物的重要去处。
3.4 盐胁迫和碱胁迫对蛋白代谢的影响
遗传信息的复制、转录、翻译和修复是响应和适应盐碱胁迫的关键过程[55]。盐胁迫下, 剪接体和RNA聚合酶中与转录相关的14种蛋白质全部下调,其中包括富含丝氨酸/精氨酸的核磷酸蛋白(SR蛋白)。SR蛋白在前体mRNA的剪接机制中发挥着特有的调控作用, 而SR蛋白的下调降低了靶基因和其他剪接因子的剪接效率[56-57]。在真核生物中, 前体mRNA的剪切是基因表达调控的重要机制, 同一个前体mRNA经过一系列的加工过程可以形成不同的成熟mRNA, 从而翻译出很多功能不同的蛋白质,因此盐胁迫对SR蛋白表达的抑制可能会破坏剪接体复合物的稳定性, 在一定程度上准确识别剪接位点从而特异性表达对耐盐性有重要作用的蛋白[58]。在翻译过程中, 我们观测到mRNA监测途径、氨酰tRNA生物合成和核质运输有关的14种蛋白质全部下调, 在核糖体中检测到的12种蛋白质却表现出不同的变化趋势, 但是下调的蛋白质数量占到7种。这意味着棉花的转录和翻译在盐胁迫下受到抑制。在复制和修复过程中鉴定出的4种蛋白质全部下调。碱胁迫下, 鉴定出与转录相关的5种蛋白质全部位于剪接体中, 而且4种下调。鉴定出与翻译相关的19种蛋白质全部位于核糖体中, 14种上调。这表明碱胁迫抑制了棉花叶片的转录, 但促进了棉花叶片的翻译。
盐碱胁迫会导致蛋白质的错误表达, 而维持蛋白质的功能构象和去除有害的蛋白质对于细胞在各种非生物胁迫下的存活也至关重要, 因此植物会表达特定蛋白质将异常蛋白质重新折叠、分类或降解[59]。在本研究中, 盐胁迫显著促进了棉花叶片中蛋白质的折叠、分类和降解, 共鉴定出13种与其相关的蛋白质, 其中有9种上调, 分别位于内质网, RNA降解途径和蛋白质出口途径中。碱胁迫下显著抑制了棉花叶片中蛋白质的折叠、分类和降解, 鉴定出4种下调的与其相关蛋白质, 且全富集于内质网中的蛋白质加工过程。
3.5 盐胁迫和碱胁迫对棉花叶片信号传导的影响
当植物暴露在盐碱胁迫下时, 不同响应信号通路被激活以抵抗损害。盐胁迫下, AMPK信号通路、MAPK信号通路、FoxO信号通路、Apelin信号通路和mTOR 信号通路等途径显著富集。AMPK 信号通路参与细胞能量传感和稳态控制[60], 通路中PRKAB(A0A7J9L324)和CAB39(A0A7J9MBY1)上调可能使棉花更合理的调控能量代谢和分配, mTOR信号通路中ATPeV1D(A0A7J9LJA3)和CAB39(A0A7J9MBY1)显著上调。AMPK在缺乏营养或能量时被激活并对细胞生长进行制动, 而mTOR在能量或营养充足时被激活, 促进合成代谢活动加速细胞生长, 虽然它们都与营养感知和能量相关, 但作用却是相互对立的, 这说明盐胁迫下棉花的能量代谢更加复杂多变, 但正是它俩之间的微妙平衡确保了棉花能够生长[61]。碱胁迫下植物激素信号转导和mTOR 信号通路途径显著富集, 植物激素信号传导中AHP(A0A7J9LIK5)调节玉米素激活细胞分裂芽启动, mTOR通路同样促进合成代谢和加速细胞生长, 说明碱胁迫提高了棉花叶片细胞的活性。
4 结论
盐胁迫和碱胁迫均抑制棉花生长, 但是盐碱胁迫对棉花蛋白组的影响不同。盐胁迫下, 与光合作用相关的蛋白表达减少, 光合作用被显著抑制, 但是糖酵解、TCA循环、氨基酸合成和代谢、2-氧代羧酸代谢、氧化磷酸化和脂肪酸代谢增强, 转录、翻译、复制和修复被抑制, 蛋白质折叠、分类和降解被促进, AMPK信号通路、mTOR信号通路被激活。碱胁迫对棉花光合作用无显著影响, 但是糖酵解、TCA循环、氨基酸合成和代谢、2-氧代羧酸代谢和硫代谢增强, 转录以及蛋白质折叠、分类和降解被抑制, 翻译被促进, mTOR信号通路和植物激素信号转导被激活。盐胁迫下棉花消耗更多的光合产物产生能量用于抵抗盐害, 碱胁迫下更多的光合产物可能运往根部合成有机酸。

