低温下环丙酸酰胺调控棉花内源激素促进噻苯隆脱叶的机制
孙尚文 束红梅 杨长琴 张国伟 王晓婧 孟亚利 王友华刘瑞显,*
1 南京农业大学农学院, 江苏南京 210095; 2 江苏省农业科学院经济作物研究所 / 农业农村部长江下游棉花与油菜重点实验室, 江苏南京 210014
脱叶催熟技术是实现棉花机械采收的重要前提,合理喷施脱叶催熟剂, 不仅促进棉花集中吐絮, 而且加快收获前叶片的脱落, 提高机采棉的采摘率和作业效率[1]。噻苯隆(thidiazuron, TDZ)是目前棉花生产中使用最广泛的化学脱叶剂[2], 但是, TDZ对环境温度比较敏感, 其喷施标准要求平均气温>16℃和最低温度>12℃[3]。但在我国主产棉区, 棉花收获期常遭遇低温天气导致噻苯隆脱叶效果下降, 不能满足机械化采收的需要[4]。
TDZ诱导棉花叶片脱落是一个多种内源激素相互配合的连续过程[5], 其中, 生长素吲哚乙酸(indole-3-acetic acid, IAA)是脱落的有效抑制剂, 而乙烯(ethylene, ET)是促进脱落的主要激素[6]。TDZ通过诱导棉叶离层IAA合成基因YUCCAs、代谢基因ILRs以及运输基因PINs、LAXs表达量的显著降低,促进离层中IAA的含量降低, 从而导致IAA下游信号被阻断, IAA信号响应因子IAAs、ARFs下调表达,令离层对ET敏感度增加[6-8]。同时, TDZ还诱导棉花离层中ET关键合成酶基因ACSs和ACOs的上调表达, 促进离层中ET前体1-氨基环丙烷羧酸(1-aminocyclopropanecarboxylic acid, ACC)含量的增加并有利于ET合成, 进而诱导脱落必需的ET下游响应因子ERFs在离层中上调表达, 正向调控脱落[6-13]。此外, 除IAA和ET, 脱落酸(abscisic acid,ABA)和茉莉酸(jasmonic acid, JA)也参与脱落[10]。TDZ诱导棉花离层中多个ABA合成基因和代谢基因上调表达[10,14-15]、JA含量短暂增加和调控因子JAZs上调表达[6,16]。我们前期研究表明, TDZ通过调节内源激素信号传导途径促进棉叶脱落, 但在低温下棉叶离层内IAA和ET的合成、信号转导通路对TDZ的响应受到明显抑制, 这可能是低温下棉花化学(TDZ)脱叶受抑制的主要原因[6]。
环丙酸酰胺(cyclanilide, CYC)是一种丙二酸酯,具有抑制植物体内生长素极性运输的能力[17], CYC单独使用没有脱叶效应, 但添加CYC可增强脱叶剂的脱叶效果。在16~30℃, CYC 和乙烯利(ETH)联合使用可使棉叶脱落率由25%提升到80%左右[18]。本研究团队前期研究发现CYC和TDZ复配使用可明显提高低温下棉花脱叶率[19], 但作用机制尚不明确。而内源激素作为叶片脱落的主要信号因子, 其如何参与低温下CYC和TDZ复配促进棉花落叶的过程尚不清楚。
因此, 本研究深入分析了不同环境温度下CYC对棉花化学(TDZ)脱叶过程中离层中IAA、ACC、ABA和JA等内源激素含量变化及这些激素合成、代谢、运输和信号转导的相关基因的表达的影响,为明确低温下CYC促进TDZ诱导棉叶脱落的生理机制提供了思路。
1 材料与方法
1.1 试验材料
本试验选用中棉425品种作为材料。种子经过催芽处理后, 播种在装有基质和蛭石(体积比为2∶1)的盆钵中, 置于温室中, 温度设置为白天27℃,夜间23℃, 自然光照培养, 待棉花长至五叶期移入光照培养箱进行处理。
1.2 试验设计
本试验设2个温度条件, 常温25℃ (27℃日/23℃夜) (normal temperature, N)和低温15℃ (17℃日/13℃夜) (low temperature, L), PPFD设为80 μmol m-2s-1, 光照周期为12 h。在2个温度条件下分别设置清水处理(对照, 标记为CK), 单独0.1% TDZ溶液处理(TDZ, 标记为T), 0.1% TDZ和0.03% CYC复配溶液处理(TDZ+CYC, 标记为TC)。试验分为6个组合, 25℃条件下CK处理、TDZ处理、TDZ+CYC复配处理和15℃条件下CK处理、TDZ处理、TDZ+CYC复配处理。
1.3 棉叶脱落率
记录每个处理的处理前叶片数, 棉花脱叶率调查从处理后24 h开始, 至处理后240 h结束, 每24 h调查一次各处理的剩余叶片数, 总计10次调查, 3次重复。棉叶脱落率的计算公式为 :
棉叶脱落率= (处理前叶片数-剩余叶片数)/处理前叶数×100%
1.4 内源激素提取和测定
1.4.1 离层组织取样与保存 25℃条件下在脱叶剂处理后12 h、24 h和48 h, 15℃条件下在脱叶剂处理后24 h、48 h和144 h, 选择棉花倒二叶、倒三叶离层组织用手术刀切下并用液氮速冻后保存在–80℃冰箱中。
1.4.2 IAA、ABA、JA的提取、纯化与检测 准确称量100 mg倒二叶、倒三叶离层样品, 液氮磨碎后, 在5 mL离心管中用1 mL提取液(2-丙醇∶H2O∶HCl = 2∶1∶0.002), 4℃震荡提取30 min。再加入2 mL二氯甲烷, 4℃震荡提纯30 min, 4℃、10,206.9×g离心5 min, 收集下清液用氮气吹干, 甲醇复溶后用高效液相色谱-串联质谱仪检测IAA、ABA、JA的含量, 重复3次。
1.4.3 ACC的提取、纯化与检测 准确称量100 mg倒二叶、倒三叶离层样品, 液氮磨碎后, 在5 mL离心管中用1 mL去离子水4℃震荡提取30 min。取上清并用0.1%乙酸将pH值调至4以下, 用等体积氯仿混匀, 洗涤一次, 取水相。过MCX固相萃取小柱, 分别用2 mL甲醇和1 mL水洗涤小柱, 最后用1 mL 1 mol L–1的氨水甲醇溶液洗脱, 收集并用氮气吹干。流动相(甲醇∶0.1%乙酸 = 1∶9)溶解后, 用高效液相色谱-串联质谱仪检测ACC含量, 重复3次。
1.5 内源激素相关基因的表达分析
利用擎科生物的RNAprep Pure多糖多酚植物总RNA提取试剂盒(离心柱型)提取棉叶离层RNA。利用擎科生物的SynScript III cDNA Synthesis Mix试剂盒应制备cDNA。按照擎科生物荧光定量试剂盒2× TSINGKE Master qPCR Mix (SYBR Green I)的反应体系和对应程序进行实时定量PCR分析(real-time quantitative polymerase chain reaction,qRT-PCR), 设3次重复。采用2-ΔΔCt法计算基因相对表达量。使用Primer primier 5软件设计引物, 引物序列见表1。

表1 引物及其序列Table 1 Primers and their sequences
1.6 数据处理
使用Microsoft Excel 2010对数据进行统计分析,使用SPSS 2019对数据通过最小显著差异法和邓肯检验进行显著性检验, 将数据与分析结果通过Origin 2017绘图。
2 结果与分析
2.1 不同处理的棉花脱叶率
常温(25℃)条件下, 脱叶剂使用24 h后, TDZ+CYC复配处理棉叶开始脱落, 72 h后TDZ+CYC复配处理棉叶全部脱落; 而TDZ处理48 h后棉叶开始脱落, 在处理96 h后棉叶全部脱落。在低温(15℃)下, 脱叶剂使用144 h后, TDZ+CYC复配处理棉叶开始脱落, TDZ处理棉叶处理168 h后开始脱落。在处理后240 h, TDZ+CYC处理棉叶脱叶率为79.6%, TDZ处理脱叶率为53.0% (图1)。说明,低温显著延迟了TDZ处理的脱叶时间, 降低了TDZ处理的脱叶效果, 与TDZ处理相比, 低温下TDZ+CYC复配处理棉叶脱落时间提前且脱叶率上升。
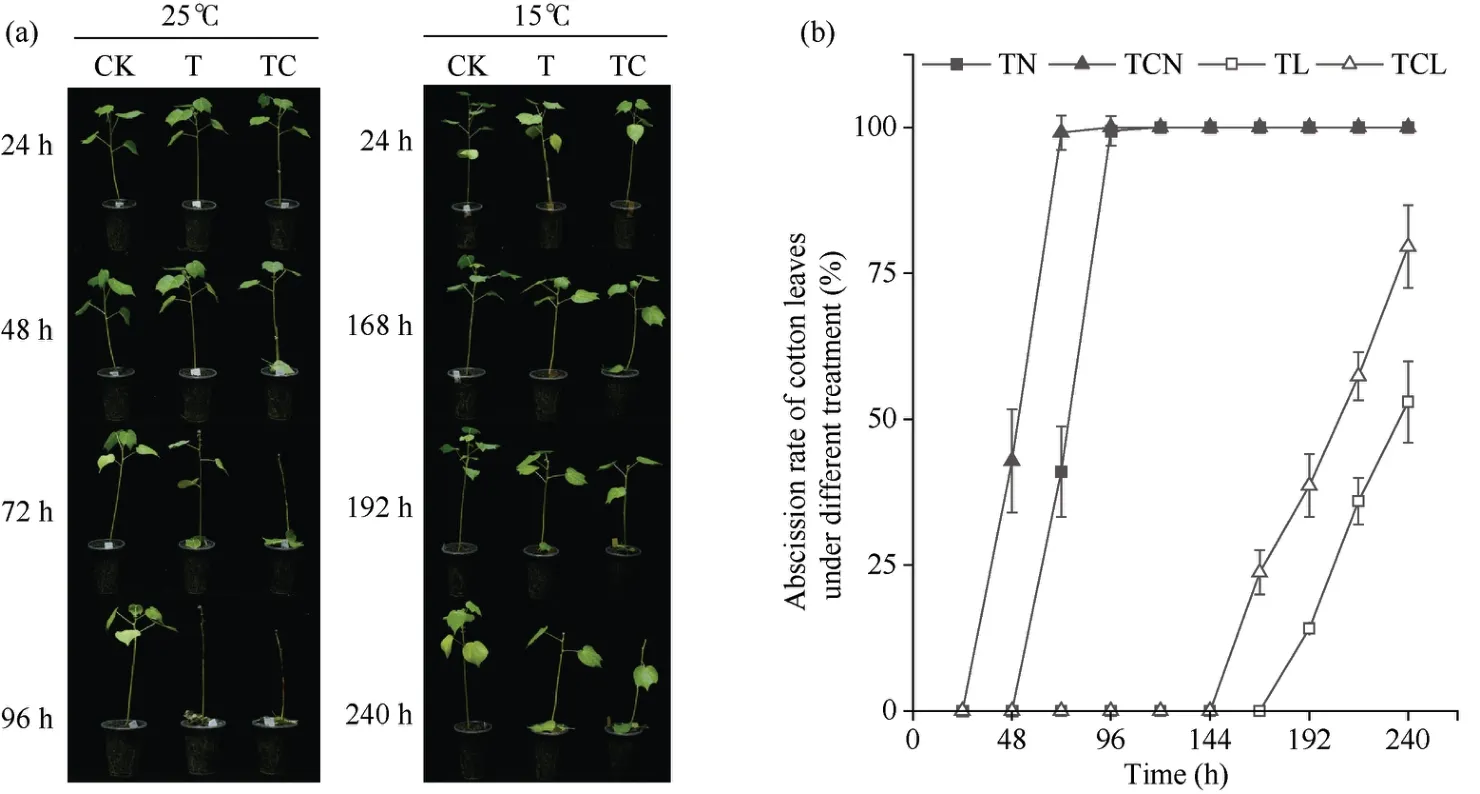
图1 不同处理棉花叶片脱落率Fig. 1 Abscission rate of cotton leaves under different treatments
2.2 棉叶离层中内源激素含量的变化
2.2.1 棉叶离层中IAA含量 由图2可知, 常温条件下, 相较于CK, TDZ+CYC处理离层中IAA含量在处理后12 h显著降低, 而TDZ处理离层中IAA含量在处理后48 h才显著下降(图2-a)。在低温条件下, TDZ+CYC处理离层中IAA含量在处理后24 h显著低于CK、TDZ处理, TDZ处理离层中IAA含量在处理后144 h才显著低于CK, 但仍高于TDZ+CYC处理(图2-b)。说明常温条件下TDZ和TDZ+CYC复配均可诱导棉叶离层中IAA含量降低,低温延迟了TDZ对棉叶离层中IAA含量的调控, 而相较于TDZ, 低温下TDZ+CYC复配能够提前且更多地降低棉叶离层中IAA含量。
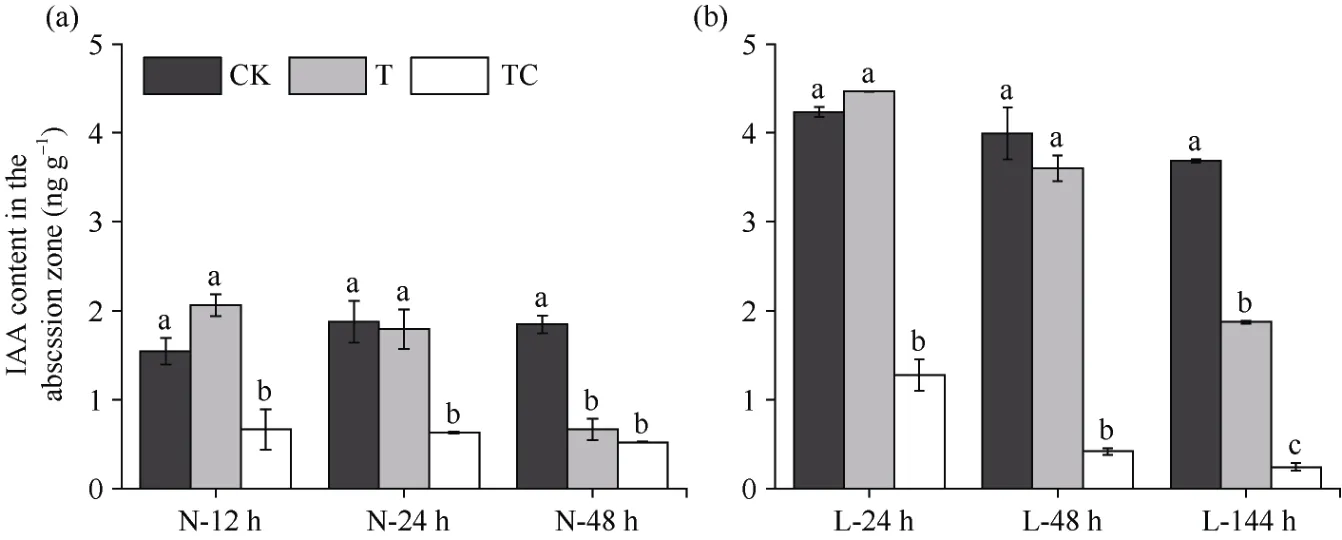
图2 不同处理棉叶离层IAA含量变化Fig. 2 Changes of IAA content in the abscission zone of cotton leaves under different treatments
2.2.2 棉叶离层中ACC含量 由图3可知, 常温条件下, TDZ处理后48 h离层中ACC含量较CK显著升高, 而TDZ+CYC处理离层中ACC含量在处理后24 h明显高于CK (图3-a)。低温条件下, TDZ处理和TDZ+CYC处理离层中ACC含量均在处理后144 h明显升高,且TDZ+CYC处理ACC含量显著高于TDZ处理(图3-b)。说明, 常温条件下TDZ和TDZ+CYC复配诱导棉花叶片离层中ACC含量升高, 但低温延迟了TDZ对棉叶离层中ACC含量的调控, 而相较于TDZ, 低温下TDZ+CYC复配可显著提高棉叶离层中ACC含量。
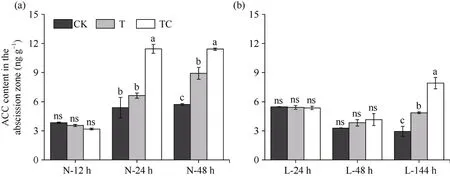
图3 不同处理棉叶离层ACC含量变化Fig. 3 Changes of ACC content in the abscission zone of cotton leaves under different treatments
2.2.3 棉叶离层中ABA含量 比较不同处理棉叶离层中ABA含量发现(图4), 相较于CK, 常温条件下, TDZ+CYC处理离层中ABA含量在处理后12 h、24 h显著降低, TDZ处理离层中ABA含量在处理后48 h才显著下降(图4-a)。在低温条件下, 3个时间点TDZ处理离层中ABA含量均显著下降, 而TDZ+CYC处理离层中ABA含量仅在处理后48 h、144 h显著低于对照, 但明显低于TDZ处理(图4-b)。结果表明, 不同温度条件下TDZ和TDZ+CYC复配均可诱导棉叶离层中ABA含量下调, 而相较于TDZ, 低温下TDZ+CYC复配诱导棉叶离层中ABA含量显著降低。
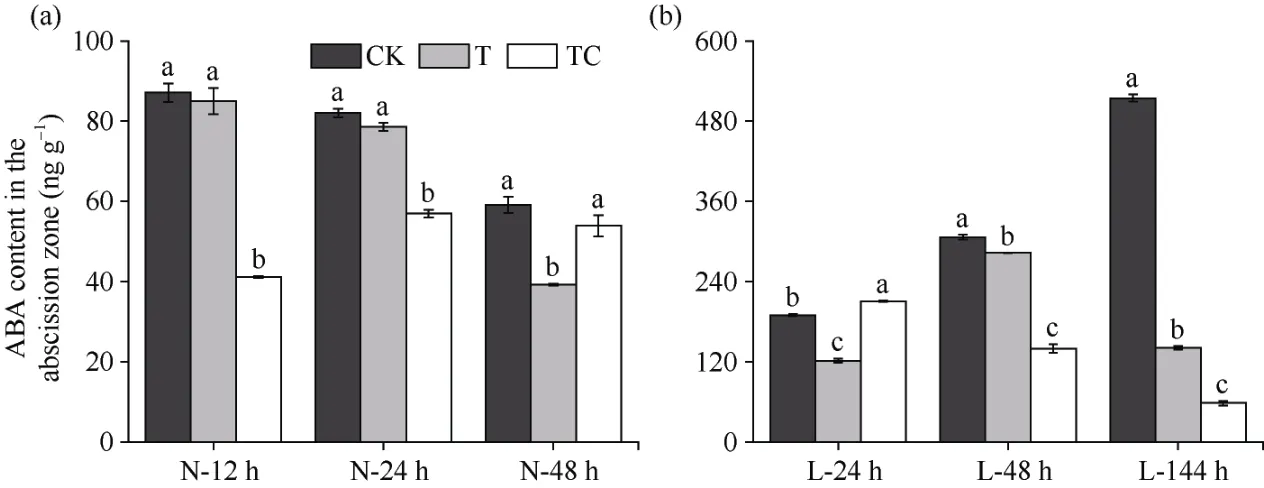
图4 不同处理棉叶离层ABA含量变化Fig. 4 Changes of ABA content in the abscission zone of cotton leaves under different treatments
2.2.4 棉叶离层中JA含量 由图5可知, 常温条件下, TDZ处理离层中JA含量在3个时间点均较CK显著下降, 而TDZ+CYC处理离层中JA含量在处理后12 h和24 h较CK显著升高, 但在处理后48 h明显低于CK (图5-a)。低温条件下, TDZ处理离层中JA含量与CK没有显著差异, 而TDZ+CYC处理的离层中JA含量在处理后24 h和48 h较TDZ处理显著上升(图5-b)。这说明, 常温条件下TDZ诱导棉叶离层中JA含量下降, 低温抑制了TDZ对棉叶离层中JA含量的调控。而不同温度下TDZ+CYC复配在脱落前期可诱导棉叶离层中JA含量升高。
2.3 棉叶离层中内源激素相关基因的表达分析
2.3.1 棉叶离层中IAA相关基因的表达 从图6可知, 常温条件下, TDZ和TDZ+CYC处理后棉叶离层中IAA运输相关基因LAX2和PIN1相对表达量在3个时间点均显著低于CK。TDZ+CYC处理后12 h至48 h棉叶离层中IAA9和ARF3表达量显著低于对照, 而TDZ处理的棉叶离层中IAA9和ARF3表达量分别在处理后24 h、48 h才低于CK (图6-a)。在低温条件下, TDZ+CYC处理棉叶离层中LAX2、PIN1、IAA9和ARF3表达量在所有时间点均显著低于CK,而TDZ处理棉叶离层中ARF3和LAX2表达量在处理后24 h、IAA9表达量在处理后48 h、PIN1表达量在处理后144 h才显著低于CK。且TDZ+CYC处理棉叶离层中LAX2、PIN1、IAA9和ARF3基因表达量在处理后24 h、48 h均显著低于TDZ处理。而在144 h, TDZ+CYC处理棉叶离层中仅ARF3基因表达量低于TDZ处理(图6-b)。说明常温下TDZ和TDZ+CYC复配均可抑制棉叶离层中IAA运输和信号相关基因表达, 低温抑制了TDZ对棉叶离层中IAA相关基因的调控, 而低温下TDZ+CYC复配相较于TDZ不仅较早诱导棉叶离层IAA运输和信号相关基因下调表达, 且其下调幅度更大。
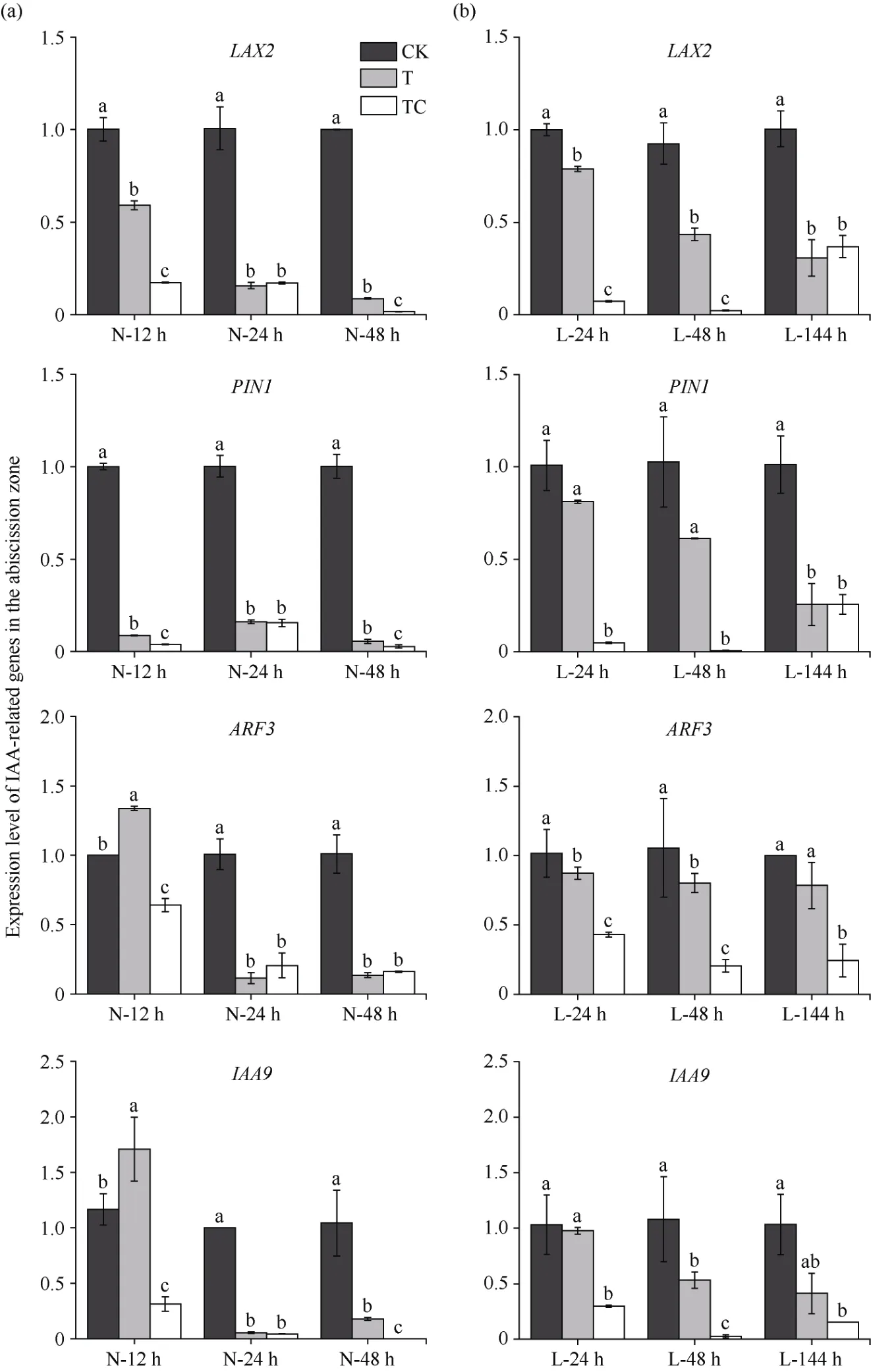
图6 不同处理棉叶离层中IAA相关基因表达量Fig. 6 Expression level of IAA-related genes in cotton leaves abscission zone under different treatments
2.3.2 棉叶离层中ET相关基因的表达 从图7可知, 常温条件下, 相较于CK, TDZ处理棉叶离层中ET合成基因ACO表达量在处理后12 h显著升高、ACS和ERF1B表达量在处理后48 h显著高于CK;而TDZ+CYC处理的棉叶离层中ACO和ERF1B表达量在处理后12 h显著高于CK、ACS表达量在处理后24 h显著高于CK (图7-a)。低温条件下,TDZ+CYC处理的棉叶离层中ERF1B表达量在处理后3个时间点均显著高于CK, 其ACS和ACO表达量在处理后144 h显著高于CK; 而TDZ处理的棉叶离层中ERF1B表达量在处理后48 h、144 h才显著高于CK, 且在处理后144 h, 棉叶离层中3个基因的表达量均低于TDZ+CYC处理(图7-b)。说明TDZ诱导棉叶离层中ET合成基因和信号基因上调表达,低温延迟了TDZ对ET相关基因的调控, 而在低温下TDZ+CYC复配处理相较于TDZ显著增加了棉叶离层中ET合成、信号基因的表达量。
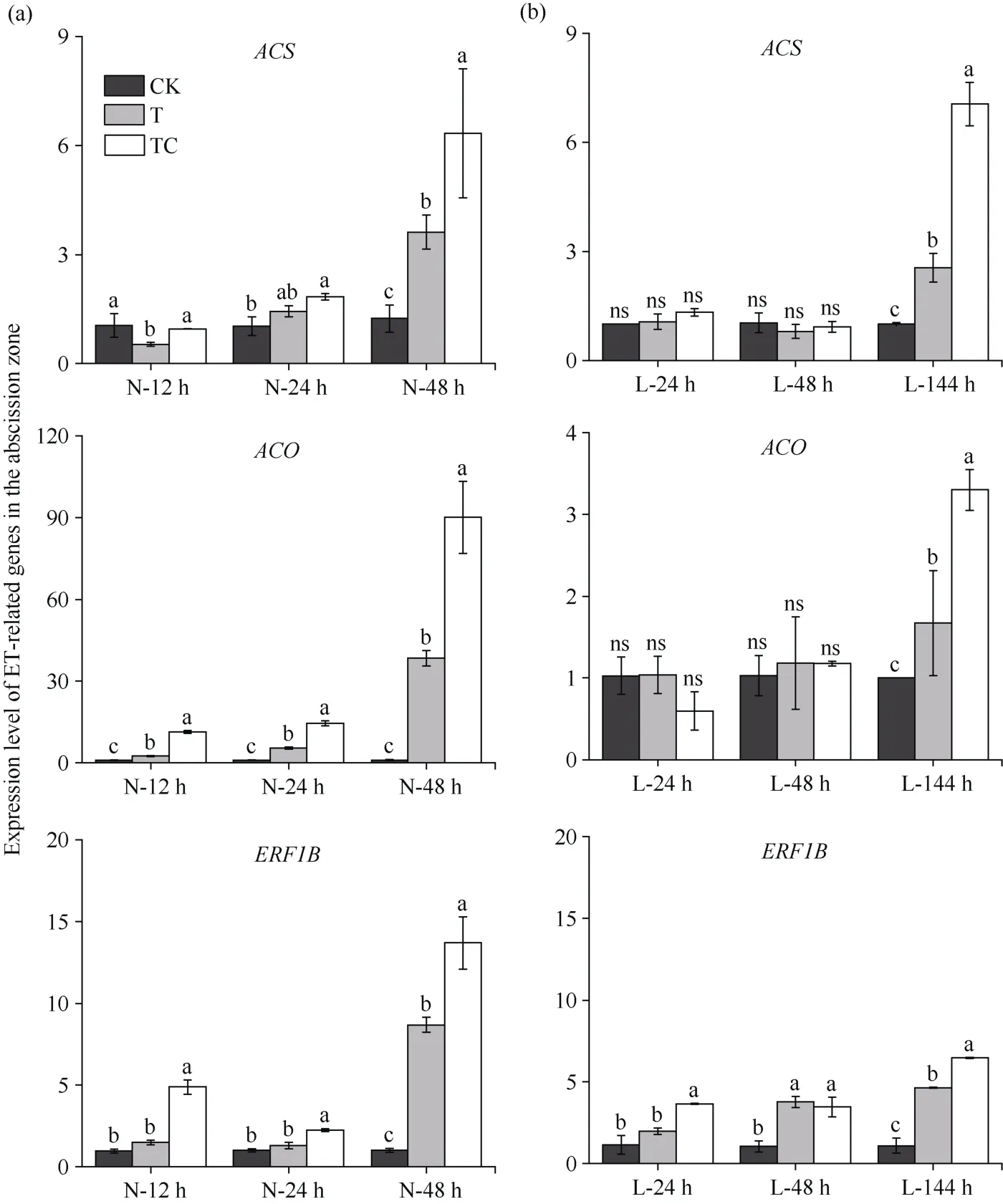
图7 不同处理棉叶离层中ET相关基因表达量Fig. 7 Relative expression level of ET-related genes in cotton leaves abscission zone under different treatments
2.3.3 棉叶离层中ABA相关基因的表达 由图8可知, 相较于CK, 常温条件下, TDZ和TDZ+CYC处理的棉叶离层中ABA代谢基因CYP707A4的相对表达量在所有时间点均显著升高, 而2个处理棉叶离层中ABA信号调控基因PP2C77相对表达量在处理后24 h、48 h显著高于CK (图8-a)。在低温条件下, TDZ+CYC处理棉叶离层中CYP707A4表达量在处理后48 h明显增加, 而TDZ处理棉叶离层中CYP707A4表达量在处理后144 h才显著升高, 且仍低于TDZ+CYC处理。此外, TDZ+CYC处理棉叶离层中PP2C77表达量在处理后144 h均显著高于CK(图8-b)。这说明, 常温下TDZ处理和TDZ+CYC处理促进了棉叶离层中ABA代谢和信号基因的表达,低温延迟了TDZ对棉叶离层中ABA相关基因的调控, 低温下TDZ+CYC处理不仅可较早地诱导棉叶离层中ABA代谢基因的上调表达, 并且显著增加了代谢基因的表达量。
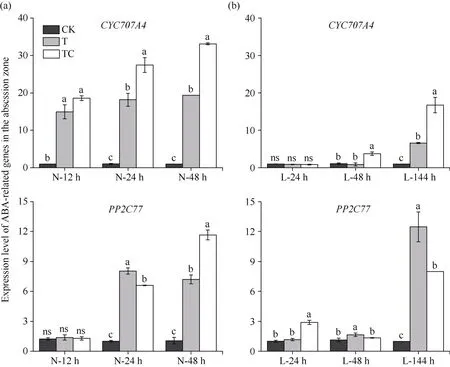
图8 不同处理棉叶离层中ABA相关基因表达量Fig. 8 Expression level of ABA-related genes in cotton leaves abscission zone under different treatments
2.3.4 棉叶离层中JA相关基因的表达 由图9可知, 常温条件下, TDZ+CYC处理的棉叶离层中JA合成基因AOC4和信号基因TIFY9表达量在3个时间点均高于CK, 而TDZ处理棉叶离层中AOC4表达量在3个时间点均低于CK,TIFY9表达量在处理后24 h、48 h才显著高于CK (图9-a)。在低温条件下, TDZ+CYC处理棉叶离层中TIFY9表达量在所有时间点均高于CK, TDZ仅在处理后24 h、48 h诱导棉叶离层中TIFY9上调表达, 且仍低于TDZ+CYC处理。另外, TDZ+CYC处理后24 h、48 h棉叶离层中AOC4表达量明显高于CK, 而TDZ处理对该基因没有显著影响(图9-b)。表明, 常温条件下, TDZ和TDZ+CYC对棉叶离层中JA合成和信号相关基因的表达具有调控作用, 但两者对AOC4的调控呈相反趋势, 这与两处理离层中JA含量变化相符, 低温抑制TDZ对棉叶离层中AOC4的调控, 相较于TDZ处理, 在低温下TDZ+CYC复配显著增加棉叶离层中JA合成、信号基因表达量。
3 讨论
TDZ诱导的棉叶脱落效果受环境温度影响[4]。本研究发现低温(15℃)下TDZ单剂诱导240 h后的棉花脱叶率仅50%左右, 而TDZ+CYC复配处理的棉叶脱落开始时间较TDZ单剂处理提前24 h, 并且显著提高脱叶率至80%左右, 说明TDZ+CYC复配可有效改善低温下棉叶的脱叶效果。TDZ作为调节剂型的脱叶剂, 主要通过调控棉叶离层中内源激素合成、代谢、信号转导过程诱导棉叶脱落, 且本实验室前期研究表明, TDZ对棉叶离层中内源激素合成、信号转导途径相关基因的调控受低温影响[6]。为此, 本研究从棉叶离层中激素含量及相关基因的表达水平方面, 分析了低温下TDZ单剂与TDZ+CYC复配对棉叶离层的作用差异。结果表明, 低温下, 相较于TDZ处理, TDZ+CYC复配对棉叶离层内源激素的合成和信号转导具有明显的调控作用。
离层中IAA持续极性运输的中断是诱导植物器官脱落的主要因素[20-21]。CYC具有IAA运输抑制剂的功能, 因此本文首先分析了棉叶离层中IAA含量、IAA运输、信号转导途径相关基因的表达的变化特征。研究表明, 在正常温度条件下, TDZ+CYC复配处理棉叶离层中IAA运输相关基因(LAXs、PINs)的下调表达, 离层IAA含量显著降低[22-25]。本研究发现在低温下, 相较于TDZ单剂, TDZ+CYC复配可快速降低离层中PIN1和LAX2的表达量, 以及离层IAA含量, 表明TDZ+CYC复配在低温下也可有效抑制棉叶离层中的IAA运输。此外本研究发现低温下TDZ+CYC复配较早地诱导生长素信号基因(IAA9、ARF3)下调表达。IAA9和ARF3分别属于AUX/IAAs家族和ARFs家族,AUX/IAAs的表达量与IAA含量正相关, 多个AUX/IAAs基因被发现能够抑制脱落[26]。转录因子ARF1,7,19在脱落过程中伴随IAA含量降低而下调表达, 其具有延缓脱落的功能[27-28]。说明相较于TDZ单剂, CYC发挥了IAA运输抑制剂的功能, 阻碍了IAA从叶片向离层细胞的运输[29], 使得低温下TDZ+CYC复配处理离层IAA含量快速降低, 离层中IAA信号基因IAA9和ARF3基因的表达量下降, 减弱了IAA对脱落的抑制作用,从而有助于棉叶脱落。
ET的合成与信号转导在棉叶脱落过程中有重要作用, 本研究发现低温抑制TDZ对ET合成基因的调控, 而TDZ+CYC复配在低温下可显著提高棉花离层中ACS和ACO的表达量、增加离层中ACC含量。ACS将S-腺苷蛋氨酸转化为ACC, ACO将ACC最终转化为ET[30], 离层中ACS、ACO表达量的升高以及ACC含量的增加说明复配处理在低温下可促进棉叶离层中ET的大量合成。本实验室前期研究[6]发现低温抑制了TDZ对ET信号基因表达的调控, 而本研究结果表明, 相较于TDZ处理, 低温下TDZ+CYC复配可促进离层中ET信号基因ERF1B的上调表达。ERFs是ET信号通路的转录调控因子, 调节ET依赖性基因的表达[31]。研究发现在植物叶或花的脱落时离层中ERF1、ERF52、ERF61、ERF92、ERF113等基因的表达量升高, 并发现ERF1、ERF52的沉默导致脱落延迟[12,32-34], 外源ET可诱导ERF1B在苹果果实中的上调表达[35]。说明低温下TDZ+CYC通过促进离层ET的合成, 诱导ERF1B上调表达, 进而促进棉花叶片脱落。
通常认为除IAA和ET, ABA也参与脱落。前人的研究认为ABA并不能单独诱导脱落[36], 而是通过促进离层中ET的合成诱导脱落发生[13,37]。当前有关TDZ诱导棉花叶片脱落时, 离层中ABA含量变化的研究结果并不一致, 有研究发现离层ABA含量增加,但也有研究发现离层ABA含量反而降低了[8,38]。本研究中, 常温下, 在脱落早期TDZ处理和对照处理离层中的ABA含量没有明显差异, TDZ+CYC复配处理离层ABA含量降低。但低温下对照处理离层中的ABA含量持续增加, 而TDZ单剂和TDZ+CYC复配处理的离层中ABA含量降低, 且TDZ+CYC复配诱导的ABA含量降低幅度更大, 并促进了ABA代谢基因CYP707A4的上调表达。非生物胁迫下ET可能参与调控ABA代谢, Saika等[39]和Tosetti等[40]研究发现, 低温以及涝渍胁迫下, 外源ET可诱导水稻幼苗以及马铃薯根茎中ABA代谢基因CYP707A1和CYP707A5的上调表达, 通过羟基化ABA的8'甲基令ABA氧化失活[41], 降低ABA含量。本研究发现, 与TDZ相比, TDZ+CYC复配处理离层中ACC含量显著增加, 其ABA代谢基因CYP707A4显著上调, 因此, 低温下TDZ+CYC复配处理离层ABA含量的降低受到ET诱导, 而不是复配促进棉叶脱落的主要诱因。
与ABA一样, JA也被发现参与植物器官的脱落。本研究发现低温完全抑制了TDZ对JA合成的调控, 而TDZ+CYC复配在脱落前期诱导离层中JA合成基因AOC4上调表达, 增加离层JA含量。AOCs基因负责生成JA最终前体12-氧代植物二烯酸((9S,13S)-12-oxo-(10,15Z)-phytodienoic acid)[42], 该基因的上调表达有利于JA的合成。多种植物叶、果实脱落的研究发现JA在离层累积可能通过促进ET合成诱导脱落[16,43-44]。这些研究说明JA可以通过ET途径调控脱落。此外本研究还发现低温抑制了TDZ对TIFY9基因的调控, 而低温下TDZ+CYC复配显著增加TIFY9基因在离层中的表达量。TIFY9属于JAZ家族基因, 负调控JA的信号转导, 是与ET串扰的关键节点[45]。研究发现, 外源ET通过诱导菠萝花中的TIFY10c-like上调表达, 激活ET信号基因EIN3,促进ET合成基因ACO1上调表达[46-47]。而JAZ10也被发现在TDZ诱导脱落的棉叶离层中上调表达[48]。以上的研究结果说明JA和ET信号途径的串扰与脱落有更密切联系。综上, 本研究推测相较于TDZ处理, 低温下TDZ+CYC复配可能通过诱导JAZs的上调表达和JA含量升高, 从而诱导离层中ET合成,最终促进低温下棉叶的脱落。
脱落在植物中是一个保守的生理过程, 因此,本研究可以通过在控制条件下的棉花苗期试验, 探究低温下CYC促进TDZ脱叶的激素调控机制。然而大田生产中吐絮期棉花叶片与试验所使用的棉苗叶片在衰老程度、代谢水平、可溶性糖积累等方面存在差异, 并且采收期气温存在复杂变化, 这是试验中控制的温度条件难以模拟的, 因此本研究结果有待在大田试验中进行验证。
4 结论
低温抑制了噻苯隆对棉叶离层激素含量和激素相关基因表达水平的调控, 导致低温下噻苯隆脱叶效果不佳; 而相较于噻苯隆单剂, 噻苯隆和环丙酸酰胺复配在低温下通过抑制棉叶离层中生长素运输和促进乙烯、茉莉酸合成, 降低了离层中生长素含量, 增加了乙烯、茉莉酸含量, 并诱导生长素信号基因下调表达和乙烯信号基因上调表达, 可以较早地形成脱落信号, 从而低温下棉叶脱落开始时间提前、脱叶率显著提高。

