广西烟草靶斑病病原菌鉴定与防效试验





摘要:采用组织分离法,从感病烟叶中分离并纯化出烟草靶斑病菌株,并通过致病性测定、形态学特征以及分子生物学手段,对病原菌进行鉴定。为筛选出能够有效抑制烟草靶斑病的药剂,采用菌丝生长速率法,测试了苯甲·丙环唑等3种类型共8种市售杀菌剂对广西贺州分离菌株HZBZ01和HZGP01菌丝生长的抑制作用。每种类型中选出效果最佳的1种杀菌剂进行田间试验,以验证其实际防效。室内毒力测定结果表明,苯甲·丙环唑的毒力最高,对2株供试菌株的平均EC50为2.911×10-2 mg/L;在生物制剂中,8%井冈霉素水剂的毒力最高;而在生防菌剂中,109 CFU/mL 贝莱斯芽孢杆菌CY30水剂的效果最佳。田间试验结果表明,使用10%苯甲·丙环唑乳油112.5 mL/hm2对烟草靶斑病的防效较为显著,第3次施药后7 d内防效达到69.89%,显著高于其他田间施药处理。本研究结果可为防控烟草靶斑病提供用药参考,为实际生产提供科学依据。
关键词:烟草靶斑病;病原菌鉴定;药剂筛选;广西烟区;防效试验;毒力测定
中图分类号:S435.72" 文献标志码:A
文章编号:1002-1302(2024)24-0127-06
收稿日期:2023-11-24
基金项目:国家自然科学基金(编号:31960540);外交部澜沧江-湄公河合作基金(编号:201806);中国烟草总公司广西壮族自治区公司项目(编号:202145000024006)。
作者简介:汤佳萸(1999—),女,贵州安顺人,硕士研究生,主要从事烟草病原真菌学研究。E-mail:632778587@qq.com。
通信作者:桑维钧,教授,博士生导师,主要从事植物病理学教学与科研工作。E-mail:984139246@qq.com。
烟草产业在我国具有重要的经济地位,多年来我国烟叶生产取得了长足的发展。然而近年来,随着种植面积的不断扩大和种烟年限的延长,烟叶生产过程中逐渐出现了如栽培模式落后、烟区土壤肥力下降等问题,从而导致叶部病害频繁发生,严重影响了烟叶的质量和经济效益[1]。广西壮族自治区位于我国西南部,是我国烟草种植大省,该地属于亚热带季风气候,常年处于高温高湿环境,极易导致叶部病害发生。
烟草靶斑病(tobacco target spot)是烟草上的重要病害,自2006年在我国首次发现后,相继在云南、四川、湖南等地区普遍发生,造成重大经济损失[2-5]。该病害由立枯丝核菌(Rhizoctonia solani)引起,自苗期到大田期均有发生,病原菌主要通过伤口和自然孔口直接侵染叶片,烟叶组织发病后,病原菌菌丝体可通过气流、风雨等媒介传播,引起病原菌的再侵染[6-7]。广西地区常年进行稻烟轮作,引起水稻纹枯病(rice sheath blight)的立枯丝核菌通过菌丝体和菌核在土壤越冬后来年再度侵染烟草,从而导致靶斑病的发生[8]。2012年,谭海文在广西烟区进行真菌性病害调查时,已在广西多个烟区查见了烟草靶斑病[9]。因此,对广西烟区靶班病病原菌的分离鉴定及防治试验,是一项至关重要的工作,可为该烟区烟叶产质量提升及激发烟农积极性提供有力支撑。
针对烟草靶斑病的防治,孙宏宇综述了国外已经开展的一些化学防治技术[10],自此我国研究者也开展了许多药效试验,并取得了大量成果。孙美丽等通过室内毒力测定及田间试验发现,苯醚甲环唑、嘧菌酯可作为烟草靶斑病防控优选药剂[11];尹秀娟等通过菌丝生长速率和田间试验防治烟草靶斑病的高效配方药剂为咯菌腈与丁子香酚1 ∶1复配[12];聂忠扬等认为,戊唑醇对于贵阳烟区的靶斑病菌株具有很好的抑制效果,可以用于开展后续大田防治试验[13]。以上药效试验的结果值得我国各地烟区在靶斑病防治时借鉴。
笔者所在课题组在广西自治区贺州烟区开展病害调查过程中发现,烟草品种K326上靶斑病危害程度较重,为因地制宜地筛选出防治广西烟草靶斑病的药剂,展开了针对广西烟区烟草靶斑病的研究。本试验采用组织中分离法从感染烟草靶斑病的烟叶组织分离纯化出烟草靶斑病病原菌,进行致病性测定、形态学鉴定及基于ITS的分子生物学鉴定,以明确病原菌的分类地位,并通过室内毒力测定及田间试验筛选出针对广西烟草靶斑病的有效药剂,因绿色防控需求,特选取化学药剂、生物农药及生防菌剂进行对比试验,旨在为广西烟草靶斑病的绿色防控提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
2022年6月,笔者所在课题组在广西自治区富川县福利镇白竹村及葛坡烟草种植基地,采集典型症状的靶斑病病叶置于采集袋内,并记录时间、地点、编号等,带回实验室保湿培养,用于后续病原菌分离。
1.1.2 主要培养基和试剂
试验所用培养基为马铃薯琼脂葡萄糖(PDA)培养基(青岛海博生物技术有限公司)。
1.1.3 供试药剂
供试药剂如表1所示。8种市售杀菌剂包括3种类型,其中化学农药有苯甲·丙环唑、丙唑·戊唑醇,生物农药有大蒜素、小檗碱、井冈霉素,生防菌剂有贝莱斯芽孢杆菌CY30、哈茨木霉、枯草芽孢杆菌。
1.2 试验方法
1.2.1 病原菌的分离与纯化
采用组织分离法用无菌剪刀在镜检病斑的病健交界处剪取5 mm×5 mm大小的叶片组织,经75%乙醇浸泡30 s及1%次氯酸钠消毒3 min后,无菌水漂洗3次,再用无菌滤纸吸净水分后接种于PDA培养基上,置于28 ℃恒温培养箱(型号为RXZ-380A,宁波江南仪器厂)中暗培养。待接种点周围长出菌丝,用无菌接种针挑取边缘菌丝接种至PDA培养皿上进行纯化培养。
1.2.2 病原菌的致病性测定
采用科赫法则验证菌株的致病性。菌株在PDA培养基上暗培养3 d后,用直径5 mm的灭菌打孔器打取菌饼。选取健康的烟株,将菌饼接种于无伤烟株中部位置叶片的两侧,并在接种部位附近放置湿润的无菌棉球保湿,以接种PDA琼脂块为空白对照,每株接种3张叶。用自封袋对接种叶片进行套袋,烟株置于28 ℃、相对湿度75%、12 h光照/12 h黑暗周期的人工气候箱中培养,定期观察记录发病情况,待出现明显病状后,对发病叶片进行病原菌的分离纯化,并与原接种菌株进行菌落形态等表型比较,若基本一致则可判定接种菌株为致病菌。
1.2.3 病原菌的形态学观察
将菌株接种在马铃薯琼脂培养基 (PDA) 上,28 ℃恒温暗培养5 d,对菌株的培养性状进行直观描述,并挑取菌丝体制作玻片在光学显微镜下观察。
1.2.4 病原菌的分子鉴定
将病原菌接种于覆有半透膜的PDA培养皿中央暗培养3 d,用无菌手术刀刮取边缘菌丝。采用EZup柱式真菌基因组DNA抽提试剂盒[产品编号为B518259,生工生物工程(上海)股份有限公司]抽提菌株DNA,并用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对菌株进行扩增,PCR反应程序参考文献[14],PCR产物用1.5%琼脂糖凝胶电泳检测后由生工生物工程(上海)股份有限公司代为测序。所得序列通过BLAST比对分析,从GenBank中收集用于比较的其他序列相关信息,通过CExpress软件将序列进行拼接和剪切,以BioEdit进行序列比对及剪切,应用MAGA 11的邻接法(neighor-joining,NJ)构建系统发育树,Bootstrap检验重复次数为1 000次。
1.2.5 室内毒力测定
生长速率法:将烟草靶斑病菌作为目的菌,对其进行室内药剂筛选。将培养7 d的供试菌株用直径为5 mm的打孔器沿菌落同一圆周打取菌饼,将菌丝面朝下接种在PDA平板中间位置,以加无菌水的培养基平板为对照(CK),每个处理3次重复,28" ℃培养箱内培养3 d,采用十字交叉法测量菌落直径,计算菌丝生长抑制率、毒力回归方程、有效抑制中浓度EC50及相关系数。
平板对峙法:将市售生防菌剂稀释成菌悬液备用。在PDA平板正中央接种直径为5 mm的病原菌菌饼,以病原菌菌饼位置为中心,在正四方各2.5 cm处用长牙签蘸取适量生防菌菌悬液,对照组点滴适量无菌水,均以菌液无流动为适量,各处理均3次重复。28 ℃培养箱中培养3 d后用十字交叉法测量菌落直径,计算菌落平均直径以及各生防菌对病原菌的抑菌率。
1.2.6 田间防效试验
试验地位于广西壮族自治区百色市靖西市化峒镇三友村,面积为0.66 hm2,种植烤烟品种K326。2023年5月12日(烟草生长中后期,已查见靶斑病发生)使用背负式电动喷雾器进行第1次施药,共设3个药剂处理:10%苯甲·丙环唑乳油112.5 mL/hm2(推荐用量,下同)、8%井冈霉素水剂1 125 mL/hm2、109 CFU/mL贝莱斯芽孢杆菌CY30水剂562.5 mL/hm2,另设喷施清水的对照。其后每隔7 d喷施1次,共喷3次。每个处理3次重复,随机区组排列,共12个小区,小区间设立保护行。烟田正常水肥管理。
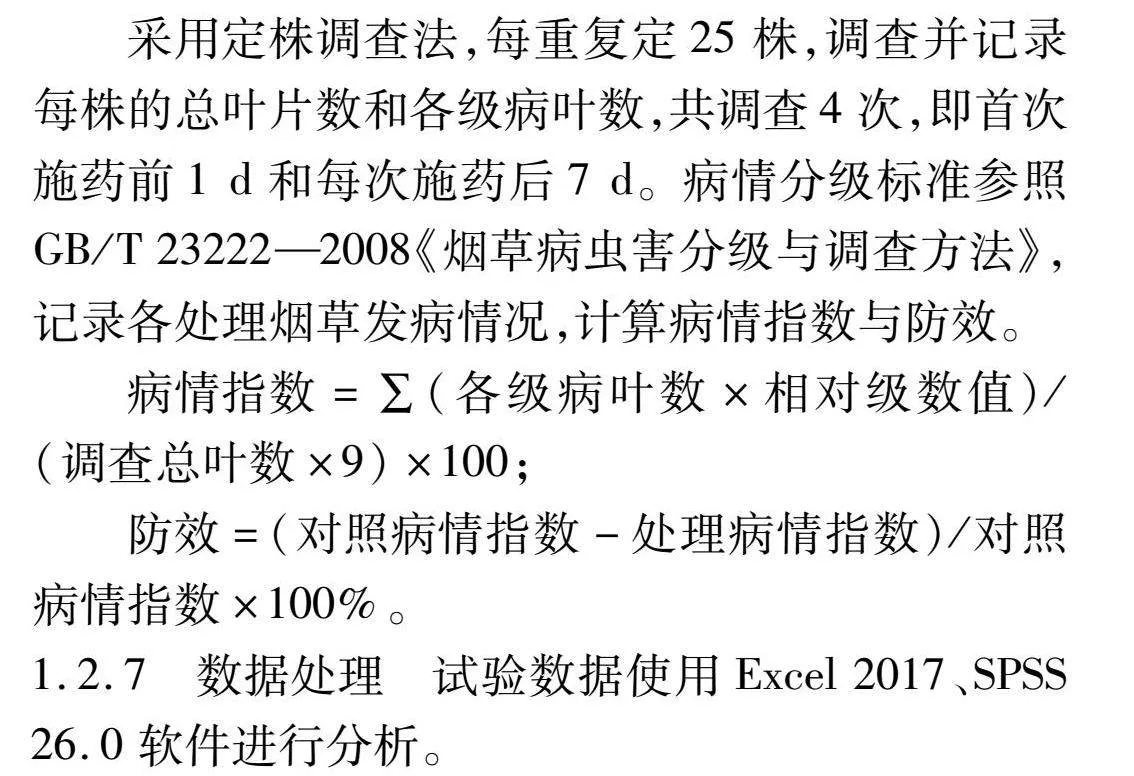
采用定株调查法,每重复定25株,调查并记录每株的总叶片数和各级病叶数,共调查4次,即首次施药前1 d和每次施药后7 d。病情分级标准参照GB/T 23222—2008《烟草病虫害分级与调查方法》,记录各处理烟草发病情况,计算病情指数与防效。
病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×9)×100;
防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.2.7 数据处理
试验数据使用Excel 2017、SPSS 26.0软件进行分析。
2 结果与分析
2.1 病原菌的分离纯化、致病性测定
经分离获得纯培养菌株2个,分别编号为HZGP01和HZBZ01。将病原菌接种到烟草叶片,早期接种部位产生水渍状病斑,7 d后变为褐色,病斑发生穿孔现象(图1-B),田间症状相似(图1-A),对照未表现出病症(图1-C) 。自病健交界处再次分离获得病原菌,镜检结果表明,再次分离获得的病原菌与原接种菌株是相同的病原菌(图2)。
2.2 病原菌的形态特征观察
病原菌HZBZ01和HZGP01的形态特征基本相同。菌株HZGP01在PDA培养基上培养5 d后,菌落表面有同心轮纹,菌丝发达,呈白色,辐射状向四周扩展,生长后期菌丝颜色转为褐色,数量增多(图2-A)。显微镜下,菌丝无色透明,分枝部位趋近于直角,分枝外部有一定程度收缩;具隔膜,常生在分枝点附近,具有很明显的“T”形分枝结构(图 2-B)。
2.3 分子生物学鉴定
将测序所获得的菌株HZBZ01和HZGP01的序列在NCBI数据库中通过BLAST比对,从GenBank数据库中下载与立枯丝核菌(Rhizoctonia solani)相关的10个菌株的ITS序列,通过邻接法构建得到系统发育进化树(图3),比对结果显示,2个菌株与立枯丝核菌具有100%的同源性。根据形态学特征与分子生物学分析 将菌株HZBZ01和HZGP01鉴定为立枯丝核菌。
2.4 室内毒力测定
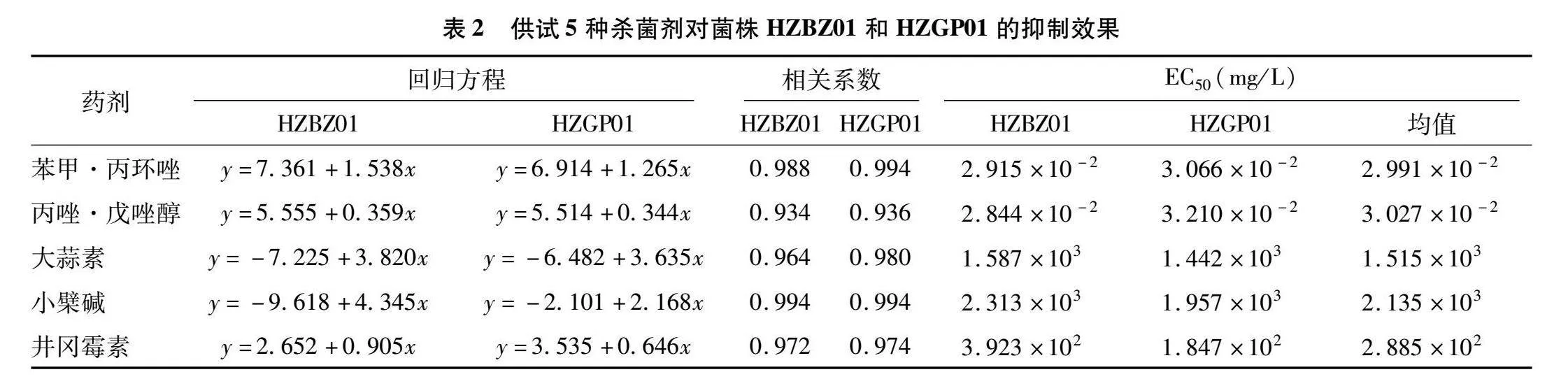
经测定,供试8种药剂对2株病原菌的菌丝生长存在不同程度的抑制活性(表2、表3)。在化学农药中,苯甲·丙环唑的抑菌活性最强,对2株菌的EC50分别为2.915×10-2、3.066×10-2 mg/L,平均值为2.991×10-2 mg/L,丙唑·戊唑醇效果稍差;在生物农药中,井冈霉素抑菌活性最好,相应地,EC50分别为1.847×102、3.923×102 mg/L,平均值为2.885×102 mg/L,大蒜素及小檗碱抑菌活性较差;在生防菌剂中,贝莱斯芽孢杆菌CY30效果最好,对2株病原菌的抑制率平均值为64.52%。
此外,烟草靶斑病菌不同菌株对同种药剂的敏感性存在一定差异。对于井冈霉素、小檗碱、大蒜素而言,菌株HZBZ01的EC50分别是菌株HZGP01的2.12、1.18、1.10倍;对于丙唑·戊唑醇、苯甲·丙环唑来说,菌株HZGP01的EC50分别是菌株HZBZ01的1.13、1.05倍。
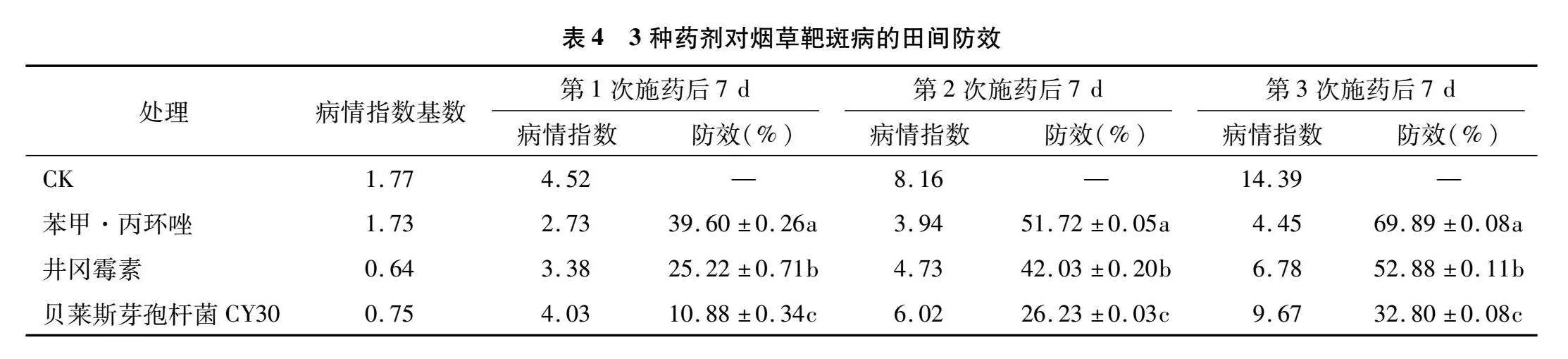
2.5 田间防效试验结果
由表4可知,在试验剂量下,田间使用的3种杀菌剂对烟草靶斑病均有一定防效,且各药剂防效均随施用次数的增加而提高。在第1次施药后7 d,苯甲· 丙环唑处理防效相对较高,为39.60%,贝莱斯芽孢杆菌CY30处理防效最低,为10.84%。第2次施药后,各药剂防效均有所提升,苯甲· 丙环唑处理防效最高,为51.72%,贝莱斯芽孢杆菌CY30处理防效最低,为26.23%,两者间存在显著差异,8%井冈霉素水剂防效居中。第3次施药后,对病害产生了更强的控制效果。其中,苯甲·丙环唑的防效最高,为69.89%,显著高于其他处理;其次是8%井冈霉素水剂,为52.88%;贝莱斯芽孢杆菌CY30处理防效最低,为32.80%。
3 讨论与结论
烟草靶斑病的病原菌为立枯丝核菌,其寄主范围广泛,能够侵染多种重要的农作物,如马铃薯、梨子、草莓、水稻、棉花等,因此,烟草种植时应避免与上述作物间套作或轮作,防止该病原菌在寄主中传播,造成更大的经济损失[15-20]。但考虑到烟农在实际生产中愿意产生更多的经济效益,因此在实际中采取有效的防控措施以防止病害暴发和减少经济损失显得至关重要。
本研究将烟草靶斑病的病原菌进行分离鉴定,并采用菌丝生长速率法及平板对峙法测定了8种杀菌剂对于烟草靶斑病的抑制效果,结果表明,10%苯甲·丙环唑乳油、8%井冈霉素水剂及109 CFU/mL贝莱斯芽孢杆菌CY30水剂对该烟草靶斑病菌均有良好的抑制效果,前二者平均EC50分别为2.991×10-2 mg/L、2.885×102 mg/L,贝莱斯芽孢杆菌CY30在对峙试验中抑制率高达64.52%。同一处理下,不同分离菌株生长存在一定差异。
基于室内毒力测定结果,选择10%苯甲·丙环唑乳油、8%井冈霉素水剂和109 CFU/mL贝莱斯芽孢杆菌CY30水剂开展田间防治试验。结果表明,随着施药次数的增加,各药剂处理对烟草靶斑病的防治效果均有所提升,其中10%苯甲·丙环唑乳油的防治效果最好,这与李再明等的试验结果[21-22]相同。目前在烟叶生产中,8%井冈霉素水剂已作为防治烟草靶斑病的新农药登记在册,但在本次试验中,8%井冈霉素水剂防效相对较低,为52.88%,这与马欣等的结果[23-24]有所出入,可能与植烟地区生态条件和病害发生程度不同有关,也可能由于生产中施用次数过多从而导致当地菌株产生抗药性。谢剑波等分离出的1株贝莱斯芽孢杆菌对水稻纹枯病具有抑制作用,且田间防效可达52.33%,与常规防治药剂5%井冈霉素水剂防效相当[25],这与笔者的试验结果有所差异,可能是由生防菌剂的菌株及所防控植物种类不同所致,抑或是当地烟叶的叶际微生物群落不适宜该菌剂的生长,具体原因有待日后进一步研究。根据以上试验结果,建议在广西烟区烟草靶斑病的田间防治中,主要施用10%苯甲·丙环唑乳油,为避免产生抗药性,可与8%井冈霉素水剂交替施用。109 CFU/mL贝莱斯芽孢杆菌CY30水剂虽在本次田间试验中效果不佳,但仍可作为备选药剂与其他药剂交替施用以降低对土壤环境的影响。
综上,尽管生物防治具有潜在的环保优势,但目前对于烟草靶斑病的防治来说,化学药剂依然是最为有效的防治手段。在未来的防治研究发展方向中,生物防治方面仍然需要更多的创新和突破,以期为烟草靶斑病的防治提供更加环保和可持续的技术措施。
参考文献:
[1]安宣鲜,桑维钧,卢燕回,等. 烟草叶斑病病原菌Epicoccum latusicollum的鉴定、生物学特性及室内药剂筛选[J]. 热带作物学报,2022,43(12):2534-2544.
[2]肖艳松,钟 权,吴文信,等. 湖南烟草靶斑病的病原鉴定及分子检测[J]. 湖南农业大学学报(自然科学版),2020,46(6):711-715.
[3]徐传涛,张 崇,张明金,等. 四川省烟草靶斑病病原鉴定及生物防治研究[J]. 湖北农业科学,2021,60(8):87-90.
[4]侯慧慧,赵秀香,吴元华. 云南省烟草靶斑病菌菌丝融合群及ITS序列分析[C]//中国植物病理学会2017年学术年会论文集.北京:中国农业科学技术出版社,2017:152.
[5]吴元华,王左斌,刘志恒,等. 我国烟草新病害:靶斑病[J]. 中国烟草学报,2006,12(6):22,51.
[6]祖庆学,张翼飞,冯裕洋. 烟草靶斑病病原生物学与综合防控措施研究进展[J]. 现代农业科技,2022(14):71-76.
[7]Shew H D,Main C E.Infection and development of target spot of flue-cured tobacco caused by Thanatephorus cucumeris[J]. Plant Disease,1990,74:1009-1013.
[8]徐云珂,李 宽. 不同药剂防治水稻纹枯病的田间效果试验初报[J]. 上海农业科技,2024(1):121-122.
[9]谭海文. 广西烟草真菌性病害调查[D]. 南宁:广西大学,2012.
[10]孙宏宇. 烟草靶斑病发生及防治技术研究进展[J]. 中国植保导刊,2015,35(7):23-26.
[11]孙美丽,汪汉成,郭沫言,等. 4种杀菌剂对烟草靶斑病菌的抑菌活性[J]. 贵州农业科学,2022,50(9):62-68.
[12]尹秀娟,肖艳松,李思军,等. 防治烟草靶斑病复配增效配方筛选及田间防效[J]. 农药,2022,61(6):453-457.
[13]聂忠扬,林 松,祖庆学,等. 贵州烟区靶斑病病原菌的融合群研究与戊唑醇室内毒力测定[J]. 安徽农业科学,2022,50(7):137-140.
[14]黄 宁,周建云,赵一君,等. 烟草靶斑病病原鉴定及室内药剂毒力测定[J]. 山地农业生物学报,2023,42(3):70-75.
[15]杨 帅,郭 梅,王文重,等. 黑龙江省马铃薯黑痣病菌融合群类型分析[J]. 中国马铃薯,2022,36(3):228-235.
[16]吴屿硕,阎维巍,张鑫楠,等. 梨立枯丝核菌果腐病菌生长条件及寄主范围测定[J]. 中国果树,2022(7):27-32.
[17]张 旭,姚苏容,孙雅桃,等. 草莓根腐病病害研究进展[J]. 现代园艺,2022,45(9):83-85.
[18]杨秀荣,霍建飞,孙淑琴,等. 水稻纹枯病的防治方法研究[J]. 天津农业科学,2020,26(5):1-4.
[19]玉山江·买买提,郭庆元,迪娜热·甫拉提. 新疆南疆棉花立枯病菌(Rhizoctonia solani Kühn)菌丝融合群及其营养体亲和群研究[J]. 新疆农业大学学报,2007,30(3):10-13.
[20]苏 杭,成 胜,孟祥佳,等. 半夏立枯病菌拮抗内生细菌的分离鉴定及功能分析[J]. 南方农业学报,2023,54(11):3277-3291.
[21]李再明,杨学红,王庙昌,等. 9种防治烟草靶斑病的药剂筛选试验[J]. 云南农业科技,2022(2):13-15.
[22]王潮钟,黄 翯,董 雪,等. 防治烟草靶斑病药剂的筛选[J]. 河南农业科学,2016,45(1):92-95.
[23]马 欣,寇宝石,李继博,等. 新农药8%井冈霉素可溶液剂对烟草靶斑病的防治效果[J]. 安徽农业科学,2022,50(11):133-134.
[24]新批准登记[J]. 农药登记公告,2020(8):1-7.
[25]谢剑波,秦梦圆,石 杨,等. 水稻纹枯病内生拮抗菌的分离鉴定及其生防作用[J]. 湖南农业科学,2019(4):73-75.

