种子休眠与萌发调控的研究进展
宋松泉 唐翠芳 雷华平 姜孝成 王伟青 程红焱
1 中国科学院植物研究所, 北京 100093; 2 湖南师范大学生命科学学院, 湖南长沙 410081; 3 湘南学院南岭现代种业研究院, 湖南郴州 423099
种子休眠(seed dormancy)被定义为种子在适宜的条件下暂时不能完成萌发的特性[1], 这一特性可防止种子在不利季节的短期有利条件下萌发[2]。种子休眠也是一种显著的农艺性状, 低水平的休眠可能产生收获前萌发(pre-harvest sprouting), 而高水平的休眠则抑制迅速和整齐的萌发; 二者都严重地影响作物的产量与质量[3-5]。研究表明, 种子休眠是一个复杂的性状, 受多种内源和外部因素的影响; 被认为是种子生物学中理解最少的领域之一[6]。种子休眠研究的一个主要困难是休眠被功能性定义, 目前仍然没有评估干燥种子是否具有休眠的方法[7],常常用在一定条件下的种子萌发率来表示; 而种子休眠和萌发是2 个相互联系的独立事件, 具有一系列不同的生理和生化过程[1,8]。
根据Nikolaeva 等[9]的分类, Baskin 和Baskin[10-11]将种子休眠分为5 种类型: 形态(morphological)、生理(physiological)、形态生理(morphophysiological, 形态和生理的结合)、物理(physical)和组合(combinational,生理和物理的结合)休眠。生理休眠是裸子植物和被子植物中最常见的休眠类型, 而浅生理休眠(nondeep physiological dormancy)又是最普遍的生理休眠形式[10-11]。浅生理休眠的种子需要具有完整性, 即胚的覆盖层是种子吸胀时阻止其生长所必需的[5,12];同时, 也需要种子吸胀时阻止胚生长的植物激素脱落酸(abscisic acid, ABA)[13]。成熟种子的最终休眠水平随着种子发育过程中母体环境的不同而发生变化,例如温度、光照和营养(如硝酸盐)可用性[14-15]。
近年来, 种子休眠与萌发的研究取得了显著的进展[7-8,15-16], 特别是DOG1(DelayofGermination-1)基因的发现和功能研究被认为是种子休眠研究的重要突破[5,17-18]。本文主要综述了植物激素ABA 和赤霉素(gibberellin, GA)对种子休眠与萌发的控制,DOG1 调控种子休眠的作用机制, 以及种子休眠与萌发的表观遗传(epigenetic)调控, 并提出了在本领域需要进一步研究的科学问题, 试图为深入理解种子休眠与萌发的分子机制、抗穗萌育种以及促进休眠种子的萌发提供参考。
1 植物激素ABA 和GA 对种子休眠与萌发的控制
1.1 ABA 和GA 对种子休眠与萌发的影响
植物激素ABA 和GA 是拮抗调节种子休眠与萌发的关键因素, ABA 正调控休眠诱导和维持, 而GA促进萌发[19-20]。在拟南芥(Arabidopsisthaliana)中,高水平的ABA 首先出现在种子成熟初期, 主要来源于母体植株; 随着成熟进程, 母体来源的ABA 逐渐被合子组织合成的ABA 所取代, 这种合子来源的ABA 对种子发育过程中休眠的诱导以及吸胀前后休眠的维持更为重要[21]。外源 ABA 显著降低水稻(Oryzasativa)[22]、莴苣(Lactucasativa)[23]和黑黄檀(Dalbergiafusca)[24]种子的萌发速率和萌发率。ABA生物合成途径中的八氢番茄红素去饱和酶(phytoene desaturase)抑制剂氟啶酮(fluridone)显著地降低莴苣种子萌发的热抑制(thermoinbibition)或者热休眠(thermodormancy), 而ABA 分解代谢酶ABA 8’-羟化酶(ABA 8’-hydroxylase)抑制剂烯唑醇(diniconazole)增加莴苣种子萌发的热抑制[23]。Xu 等[25]报道了一个来自aus型水稻的数量遗传位点(quantitative genetic locus)SD6(SeedDormancy6), 它编码碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)转录因子。SD6和另一种ICE2 (inducer of C-repeat binding factors expression 2)的bHLH 因子以温度依赖的方式通过直接调控 ABA 分解代谢基因ABA8OX3和通过OsbHLH048 间接调控ABA 生物合成基因NCED2,拮抗控制种子休眠。
后熟增加大麦休眠胚中生物活性GA1的水平[26]。随着种子后熟, ABA 的水平下降, GA 的水平增加[27-28]。GA3能够降低莴苣种子萌发的热抑制, GA 生物合成途径中的内根-贝壳杉烯氧化酶(ent-kaurene oxidase)抑制剂多效唑(paclobutrazol)增加莴苣种子萌发的热抑制[23]。此外, GA3也能够显著地解除黄栌(Cotinus coggygriavar.cinerea)种子的休眠和促进萌发[29]。Chen 等[30]发现, GA 通过启动胚的活性、克服糊粉层或种皮施加的机械抑制以及促进胚的生长来增加萌发。
此外, GA3对莴苣种子萌发的促进作用被ABA降低, 被氟定酮增加; 而氟定酮降低的莴苣种子萌发热抑制被多效唑拮抗[23]。GA3处理解除水稻种子休眠[31], 而多效唑增加高粱(Sorghumbicolor)种子的休眠[32]。这些结果表明, GA3在种子萌发过程中具有拮抗ABA 的作用。
1.2 ABA 和GA 调控种子休眠与萌发的机制
不管种子的休眠水平深浅, ABA 的水平在干种子吸胀初期下降; 然而, 在吸胀的休眠种子中其萌发的抑制是由于在吸胀过程中持续的较高水平的ABA 积累[7]。吸胀时ABA 的积累激活ABA 信号, 维持胚的状态和阻止种子萌发[33]; 这个过程包括增加ABI3(ABAINSENSITIVE3)和ABI5的表达。ABI3和ABI5分别编码B3 转录因子(transcription factor)和碱性亮氨酸拉链(basic leucine-zipper, bZIP)转录因子,促进种子成熟保护程序; 同时, 它们也引起LEA(LATEEMBRYOGENISISABUNDANT)基因的表达,以及通过阻断三酰甘油(triacylglycerol)的分解代谢来抑制胚中的储存物消耗[34]。核心ABA 信号转导组分包括ABA 受体PYR/PYL/RCAR (pyrabactin resistance 1/pyrabactin resistance 1-like/regulatory components of ABA receptor)家族、A 组2C 型蛋白磷酸酶(group A type 2C protein phosphatase, PP2C)和蔗糖非发酵-1-相关的蛋白激酶2 (sucrose non-fer menting-1-related protein kinase 2, SnRK2)。当ABA缺乏时, PP2C 与SnRK2 结合, 这种结合使下游的ABA 信号因子失活, 抑制ABA 反应以促进种子萌发;当ABA 存在时, ABA 受体PYR/PYL/RCAR 与PP2C结合并使PP2C 失活, SnRK2 从PP2C 介导的抑制中释放, 引起激酶的自体磷酸化(autophosphorylation)或磷酸化(phosphorylation), 激活的SnRK2 磷酸化下游靶子, 包括转录因子和通道蛋白(channel protein),从而诱导和维持种子休眠[5,8,35-37](图1)。
赤霉素能解除种子休眠, 促进萌发[1,38-39]。核心GA 信号转导途径主要由 GA 受体 GID1 (GA INSENSITIVE DWARF 1)、DELLA (Asp-Glu-Leu-Leu-Ala)蛋白、F-box 蛋白和 DELLA 调控的靶因子组成[40]。当GA 缺乏时, DELLA 蛋白是稳定的,抑制GA 的反应; 当GA 存在时, GID1 与GA 结合,这种结合促进GID1-GA-DELLA 复合物的形成, 依次促进其与SLY1 (SLEEPY1)/GID2 F-box 蛋白结合和多泛素化DELLA, 从而通过26S 蛋白酶体靶向降解DELLA。这样就解除了GA 反应的DELLA 抑制[8,40-41](图 1)。在拟南芥DELLA 因子中, RGL2(REPRESSOR OF GA-LIKE 2)在抑制种子萌发中起主要作用[8]。
研究表明, 在种子成熟1 周内ABA 信号显著下降, GA 信号增加, 最终导致种子萌发[42]。ABA 和GA 信号与种子休眠和休眠解除之间存在着明显的联系: (1) 在休眠解除过程中, ABA 水平和/或敏感性降低, 而对GA 的敏感性增加; (2) GA 不敏感与休眠种子的萌发缺陷有关, 而GA 促进非休眠种子的萌发; (3) 当休眠种子后熟时, 休眠被解除, 对ABA 和/或 GA 的敏感性发生变化[43-44]。对于水稻、大麦(Hordeumvulgare)、小麦(Triticumaestivum)和其他禾谷类植物糊粉层中控制转录的基因,GAMYB以GA依赖的方式促进α-淀粉酶基因的表达[8]。休眠是由被控制的激素信号网络维持和严格调节的, 几乎没有发现, 由GA20-氧化酶基因表达水平引起的GA 含量和激素生物合成的增加降低后熟种子的ABA 敏感性和增加GA 的敏感性; 然而, 当休眠降低时, GA分解代谢基因GA2-氧化酶的表达则有下降的趋势。此外, 随着后熟, GA 受体GID1 增加; 当休眠解除时,由于ABA 的分解代谢增加, ABA 的积累减少[44]。其他激素, 包括茉莉酸异亮氨酸(jasmonic acid isoleucine)、油菜素内酯(brassinosteroid, BR)和吲哚-3-乙酸(indole-3-acetic acid, IAA), 也参与种子休眠, 从而导致种子在穗上萌发或成熟前萌发[8,45](图1)。另外, DELLA 因子促进种子中ABA 的积累; 缺乏DELLA 因子的胚乳释放较少的 ABA[46-47], 以及DELLA 因子缺陷的突变体种子即使在低温下也完全是非休眠的[48]。然而, 在深休眠的种子中, 外源GA 不能下调RGL2 蛋白的水平, 也不能显著地促进种子萌发[47], 这也许是因为ABA 也能够以不依赖GA 的作用增加DELLA 蛋白水平[46]。因此, 休眠可能是一种缺乏GA 介导的DELLA 因子降解的状态,从而触发种子中组成性的高ABA 积累。
ABA/GA 比率也调控种子的休眠状态, 而其他植物激素, 包括乙烯(ethylene, ET)、BR、茉莉酸( jasmonic acid, JA)、水杨酸(salicylic acid, SA)、细胞分裂素(cytokinin, CTK)和独脚金内酯(strigolactone,SL), 也通过影响ABA 和GA 的水平和信号转导来调控种子休眠[8](图1)。在种子休眠过程中, 内源/外源ABA 水平是通过类胡萝卜素(carotenoid)前体的解体和不同种子组织中8’-羟基化沉默来精确调节激素的产生[15]。在种子脱落后, 除GA 外, ABA 的分解在种子萌发之前发生, 从而解除休眠。研究表明,ABA/GA 的比率也整合了环境因素例如光照、温度和氨态氮, 并对胚的发育和胚乳弱化起作用[8,38](图1)。
2 DOG1 调控种子休眠的作用机制
2.1 DOG1 调控种子休眠的分子机制
DOG1 是一种血红素(heme)结合蛋白, 是拟南芥种子休眠的重要调控因子[7,17,49]; 其显著功能是诱导种子休眠, 包括温度依赖的休眠[50-53]。研究发现, 种子成熟时的温度越低, 休眠程度越高,DOG1-mRNA 和蛋白的水平也增加[50]。在拟南芥中,DOG1基因由3 个外显子(exon)和2 个内含子(intron)组成, 其中, 第2 个内含子被可变剪接(alternative splice), 从而产生 5 个转录变异体(transcript variant)[54]; 由于β、γ 和ε 转录本的翻译产生相同的蛋白, 因此, 只产生3 种不同的蛋白异构体[17,55]。短DOG1-ε 不包含第3 个外显子, 但含有第2 个外显子的一部分[56]。新生的mRNA-ε 是通过可变多聚腺苷酸化(alternative polyadenylation)而不是通过可变剪接形成的[57-58]。DOG1α、β、γ、δ 和ε 蛋白异构体都具有生物学功能[54]。DOG1-α、-β 和-δ 定位于细胞核内, DOG1-β 比其他异构体丰富[54]。短DOG1-ε蛋白异构体的积累足够产生休眠表型, 即短DOG1-mRNA 在体内被翻译, 产生的DOG1 蛋白也在控制种子休眠的建立中起作用[56]。在拟南芥中,短ε-mRNA 最丰富, 产生与β-和γ-mRNA 相同的蛋白; 这种短DOG1 蛋白异构体比其他2 种蛋白异构体更保守, 因为第3 个外显子在其他物种中高度可变甚至被丢失, 以及在休眠诱导中也最为活跃。Nakabayashi 等[54]描述, 所有的DOG1 蛋白异构体都表现出自身结合的特性, 这种自身结合能力的丧失不改变蛋白水平, 但引起非休眠表型: 即DOG1 蛋白的功能通过其自身结合的特性增加。因此, 在不同的DOG1 异构体中二聚体的形成对于DOG1 功能的精确调控是必需的。在种子成熟的最后阶段, 尽管DOG1 蛋白的丰度没有减少, 但DOG1转录本的水平显著下降[59]。
在拟南芥基因组中有5种类DOG1(DOG1-LIKE,DOGL)基因,DOGL1、DOGL2、DOGL3、DOGL4和DOGL5[5]。DOGL1~DOGL4位于4号染色体上, 彼此相邻, 而DOGL5位于3号染色体上。DOGL1、DOGL2和DOGL3与DOG1相对类似, 而DOGL4和DOGL5在氨基酸序列上分别与DOG1只有28%和30%的相似性[5]。与拟南芥类似, 在一些双子叶和许多单子叶植物中也发现了DOG1基因[17]。在所研究的双子叶植物中, DOG1之间的氨基酸序列相似性很高[60-61]。许多单子叶植物中也存在DOGL基因,如大麦、小麦、水稻、玉米(Zeamays)、高粱和二穗短柄草(Brachypodiumdistachyon)[3,60,62]。
张洋洋[63]从发育中的水稻9311 (O.sativaL.‘9311’, 非休眠)种子中克隆了AtDOG1的同源基因OsDOG1L1和OsDOG1L2, 并研究了这2个基因在9311和东乡野生稻 (O.rufipogonGriff., 休眠)种子发育和萌发过程中的表达变化。OsDOG1L1位于1号染色体上, 含有2个外显子和1个内含子;Os-DOG1L2位于5号染色体上, 不含内含子。比较分析这2个基因编码的蛋白的氨基酸序列和二级结构发现, 它们都含有与AtDOG1相同的结构域和保守结构域。利用实时定量PCR技术分别比较了OsDOG1L1和OsDOG1L2在9311和东乡野生稻种子发育和萌发过程中的表达变化, 结果表明在东乡野生稻胚中,OsDOG1L2的表达量在发育和萌发过程中增加, 而在9311胚中则降低。因此推测,OsDOG1L2与种子的休眠与萌发显著相关[63]。
DOG1与2种磷酸酶AHG1 (ABAHYPERSENSITIVE GERMINATION 1)和AHG3发生物理相互作用, 在种子休眠解除中在功能上阻断它们必需的下游作用[17,64-65](图2)。AHG1和AHG3属于A分枝2C型PP2C家族(clade-A type 2C PP2C family); 在拟南芥中有9个成员, 作为ABA信号转导和种子休眠的负调控因子起作用[64-65]。因此, 当DOG1蛋白水平增加时, 不仅增加种子的休眠和ABA敏感性[59], 而且在ahg1-ahg3双突变体中也增加种子的休眠和ABA敏感性[64]。同样,ahg1-1ahg3-1hai3-1三重突变体的种子具有更强的休眠, 从而提出至少AHG1、AHG3和HAI3 (HIGHLY ABAINDUCED PP2C GENE3)参与休眠的调控[65]。此外,DOG1通过抑制专一的PP2C的作用来控制休眠,PP2C作为ABA和DOG1途径的交汇点起作用[64]。另一方面, 在休眠过程中, DOG1与血红素基团的结合对于DOG1的作用也是必需的[65]。血红素是一种结合铁的原卟啉IX (protoporphyrin IX), 调控不同的生物学活性, 如信号转导; 但其在ABA信号转导中的作用研究仍处于初期阶段。DOG1与AHG1或者血红素的结合似乎是一个独立的过程, 尽管这2个过程对DOG1在体内的功能是必需的[66]。像DOG1一样,DOGL3和DOGL5也与PP2C结合,DOGL3的过表达导致种子萌发时ABA过敏感, 而DOGL5过表达不引起种子对ABA的敏感性增加[66]。
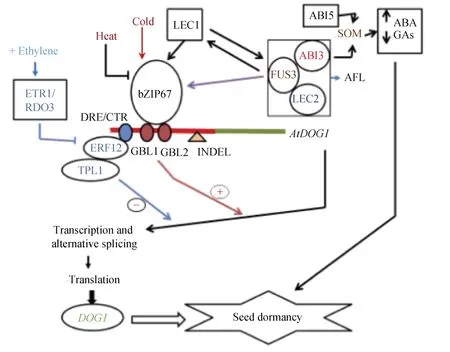
图2 拟南芥种子休眠的DOG1基因(启动子为红色, 编码区为绿色)的转录调控模型Fig. 2 A model for the transcriptional regulation of DOG1 gene (promotor in red; coding region in green) to induce dormancy in Arabidopsis thaliana seeds
2.2 直接参与DOG1功能的转录因子
种子成熟是其发育的重要阶段, 包括储藏物积累、胚生长停止、耐脱水性和休眠特性的获得[1,67]。虽然有许多转录因子专一地与种子成熟相关, 但只有ABI3、FUS3 (FUSCA3)、LEC1 (LEAFY COTYLEDON 1)和LEC2被认为是拟南芥种子中的关键调控因子[4-5,17](图2)。这些转录因子的突变引起种子成熟发生变化, 包括种子贮藏蛋白(seed storage protein, SSP)的积累, ABA敏感性和种子休眠程度,例如, 突变体abi3-lec1和abi3-fus3表现出SSP含量显著降低, 产生严重的胎生现象(viviparism)[4-5,68]。研究表明,DOG1的表达间接地依赖于LEC1[69-70]。然而, LEC1与DOG1启动子之间没有直接地相互作用。在lec1突变体中,DOG1的基因活性降低。ABI3、FUS3和LEC2都包含一个B3 DNA结合结构域, 该结构域专一地识别许多成熟相关基因启动子区域中存在的RY (CATGCA (TG))基序[62,69]。AtDOG1启动子中存在一个RY基序, 其在种子发育中的转录模式表明,DOG1很可能被上述至少一个转录因子调控[59]。bZIP67是大豆(Glycinemax)中参与SSP沉积的几个基因的调控因子[71]; 在种子成熟过程中,bZIP67在LEC1下游起作用, 反式激活DOG1, 有助于拟南芥种子产生休眠[17,72](图2)。研究证明, (1)bZIP67是DOG1表达和DOG1积累所必需的; (2)bZIP67和DOG1在功能上可能属于同一途径; (3)bZIP67可能通过控制DOG1的表达有助于休眠的调控; (4) DOG1由LEC1诱导, 这一过程发生在bZIP67诱导之后; (5) 体内外试验表明, bZIP67通过GBL顺式元件与DOG1启动子结合; (6) 种子成熟过程中, 低温条件增加bZIP67的数量, 但不增加bZIP67-mRNA的数量[72]。
2.3 DOG1与ABA和乙烯信号
DOG1和ABA的协同作用引起休眠, 这是种子发育过程中的一个显著特征[35,58], 即DOG1对休眠的调控在功能上需要ABA信号途径[5]。尽管dog1的休眠表型类似于ABA合成和信号转导的突变体[65,73],但现有的证据表明DOG1和ABA以独立的途径起作用。近等基因系(near isogenic line, NIL) DOG1-Cvi(强DOG1表达)与ABA缺陷突变体aba1-1(ABA生物合成缺陷和种子休眠缺乏)的整合仍然产生非休眠的种子[74], 这些结果表明, ABA对于DOG1在种子休眠中的作用是不可缺少的, 尽管在缺乏DOG1的情况下ABA不能强加种子休眠[74]。ABA和DOG1必须同时存在以诱导休眠, 因为这2个调控因子中的一个因子缺乏都将导致休眠的完全丧失, 即使当另一个调控因子被高度积累[49,73-74]。
ABI3和ABI5编码ABA依赖的必需转录因子,是种子中ABA信号转导中的2个主要组分。Zhao等[75]表明, ABI5与休眠有关, DOG1通过调控ABI5的表达来控制休眠。此外, DOG1通过激活种子成熟基因和抑制萌发相关基因来刺激ABI5的表达[52]。Dekkers等[76]也证明, DOG1与PP2C相互作用, 从而促进ABI5的表达和种子休眠; 即ABA的积累和ABI5的活性有助于种子休眠的维持。
体内下拉试验(pull-down experimentinvivo)表明, 有184组蛋白与DOG1直接相互作用, 这些结果显示DOG1与ABA反应有关的蛋白相互作用[51,64]。这些下拉蛋白中包括一些PP2C家族成员[64-65]。在ABA信号转导途径中, DOG1在AHG1的上游起作用, 并以ABA依赖的方式直接调控AHG1的PP2C活性[64]。在拟南芥中, DOG1蛋白N端区域中1~18残基的缺失对与AHG1的相互作用和休眠的诱导均有强大的负作用[65]。这种缺失阻止了DOG1赋予ABA过敏感表型的能力, 表明与AHG1的相互作用对于DOG1在休眠和萌发控制中的作用是必不可少的。相反, C-端区域257~291残基的缺失不影响DOG1与AHG1的相互作用[65]。Nishimura等[65]证明,DOG1的DSYLEW N-端序列(跨越位置13~18)对于与AHG1的相互作用是必需的。因此, DOG1通过与AHG1和AHG3的结合增加ABA的信号转导[64]。此外, DOG1的存在降低了其靶子SnRK2上的AHG1活性, 与PYL/PYR/RCAR相同, DOG1通过抑制AHG1的PP2C活性来正调控SnRK2的活性[65]。
Li等[77]在拟南芥中发现了一个调节初生休眠的模块。DOG1在ETR1 (ethylene receptor 1)/RDO3(reduced dormancy 3)和ERF12 (ethylene-responsive transcription factor-12, ERF-1B家族成员)的下游起作用;RDO3编码一种乙烯受体ETR1(图2)。事实上,ERF12直接与DOG1启动子结合, 在细胞核过程中招募辅阻遏因子TPL (TOPLESS), 以及抑制DOG1的表达。同样, 双突变体tpl-9dog1-2的遗传分析表明, TPL对休眠的调控依赖于DOG1[78]。此外, 拟南芥中的转录抑制因子ERF12和TPL通过抑制DOG1途径来促进种子萌发; ERF12在ETR1的下游起作用,参与调控由RDO3介导的休眠; ETR1和ERF12可能通过DOG1途径调控休眠[77]; 以及ERF12与DOG1的启动子结合并抑制其表达[17](图2)。Li等[77]提出,ETR1/RDO3-ERF12-TPL-DOG1模块的作用是乙烯控制休眠机制的一个重要部分。
3 种子休眠与萌发的表观遗传调控
3.1 表观遗传对种子休眠与萌发的调控
植物通过激活信号途径对环境刺激起反应, 信号途径迅速修饰反应基因的转录速率并诱导生理反应[79]。对于不可避免地暴露于每天和季节性环境变化的陆生植物, 发育重编程(development reprogramming)和对环境刺激的反应尤为重要[80]。环境条件可以诱导植物的适应性表观遗传反应(adaptive epigenetic response), 并且这种影响可以持续数代[81]。在种子中, 表观遗传过程在许多关键的温度响应基因的调节中起作用, 包括DOG1和FLC(FLOWERINGLOCUSC)[82-83]。转录调控包括多个层次, 组蛋白(histone)的翻译后修饰(post-translational modifification, PTM)是一个重要的调控过程。组蛋白修饰通过建立全染色质环境和协调基于DNA的生物学过程来影响基因表达和基因组功能[84]。染色质结构显著地受环境相关的重编程过程的影响[83,85]。组蛋白上专一赖氨酸残基的乙酰化(acetylation)以及赖氨酸和精氨酸残基的甲基化(methylation)在基因表达的调节中起关键作用。活性基因的启动子区域降低了核小体(nucleosome)的占有率, 增加了组蛋白的乙酰化和组蛋白3赖氨酸4 (H3K4)的甲基化,而H3K27甲基化水平的增加与基因抑制相关[84]。H3K27、H3K9、H4K20、H3K79和H2BK5的单甲基化(monomethylation)都与基因的激活有关, 而H3K27、H3K9和H3K79的三甲基化(trimethylation)都与基因的抑制有关[84]。许多研究表明, 染色质重塑(chromatin remodeling)在种子萌发过程中起重要作用。组蛋白H3K4的三甲基化通过调控AHG3的表达在ABA驱动的种子萌发抑制中起作用[86]。Wolny等[87]表明, 在种子成熟和萌发过程中, 二穗短柄草胚中的组蛋白H3和H4的乙酰化模式比DNA甲基化的模式更为活跃。根据染色质重塑对拟南芥种子休眠循环的分析表明,DOG1上三甲基化的H3K4 (H3K4me3)和H3K27me3随着季节性环境信号的变化而发生改变[88]。
对种子库中休眠循环期间通过组蛋白2B (H2B)与染色质重塑有关的基因表达分析表明, 基因沉默阻遏因子(gene-silencing repressor)ROS1(REPRESSOROF SILENCING1)的表达与休眠呈正相关, 而抑制的组蛋白甲基转移酶(repressive histone methyl transferase) CLF (Curly leaf)和沉默的KYP/SUVH4(Kryptonite)启动子则相反[88]。ROS1依赖的沉默抑制,以及CLF和KYP/SUVH4依赖的基因抑制与沉默对于维持和抑制休眠是重要的[88]。DOG1上的组蛋白标记H3K4me3和H3K27me3的变化与季节性环境信号有关。在种子休眠降低过程中, H3K27me3抑制性标记在光照下缓慢积累和增加, 完成休眠解除[88]。研究表明, 染色质重塑因子PKL (Pickle)在种子萌发过程中抑制胚性状的表达[89]。在pkl拟南芥幼苗中, GA促进种子相关性状的抑制[90]。组蛋白脱乙酰酶(histone deacetylases) HDA6和HDA19通过抑制胚特异性基因(包括LEC1、FUS3和ABI3)来调节萌发[91-93]。
3.2 基因组印记调控种子休眠的建立与释放
3.2.1 胚乳的基因组印迹由配子中的表观遗传机制建立 基因组印记(genomic imprinting)是一个给定的亲本等位基因对其他亲本等位基因的优先表达,这种现象在哺乳动物和种子植物中都能观察到[94]。有花植物的种子由胚、胚乳和种皮组成。种皮来源于母体珠被的孢子体组织, 但胚和胚乳是通过双受精形成的。受精后, 亲本专一的基因表达模式是雄性和雌性配子发生过程中受精前的表观遗传机制的结果[94-95]。由此产生的不对称表观遗传修饰(asymmetric epigenetic modification)被称为印记(imprint)[96], 引起等位基因在母系活跃和父系沉默被称为母系表达基因(maternally expressed gene,MEG), 或者父系活跃和母系沉默被称为父系表达基因(paternally expressed gene, PEG)。
母系表达基因的建立。胞嘧啶C-5位置的DNA甲基化是一种典型的沉默标记(silencing mark), 这种标记在植物中发生在3种不同的序列: CG、CHG和CHH, 其中H相应于A、T或G[97]。通过碱基切除修复依赖的DNA去甲基化, 5-甲基胞嘧啶的去除由类DEMETER DNA糖基化酶(DEMETER-like DNA glycosylase)介导[98]。DNA糖基化酶DEMETER(DME)在雌性配子体(gametophyte)的中央细胞中具有活性, 但在精子细胞中不具有活性[99], 由于胚乳中MEG的母系等位基因的局部低甲基化, 导致母系偏向的基因表达(maternally-biased gene expression)[100-101]。DME激活了2个基因FIS2(FERTILIZATION INDEPENDENT SEED 2)和MEA(MEDEA), 它们编码中央细胞和胚乳专一的FISPRC2 (Polycomb Repressive Complex 2)组分[102]。FIS-PRC2在PEG母系等位基因上的组蛋白H3的赖氨酸27上建立三甲基化标记(H3K27me3), 导致其抑制[94]。H3K27me3的去甲基化由JMJ (Jumonji-type)组蛋白去甲基化酶(JMJ histone demethylase)介导,这些酶对PRC2起拮抗作用[103]。研究表明, JMJ组蛋白去甲基化酶REF6 (RELATIVE OF EARLY FLOWERING 6)和ELF6 (EARLY FLOWERING 6)通过激活MEG的母系等位基因来控制种子休眠[104-106]。
MEG的父系等位基因的抑制由甲基转移酶1(methyltransferase 1, MET1)介导, MET1在DNA复制过程中维持CG形式的甲基化。父系MET1功能的丧失足以激活MEG的父系等位基因, 从而消除其母系偏向的表达[107]。除MET1介导的CGm外, 营养细胞和精细胞中RNA指导的DNA甲基化(RNAdirected DNA methylation, RdDM)途径对抑制MEG的父系等位基因也是重要的; 这一过程可能参与小分子干扰RNA (small interfering RNA, siRNA)的细胞间运动[108-109]。在这一途径中, 花粉营养细胞中DME和ROS1的激活导致转座子(transposable element)上甲基化胞嘧啶的切除, 引起转座子表达的激活和siRNA的产生, siRNA从营养细胞移动到精细胞, 在靶区域建立CHHm[110-111]。这些siRNA优先在精细胞中的MEG位点积累[110]。
父系表达基因的建立。除DME直接激活中央细胞中编码PRC2组分的基因功能外, 通过DME去除DNA甲基化有助于PRC2介导的H3K27me3沉积的范围, 因为DNA甲基化和H3K27me3是相互拮抗的[100,112-113]。母系专一的H3K27me3与父系偏向的表达(paternally-biased expression)相关[100],除H3K27me3外, 组蛋白H3的赖氨酸9上的二甲基化(H3K9me2)和母系等位基因上的CHGm的存在是稳定父系偏向表达的标志[100,114-115]。PRC2组分FIE(FERTILIZATION INDEPENDENT ENDOSPERM)的缺失引起胚乳中CHGm的减少, 表明PEG上CHGm的建立依赖于FIS-PRC2活性[114]。PEG的父系等位基因的活性状态与精子中起作用的表观遗传重置(epigenetic resetting)机制有关, 引起H3K27me3的去除。这种表观遗传重置的一个关键组分是精细胞专一的组蛋白变体H3.10, 它取代了组蛋白变体H3.1和H3.3。H3.10在赖氨酸27周围存在很大的差异, 因此不被PRC2靶定[116]。这与精子中H3K27me3去甲基化酶的活性一起, 引起精子基因组大多数位置上的H3K27me3去除[117]。受精后, MADS-box转录因子PHE1 (PHERES 1)结合并激活父系PEG等位基因, 可能阻止它们在受精后被PRC2活性沉默[118]。是否需要重置H3K27me3才能允许PHE1激活其靶子仍有待研究。
3.2.2 基因组印记控制种子休眠 与单一的H3K27me3相比, 稳定的父系偏向表达与母系等位基因上存在的三重抑制标记H3K27me3、H3K9me2和CHGm (H3K27me3/H3K9me2/CHGm)紧密相关[114]。事实上, 表观遗传标记(epigenetic mark)的不同组合决定拟南芥发育胚乳中母系等位基因的活性状态。尽管由三重抑制标记作记号的母系等位基因在胚乳发育过程中趋于沉默, 但仅仅由H3K27me3标记的等位基因很可能被激活, 并在控制种子休眠中起重要作用[2,104]。Sato和Köhler[2]描述了胚乳中由亲本专一的表观遗传修饰标记的基因的调节及其以亲本特异的方式在控制种子休眠中的作用(图3)。
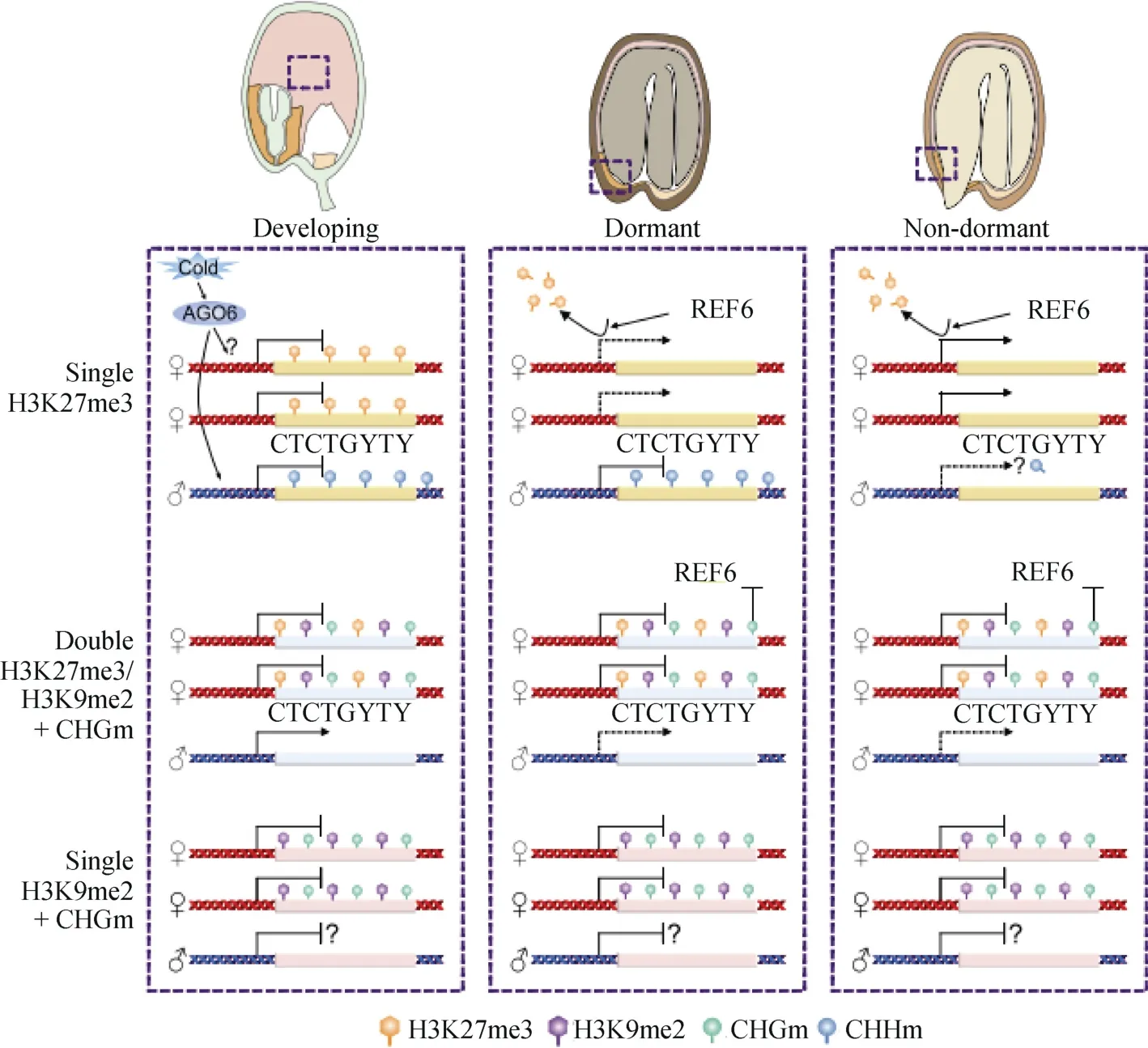
图3 描述亲本等位基因的不同表观遗传修饰组合如何影响胚乳基因表达和控制种子休眠的模型Fig. 3 Model depicting how different combinations of epigenetic modifications on parental alleles affect gene expression in the endosperm and control seed dormancy
母系等位基因上具有单一H3K27me3的基因控制种子休眠。许多由单一H3K27me3标记的基因在萌发过程中被诱导, 并富含与乙烯反应相关的功能[104]。研究发现, 乙烯通过细胞松弛促进萌发, 表明H3K27me3的去除通过激活乙烯反应在促进种子萌发中起作用[119]。与该结果一致, H3K27me3去甲基化酶REF6/ELF6的突变体表现出种子休眠增加和许多由单一H3K27me3标记的基因表达减少[104-105]。有趣的是, 具有单一H3K27me3的基因在休眠种子中表现出母系偏向的表达模式, 但在非休眠种子中不表现出母系偏向的表达模式[104,106], 这与CHHm在父系等位基因上的积累有关[120]。冷诱导的CHHm由非典型RdDM途径介导[121], 冷敏感性与冷诱导的AGO6 (ARGONATE 6)积累相关[120]。这些结果表明,母系专一的种子休眠控制由2种不同的表观遗传机制介导: H3K27me3的去除引起母系等位基因的激活,冷诱导的母系等位基因的沉默通过CHHm产生。因此, 亲代专一的表观遗传标记不仅在受精后, 而且在种子发育后期, 可以引起亲代特异的表达模式, 从而对种子发育产生亲代的特异性影响[2](图3)。
REF6靶子CYP707A1和CYP707A3编码细胞色素P450单加氧酶(cytochrome P450 monooxygenase),该酶通过分解代谢ABA来诱导萌发[105]。在ref6突变体的胚乳中, 这2个基因在种子萌发过程中都被显著地下调[104],CYP707A3在发育的胚乳中表现出母系偏向的表达[100-101]。然而, 在授粉后4 d的胚乳中, 这2个基因在母系等位基因上都没有检测到H3K27me3[100], 表明REF6在授粉后的4 d前在受精前的中央细胞中起作用。同样, 在种子休眠中具有已知作用的2个MEG, 半胱氨酸蛋白酶1(CYSTEINEPROTEASE1,CP1)和尿囊素酶(ALLANTOINASE,ALN)在授粉后4 d的胚乳中的母系等位基因上也没有检测到H3K27me3[100,106,120]。与CYP707A1和CYP707A3类似, 这2个基因在种子萌发过程中在ref6突变体的胚乳中被下调[104], 表明其REF6介导的激活发生在授粉后的4 d之前。REF6在雌配子体中央细胞中的可能作用也被遗传结果所支持, 表明母系同源和异源的ref6突变体增加了种子休眠[104]。然而, 因为由H3K27me3标记的REF6靶子在授粉后4 d被检测到, 表明REF6至少有2个不同的作用时间点: 一个在受精前, 一个在胚乳发育后期。为了确定REF6的作用时间和了解早期和后期REF6靶子之间的差异需要做进一步的研究。
具有三重H3K27me3/H3K9me2/CHGm抑制标记的基因保持稳定的印迹。具有单一H3K27me3的基因在萌发过程中被REF6/ELF6的活性激活, 与这些基因相反, 三重抑制标记H3K27me3/H3K9me2/CHGm的存在可能阻止REF6/ELF6靶向和激活一些基因[104], 与CHGm阻止REF6的结合活性一致[122]。在SUVH4、SUVH5和SUVH6(suvh456)突变体中,H3K9me2和CHGm的缺失引起胚乳中具有三重抑制标记的基因在萌发过程中上调。在这些上调的基因中, 有关键的休眠调控因子ABI3[104,123], 这可能是导致suvh456和suvh45突变体休眠增加的原因[104,124]。同时, 这些结果表明, 存在一个由H3K27me3/H3K9me2/CHGm建立的胚乳专一的双重控制层次,它们阻止基因在萌发过程中激活。含有三重修饰的母系等位基因在萌发过程中将受到抑制; 相反, 由单一H3K27me3标记的基因可能在萌发过程中被激活, 以及在控制这一过程中具有重要作用[2](图3)。这种机制确保对种子休眠的母系控制, 从而有助于最大限度地成功繁殖。被和不被REF6/ELF6激活的基因之间的关键区别在于H3K27me3标记的等位基因上是否存在H3K9me2/CHGm, 这就表明SUVH456和CMT3在控制种子休眠中的关键作用。此外, 值得注意的是, 小部分具有三重标记的基因在萌发过程中被激活, 这显示一种未知的分子机制可以消除这种表观遗传抑制。然而, 为了充分了解表观遗传修饰的动态及其对种子休眠的影响, 需要对萌发过程中胚乳的全基因组表观遗传谱进行研究[2]。
4 结语
种子休眠是植物在长期进化过程中所形成的一种适应性特征, 这种特征使植物能够在逆境条件下存活[6], 包括延长种子储存寿命[125]和防止种子在不利季节的短期有利条件下萌发所引起的幼苗死亡[1,126]。种子休眠是一种复杂的性状, 由多种内源和外部因素共同决定; 其中ABA的水平及其信号转导是种子休眠调控的主要因素[15,37]。研究发现, E3连接酶催化的泛素化(ubiquitination)有助于26S蛋白酶体介导的ABA受体PYR/PYL和PP2C蛋白的降解, 许多E3连接酶通过直接或间接的相互作用调节这些靶蛋白的稳定性。然而, E3连接酶是否直接泛素化SnRK2蛋白还不明确, 这限制了对E3连接酶介导的SnRK2蛋白稳定性调控的理解[37]。此外, 种子组织特别是胚和胚乳是如何协调控制休眠诱导和萌发的信号途径以及响应环境条件如光照、温度和硝酸盐的作用也不清楚[15]。
DOG1是一种休眠诱导绝对必需的蛋白[7,17], 但目前的研究进展主要是基于拟南芥突变体种子, 以及与DOG1不同位点结合的辅因子特征。虽然DOG1的功能在被子植物中似乎是保守的, 但在单子叶植物和双子叶植物种子休眠中的作用是否不同还需要做更多的研究。DOG1在什么发育阶段起促进种子休眠的作用, 即DOG1的功能是在种子发育过程中还是在种子吸胀时起作用也有待研究[7]。Dekkers等[76]表明,DOG1在种子成熟过程中调控数百个基因的表达, 包括ABI5的表达, 并与ABI3发生遗传相互作用以促进种子成熟。因此, 研究DOG1和ABA在种子成熟和萌发事件中的相互作用, 从而调控种子休眠将成为一个新的研究内容。
调控种子休眠的表观遗传效应发生在胚乳中,胚乳是一种唯一的在种子整个发育过程中具有亲本专一的基因表达模式的种子组织[106-107]。这与胚中大量的双等位基因(biallele)表达不同[127], 表明中央细胞/胚乳是建立母系决定的控制休眠的关键部位。胚乳不同于其他组织在于抑制性表观遗传修饰H3K27me3和H3K9me2/CHGm共存, 但这种共存通常在孢子体组织中不存在[114]。由于种子休眠受到环境条件的调控, 不同的环境条件是否以及如何影响亲本专一的表观遗传修饰和基因组印记是不清楚的,揭示这些关系的研究将为休眠控制及其潜在的表观遗传机制提供新的知识。

