高压电击伤小鼠的血液代谢组学研究
陈思羽,王 徽,罗 燕,陶嘉雯,张文娟,岳 洋,余争平,皮会丰 (陆军军医大学军事预防医学系军队劳动卫生学教研室/教育部电磁辐射医学防护重点实验室,重庆 400038)
电工作业是通用的特种作业之一,分为高压电工作业、低压电工作业和防爆电器作业。高压电工作业的职业危险因素主要是高压电击伤,高压电击伤的死亡率高,发生率呈逐年递增的趋势[1-2]。生物体遭受电击是一个复杂的生理过程,高压电击伤涉及多系统损伤,包括中枢神经系统、心血管系统、血液系统、内分泌系统、视觉系统、生殖和遗传效应等[3-6]。高压电击伤对血液系统的影响表现为凝血功能异常[7]、血小板相关因子和血小板聚集数改变[8]等,其损害血液代谢活动的机制至今尚无清晰准确的科学论述,本研究通过高压电击伤后小鼠的血液代谢组学变化,揭示高压电击伤对全身血液代谢活动的潜在危害。
代谢组学是系统生物学的重要组成部分,也是目前组学领域研究热点之一[9-10]。气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)和液相色谱- 质谱(liquid chromatography-mass spectrometer,LC-MS)是目前代谢组学检测的主流技术,具有灵敏度高、定性能力强、稳定可靠等特点,主要用于分析挥发性和热稳定性代谢物[11]。LC-MS 具有高通量、高分辨率、高灵敏度等特点,适用于分析难挥发或热稳定性差的代谢物[12]。GC-MS和LC-MS联用能相互补充代谢信息,提高代谢组学检测的覆盖度,获取更加全面的代谢物及其丰度信息,增加可靠性[13]。本研究的小鼠血清样本代谢组学采用GC-MS 和LC-MS 联合分析,通过非靶向代谢组学,筛选出电击组和对照组的差异代谢物并分析其对应的代谢通路,揭示可能存在的调控作用与机制,为进一步探索高压电击对血液系统代谢活动的损伤提供理论依据。
1 材料与方法
1.1 实验动物及分组
SPF级C57BL/6J雄性小鼠,6周龄,体质量20 g,购自陆军军医大学实验动物中心[SCXK(渝)2022-0011],本研究的实验设计、实验过程及动物处死方法均由陆军军医大学实验动物福利伦理审查委员会审核通过(AMUWEC20226182)。小鼠饲养环境温度为20~25 ℃,湿度为50%~60%,适应性饲养1 周后随机分为电击组(ES)和对照组(Con),每组10只。
电击组:按1.2 g/kg 乌拉坦的剂量进行腹腔麻醉后,固定小鼠并充分暴露已备皮的颅顶区域,用电击装置(型号K98,江苏柯林,电极片分别对称置于小鼠头顶两侧,持续稳定输出电压20 kV)持续电击小鼠头部5 s,用眼球取血法收集血液至含抗凝剂EDTA 的EP管中,室温静置2 h,于4 ℃以3 000 r/min离心15 min,取200 µL上层血清样品,-80 ℃保存。
对照组:按1.2 g/kg 乌拉坦的剂量进行腹腔麻醉后,固定小鼠并充分暴露已备皮的颅顶区域,用电击装置(型号K98,江苏柯林,电极片分别对称置于小鼠头顶两侧,持续稳定输出电压20 kV)的声光刺激小鼠5 s,用眼球取血法收集血液至含抗凝剂EDTA 的EP管中,室温静置2 h,于4 ℃以3 000 r/min 离心15 min,取200 µL上层血清样品,-80 ℃保存。
1.2 主要材料与试剂
葡萄糖测定试剂盒、糖化血清蛋白测定试剂盒、三酰甘油(triglyceride,TG)测定试剂盒、总胆固醇测定试剂盒、高密度脂蛋白(high-density lipoprotein,HDL)测定试剂盒、低密度脂蛋白(low-density lipoprotein,LDL)测定试剂盒购自深圳雷杜生命科学股份有限公司;甲醇、乙腈、甲酸购自赛默飞世尔科技(中国)有限公司;L-2-氯苯丙氨酸购自上海恒创生物科技有限公司;正己烷购自德国CNW 公司;吡啶购自上海阿拉丁生化科技股份有限公司;氯仿购自上海泰坦科技股份有限公司;BSTFA 购自梯希爱(上海)化成工业发展有限公司;O-甲基羟胺盐酸盐购自上海麦克林生化科技股份有限公司;辛酸甲酯标准品、十六烷酸甲酯/棕榈酸甲酯(C16:0)标准品购自德国DR.Ehrenstorfer 公司;壬酸甲酯(C9:0)标准品、癸酸甲酯(C10:0)标准品、十二烷酸甲酯/月桂酸甲酯(C12:0)标准品、十四烷酸甲酯/肉豆蔻酸甲酯(C14:0)标准品、十八烷酸甲酯/硬脂酸甲酯(C18:0)标准品、二十烷酸甲酯/花生酸甲酯(C20:0)标准品、二十二烷酸甲酯/山俞酸甲酯(C22:0)标准品、二十四烷酸甲酯/木蜡酸甲酯(C24:0)标准品购自美国Nu-chek公司;纯净水购自杭州娃哈哈集团有限公司。
1.3 血清生化指标分析
测定高压电击后小鼠的HDL、LDL、血糖(blood glucose,GLU)、糖化血清蛋白(glycosylated serum protein,GSP)、胆固醇(cholesterol,CHO)、TG 等血清生化指标。
1.4 代谢组学分析
本研究的代谢组学方法主要参考文献[14],具体流程见图1。采用无监督的主成分分析法(principal components analysis,PCA)反映数据的原始情况,采用有监督的正交偏最小二乘法(orthogonal partial least squares discriminant analysis,OPLS-DA)分析模型内部不同组别之间的差异,并对模型进行验证,随后通过数据库进行差异代谢物筛选,最后进行相关性分析和代谢通路富集。
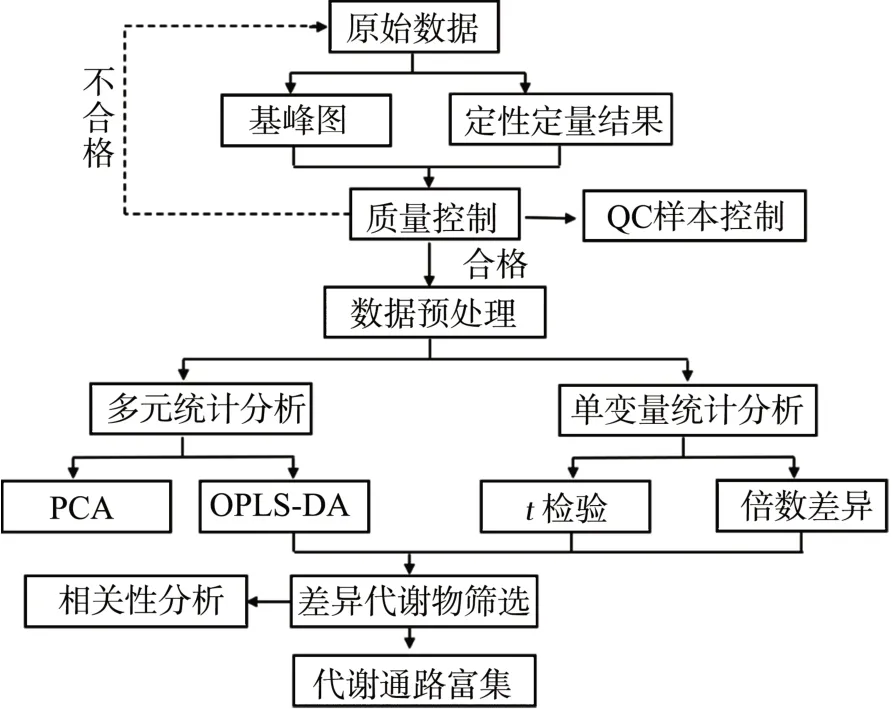
图1 代谢组学流程图
1.5 数据分析及统计学处理
首先将采集到的质谱原始数据用AbfConverter 软件进行数据转换,然后用MS-DIAL 和Progenesis QI 软件进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化处理,R 软件分析。本研究的小鼠血液代谢组学采用无监督的PCA 模型观察各样本之间的总体分布,电击组和对照组代谢轮廓的总体差异采用有监督的OPLS-DA 模型进行分析,差异代谢物的检索数据库为LUG 数据库、EMBD 数据库和KEGG 数据库。血清生化指标运用SPSS 22.0 软件进行独立样本t检验,所有数据以均数±标准差()表示,P<0.05 表示差异有统计学意义。
2 结果
2.1 高压电击小鼠的表现
小鼠电击前处于麻醉状态,高压电击时小鼠全身肌肉紧张,四肢强直甚至站立,眼球突出、充血,部分小鼠出现甩尾动作;电击结束后,小鼠全身肌肉松弛,尾柔软,开始张口,深快喘气,出现非自主的凝视、频繁点头、咀嚼、嘴和面部节律性抽动,部分小鼠头皮点状出血。
2.2 血清生化指标结果
电击组与对照组小鼠的HDL、LDL、GLU、GSP、CHO、TG比较,差异均无统计学意义(P>0.05),见图2。
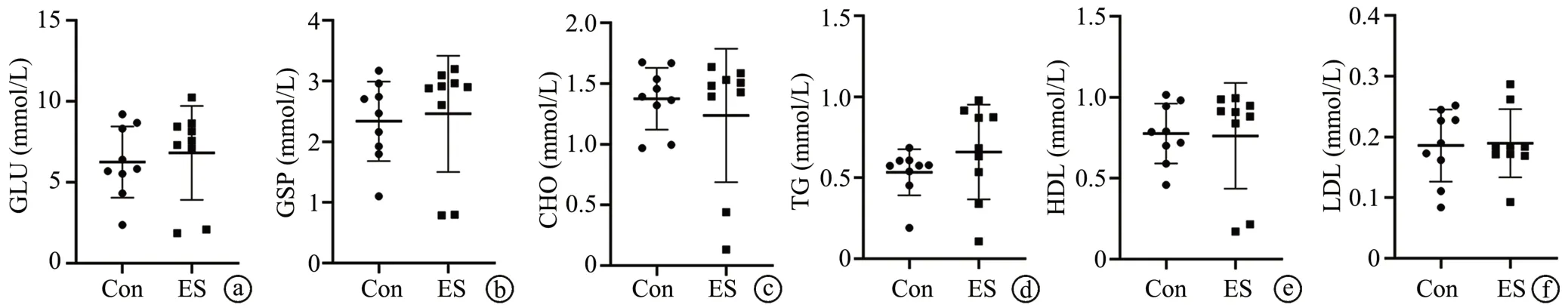
图2 血清生化指标图
2.3 GC-MS和LC-MS检测电击后的血液代谢谱分析
无监督的PCA 和有监督的OPLS-DA 分析结果显示,在无监督和有监督状态下电击组和对照组均能区分。在无监督状态下,运用GC-MS 技术分析的第一主成分和第二主成分分别为36.3%和15.3%(图3a),对照组的其中一个样本与电击组区分不太明显;运用LC-MS 技术分析的第一主成分和第二主成分分别为30.7%和8.6%(图3b),电击组有两个样本与对照组差异不太明显。为了更好地确立样本关系,消除随机误差和组内误差,本研究采用有监督的OPLS-DA 分析,结果显示,GC-MS的代谢谱第一主成分和第二主成分分别为34.7%和17.9%(图3c),电击组和对照组区分明显,LC-MS 的代谢谱第一主成分和第二主成分分别为31.2%和24.1%(图3d),电击组和对照组区分明显。

图3 GC-MS和LC-MS的PCA、OPLS-DA模型图
2.4 OPLS-DA模型验证
为了考察OPLS-DA 模型的质量,本研究采用7 次循环交互验证和200 次响应排序检验的方法来验证,见图4。GC-MS 代谢组学和LC-MS 代谢组学的R2 和Q2 值见图4a、b。Splot 图结果表明,GC-MS 和LC-MS电击组和对照组的差异程度较大,可靠程度较高。综合分析Permutation和Splot结果,本研究的OPLS-DA模型不存在过度拟合的情况,此模型计算的数据可靠。
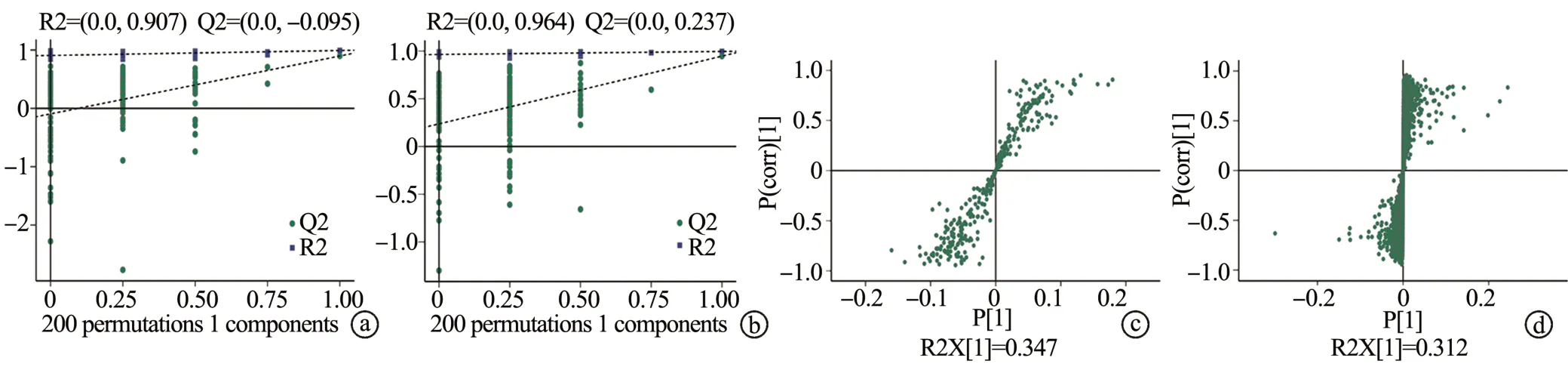
图4 GC-MS和LC-MS模型验证和Splot图
2.5 差异代谢物分析
本研究基于OPLS-DA 模型,筛选出与高压电击密切相关的差异代谢物(图5)。GC-MS 筛选的差异代谢物主要有羧酸及其衍生物(22.71%)、二氮杂苯类(2.79%)、脂肪酰基(13.55%)、羟基酸及其衍生物(3.98%)、吲哚及其衍生物(2.39%)、酮酸及其衍生物(2.79%)、有机氮化合物(2.79%)、有机氧化合物(25.50%)、类固醇和类固醇衍生物(3.19%)、其他类(20.32%),见图5a;LC-MS 筛选的差异代谢物有苯及其取代衍生物(5.95%)、羟基酸及其衍生物(13.98%)、脂肪酰基(16.62%)、甘油磷脂(6.24%)、有机氮化合物(1.90%)、有机氧化合物(7.53%)、丙烯酰酯类(4.66%)、类固醇和类固醇衍生物(3.56%)、其他类(39.56%),见图5b。

图5 GC-MS和LC-MS差异代谢物
本研究采用多维分析和单维分析相结合的方法筛选差异代谢物,筛选标准为第一主成分的变量权重值>1,且t检验的P<0.05,结果显示,差异代谢物共415种,其中GC-MS平台筛选出91种:上调57种,下调34种(图5c);LC-MS平台筛选出324种:上调130种,下调194种(图5d)。为了展示样本之间的关系及代谢物在不同样本之间的表达差异,本研究对所有显著差异代谢物按照VIP排序前50进行了层次聚类分析,见图5e、f。
2.6 相关性分析和代谢通路富集
结合GC-MS 和LC-MS 差异代谢物结果,按照第一主成分的变量权重值排序的前20 对显著差异代谢物进行相关性分析(图6a),并基于KEGG 数据库对差异代谢物进行代谢通路富集分析(图6b、c)。排名前20的代谢通路分别是癌症中心碳代谢,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,柠檬酸盐循环,缬氨酸、亮氨酸和异亮氨酸生物合成,不饱和脂肪酸的生物合成,胰高血糖素信号通路,丁酸盐代谢,近端小管碳酸盐回收通路,赖氨酸降解,氨酰-tRNA生物合成,肾细胞癌,味觉传导通路,组氨酸代谢,鞘磷脂信号通路,泛酸盐和辅酶A生物合成,氧化磷酸化,ABC转运蛋白,甘氨酸、丝氨酸和苏氨酸代谢,戊糖磷酸途径。
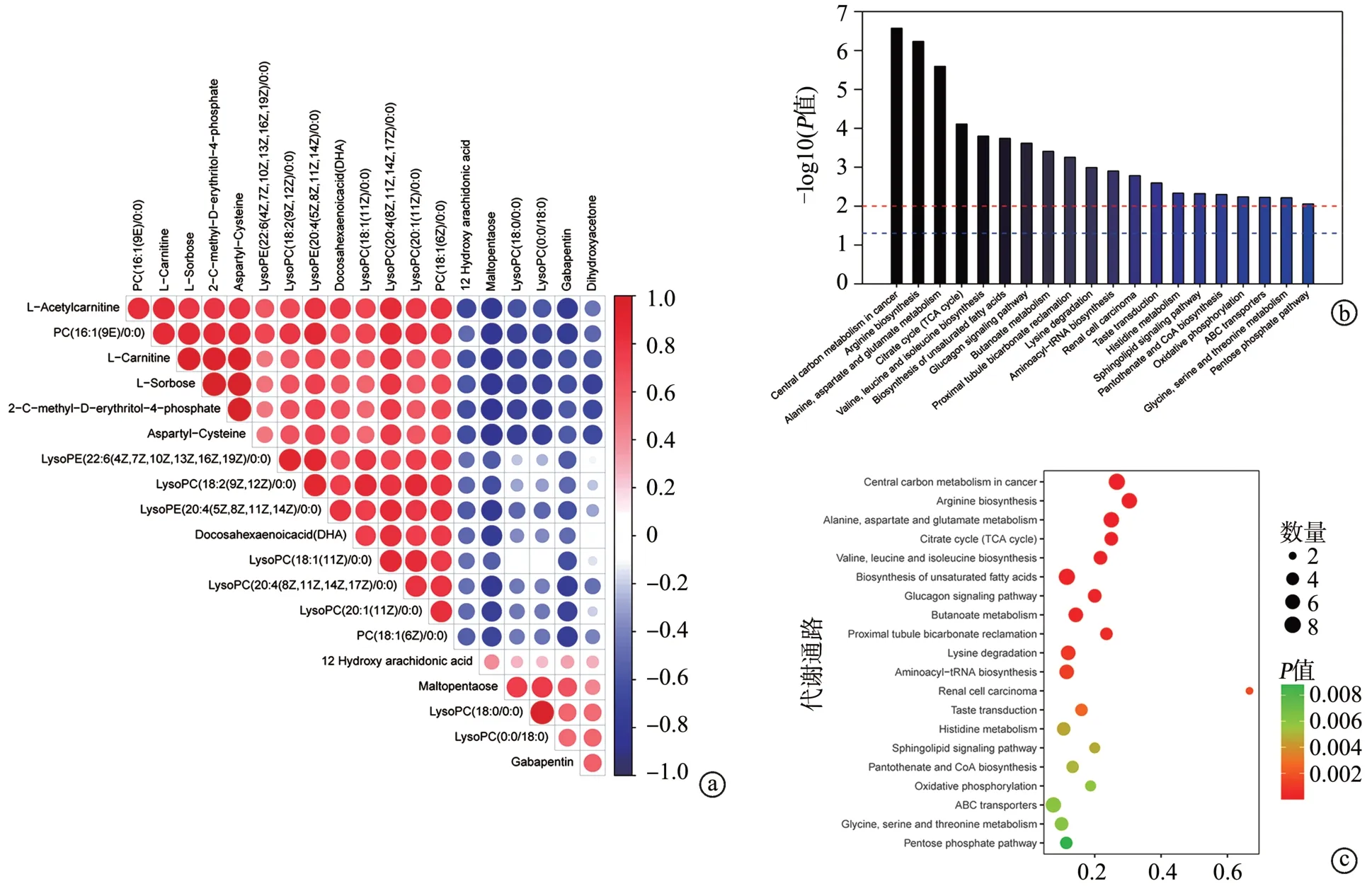
图6 相关性分析和代谢通路富集图
3 讨论
近年来高压电击伤频发,主要好发于高压电工、铁道工人、建筑工人等人群,高压电击可引起肢体损伤[14]、腹壁损伤[15]、电击部位局部和全身性损伤[16]等,高压电击伤的血液损害包括局部血液流变学改变[17]、血小板流变学变化[18],其对血液代谢活动的影响尚不清楚,因此,研究高压电击伤的血液代谢组学具有重要的临床意义。本研究的高压电击小鼠模型与文献报道的电击动物模型方法类似[19-20],小鼠高压电击后的表现与大鼠电击后的表现相仿[21],本研究的小鼠高压电击模型可成功应用于血液代谢组学研究。
既往研究表明,高压电击伤后血清肌酸激酶和肌红蛋白水平明显升高,血清中脑钠素前体水平与高压电击伤后死亡率密切相关[22];也有研究表明,高压电击后血清肌酸激酶的升高对组织损伤程度具有一定的预测价值[23];本研究中高压电击小鼠血清GLU、GSP、CHO、TG、HDL、LDL 等生化指标无明显变化,表明高压电击对小鼠的此类血清生化指标没有影响或影响是可逆性的。本研究通过非靶向代谢组学对小鼠高压电击模型血清进行差异代谢物及相关代谢通路分析,从代谢组学角度研究高压电击引起小鼠血液中的代谢物变化,通过GC-MS平台筛选出了91种差异代谢物,通过LC-MS 平台筛选出了324 种差异代谢物。将各自的差异代谢物分别进行KEGG 分析发现,差异代谢物均富集到的代谢通路有癌症中心碳代谢,丙氨酸、天冬氨酸和谷氨酸代谢,柠檬酸盐循环。癌症中心碳代谢是生物体所需能量的主要来源,并为体内其他代谢提供前体物质,传统意义上包括糖酵解途径、磷酸戊糖途径以及三羧酸循环。三羧酸循环是糖、蛋白质和脂肪彻底氧化分解的共同途径,蛋白质的水解产物(如谷氨酸、天冬氨酸、丙氨酸等脱氨后或转氨后的碳架)要通过三羧酸循环才能被彻底氧化,产生大量能量[24-25],这可能与高压电击后机体的应激反应有关。本研究中血液代谢组学富集到的代谢通路揭示高压电击伤会引起血液中碳代谢出现显著改变。有研究表明,兔胫骨前肌受到28 d 的慢性电刺激后,肌肉浅表中柠檬酸循环和脂肪酸氧化的酶活性增加了5~6 倍[26]。进一步说明高压电击伤可能通过引起肌肉损伤造成血液中柠檬酸循环的改变。在GC-MS 中筛选到的差异代谢物会显著富集到胰高血糖素信号通路。既往报道显示,电击伤可以引起机体产生高钾血症,当血液中K+浓度上升到1 mmol/L 以上时会直接刺激胰岛素释放,胰岛素增多可以促进骨骼肌摄取细胞外液中的K+,因而在高钾血症时有代偿意义[27]。研究表明,高钾血症可以直接刺激胰高血糖素的分泌,而胰高血糖素与胰岛素共同维持血糖的调节[28]。所以,高压电击伤可能会通过引起高钾血症间接刺激胰高血糖素分泌。
综上所述,高压电击伤引起的血液代谢活动变化可能与癌症中心碳代谢、胰高血糖素信号通路等有关。本实验仅对代谢物的改变进行通路富集分析,未涉及高压电击引起的代谢物改变机制,其具体机制还有待进一步探究。