室温制备铁基有机金属框架吸附三价砷的研究
贺翌鹏,熊晨曦,王一平,李 军,金 央
(四川大学化学工程学院,四川成都 610065)
地下水是人类赖以生存的重要饮用水来源之一[1-2],但由于地质活动和电子、化工、冶金等人类活动,地下水中砷的富集程度越来越高[3]。人类摄入高砷地下水会发生砷中毒,严重时可导致死亡。因此,世界卫生组织规定,饮用水中砷的标准是砷质量浓度不超过10 μg/L[4]。目前,全世界有超过70个国家和过亿的人口正面临高砷地下水的威胁[5]。在砷污染愈发严重的今天,实现水中As的高效脱除具有重要意义。
近年来,关于从水体中脱除砷的研究越来越多。脱除砷的主要处理方法有膜分离法、生物降解法、化学沉淀法和吸附法等[6-10]。其中,吸附法具有选择性高、成本低、能耗低(相较于膜分离法)和副产物少(相较于化学沉淀法)等优势[11]。常用的砷吸附材料有氧化物、活性炭、树脂、金属有机框架(MOF)、纳米复合材料和生物吸附剂等[12-13]。其中,MOF 是一种新兴的吸附材料,具有比表面积大、活性位点多等特点。FOLENS等[14]制备了MOF基材料Fe3O4@MIL-101(Cr),发现其对地下水和地表水中的亚砷酸盐和砷酸盐化合物表现出良好的亲和力,具有吸附量大、去除效率高的优点,对As(Ⅲ)和As(Ⅴ)的吸附量分别为121.5、80.0 mg/g;HE等[15]合成了高度稳定的锆金属有机骨架UiO-66 材料并将其用于去除水中的As(Ⅲ),吸附量高达205.0 mg/g;HUO等[16]成功制备了一种性能稳定的Fe3O4@ZIF-8复合材料,其对As(Ⅲ)的最大吸附量为100 mg/g。从以上研究可以看出,MOF 材料对砷的吸附量较高,在砷吸附领域有着广阔的应用前景。其中,MIL-88A 是一种具有良好水稳定性的铁基MOF 材料,可用于吸附水体中的As。WU 等[17]通过水热法合成了铁基金属有机骨架MIL-88A 微棒用于吸附水中的As(V),最大吸附量为145 mg/g。然而,采用水热法合成MOF 材料时,需要使用压力容器,能耗较高,增加了材料的制备难度,限制了MOF 材料在砷吸附领域的应用。
FU 等[18]开发了MIL-88A 的室温合成方法并用于光催化研究,该方法以水和乙醇的混合物为溶剂,在常温常压下进行合成,解决了常规水热法合成的弊端。本研究采用以上方法合成MIL-88A,以毒性较强的As(Ⅲ)为代表,考察了材料对砷的吸附能力。通过SEM、XRD、FT-IR和XPS等手段对材料进行了表征,探究了温度、As(Ⅲ)的初始浓度和pH等参数对吸附过程的影响。测试并拟合了吸附过程的动力学、热力学参数,结合吸附前后的XPS、FT-IR表征分析推测MIL-88A对As(Ⅲ)的吸附过程。
1 实验部分
1.1 实验试剂
富马酸(C4H4O4)、六水氯化铁(FeCl3·6H2O)、无水乙醇(C2H6O)、硝酸(HNO3)、氢氧化钠(NaOH)、亚砷酸钠标准溶液(NaAsO2)、高锰酸钾(KMnO4)、硫酸(H2SO4)、L-抗坏血酸(C6H8O6)、钼酸铵[(NH4)2MoO4]、酒石酸锑钾(C8H4K2O12Sb2),均为分析纯。所有化学试剂均未经进一步纯化,直接使用。
1.2 室温合成MIL-88A
在室温下,将2.702 9 g (10 mmol) FeCl3·6H2O和1.160 4 g (10 mmol)富马酸分别溶解在75 mL 去离子水和75 mL 无水乙醇中,二者充分混合后在室温下以850 r/min的转速磁力搅拌24 h。将得到的浆料在离心机中以10 000 r/min的转速离心10 min,将离心分离得到的砖红色固体分别用乙醇和蒸馏水洗涤3 次,随后转移至真空干燥箱中于333.15 K 干燥24 h,干燥后得到粉红色粉末即为MIL-88A(制备过程见图1)。

图1 MIL-88A的制备过程Fig.1 Synthesis process of MIL-88A
1.3 分析方法
通过X 射线衍射仪(XRD,Empyrean)表征材料的物相和晶体结构。通过高分辨场发射扫描电子显微镜(SEM,Apreo S)表征材料的表面形貌和粒径。通过傅里叶变换红外光谱仪(FT-IR,Nicolet 6700)表征材料的化学键或官能团信息。通过X射线光电子能谱仪(XPS,K-Alpha)表征材料的元素组成及各元素的价键结构。通过紫外-可见分光光度计测定溶液中As(Ⅲ)含量。
1.4 分光光度法测砷
将2.0 g/L 亚砷酸钠标准液稀释不同的倍数制备成不同质量浓度的含As(Ⅲ)溶液。移取1 mL 待测溶液于25 mL 容量瓶中,依次加入10 mL 去离子水、0.5 mL H2SO4[w(H2SO4)=50%]、适量的KMnO4溶液,混匀使溶液呈淡红色,再依次加入2 mL 钼酸铵溶液(15 g/L)、2 mL L-抗坏血酸溶液(15 g/L)、2 mL酒石酸锑钾溶液(0.15 g/L),混匀后加水定容。在常温下放置120 min 后,以空白样作参比溶液,用紫外-可见分光光度计在波长为720 nm 处测定吸光度。取不同浓度的含As(Ⅲ)溶液进行上述操作可以得到As(Ⅲ)的标准曲线方程:y=130.912 3x-5.969 4(图2),拟合直线的相关系数R2为0.999 9。

图2 As(Ⅲ)的分光光度法标准曲线Fig.2 Spectrophotometric standard curve of As(Ⅲ)
1.5 As(Ⅲ)吸附实验与吸附动力学
用适量去离子水稀释2.0 g/L 的亚砷酸钠标准溶液制备成不同质量浓度的含As(Ⅲ)溶液(50、100、150、200、300 mg/L)。每组实验均使用40 mL含As(Ⅲ)溶液和0.016 g 吸附剂(0.4 g/L)进行As(Ⅲ)吸附实验,实验温度分别为288.15、298.15、308.15 K。吸附过程中用Teflon 搅拌子以400 r/min的速率进行搅拌,分别在10、30、60、90、120、150、180、240、360 min 对悬浮液进行采样,采样量为1 mL。使用0.22 μm聚醚磺酸树脂膜对样品进行固液分离,用分光光度法测试清液的As(Ⅲ)质量浓度。溶液中As(Ⅲ)的去除率α采用公式(1)计算:
式中:ρ0和ρt分别是吸附实验中As(Ⅲ)的初始质量浓度和反应时间t(min)时As(Ⅲ)的质量浓度,mg/L。
吸附动力学描述了吸附质在吸附剂颗粒中的扩散特性,是研究吸附机理的重要指标。在298.15 K、pH=11.0、MIL-88A 用量为0.4 g/L 条件下,考察了不同As(Ⅲ)初始质量浓度下吸附时间为10~360 min时的吸附动力学,并应用模拟动力学过程的准一级和准二级动力学模型来拟合实验数据。
式中:k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g/(mg·min);Qt为吸附过程中t时刻吸附材料上As(Ⅲ)的吸附量,mg/g;Qe为平衡状态时吸附材料上As(Ⅲ)的吸附量,mg/g。
1.6 As(Ⅲ)的脱附及吸附剂再生
在298.15 K、pH=11、As(Ⅲ)初始质量浓度为300 mg/L、MIL-88A 用量为4.0 g/L 条件下进行吸附实验,反应360 min 后取样测试As(Ⅲ)质量浓度。在10 000 r/min 的转速下离心10 min 后,将吸附As(Ⅲ)的MIL-88A 加入到30 mL 1 mol/L HNO3溶液中,在308.15 K的恒温水浴锅中加热搅拌2 h以确保脱附充分,将脱附后的吸附剂在10 000 r/min的转速下离心10 min,再经多次水洗、离心,直至洗液呈中性后对吸附剂进行干燥,即得到再生的吸附剂。
2 结果与讨论
2.1 MIL-88A表征分析
图3a 为MIL-88A 的XRD 谱图。由图3a 可知,在2θ=7.94°、10.27°、12.97°、15.22°处出现明显的特征峰,与文献[18]报道的结果一致,说明材料结晶度高、无杂相。
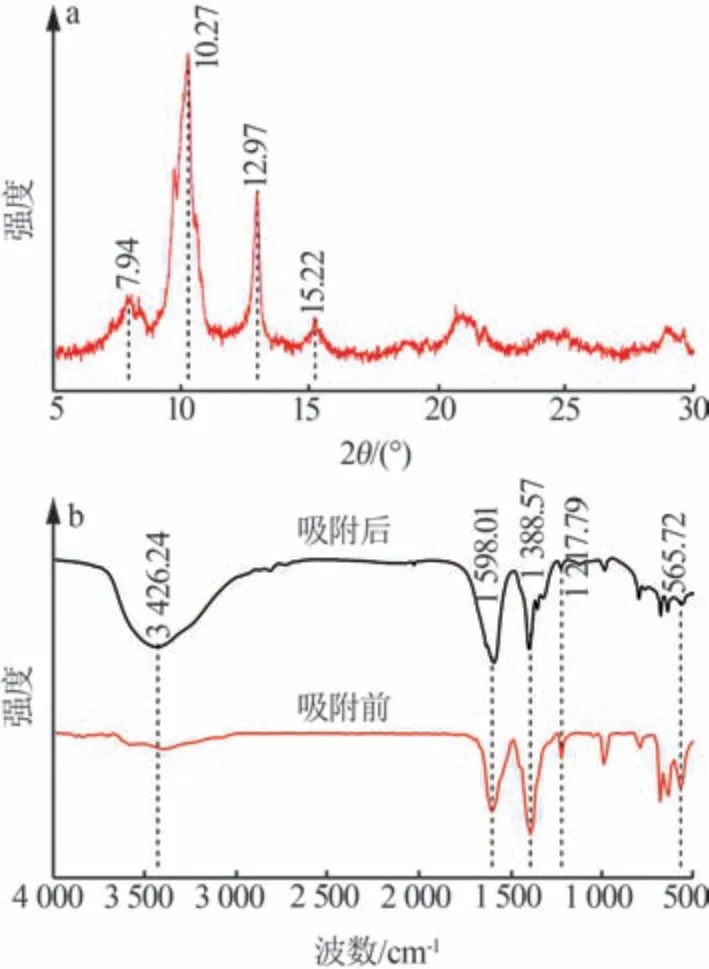
图3 MIL-88A的XRD谱图(a)和吸附前后MIL-88A的红外光谱(b)Fig.3 XRD pattern of MIL-88A(a) and FT-IR spectra of MIL-88A before and after adsorption(b)
图3b为MIL-88A的红外光谱图。由图3b可知,位于1 388.57 cm-1和1 598.01 cm-1处的吸收峰分别归属于羧基的对称与不对称振动;位于1 217.79 cm-1处的吸收峰归属于羧基中C—O 的伸缩振动,说明MIL-88A 框架中存在二羧酸连接物[18];位于565.72 cm-1处的吸收峰归属于MIL-88A中Fe—O键的振动峰。
图4 为MIL-88A 的SEM 图。从图4 看出,MIL-88A 的形貌为均匀且结晶度良好的六角微棒结构,轴向平均长度约为0.8 μm,径向平均长度约为0.4 μm,长径比约为2。室温下制备的MIL-88A形貌与文献[18]一致,长径比较水热法制备的材料要小[17]。

图4 MIL-88A的SEM图Fig.4 SEM images of MIL-88A
图5 为MIL-88A的XPS图。XPS全谱(图5a)中包含C、O、Fe 3种元素的特征峰,证实了MIL-88A中存在这3种元素。Fe 2p精细谱(图5b)中有2个特征峰,位于711.24 eV和724.68 eV,分别对应于Fe(Ⅲ)的Fe 2p3/2和Fe 2p1/2峰[19]。Fe 2p1/2峰和Fe 2p3/2峰之间的结合能差约为13.44 eV,且中间存在卫星峰,与α-Fe2O3的典型特征峰相符[19],说明Fe 在有机金属框架中的化合价为+3 价,与文献[18]报道结果一致。C 1s 精细谱(图5c)中出现了3 个峰,位于288.63 eV、286.18 eV 和284.80 eV 处,分别对应于O—C=O、C—O 和C—C,与制备MIL-88A 的原料富马酸的官能团相匹配。MIL-88A 的O 1s 精细谱(图5d)中同样有3 个峰,位于530.36 eV、532.71 eV和531.69 eV,分别对应于Fe—O、C=O和C—O—H,与FT-IR中表征出的官能团内所含的价键相一致。
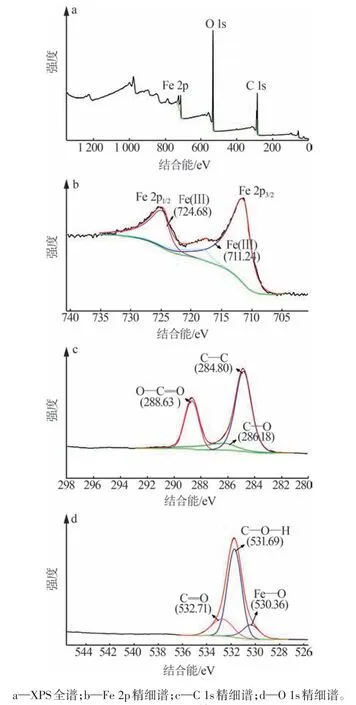
图5 MIL-88A的XPS图Fig.5 XPS spectra of MIL-88A
以上表征结果均表明,采用室温法成功制备了高纯度、结构完整的铁基MOF材料MIL-88A。
2.2 As(Ⅲ)吸附实验
在298.15 K、pH=11.0、MIL-88A 用量为0.4 g/L条件下,考察了不同As(Ⅲ)初始质量浓度下MIL-88A 对As(Ⅲ)的吸附量和去除率随时间的变化,结果如图6a、b所示。从图6a可以看出,在不同As(Ⅲ)初始质量浓度下MIL-88A 对As(Ⅲ)的吸附量随时间的变化趋势相似,即前30 min的吸附速率较快;随着处理时间的延长,吸附量增长缓慢。这是因为在吸附初期溶液中As(Ⅲ)与吸附剂上的羧基发生化学吸附反应,被氧化成As(Ⅴ)并吸附在材料表面,吸附速率较快;反应中后期时,溶液中未反应的As(Ⅲ)与吸附在材料上的As(Ⅴ)形成氢键[20],该过程吸附速率较慢,且需要时间稳定。从图6b可以看出,当As(Ⅲ)初始质量浓度为200、300 mg/L时反应速率较快,能在180 min时达到平衡,而As(Ⅲ)初始质量浓度为50、100、150 mg/L 时,则需在300 min 时才能达到平衡。因此,为保证反应的充分进行,反应时间统一定为360 min。

图6 MIL-88A对As(Ⅲ)的吸附实验结果Fig.6 Experimental results of adsorption of As(Ⅲ) by MIL-88A
在298.15 K、pH=11.0、MIL-88A 用量为0.4 g/L的条件下,考察了As(Ⅲ)初始质量浓度对MIL-88A吸附As(Ⅲ)的平衡容量的影响,结果如图6c 所示。从图6c 看出,随着As(Ⅲ)初始质量浓度的增加,吸附As(Ⅲ)的平衡容量逐渐增大,这是因为在吸附剂量固定的情况下,As(Ⅲ)初始质量浓度越高,驱动力越强,MIL-88A 上活性位点的利用率就越高。此外,在As(Ⅲ)初始质量浓度从50 mg/L 升高到300 mg/L 的过程中,该材料能够保持吸附量的持续升高,最大吸附量为286.37 mg/g,说明MIL-88A 上可用于吸附As(Ⅲ)的活性位点较多,具有优异的吸附性能,其能够在高As(Ⅲ)浓度的情况下正常工作。
在298.15 K、As(Ⅲ)初始质量浓度为100 mg/L、MIL-88A用量为0.4 g/L条件下,考察了溶液初始pH对MIL-88A吸附As(Ⅲ)的平衡容量的影响,结果见图6d。从图6d 看出,随着初始pH 的降低,砷的吸附量急剧下降,特别是当pH 小于9 时,MIL-88A 对As(Ⅲ)的吸附量小于20 mg/g,表明溶液pH 是影响As(Ⅲ)吸附平衡容量的重要因素。这是因为H+是吸附反应的产物,会直接影响反应平衡,当环境为碱性时,羧基与As(Ⅲ)发生氧化反应,As(Ⅲ)在材料表面被氧化成As(Ⅴ)并产生H+;随着反应的进行,H+浓度升高,直至系统接近中性,化学吸附达到平衡,此时环境中As(Ⅲ)只以As(OH)3形式存在[20],并与吸附在材料上的As(Ⅴ)形成氢键。显然,碱性条件下更利于MIL-88A对As(Ⅲ)的吸附。
2.3 吸附动力学
MIL-88A吸附As(Ⅲ)的准一级、准二级动力学模型拟合曲线如图7 所示,得到的动力学参数和线性回归系数见表1,其中k1、k2和Qe1、Qe2分别由拟合曲线的截距和斜率计算得到。由表1 可知,不同浓度下准二级动力学回归系数R2均大于0.99,拟合吸附平衡容量值与实验值偏差在3%以内。因此,MIL-88A 对As(Ⅲ)的吸附过程符合准二级动力学模型,表明MIL-88A 与As(Ⅲ)的吸附过程是化学吸附[21]。

表1 MIL-88A吸附As(Ⅲ)的准一级、准二级动力学模型拟合参数Table 1 Quasi-first-order and quasi-second-order kinetic model fitting parameters for adsorption of As(Ⅲ) by MIL-88A
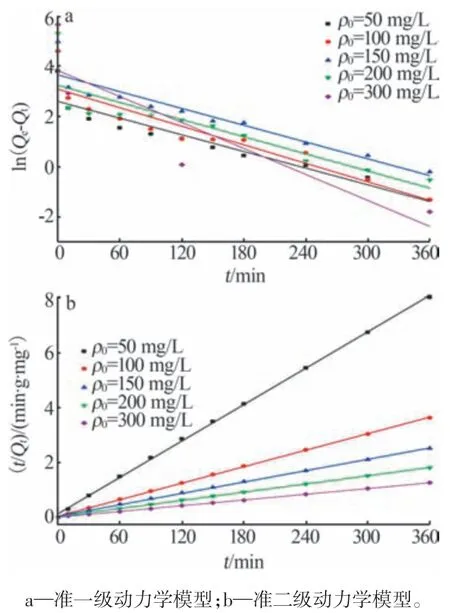
图7 MIL-88A吸附As(Ⅲ)的动力学模型拟合曲线Fig.7 Adsorption kinetics fitting curves of As(Ⅲ) adsorbed by MIL-88A
2.4 吸附等温线
吸附等温线可以反映吸附剂的吸附性能。采用Langmuir 模型和Freundlich 模型对不同温度下的实验数据进行拟合,分析了As(Ⅲ)在吸附剂上的吸附过程。
式中:ρe表示平衡质量浓度,mg/L;Qe表示平衡吸附量,mg/g;Qm表示最大吸附量,mg/g;KL表示Langmuir常数,L/mg;n为Freundlich 等温线模型与温度相关的常数;KF表示与吸附剂的吸附能力相关的Freundlich常数,(mg/g)/(L/mg)n。
MIL-88A 吸附As(Ⅲ)的等温线模型拟合曲线和拟合参数分别见图8 和表2。通过比较两个方程的R2值可以发现,Langmuir 模型对数据的拟合度较低,而Freundlich 模型对数据拟合度良好(图8和表2),可以更好地描述该吸附过程,表明As(Ⅲ)在MIL-88A 上的吸附属于多层吸附[22]。从本研究的实验结果来看,MIL-88A对As(Ⅲ)的最大吸附量达到了286.37 mg/g,超过了文献报道的其他MOF材料(表3),说明该材料对As(Ⅲ)的吸附能力很强,可适用于处理高浓度的含砷废水。

表2 MIL-88A吸附As(Ⅲ)的等温线性模型拟合参数Table 2 Fitting parameters of isothermal linear model for adsorption of As(Ⅲ) by MIL-88A
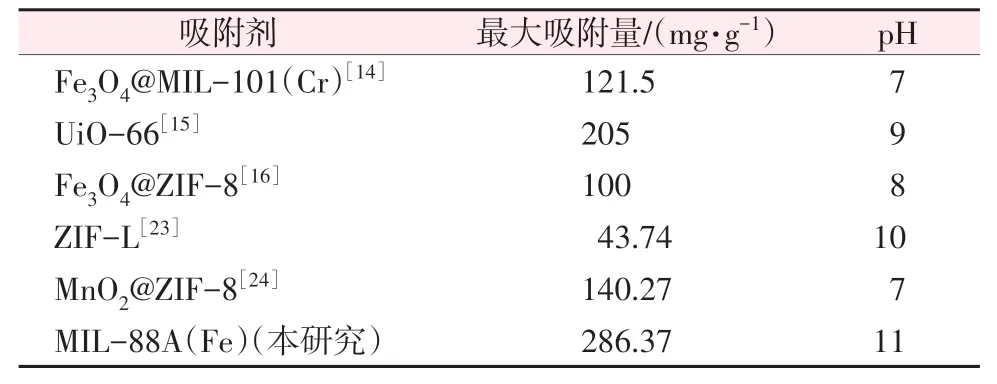
表3 MIL-88A与其他吸附剂吸附As(Ⅲ)的性能比较Table 3 Comparison of adsorption capacity of MIL-88A and other adsorbents for As(Ⅲ)

图8 MIL-88A对As(Ⅲ)的吸附等温线性模型拟合曲线Fig.8 Linear fitting curves of adsorption isothermal model of MIL-88A for As(Ⅲ)
2.5 吸附热力学
为探究本实验的热力学参数,在反应时间为360 min、pH=11.0、MIL-88A 用量为0.4 g/L 条件下,研究了不同As(Ⅲ)初始质量浓度下的吸附热力学。MIL-88A吸附As(Ⅲ)的自由能变、焓变和熵变等热力学参数根据以下公式计算:
式中:Kd为吸附分配系数;m为吸附剂的质量,mg;ρ0和ρe分别为吸附过程中溶质的初始质量浓度和平衡质量浓度,mg/L;V为含As(Ⅲ)溶液的体积,mL;R为通用气体常数,8.314 J/(mol·K);T为温度,K;ΔH为反应的焓变,kJ/mol;ΔS为反应的熵变,J/mol;ΔG为反应的自由能变,kJ/mol。
不同温度下ΔG可由公式(7)计算得到;ΔH和ΔS的值可根据公式(8),并由lnKd对1/T作图(图9),从曲线的斜率和截距计算得出。得到的热力学参数ΔH、ΔS和ΔG如表4 所示。由表4 可知,ΔH为负值,说明该吸附过程属于放热反应;ΔG为负值,表明该吸附过程可以自发进行,且ΔG的绝对值随温度的升高而减小,说明温度的升高不利于As(Ⅲ)的吸附;ΔS为负值,代表反应前后体系的混乱度降低,说明As(Ⅲ)在MIL-88A上的吸附是一个趋于有序的过程。综上所述,MIL-88A吸附As(Ⅲ)是一个自发、放热、趋于有序的过程。

表4 MIL-88A吸附As(Ⅲ)的热力学拟合参数Table 4 Thermodynamic fitting parameters of MIL-88A for adsorption of As(Ⅲ)

图9 MIL-88A吸附As(Ⅲ)的热力学拟合曲线Fig.9 Thermodynamic fitting curves of MIL-88A for adsorption of As(Ⅲ)
2.6 脱附与再循环研究
脱附和可重复使用性是决定吸附剂应用的关键因素。图10 为以1 mol/L HNO3溶液为脱附剂时MIL-88A 的循环使用性能。由图10 可知,在3 次吸附-脱附循环过程中,MIL-88A 对As(Ⅲ)的吸附量基本维持在26 mg/g左右,表明该材料在多次循环后仍能保持较好的吸附能力。

图10 MIL-88A吸附As(Ⅲ)的循环实验结果Fig.10 Results of cyclic experiments on adsorption of As(Ⅲ) by MIL-88A
2.7 As(Ⅲ)的吸附机理
MIL-88A 在酸性环境下对As(Ⅴ)的吸附性能较好[17],而在本研究中MIL-88A 在碱性条件下对As(Ⅲ)的吸附性能较好。两种情况截然不同,因此应该单独对MIL-88A吸附As(Ⅲ)的情况进行讨论。
为了进一步探究MIL-88A 对As(Ⅲ)的吸附机理,对比了MIL-88A吸附As(Ⅲ)前后的XPS图(图5和图11)。从XPS 全谱(图11a)可以看出,MIL-88A吸附As(Ⅲ)后出现了典型的As 吸收峰,说明As 吸附在MIL-88A表面。图11b为MIL-88A吸附As(Ⅲ)后的As 3d 精细谱,该谱可以拟合出两个双峰,即43.83 eV 与44.63 eV 及45.48 eV 与46.08 eV,其分别归属于As(Ⅲ)的3d5/2、3d3/2峰及As(V)的3d5/2、3d3/2峰,说明吸附在材料表面的As存在As(Ⅲ)和As(V)两种价态。采用分光光度法测定As 时使用的显色剂只能与As(Ⅴ)发生反应。根据该原理测试后发现,MIL-88A循环实验脱砷再生液中的砷为As(Ⅲ)。结合图11b 的表征结果说明,MIL-88A 吸附As(Ⅲ)是一个可逆的过程,碱性条件下As(Ⅲ)被氧化成As(Ⅴ)并吸附在吸附剂表面,而酸性条件下吸附剂表面的As(Ⅴ)被还原为As(Ⅲ)并重新回到溶液中。图11c 为MIL-88A 吸附As(Ⅲ)后的C 1s 精细谱。XPS图中特征峰的峰面积占比可以代表对应基团的占比。与图5d相比,图11c中O—C=O特征峰的面积占比减小,说明吸附As(Ⅲ)后O—C=O 官能团数量减少,表明MIL-88A吸附As(Ⅲ)的过程消耗了O—C=O 官能团。图11d 为MIL-88A 吸附As(Ⅲ)后的O 1s 精细谱,吸附As 后在529.74 eV 处出现新峰,归属于O—As键,说明As(Ⅲ)吸附在材料上[20]。

图11 MIL-88A吸附As(Ⅲ)后的的XPS图Fig.11 XPS spectra of MIL-88A after adsorption of As(Ⅲ)
通过对比吸附前后的FT-IR 图(图3b)可以发现,吸附后的材料在3 426.24 cm-1处出现了新的特征峰,表明在吸附过程中形成了新的键,通过特征峰位置可以判断该键为溶液中的As(Ⅲ)与吸附在MIL-88A 表面的As 之间形成的氢键。吸附后材料于1 388.57 cm-1处对应的羧基特征峰发生分裂,表明有官能团与羧基发生相互作用[25],与图11c 结论相符。
图12 为MIL-88A 吸附As(Ⅲ)的机理图,MIL-88A 对As(Ⅲ)的吸附过程可能是:在碱性环境中,MIL-88A 表面上羧基的—O-基团与As(Ⅲ)上的孤对电子结合成键,表观上的现象是As(Ⅲ)在MIL-88A 的表面被氧化成As(Ⅴ)并释放H+导致溶液酸化;随着反应的进行溶液的环境逐渐变为中性,此时化学吸附达到平衡,溶液中未反应的As(Ⅲ)以As(OH)3的形式存在,并以氢键的形式与吸附在吸附剂上的As(Ⅴ)结合,形成多层结构。这样的吸附结构对活性位点的利用率高,表现为MIL-88A对As(Ⅲ)具有高吸附能力。

图12 MIL-88A吸附As(Ⅲ)的机理图Fig.12 Mechanism of MIL-88A for adsorption of As(Ⅲ)
3 结论
本研究采用室温法合成了MIL-88A 微棒用于吸附水中的As(Ⅲ)。SEM、XRD、FT-IR和XPS等结果表明,室温法合成的MIL-88A尺寸均一、纯度高。吸附实验结果表明,MIL-88A对As(Ⅲ)具有高吸附效率,特别是对高浓度的As(Ⅲ)溶液;MIL-88A 对As(Ⅲ)的最大吸附量可达286.37 mg/g,高于现有的同类型砷吸附剂。动力学、等温线模型和热力学方程对实验数据的拟合结果表明,MIL-88A 吸附As(Ⅲ)的过程中化学吸附占主导地位并与多层吸附相结合,是一个自发、放热、趋于有序的过程。通过对比吸附前后的表征结果和分析总结实验数据的规律,揭示了MIL-88A 通过表面羧基基团吸附As(Ⅲ)并氧化生成As(Ⅴ),As(Ⅴ)再通过氢键吸附As(Ⅲ)形成多层结构的吸附机理,这种多层吸附结构使得MIL-88A 对As(Ⅲ)具有高吸附能力。本研究为MOF 材料运用于砷污染治理提供了理论参考。

