艾灸对佐剂性关节炎大鼠滑膜组织Beclin-1、LC3-Ⅱ表达的影响
彭雄 周兰 施雨燕 龚志贤 张亮 艾坤 李鑫 陈青 刘梨

〔摘要〕 目的 觀察艾灸对类风湿关节炎(rheumatoid arthritis, RA)大鼠炎症因子白细胞介素-2(interleukin-2,IL-2)及滑膜细胞中自噬相关因子Beclin-1、微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein1 light chain 3-Ⅱ,LC3-Ⅱ)表达的影响,探索艾灸治疗RA的作用机制。方法 将36只雄性SD大鼠随机分为空白组、模型组、甲氨蝶呤组、艾灸组,每组9只。采用弗氏完全佐剂造模法制备RA大鼠模型。造模成功后艾灸组予艾灸足三里、关元,每次20 min,每天1次;甲氨蝶呤组予甲氨蝶呤0.35 mg/kg灌胃,每周2次。空白组、模型组、甲氨蝶呤组每天给予艾灸组大鼠同样时长及强度的捆绑。每组均干预3周。观察大鼠一般情况,采用足趾容积测量仪检测大鼠左后肢足趾容积,ELISA法检测血清中IL-2含量,Western blot检测大鼠踝关节滑膜组织中Beclin-1、LC3-Ⅱ蛋白相对表达量。结果 与模型组比较,甲氨蝶呤组及艾灸组精神一般,反应尚可,体质量恢复,较活跃,摄食、饮水尚可,足部肿胀、红肿缓解,其局部炎症及全身多发性关节炎情况均轻于模型组。与空白组比较,模型组大鼠于造模后第3、10、17、24天足趾容积明显增大(P<0.01),结合一般情况,提示模型制备成功;甲氨蝶呤组、艾灸组足趾容积于第24天增大(P<0.05)。与模型组比较,甲氨蝶呤组造模后第17、24天足趾容积降低(P<0.05,P<0.01),艾灸组第10、17、24天足趾容积明显降低(P<0.01)。干预3周后,与空白组比较,模型组血清中IL-2含量明显升高(P<0.01),滑膜组织Beclin-1、LC3-Ⅱ蛋白表达量明显上升(P<0.01);与模型组比较,甲氨蝶呤组、艾灸组血清中IL-2含量降低(P<0.05),艾灸组滑膜组织Beclin-1、LC3-Ⅱ蛋白表达量下降(P<0.05)。结论 艾灸能改善RA大鼠关节肿胀,降低IL-2含量,其作用机制可能是通过调节自噬因子Beclin-1、LC3-Ⅱ蛋白表达量有关。
〔关键词〕 类风湿关节炎;佐剂性关节炎;滑膜组织;艾灸;白细胞介素-2;Beclin-1;微管相关蛋白1轻链3-Ⅱ
〔中图分类号〕R245.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.01.018
Effects of moxibustion on Beclin-1 and LC3-Ⅱ expressions in
synovium of rats with adjuvant-induced arthritis
PENG Xiong1,2, ZHOU Lan2, SHI Yuyan1, GONG Zhixian1, ZHANG Liang2, AI Kun2,
LI Xin3, CHEN Qing1*, LIU Li1*
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. Hunan Key Laboratory of TCM Diagnostics, Hunan University of
Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of moxibustion on the inflammatory factor interleukin-2 (IL-2) and the expressions of Beclin-1 and microtubule-associated protein 1 light chain 3-Ⅱ (LC3-Ⅱ) in the synovium of rats with rheumatoid arthritis (RA), and to explore the mechanism of action of moxibustion treating RA. Methods A total of 36 SD male rats were randomly divided into blank, model, methotrexate, and moxibustion groups, with nine rats in each group. The rat model of RA was established by complete Freund's adjuvant. After modeling, moxibustion group was treated with moxibustion at "ZuSanli" (ST36) and "Guanyuan" (CV4) for 20 min, once a day. Methotrexate group was given methotrexate intragastrically (0.35 mg/kg) twice a week. The rats in blank, model, and methotrexate groups were bound for the time and intensity as same as those of moxibustion group daily. All groups were intervened for three weeks. The general condition of the rats was observed. The paw volume of the left hind limb of rats was measured by the paw volume measuring instrument, the content of serum IL-2 was determined by ELISA, and the relative expression levels of Beclin-1 and LC3-Ⅱ proteins in the ankle synovial tissues of the rats were determined by Western blot. Results Compared with model group, the spirit of the rats in methotrexate and moxibustion groups was average, their reaction and intake of food and water were passable with more activities, the body weight was restored, the redness and swelling of their paws were alleviated, and the local inflammation and systemic polyarthritis were less severe than those in model group. Compared with blank group, the paw volume of the rats in model group increased on the 3rd, 10th, 17th, and 24th days after modeling (P<0.01), which, along with the general condition of the rats, suggested a successful modeling; meanwhile, the paw volume of the rats in methotrexate and moxibustion groups increased on the 24th day (P<0.05). Compared with model group, the paw volume of the rats in methotrexate group significantly decreased on the 17th and 24th days after modeling (P<0.05, P<0.01), and that in moxibustion group significantly decreased on the 10th, 17th, and 24th days (P<0.01). After three-week intervention, the expression level of serum IL-2 in model group was significantly elevated (P<0.01), and the protein expression levels of Beclin-1 and LC3-Ⅱ in the synovial tissues were significantly higher (P<0.01); compared with model group, the expression level of serum IL-2 in methotrexate and moxibustion groups was reduced significantly (P<0.05), and the protein expression levels of Beclin-1 and LC3-Ⅱ in the synovial tissues of moxibustion group were lower significantly (P<0.05). Conclusion Moxibustion can alleviate the joint swelling of RA rats and decrease the content of IL-2. The mechanism of action may be related to regulating the protein expression levels of Beclin-1 and LC3-Ⅱ.
〔Keywords〕 rheumatoid arthritis; adjuvant-induced arthritis; synovial tissue; moxibustion; interleukin-2; Beclin-1; microtubule-associated protein 1 light chain 3-Ⅱ
类风湿关节炎(rheumatoid arthritis,RA)是以对称性、侵蚀性滑膜炎为主的全身性自身免疫性疾病,以关节滑膜的炎症、血管翳的形成、随着病程加重出现的关节软骨和骨破坏为特征,是造成我国人群丧失劳动力和致残的主要原因之一[1]。临床研究表明,艾灸可显著改善RA患者临床症状与生活质量[2-3]。有研究发现,滑膜细胞自噬与RA密切相关,细胞自噬可能引起滑膜细胞的过度活化及分化,促进滑膜细胞增殖,加重RA病情,通过调节自噬可抑制RA炎性反应[4-5]。白细胞介素-2(interleukin-2,IL-2)与RA滑膜炎症密切相关,可增加关节腔内白细胞数量,使中性粒细胞炎性反应加重,是产生滑膜炎症的关键因子[5]。自噬相关因子Beclin-1和微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein1 light chain 3-Ⅱ,LC3-Ⅱ)是自噬启动的标志性蛋白。本课题组前期研究证实,艾灸治疗佐剂性关节炎(adjuvant arthritis, AA)模型大鼠足三里、关元能明显缓解大鼠足跖肿胀程度,改善局部炎症[4]。但目前从细胞自噬角度探讨艾灸治疗RA生物学机制的研究较少,因此,本研究拟采用艾灸足三里、关元干预AA模型大鼠,探讨艾灸是否通过调节自噬相关因子Beclin-1、LC3-Ⅱ改善RA炎症的生物学机制。
1 实验材料与方法
1.1 实验动物及分组
健康雄性SD大鼠36只,体质量100~120 g,由湖南斯莱克景达实验动物公司提供,动物许可证号:SCXK(湘)2019-0004。饲养于湖南中医药大学动物实验中心,温度20~25 ℃,湿度50%~70%,适应性喂养7 d后将大鼠按照体质量分层原则[6]随机分为空白组、模型组、艾灸组、甲氨蝶呤组,每组9只。实验全程遵从《关于善待实验动物的指导性意见》中的动物伦理相关规定(2006年版)。本实验伦理编号:LLBH-202203140004。
1.2 主要试剂与仪器
灭活结合分枝杆菌(美国Sigma Aldrich,批号:SLBW7430);甲氨蝶呤(美国AbMole BioScience,批号:M2228);BCA试剂盒(美国Thermo Scientific公司,批号:QB214754);RIPA裂解液(美国Solarbio公司,批号:R0010);大鼠Beclin-1抗体(美国Abcam公司,批号:Ab210498);大鼠LC3-Ⅱ抗体、羊抗鼠二抗(美国Proteintech公司,批号分别为:18722-1、SA00001);SDS-PAGE制胶试剂盒(上海碧云天生物技术有限公司,批号:072319190723);IL-2试剂盒(美国Elabscience公司,批号:E-EL-R0013c)。
足趾容积测量仪(济南益延科技发展有限公司,型号:YLS-7C);PVDF膜(美国Amersham Pharmacia GE公司,型号:K5NA8023B);艾灸条(湘味堂艾草制品,型号:4 mm);高速低温离心机(美国SCILOGEX公司,型号:D3024R);GloMax酶标仪(美国Promega公司,型号:GM3030);振荡仪(海门市其林贝尔仪器制造有限公司,型号:10RTEX-5);电泳仪(美国BIO-RAD公司,型号:041BR126545);水浴鍋(厦门精艺兴业科技有限公司,型号:SB-1100);电热恒温槽(上海精宏实验设备公司,型号:DK-8D);移液枪(德国 Ep-pendorf 公司,型号:3120000267)。
1.3 造模方法
采用完全弗氏佐剂造模法[7]:将定量灭活结核分枝杆菌与矿物油放入高温灭菌的研钵中充分研磨,直至溶液清透无杂质,配制成2.5 mg/mL的弗氏佐剂备用,使用时需震荡以充分混匀。将造模大鼠(模型组、艾灸组、甲氨蝶呤组)固定,以巴比妥酸盐30 mg/kg腹腔注射麻醉大鼠,等待3 min,大鼠无基本活动且反应迟钝后,用乙醇棉球消毒尾根部后皮下注射佐剂0.1 mL/只。空白组大鼠用相同方法注射矿物油0.1 mL/只。造模后24 h左侧足部急性炎症肿胀,2~3 d出现双侧足趾持续肿胀以及发生颜色改变,双侧肢体或者前肢、耳部、尾部发生红肿或出现炎性结节,提示造模成功[7]。
1.4 干预方法
各组大鼠均于造模后第4天开始干预。艾灸组大鼠用特制固定器捆绑并予艾灸治疗。穴位定位参照《实验针灸学》[8]大鼠标准穴位图谱及拟人对照法。足三里位于膝关节后外侧,腓骨小头下约5 mm处;关元位于耻骨联合上缘3寸(胸剑联合至耻骨联合上缘以松紧带平均分为13等份,每一等份模拟大鼠同身寸1寸)。用动物特用艾条,将多头艾灸器置于穴位上2 cm处悬灸,每次20 min,每天1次,连续干预3周,共21次。甲氨蝶呤组大鼠给予甲氨蝶呤粉剂,按照0.35 mg/kg剂量[4]用去离子无菌水溶解后灌胃,每周2次,干预3周,共6次。空白组、模型组、甲氨蝶呤组每天给予艾灸组大鼠同样时长及强度的捆绑。
1.5 取材方法
各组大鼠干预3周后,用巴比妥酸盐溶液以30 mg/kg腹腔注射麻醉。将大鼠仰位固定,采血管于腹主动脉取血5 mL放入-80 ℃冰箱保存,拟行ELISA法检测。继续将大鼠固定于冰上,用骨科剪迅速剪断大鼠左右两侧足趾关节2 cm以上的后肢,打开足趾关节,找到关节软骨下附着的淡黄色光滑透亮的滑膜组织,用眼科剪小心完整剪下。所有的滑膜组织取出后,放于冻存管并在液氮中冻存,再移至-80 ℃冰箱中保存,拟行Westen blot检测。
1.6 观察指标
1.6.1 观察大鼠一般行为学 观察各组大鼠精神、反应、活力、体质量、二便及足趾肿胀情况。
1.6.2 足趾容积测量 采用足趾容积测量仪检测大鼠左后肢足趾容积。在造模后第3、10、17、24天分别测量各组大鼠足趾容积并记录。测量方法为:在大鼠足趾关节处用记号笔划线标记,足趾测量仪校零后,一手抓住大鼠背部皮毛使其固定,另一手捉住大鼠左后膝关节处使其后足伸直,垂直并缓慢放入测量杯内,当测量杯水平面与鼠足上的测量标线重叠时,启动测量开关并读取测量数据,精确至小数点后3位。每只足爪每次测量3次取平均值。
1.6.3 血清IL-2含量检测 用ELISA法,取出血清样品置于冰上融化,4 ℃离心机中12 000 r/min离心20 min(离心半径8.5 cm),取上清液。加入IL-2标准品1 mL至标准管中,静置10 min并充分溶解。进行2倍比稀释,配制不同浓度的标准品。加样封板后温育(37 ℃,90 min),加酶后洗涤,每孔加酶结合物工作液100 μL,封板后置于37 ℃烘箱中温育30 min。再次洗涤后加底物溶液,封板膜封板后置于37 ℃烘箱中温育15 min进行显色。加终止液终止反应,15 min内在450 nm波长测量各孔的吸光度(OD值),绘出标准曲线和标准方程,计算每个样本的浓度。
1.6.4 滑膜组织中Beclin-1、LC3-Ⅱ蛋白相对表达量检测 采用Western blot法检测蛋白表达量。取大鼠滑膜组织100 mg,加入组织裂解液,置于冰上裂解30 min后4 ℃离心机中12 000 r/min离心20 min(离心半径8.5 cm),用BCA法测定样本的蛋白浓度。将样品以每个孔30 μg为标准进行上样,在10%的SDS-PAGE胶上电转移蛋白至PVDF膜后,浸泡在含5%脱脂奶粉的封闭液中,室温孵育1 h。加入相应的一抗Beclin-1(1∶1 000)、LC3-Ⅱ(1∶1 000)、β-actin(1∶2 000),4 ℃过夜。TBST洗3次,每次10 min;加入二抗(1∶10 000)溶液,室温孵育1 h。TBST洗3次,每次10 min。将PVDF膜与新鲜配制的增强型化学发光剂溶液反应2 min,快速于暗室中曝光显影。用Image J 软件做图片灰度分析,将空白组进行归一化处理,以目标蛋白与内参β-actin灰度值的比值作为相对表达量。
1.7 统计学分析
采用SPSS 22.0软件进行统计学处理。对所有数据进行正态性检验,符合正态分布的数据以“x±s”表示。组间比较采用单因素方差分析:若满足正态性检验、方差齐时选用LSD法,满足正态性检验、方差不齐时选用Tamhane T2法进行检验。以P<0.05表示差异有统计学意义。
2 实验结果
2.1 各组大鼠一般行为学观察
空白组大鼠精神尚可,反应灵敏,活动自如,摄食、饮水正常,二便正常。模型组大鼠精神欠佳,反应迟钝,体质量下降,摄食、饮水均下降,足部明显肿胀、红肿,左后肢足跖部尤以严重,伴有四肢各关节处稍微红肿。与模型组比较,甲氨蝶呤组及艾灸组精神一般,反应尚可,体质量恢复,较活跃,摄食、饮水尚可,足部肿胀、红肿缓解,其局部炎症及全身多发性关节炎情况均轻于模型组。
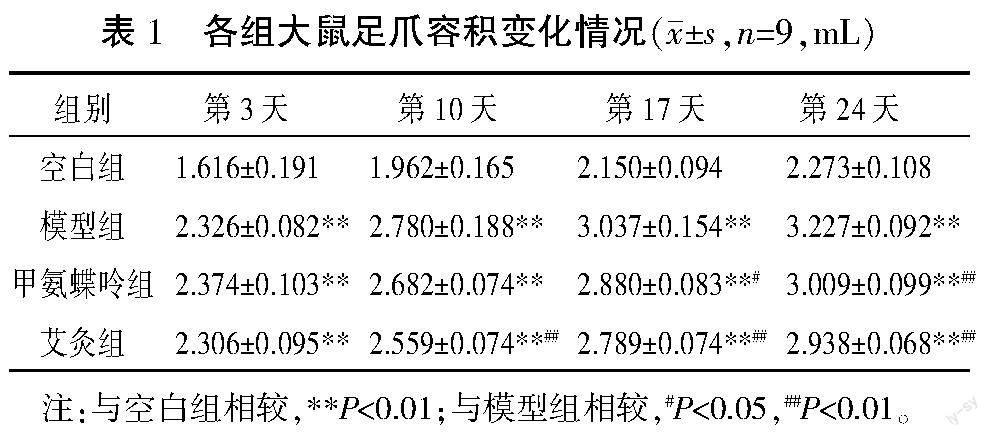
2.2 各组大鼠足爪容积比较
与空白组比较,模型组于造模后第3、10、17、24天足趾容积明显增大(P<0.01),结合一般情况,提示模型制备成功;甲氨蝶呤组、艾灸组足趾容积于造模后第3、10、17天差异无统计学意义(P>0.05),于第24天增大(P<0.05)。与模型组比较,甲氨蝶呤组造模后第17、24天足趾容积降低(P<0.05,P<0.01),艾灸组第10、17、24天足趾容积明显降低(P<0.01)。与甲氨蝶呤组比较,艾灸组足趾容积差异均无统计学意义(P>0.05)。详见表1。
2.3 各组大鼠IL-2含量比较
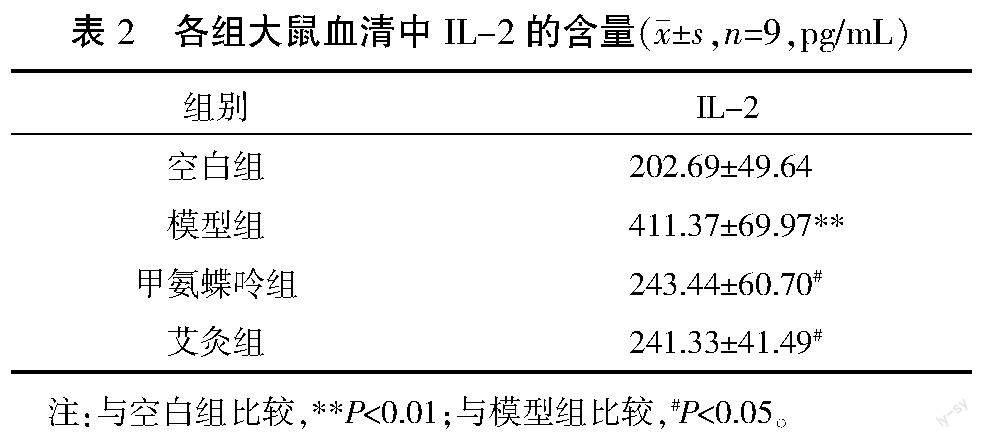
干预3周后,与空白组比较,模型组血清中IL-2含量明显升高(P<0.01);与模型组比较,甲氨蝶呤组、艾灸组血清中IL-2含量降低(P<0.05)。详见表2。
2.4 各组大鼠滑膜组织中Beclin-1、LC3-Ⅱ蛋白表达量比较
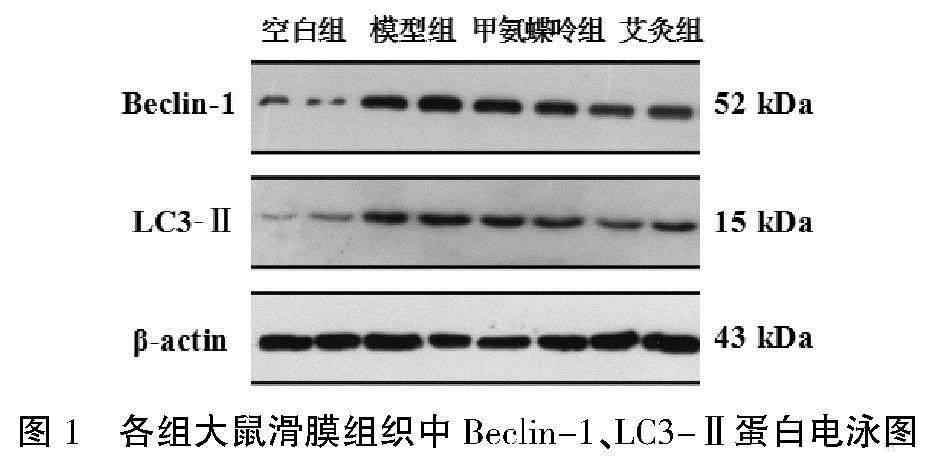
干预3周后,与空白组比较,模型组Beclin-1、LC3-Ⅱ蛋白表达量明显上升(P<0.01);与模型组比较,艾灸组Beclin-1、LC3-Ⅱ蛋白表达量下降(P<0.05)。详见图1、表3。
3 讨論
RA属于中医学“历节病”“痹病”范畴,多由“正气不足、复感外邪”所致,正气虚弱是痹病发病的内因。素体虚弱,气血不足,腠理疏松,卫外不固;若感受风寒湿热等外邪,阻滞气血运行,使关节、肌肉、经络痹阻不通而形成痹病。针灸治疗RA疗效显著,能抗炎消肿止痛,恢复关节功能[10-11],常用足三里、关元等穴位[12]。足三里为足阳明胃经的合穴,《针灸真髓·泽田派治病特效穴》曰:“三里养先后天之气,灸三里可使元气不衰,故称长寿之灸。”可补益气血。关元属任脉,为足三阴经与任脉之会,小肠之募穴,可培补元气。足三里与关元联用,先天后天同治,共起温阳扶正补益之功,治其正虚内因;同时足三里又能起近治之用[13]。
RA是一种全身性自身免疫性疾病,利用灭活的结核分枝杆菌配制的完全弗氏佐剂所诱导的佐剂性关节炎动物模型,是细菌学家Freund于20世纪50年代创立,作为经典的免疫性疾病实验动物模型广泛用于RA的病因探索、新药开发、新的治疗方法的筛选等方面[14]。RA的临床表现为慢性滑膜炎、关节组织破坏,最终导致关节功能受损[15-16]。IL-2与RA滑膜炎症密切相关,可增加关节腔内白细胞数量,使中性粒细胞炎性反应加重,是产生滑膜炎症的关键因子[17],并可诱导其他炎性因子的表达。RA患者体内IL-2表达水平明显上升,且和RA病变程度呈正相关[18]。RA最突出的病理特征是滑膜炎与滑膜细胞增殖,该过程可能与细胞自噬密切相关[19-20]。自噬是细胞吞噬自身细胞质或细胞器、与溶酶体融合,形成自噬溶酶体、降解其所包裹的内容物的过程[19]。研究发现,自噬能调节滑膜细胞增殖,从而介入RA病程[21];可调节、释放或产生炎症因子[22-23]。在RA动物模型中,抑制自噬也可以减轻滑膜炎症[24]。细胞自噬最重要的现象是形成自噬小体,自噬小体成核阶段、延伸阶段,由Beclin-1、LC3-Ⅱ基因编码的相关蛋白参与[25]。Beclin-1是与自噬调控相关的关键因子,可与Ⅲ型磷脂酰肌醇3-激酶形成复合物,参与自噬体双层膜的形成,调动相关自噬蛋白质定位于前自噬体,其表达水平上调可诱导自噬发生[26-27]。Beclin-1是启动自噬的标志,同时可反映自噬活性、评估其程度并调控其水平[28]。微管相关蛋白1轻链3(microtubule-associated protein1 light chain 3,LC3)是检测自噬发生的标志性蛋白,并且是首个自噬小体膜蛋白,在自噬过程中,LC3被具有蛋白内切酶活性的自噬蛋白4剪切,生成的LC3-Ⅰ通过Atg3和Atg7参与的泛素样反应,使其与磷脂酰乙醇胺发生作用,生成膜结合形式的LC3-Ⅱ,并持续附着于自噬体膜上。因此,LC3-Ⅱ的表达水平与自噬呈正相关,可用LC3-Ⅱ评估自噬水平表达高低[29-31]。研究表明,RA患者Beclin-1、LC3-Ⅱ蛋白表达量显著性升高,且Beclin-1、LC3-Ⅱ相对表达水平与疾病活动度相关[32-33]。
本研究发现,模型组大鼠后足趾容积增大,血清中IL-2含量显著性升高,滑膜组织Beclin-1、LC3-Ⅱ蛋白表达量显著性升高,提示大鼠足趾关节滑膜组织自噬被促进,足趾关节局部发生病变,炎性反应增强。艾灸干预后,大鼠足趾容积显著下降,血清IL-2含量降低,滑膜组织Beclin-1、LC3-Ⅱ蛋白表达量降低,提示艾灸可能通过下调RA滑膜组织Beclin-1、LC3-Ⅱ的表达水平,从而抑制滑膜细胞自噬,以此减轻炎症反应。
综上所述,艾灸可能通过下调RA滑膜组织Beclin-1、LC3-Ⅱ的表达水平,抑制自噬活性,改善局部炎性反应,使关节局部炎性反应得到一定程度纠正,从而缓解RA局部症状,发挥治疗RA的生物学效应。
参考文献
[1] 柏林康, 梁 慧, 王文娟, 等. 艾灸联合西药治疗瘀血痹阻型类风湿关节炎及对血小板活化的影响[J]. 中国针灸, 2023, 43(8): 927-931.
[2] 唐 洁, 武 平, 余泽芸, 等. 艾灸对类风湿关节炎患者血清中白三烯B4、基质金属蛋白酶-9的影响[J]. 针刺研究, 2023, 48(5): 488-493.
[3] 罗业浩, 方 刚, 许栋涵, 等. 灸法治疗类风湿关节炎的临床研究进展[J]. 中国老年学杂志, 2022, 42(16): 4113-4119.
[4] 刘 梨, 张 亮, 艾 坤, 等. 艾灸对佐剂性关节炎大鼠足趾滑膜组织自噬和凋亡的影響[J]. 针刺研究, 2023, 48(3): 253-258.
[5] 龙轶映, 张 亮, 祁 芳, 等. 电针对佐剂性关节炎大鼠滑膜组织中mTOR磷酸化水平的影响[J]. 湖南中医药大学学报, 2021, 41(12): 1881-1885.
[6] 李晓松. 卫生统计学[M]. 8版. 北京: 人民卫生出版社, 2017: 97.
[7] 孙晓莹, 龙轶映, 赵凌云, 等. 电针对佐剂性关节炎大鼠膝关节滑膜VEGF/Vav2/Rac1信号通路的影响[J]. 湖南中医药大学学报, 2023, 43(10): 1830-1837.
[8] 李忠仁. 实验针灸学[M]. 2版. 北京: 中国中医药出版社, 2007: 255-257.
[9] 刘 梨, 周 巍, 黎铭玉, 等. 电针对类风湿关节炎大鼠踝关节滑膜组织自噬的影响[J]. 针刺研究, 2021, 46(12): 1023-1028.
[10] 张俊鹏, 秦元梅, 田一川, 等. 中医外治法对类风湿性关节炎疗效的网状Meta分析[J]. 中医学报, 2023, 38(12): 2697-2712.
[11] 李世永, 高希言, 李胜男, 等. 针灸联合补肾祛风湿中药治疗老年类风湿性关节炎的临床观察[J]. 世界中医药, 2023, 18(20): 2963-2966.
[12] 张 阔, 徐 媛, 丁沙沙, 等. 基于文献研究针刺治疗类风湿关节炎选穴规律[J]. 中国针灸, 2017, 37(2): 221-224.
[13] 周 兰, 周 巍, 黎铭玉, 等. 基于数据挖掘探讨电针治疗类风湿关节炎的选穴用经规律[J]. 海南医学院学报, 2022, 28(2): 135-139, 147.
[14] 祁 芳, 李艳玲, 艾 坤, 等. SD大鼠佐剂性关节炎模型的建立与评估[J]. 湖南中医药大学学报, 2016, 36(1): 23-26.
[15] ANDONIAN B J, HUFFMAN K M. Skeletal muscle disease in rheumatoid arthritis: The center of cardiometabolic comorbidities[J]. Current Opinion in Rheumatology, 2020, 32(3): 297-306.
[16] FAVALLI E G, INGEGNOLI F, DE LUCIA O, et al. COVID-19 infection and rheumatoid arthritis: Faraway, so close![J]. Autoimmunity Reviews, 2020, 19(5): 102523.
[17] 张 颖, 刘 健. 类风湿性关节炎患者血清免疫炎症相关蛋白的分析及新风胶囊对细胞因子的调节作用[J]. 细胞与分子免疫学杂志, 2022, 38(5): 439-445.
[18] 徐玲玲. 白细胞介素2与类风湿性关节炎患者疾病活动度相关性研究[D]. 沈阳: 中国医科大学, 2022.
[19] CHEN Y M, CHANG C Y, CHEN H H, et al. Association between autophagy and inflammation in patients with rheumatoid arthritis receiving biologic therapy[J]. Arthritis Research & Therapy, 2018, 20(1): 268.
[20] GAO X Z, KANG X D, LU H W, et al. Piceatannol suppresses inflammation and promotes apoptosis in rheumatoid arthritis-fibroblast-like synoviocytes by inhibiting the NF-κB and MAPK signaling pathways[J]. Molecular Medicine Reports, 2022, 25(5): 180.
[21] LIU W F, WANG X S, SUN J J, et al. Parthenolide suppresses pancreatic cell growth by autophagy-mediated apoptosis[J]. OncoTargets and Therapy, 2017, 10: 453-461.
[22] YANG R, ZHANG Y Z, WANG L, et al. Correction: Increased autophagy in fibroblast-like synoviocytes leads to immune enhancement potential in rheumatoid arthritis[J]. Oncotarget, 2017, 8(34): 57906.
[23] 高仰来, 冯 鹏, 李晓霞. 火针对膝骨关节炎大鼠关节软骨细胞自噬相关蛋白LC3及血清炎症因子的影响[J]. 风湿病与关节炎, 2023, 12(10): 6-10.
[24] LI S, CHEN J W, XIE X, et al. Autophagy inhibitor regulates apoptosis and proliferation of synovial fibroblasts through the inhibition of PI3K/AKT pathway in collagen-induced arthritis rat model[J]. American Journal of Translational Research, 2017, 9(5): 2065-2076.
[25] GIATROMANOLAKI A, KOUKOURAKIS M I, GEORGIOU I, et al. LC3A, LC3B and beclin-1 expression in gastric cancer[J]. Anticancer Research, 2018, 38(12): 6827-6833.
[26] SAHA S, VARSHNEY T, SINGH P, et al. Predictive value of Beclin1 in the pathogenesis of rheumatoid arthritis in the Indian population[J]. Journal of Medical Evidence, 2022, 3(3): 238.
[27] WEN L, CHENG X, FAN Q G, et al. TanshinoneⅡA inhibits excessive autophagy and protects myocardium against ischemia/reperfusion injury via 14-3-3η/Akt/Beclin1 pathway[J]. European Journal of Pharmacology, 2023, 954: 175865.
[28] WAN L, LIU J, HUANG C B, et al. Effects of triptolide on the autophagy in synovial, spleen and Thymus of rats with adjuvant arthritis[J]. Journal of Sichuan University (Medical Science), 2017, 48(4): 520-525.
[29] CHEN X, WANG Y Y, CAI J Y, et al. Anti-inflammatory effect of baicalin in rats with adjuvant arthritis and its autophagy-related mechanism[J]. Technology and Health Care, 2022, 30(S1): 191-200.
[30] APARICIO I M, MARTIN MU?譙OZ P, SALIDO G M, et al. The autophagy-related protein LC3 is processed in stallion spermatozoa during short-and long-term storage and the related stressful conditions[J]. Animal, 2016, 10(7): 1182-1191.
[31] SUN J B, ZHAI W D, WANG Z, et al. Methotrexate plus electroacupuncture reduces autophagy in ankle synovial tissue in rats with rheumatoid arthritis[J]. American Journal of Translational Research, 2023, 15(4): 2747-2756.
[32] 陸麒瑾, 李佳钰, 蔡义思, 等. 当归拈痛汤对风湿热痹型佐剂性关节炎大鼠自噬蛋白LC3, Beclin1, p62表达的影响[J]. 中国实验方剂学杂志, 2022, 28(1): 41-49.
[33] 吴 茜, 赵莉平, 李彦魁, 等. 外周血单个核细胞自噬相关基因LC3Ⅱ、Beclin-1与类风湿关节炎的相关性研究[J]. 国际检验医学杂志, 2021, 42(3): 305-308.

