枫杨叶多糖增强免疫功能及抗疲劳作用的研究
刘静,蔡延渠,李梦阳,谢朋飞*,王俊杰,张远芳,刘思妤
(1.郴州市第一人民医院药学部,湖南 郴州 423000;2.广东药科大学新药研发中心,广东 广州 510006;3.湘南学院,湖南 郴州 423000)
枫杨(Pterocarya stenopteraC.DC)为胡桃科枫杨属植物,在我国各地均有分布。其皮、叶、果实、根等均可入药,文献报道,枫杨中含有萘醌类、甾醇类、多糖类、萜类、鞣质类等化合物,具有抗肿瘤、抗菌、抗氧化、抗病毒、杀灭钉螺等作用[1−4]。
现代研究发现,天然植物多糖具有多种良好的生物活性,如抗肝损伤、抗肿瘤、抗病毒、降血糖、抗氧化、免疫调节等[5−6],尤其是在增强免疫、抗疲劳方面,如已报道的黄芪多糖[7−8]、石斛多糖[9−10]等,更是越来越多地开发应用于药品、保健品、食品等产业,然而枫杨叶多糖在这方面的活性研究尚未有相关研究报道。课题组前期已筛选出枫杨叶多糖最优提取工艺,同时展开抗氧化活性等研究[11];本实验在此基础上进一步纯化枫杨叶多糖,拟通过小鼠增强免疫力和抗疲劳的药理模型,对枫杨叶多糖的增强免疫功能及抗疲劳作用进行研究与评价,以期为枫杨叶多糖的进一步开发利用提供理论依据。
1 实验材料
1.1 主要仪器
UV-1700 双光束紫外分光光度计(日本岛津公司);KDC-140HR 高速冷冻离心机(安徽中科中佳科学仪器有限公司);LB940 多功能酶标仪(美国BioTek 公司);CP-225D 电子天平(0.01 mg,德国赛多利斯公司);JJ1000Y 电子天平(美国双杰集团有限公司)。
1.2 试药
枫杨叶样品采自湖南郴州,经湘南学院王俊杰教授鉴定为胡桃科枫杨属植物枫杨(Pterocarya stenopteraC. DC)的叶。D-无水葡萄糖对照品(99.9%,中国食品药品检定研究院,批号110833-201707);2,4-二硝基氟苯(DNFB,上海西亚试剂有限公司产品,批号C10362633);环磷酰胺(上海源叶生物科技有限公司,批号X16M10Y83260);印度墨水(上海源叶生物科技有限公司,批号L15M10G830 70);超氧化物歧化酶(SOD,批号:20190602)、丙二醛(MDA,批号:20190503)试剂盒:(南京建成生物工程研究所);其他试剂均为分析纯。
1.3 实验动物
SPF级昆明种小鼠,体质量18~22 g,雌雄各半;由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2018-0002。实验环境条件:室温20~25 ℃,日温差≤3 ℃,湿度40%~70%。本研究经湘南学院实验动物学部伦理委员会批准(2022 DWLL066)。
2 方法
2.1 枫杨叶多糖的制备
将枫杨叶干燥、粉碎,称取一定量粗粉,加入40倍量60%(φ)乙醇加热提取2 次、3.5 h/次[11],药液75 ℃减压浓缩至适宜浓度,再加入无水乙醇至含醇体积分数为85%,冰箱4 ℃静置12 h,弃去上清液,取沉淀物进行冷冻干燥,所得物质为枫杨叶多糖;采用苯酚-硫酸法[12]测得多糖得率为(3.93±0.74)%,多糖含量为(74.86±3.78)%(n=3)。
2.2 枫杨叶多糖调节免疫功能的研究
参考文献[13-14]中所用实验技术方法等进行方案设计及操作。
2.2.1 枫杨叶多糖对小鼠免疫器官的影响 将小鼠随机分成空白对照组、模型组、枫杨叶多糖高剂量组(100 mg/kg)、中剂量组(50 mg/kg)、低剂量组(25 mg/kg),每组10 只。空白对照组、模型组按20 mL/kg 灌胃给予生理盐水,枫杨叶多糖组分别灌胃给予不同剂量药物,1 次/d,连续30 d。从第31 天开始,除空白对照组外,其余各组小鼠每天按0.2 mL/10 g腹腔注射环磷酰胺,连续5 d。末次给药1 h 后,脱颈处死小鼠,精密称定胸腺和脾脏质量(mg),根据公式计算脏器系数。
2.2.2 枫杨叶多糖对小鼠碳廓清能力的影响 分组及给药同“2.2.1”项下操作。从第31天开始,除空白对照组外,其余各组小鼠按0.2 mL/10 g 进行腹腔注射环磷酰胺,连续5 d。在第35 天给药1 h 后,尾部静脉注射稀释的印度墨水(5 mL/kg),于注射后2 min 和8 min 进行眼眶取血20 μL,加入装有2 mL的0.1%碳酸氢钠溶液中,混匀;在酶标仪600 nm 波长处测定吸光度值A1(2 min 样品)和A2(8 min 样品),以0.1%碳酸氢钠溶液作为空白对照。同时脱颈处死小鼠,精密称定胸腺和脾脏质量,根据公式计算廓清指数K和吞噬指数α值。
2.2.3 枫杨叶多糖对小鼠迟发型变态反应的影响分组及给药同“2.2.1”项下操作。第31天,在小鼠腹部剃毛约3 cm×3 cm,并涂上1% 二硝基氟苯50 μL;第35 天于小鼠右耳涂上1%二硝基氟苯10 μL,24 h 后脱颈处死小鼠,于两耳相同部位以打孔器各打取一片直径6 mm 的耳片,精密称定质量,根据公式计算肿胀度。
2.3 枫杨叶多糖抗疲劳的研究
参考文献[13,15-16]中所用实验技术方法等进行方案设计及操作。
2.3.1 小鼠负重游泳试验 将小鼠随机分为空白组、枫杨叶多糖高、中、低剂量组,每组10只,空白对照组按20 mL/kg 灌胃给予生理盐水,各药物组灌胃给予相应剂量药物,1次/d,连续灌胃30 d;末次给药1 h 后称量体质量,在小鼠尾部负重其体质量5%的铅丝,放入水温(25±1)℃自制水槽中进行游泳,记录小鼠自游泳开始至死亡(以小鼠沉入水中后未有张口呼吸为判断标准)的时间(min)。
2.3.2 小鼠耐缺氧试验 分组及给药同“2.3.1”项下操作;末次给药1 h 后将小鼠放入内置已点燃蜡烛的广口瓶中,盖紧后以凡士林封口,记录从蜡烛熄灭至小鼠停止呼吸的时间(min)。
2.3.3 小鼠血清SOD、MDA 含量的测定 分组及给药同“2.3.1”项下操作;末次给药1 h 后让小鼠自由游泳30 min,摘眼球取血,血样于冷冻离心机3 500 r/min 离心10 min,取上清液,分别按照试剂盒说明书方法测定血清中SOD和MDA含量。
2.4 统计方法
采用软件GraphPad Prism 5 进行数据统计分析,实验数据用表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 枫杨叶多糖调节免疫功能评价
3.1.1 枫杨叶多糖对小鼠免疫器官的影响 与空白对照组比较,模型组小鼠的胸腺指数与脾脏指数均显著降低(P<0.01),表明通过注射环磷酰胺能够引起小鼠胸腺、脾脏的显著萎缩,降低免疫功能。与模型组相比,枫杨叶多糖中、高剂量组均可显著提高小鼠胸腺指数与脾脏指数(P<0.05 或P<0.01),明显拮抗环磷酰胺所致免疫器官萎缩,有效提高小鼠自身免疫功能。见表1。
表1 枫杨叶多糖对小鼠胸腺指数和脾脏指数的影响Table 1 Effect of polysaccharide from Pterocarya stenoptera leaves on thymus index and spleen index in mice(,n=10)
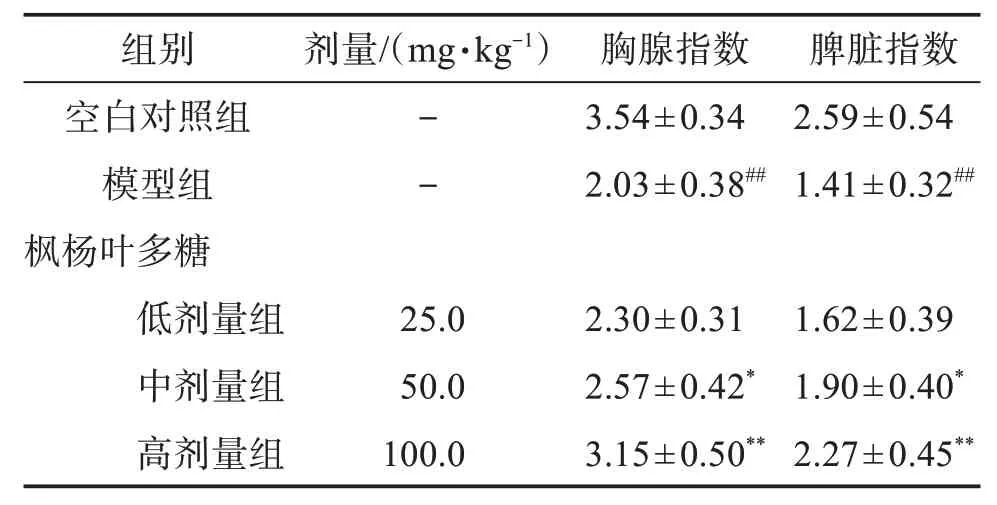
表1 枫杨叶多糖对小鼠胸腺指数和脾脏指数的影响Table 1 Effect of polysaccharide from Pterocarya stenoptera leaves on thymus index and spleen index in mice(,n=10)
与空白对照组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01。
?
3.1.2 枫杨叶多糖对小鼠碳廓清能力的影响 与空白对照组比较,模型组小鼠的廓清指数K和吞噬指数α显著降低(P<0.01),表明注射环磷酰胺能够弱化小鼠腹腔巨噬细胞吞噬功能。与模型组相比,中、高剂量组能够明显提高小鼠廓清指数K和吞噬指数α(P<0.05),表明枫杨叶多糖能够增强小鼠腹腔巨噬细胞的吞噬能力。见表2。
表2 枫杨叶多糖对小鼠廓清指数和吞噬指数的影响Table 2 Effect of polysaccharide from Pterocarya stenoptera leaves on carbon clearance index and phagocytosis index in mice(,n=10)
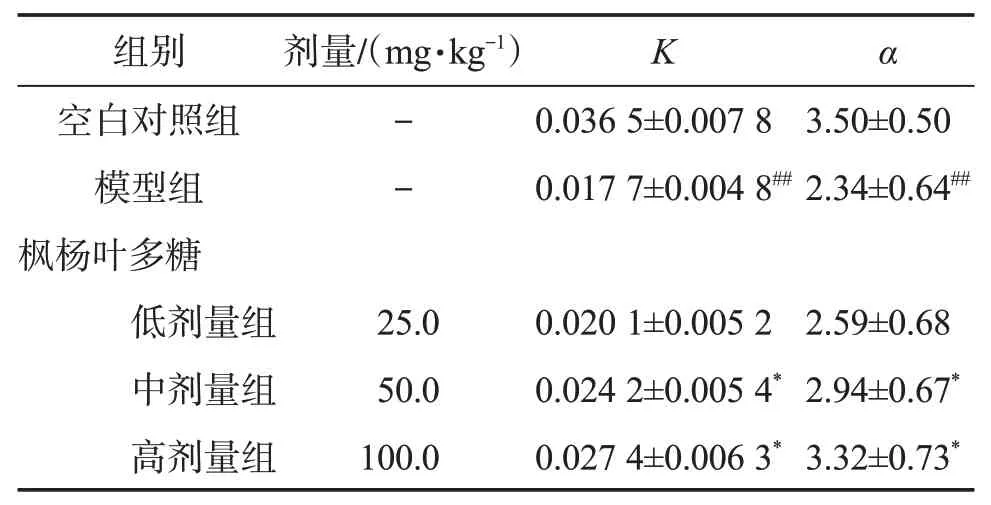
表2 枫杨叶多糖对小鼠廓清指数和吞噬指数的影响Table 2 Effect of polysaccharide from Pterocarya stenoptera leaves on carbon clearance index and phagocytosis index in mice(,n=10)
与空白对照组比较:##P<0.01;与模型组比较:*P<0.05。
?
3.1.3 枫杨叶多糖对小鼠迟发型变态反应的影响
与空白对照组比较,模型组小鼠的耳肿胀度明显降低(P<0.01),表明注射环磷酰胺能够显著抑制小鼠淋巴细胞增殖功能。与模型组比较,枫杨叶多糖中、高剂量均能显著提高小鼠耳肿胀度(P<0.05或P<0.01),表明枫杨叶多糖能够提高小鼠淋巴细胞增殖能力。见表3。
表3 枫杨叶多糖对小鼠耳肿胀度的影响Table 3 Effect of polysaccharide from Pterocarya stenoptera leaves on ear swelling in mice(,n=10)
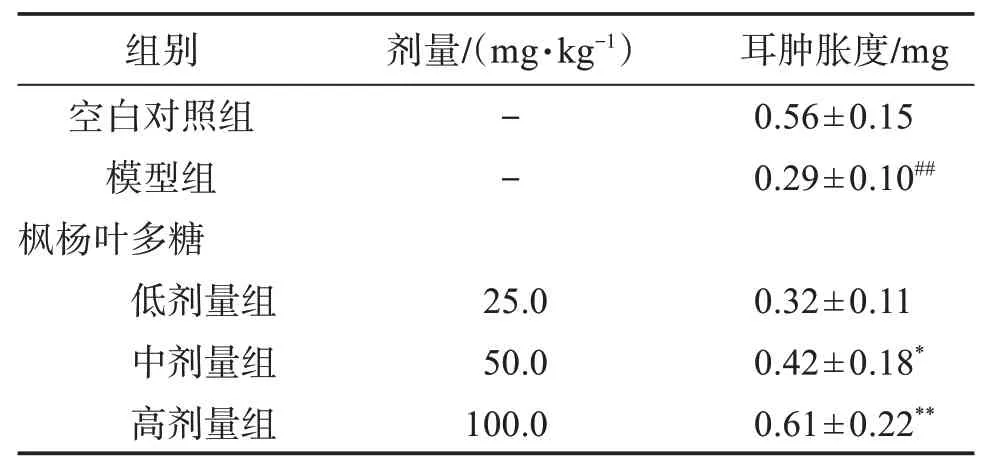
表3 枫杨叶多糖对小鼠耳肿胀度的影响Table 3 Effect of polysaccharide from Pterocarya stenoptera leaves on ear swelling in mice(,n=10)
与空白对照组比较:##P <0.01;与模型组比较:*P <0.05,**P <0.01。
?
3.2 枫杨叶多糖抗疲劳作用评价
3.2.1 枫杨叶多糖对小鼠负重游泳时间、耐缺氧时间的影响 与空白对照组比较,枫杨叶多糖低剂量组对小鼠耐缺氧时间及负重游泳时间无显著性影响(P>0.05),中、高剂量组均能显著性地延长小鼠负重游泳时间和耐缺氧时间(P<0.05 或P<0.01),表明枫杨叶多糖能够增强机体代谢功能,改善体内微循环。结果见表4。
表4 枫杨叶多糖对小鼠负重游泳时间和耐缺氧时间的影响Table 4 Effect of polysaccharide from Pterocarya stenoptera leaves on weight-bearing swimming time and hypoxia tolerance time in mice(,n=10)
与空白对照组比较:#P <0.05,##P <0.01。
?
3.2.2 枫杨叶多糖对小鼠血清SOD、MDA含量的影响 与空白对照组比较,枫杨叶多糖低、中剂量组对小鼠血清中SOD 与MDA 含量均无显著性影响(P>0.05);高剂量组能够显著提高小鼠血清中的SOD含量,降低MDA 含量(P<0.05)。表明枫杨叶多糖在高剂量下能够增强小鼠组织的抗氧化能力,减少细胞膜脂过氧化损伤。见表5。
表5 枫杨叶多糖对小鼠血清SOD、MDA含量的影响Table 5 Effect of polysaccharide from Pterocarya stenoptera leaves on serum SOD and MDA content in mice(,n=10)
与空白对照组比较:#P <0.05。
?
4 讨论
目前天然植物多糖在免疫调节、抗疲劳功能方面的研究较多,课题组前期亦系统性地综述了中药多糖增强免疫、抗疲劳作用[17]。本实验基于文献所报道的实验方法对枫杨叶多糖在免疫调节、抗疲劳功能方面进行系统性研究。
免疫功能对于人体健康十分重要,脾脏和胸腺是重要的中枢和外周免疫器官,可起到清除病原和防止病原入侵的重要作用。本文通过环磷酰胺所致急性免疫力低下小鼠模型、碳粒廓清实验与二硝基氟苯诱导小鼠耳肿胀实验,系统性评价枫杨叶多糖对小鼠免疫器官、单核-巨噬细胞吞噬功能和迟发型变态反应的影响。结果表明,枫杨叶多糖能够促进小鼠胸腺及脾脏的生长,提高肝脏与脾脏巨噬细胞功能,增强淋巴细胞增殖能力,从而拮抗环磷酰胺所致的器官萎缩等症状,促进免疫力低下小鼠各脏器组织的修复与健康。枫杨叶多糖具有良好的增强免疫功能作用,且呈剂量依赖性。在同等作用效果下,枫杨叶多糖的剂量高于黄芪多糖[7],等同于枸杞多糖[18],低于灵芝多糖[19]、西洋参多糖[20]等。
现代研究发现,氧自由基可引发细胞膜损伤、核酸与DNA损伤、蛋白变性、酶失去活性等,导致多种疾病的发生与恶化[21]。SOD 是体内最主要的自由基清除剂,MDA 为脂质过氧化反应终产物,二者可用于评价运动疲劳程度[22]。本实验结果表明,枫杨叶多糖能够延长小鼠负重游泳时间和耐缺氧时间,提高血清中SOD 含量,降低MDA 含量,有效起到抗疲劳作用,且其起效剂量(100 mg/mg)与龙眼多糖[23]、五味子多糖[24]、红枣多糖[25]、党参多糖[26]、石斛多糖[10]等传统补益药相当。
基于以上实验结果,小鼠服用枫杨叶多糖后明显改善免疫功能,促使机体内的肝糖原等能量储备增加、利用率提高,从而在体外表现为明显延长负重游泳、耐缺氧的时间;在体内表现为提高血清中SOD 含量、降低MDA 含量。增强免疫力、抗疲劳相辅相成,一方面,增强免疫力有助于提高免疫系统识别和清除异常细胞的能力,降低机体慢性疾病发生的概率;另一方面,免疫力低下与机体过度劳累紧密相关,特别是现代生活中,长期熬夜所导致的睡眠不足,极易引发机体疲劳,导致机体免疫系统破坏、免疫力降低,诱发心梗、心肌炎等各种急慢性疾病,所以,抗疲劳也是增强免疫力的一种方式。
综上,枫杨叶多糖具有良好的免疫调节能力及抗疲劳作用,提示可作为新型免疫佐剂和抗疲劳制剂应用于药品、保健品、食品等工业中,其具体的抗疲劳、免疫机制有待于进一步研究。

