基于网络药理学和分子对接探究莪术-三棱药对治疗前列腺癌的作用机制
张 蝶,刘曾晶,蒙秋霞,王慧丰,胡艳玲,4,5
1. 广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心(南宁 530022)
2. 广西医科大学信息与管理学院(南宁 530022)
3. 广西医科大学基础医学院人体解剖学教研室(南宁 530022)
4. 广西医科大学生命科学研究院(南宁 530022)
5. 广西医科大学基因组与个性化医学研究中心(南宁 530022)
前列腺癌(prostate cancer, PCa)是一种严重威胁男性健康和生命的癌症,其发病率逐年上升且在男性生殖系统疾病中居首位,死亡率排第二[1-2]。临床上PCa 的治疗以雄激素阻断为主,同时辅以放疗和化疗。在过去的70 年间,雄激素剥夺治疗(androgen deprivation therapy,ADT)一直被认为是治疗PCa 最有效和最广泛的方法[3]。近几年,虽然在药物治疗、放射性核素治疗和免疫治疗等方面取得了一些新进展,但PCa 的治疗仍存在巨大挑战,寻找PCa 的高效治疗方法已成为当前的趋势。研究发现,传统中药由多种成分组成,具有多功能、多靶点和协同作用的优点,能够有效防止肿瘤细胞的增殖和转移,且副作用较小,能够调节身体的阴阳平衡,对于PCa 的治疗具有独特优势[4]。
古代中医书籍对于PCa 并无其病名的记载,根据PCa 具有血尿、尿不尽等临床特点和表现,可将其纳入中医学“癃闭”“淋证”“血尿”等范畴[5]。古代中医学认为,PCa 病机关键在于正气亏虚,阴阳失调,外感毒邪乘虚侵入下焦,致使肾与膀胱气化失司,脏腑功能紊乱,气血津液运化失常,湿热、瘀血、癌毒内生,从而诱发PCa[6]。
莪术、三棱为破血除淤的代表性中药,两种药物的配伍关系在中医中属于“相须”关系。莪术-三棱药对具有气血兼顾、活血祛瘀、行气止痛和化积消癥的功效,莪术行气之力优于三棱,三棱活血之力优于莪术,两者相须配伍使用可活一身之气血[7]。莪术目前被公认具有抗肿瘤活性的有效成分β-榄香烯和莪术醇等,三棱也已被证实可以分离出具有抗癌活性的多个化合物,具有显著的抗癌活性[8-9]。莪术和三棱治疗癌症的机制具有共同之处,如诱导肿瘤细胞凋亡、干扰肿瘤细胞周期等[10]。目前莪术-三棱药对治疗PCa 的机制尚不明确,本研究采用网络药理学和分子对接技术初步探究莪术-三棱药对抗PCa 的有效活性成分和作用机制。
1 资料与方法
1.1 莪术-三棱药对活性成分靶点收集
通过HERB 数据库(http://herb.ac.cn/),以“莪术”“三棱”为关键词进行检索,获取两种药物的活性成分。利用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获取各活性成分的SMILES 结构式,并导入SwissADME 数据库(http://www.swissadme.ch/)进行药物结构的预测。根据Lipinski 类药五原则(Lipinski、Ghose、Veber、Egan、Muegge),筛选出具有两个或两个以上“Yes”以及GI absorption 为“high”的化合物,并导入SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/),以预测靶点Probability >0 作为筛选原则,得到所选成分对应靶标蛋白的UniProt ID。通过Uniport 数据库(https://www.uniprot.org/)的IDmapping 工具将UniProt ID 转换成Gene Symbol,并在去除重复项后得到有效活性成分靶点。
1.2 PCa相关靶点获取
以“Prostate Cancer”“Prostatic Cancer”“Prostatic Carcinoma”为关键词,分别在Genecards 数据库(https://www.genecards.org/)、OMIM 数据库(https://www.omim.org/)、PhamGkb 数据库(https://www.pharmgkb.org/)、TTD 数据库(http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp)、DrugBank 数据库(https://www.drugbank.ca)中进行检索和筛选,下载相关疾病靶点。将筛选结果整合并删除重复项,得到PCa 相关靶点。将莪术-三棱活性成分靶点与PCa 相关靶点进行交集运算,选取重叠靶点作为莪术-三棱治疗PCa 的相关靶点。采用R 4.2.3 软件绘制Venn 图,以展示莪术-三棱抗PCa 的相关靶点。
1.3 药物有效成分与疾病靶点网络构建
采用Cytoscape 3.9.0 软件对莪术-三棱的活性成分和PCa 靶点网络进行构建,以直观地展示药物活性成分与疾病靶点之间的关系。通过Network Analyzer Apps 软件对网络的拓扑特征进行分析,包括度中心性(degree centrality,DC)、紧密中心性(closeness centrality, CC)和介数中心性(betweenness centrality, BC)。设定介数中心性值和紧密中心性值的中位数为阈值,并以节点度值的大小顺序排列,筛选出关键活性成分。
1.4 蛋白-蛋白相互作用网络构建及核心靶点筛选
为构建莪术-三棱抗PCa 的相关靶点蛋白-蛋白相互作用网络(protein-protein interaction network, PPI), 利用STRING 数据库(https://string-db.org/)揭示蛋白质之间的关系。首先,将相关靶点导入STRING 数据库,获取TSV 格式的数据文件,然后导入Cytoscape 进行可视化。采用节点度值大于中位数的标准,并通过拓扑分析筛选核心靶点[11]。利用Cytoscape 的MCODE 和cytohubba 插件对网络进行分析,输出度值得分排名前10名的靶点为莪术-三棱抗PCa的核心靶点。
1.5 GO和KEGG富集分析
采用基因本体(gene gontology, GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析对莪术-三棱药对与PCa 的共同靶点进行分析,进一步挖掘药物-疾病信号通路。将Gene Symbol 转化为Entrez ID,利用R 4.2.3 软件中的RGUI、DOSE 和Cluster Profiler 等工具进行GO 功能富集和KEGG 通路分析,设定p-value Cutoff=0.05 和q-value Cutoff=0.05,以确保结果的可靠性。分别选择GO 富集结果中富集程度最高的前10 项,包括生物过程(biological process,BP)、细胞成分(cellular component, CC)、分子功能(molecular function, MF),通过R 4.2.3软件制作柱状图进行结果可视化。最后,通过KEGG 数据库及R 4.2.3 软件的pathview 包进行通路富集分析和气泡图绘制,获得富集程度最高的前30 项通路。
1.6 莪术-三棱活性成分与关键靶点分子对接
在Uniprot 数 据 库(https://www.uniprot.org/)中检索候选靶点的条目标识符,然后将其导入RCSB PDB 数据库(https://www.rcsb.org/),获取蛋白受体3D 结构并导入PyMOL 软件,去除水分子和小分子配体。然后在PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取配体的3D 晶体结构,并导入Chem3D 软件进行结构优化处理,提高分子对接结果的可靠性。将经过处理的受体和配体文件导入AutoDockTools 1.5.7 软件,进行加氢处理并确定活性口袋。最后,使用AutoDock Vina 软件进行受体与配体的分子对接,计算最小自由能,并使用PyMOL 软件进行对接结果的优化和可视化。
2 结果
2.1 莪术-三棱治疗PCa的有效成分筛选
初步筛选出72 个化合物,其中莪术44 个、三棱28 个。通过删除重复项,并基于Uniport 数据库进行确认和转换,最终得到760 个有效活性成分靶点,见图1-A。
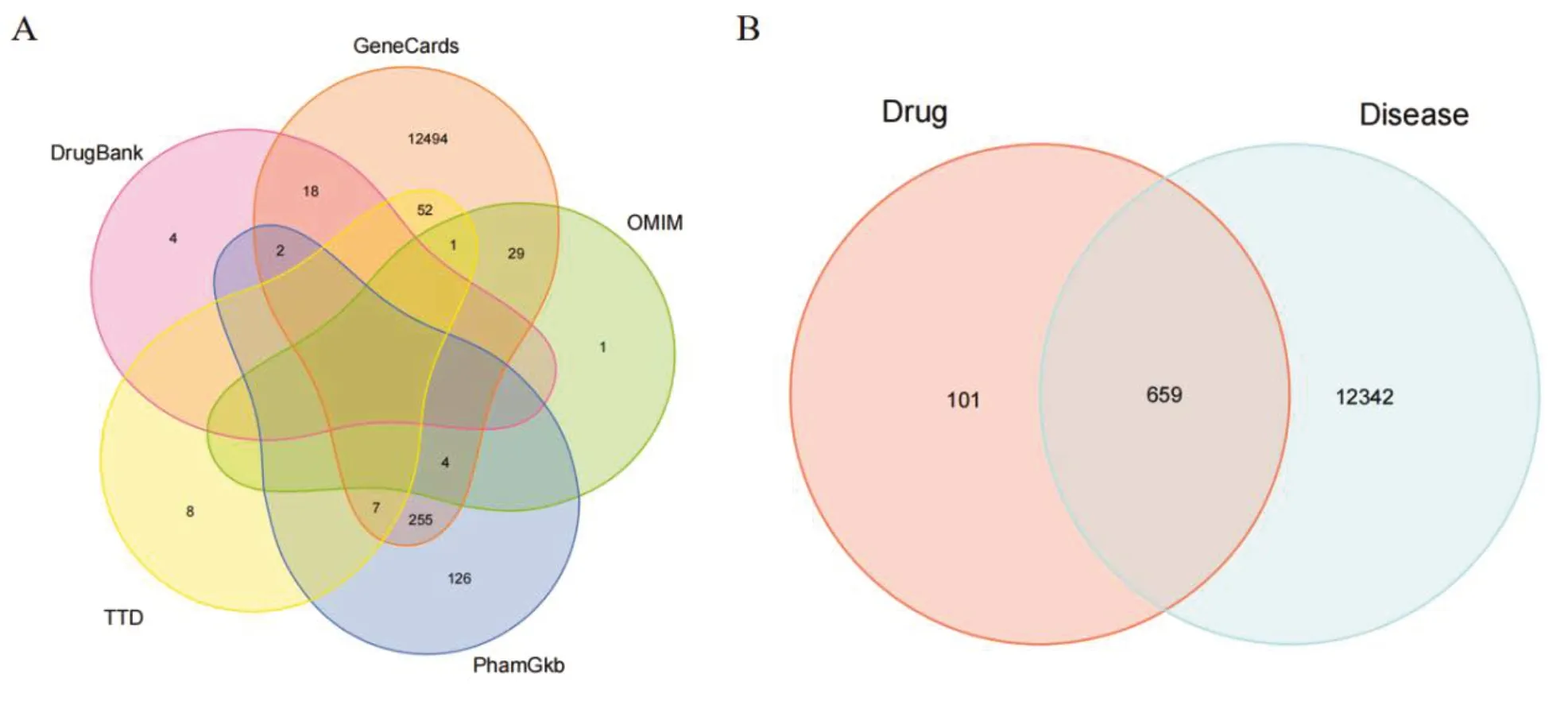
图1 药物有效活性成分靶点与PCa基因靶点Venn图Figure 1. Venn diagram of the intersection of targets between active ingredients of the drug and gene targets of PCa
2.2 有效活性成分库和疾病靶标集构建
共获取13 001 个PCa 基因靶点,将760 个莪术-三棱药对有效活性成分靶点与13 001 个PCa基因靶点取交集,作为莪术-三棱药对治疗PCa的共同靶点,得到659 个共同靶点,见图1-B。
2.3 药物成分-靶点网络构建
本研究构建了一个涵盖727 个节点和3 148 条边的莪术-三棱活性成分与PCa 靶点网络,展示了72 个药物有效成分与659 个潜在靶点间的相互作用,药物成分和疾病靶点分别以不同颜色和形状展示。如图2 所示,不同药物活性成分可与多个基因靶点相连,且一个基因靶点可与多个药物活性成分相连。根据度值大小进行排序,共筛选出10 种关键活性成分,分别为莪术双环烯酮、无患子皂苷B、花椒麻素、(2s)-3',4'- 亚甲二氧基-5,7-二甲氧基黄酮、芹菜素、天人菊内酯、山奈酚、三棱酸、脱甲氧姜黄素以及5,7,2',3'-四羟基黄酮。
2.4 PPI网络构建与核心靶点筛选
图3 为莪术-三棱抗PCa 相关靶点的PPI 网络图,包含497 个节点和2 912 条边。
按照度值由高到低的顺序,共获取10 种关键蛋白,分别为SRC、TP53、MAPK3、MAPK1、STAT3、HSP90AA1、AKT1、PIK3R1、RHOA、GRB2,见图4。排名前10 名的关键蛋白在PPI网络中发挥着重要作用,由于SRC、TP53 和MAPK3 评分最高,可能在莪术-三棱药对治疗PCa 中起关键作用。
2.5 GO和KEGG通路富集分析
对莪术-三棱与PCa 的659 个共同靶点进行GO 功能富集,得到3 667 个GO 条目,筛选出3 188 个BP、148 个CC、331 个MF,见图5。在BP 方面,主要富集于肽酰基酪氨酸磷酸化、异物质刺激反应、肽酰基酪氨酸修饰、蛋白质自磷酸化以及肽酰基丝氨酸磷酸化等过程;在CC方面,富集显著发生在膜微区域、蛋白激酶复合物、神经元细胞体、丝氨酸/苏氨酸蛋白激酶复合物以及突触前膜的整体组分等结构;在MF 方面,主要涉及蛋白质丝/苏氨酸激酶活性、蛋白质酪氨酸激酶活性、蛋白质丝氨酸激酶活性、核受体活性以及配体激活的转录因子活性等分子功能。
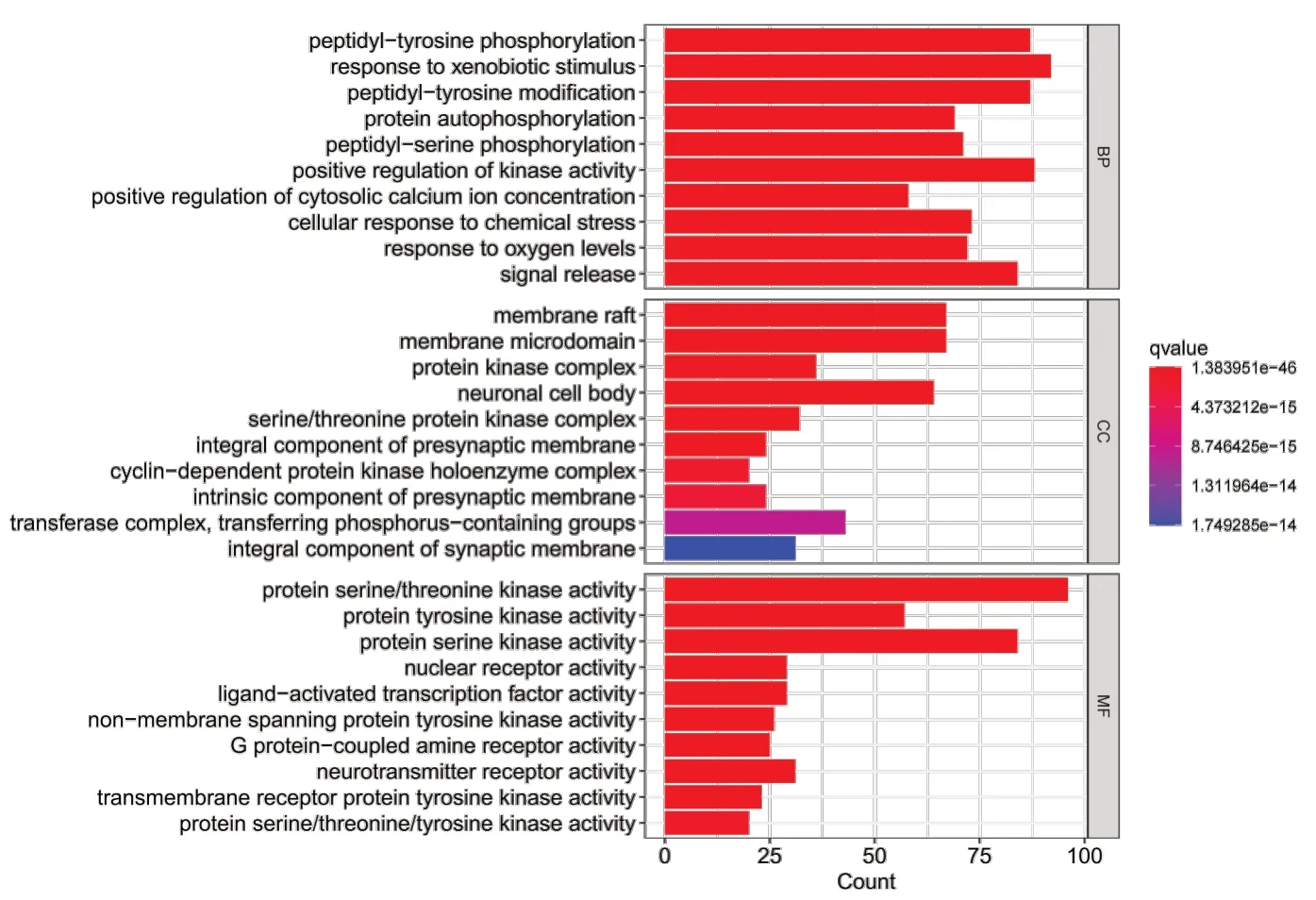
图5 GO富集分析Figure 5. GO enrichment analysis
为深入研究莪术-三棱对PCa 的信号通路机制,本研究进行了KEGG 通路分析,图6 展示了前30 条信号通路,包括神经活性配体-受体相互作用通路、PI3K-AKT 信号通路以及钙信号通路等。
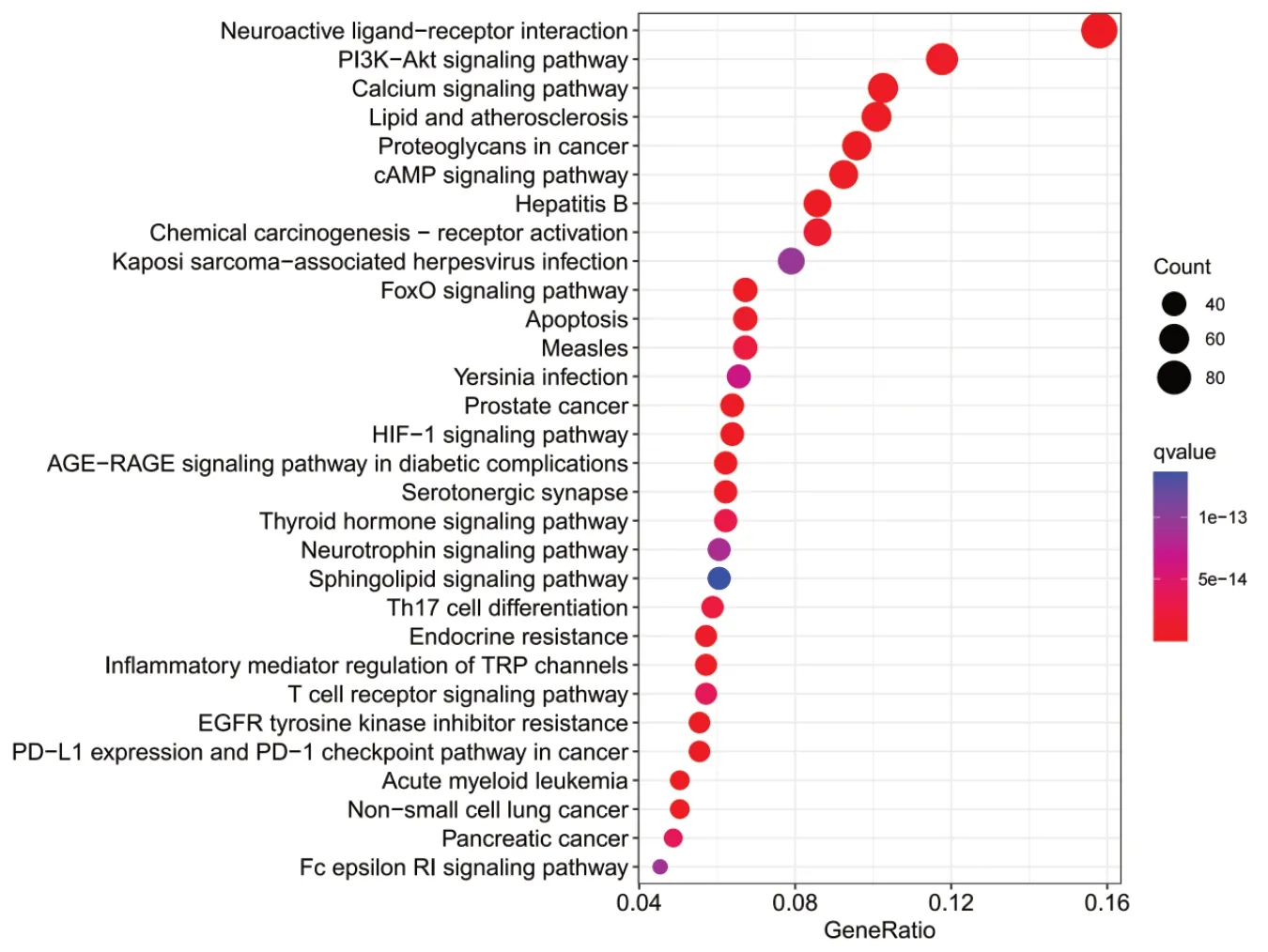
图6 莪术-三棱药对治疗PCa作用靶点的KEGG通路富集分析Figure 6. KEGG pathway enrichment analysis of the targets of Ezhu-Sanleng in the treatment of PCa
以PI3K-AKT 信号通路为例,如图7 所示,莪术-三棱治疗PCa 的作用靶点主要包括PI3K、AMPK、JAK 以及AKT 等40 个。
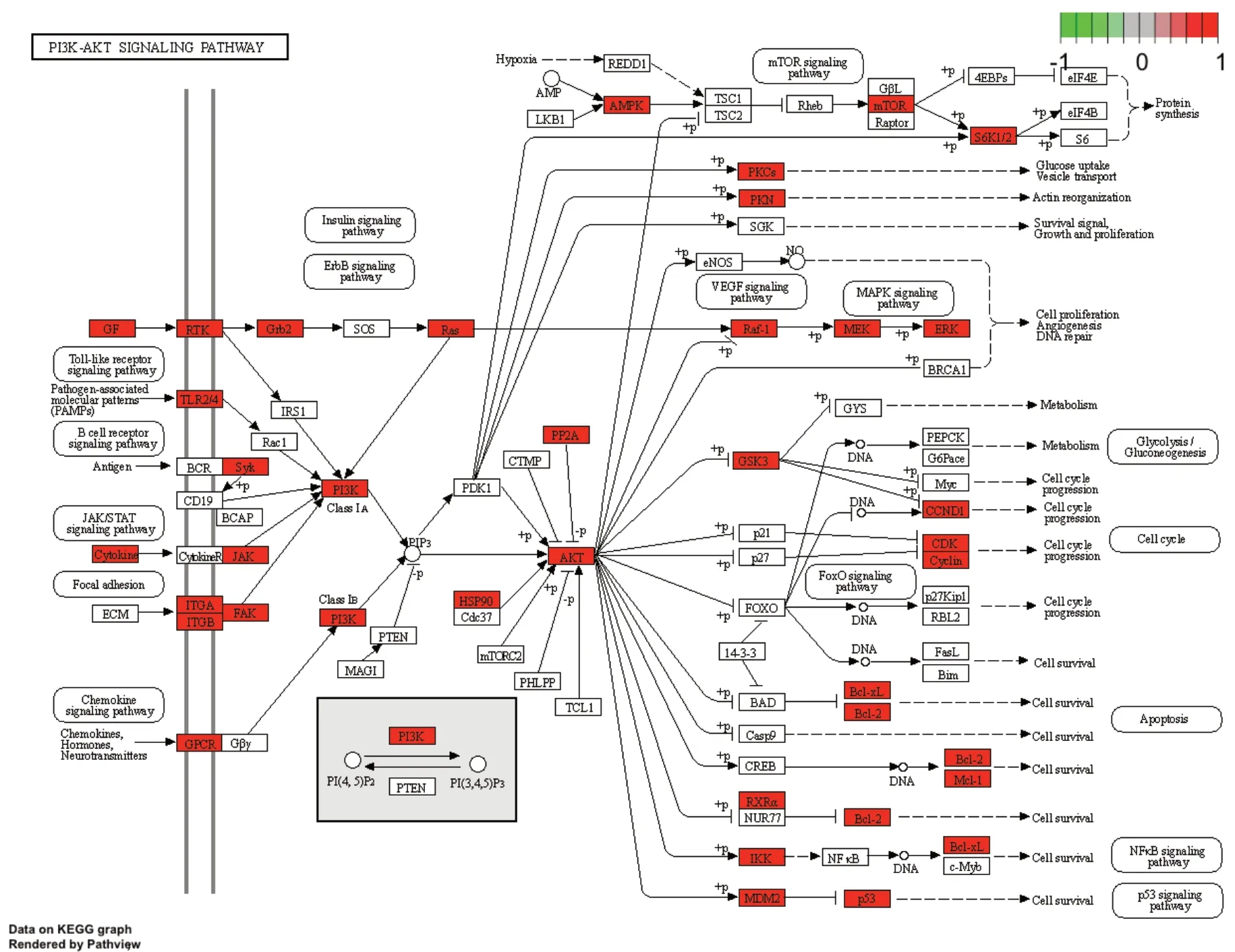
图7 莪术-三棱药对治疗PCa作用靶点在PI3K-AKT信号通路上的富集图Figure 7. Enrichment diagram of the targets of Ezhu-Sanleng in the treatment of PCa on the PI3KAKT signaling pathway
2.6 核心靶点与药物活性成分的分子对接验证
在莪术-三棱活性成分与PCa 靶点网络中,将核心靶点和与之相互作用的药物关键活性成分进行分子对接,具体对接信息见表1。图8 为利用PyMOL 软件可视化后受体与配体的最佳对接图像。研究表明,配体与受体结合的构象稳定时能量越低,结合的可能性越大,当结合能小于-5.0 kcal·mol-1时,配体与受体的结合活性较好[12-15]。由分子对接结果可知,结合能均小于-5.0 kcal·mol-1,表明这些核心靶点与对应的药物活性成分均具有较高的亲和力。
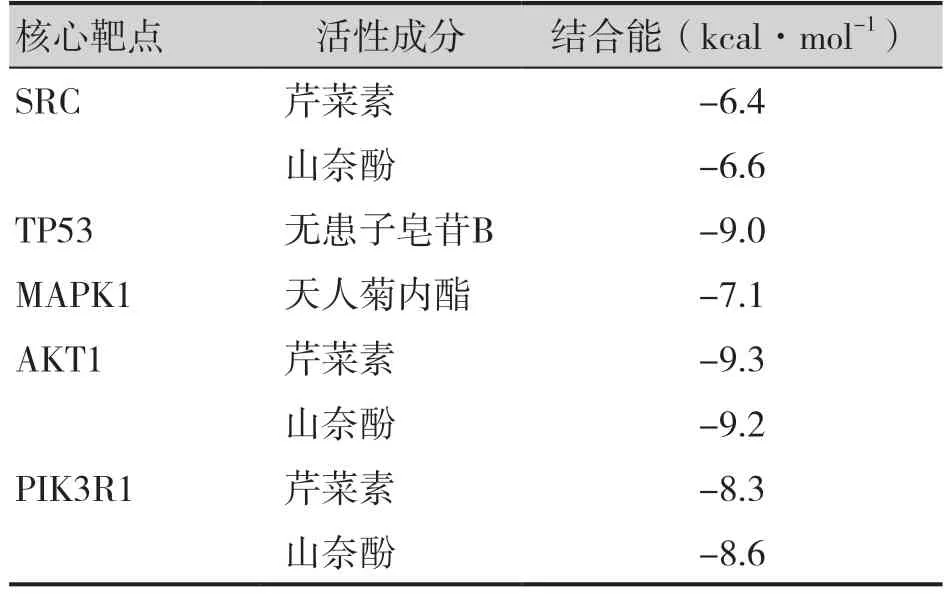
表1 核心靶点与药物活性成分的分子对接信息Table 1. Molecular docking information between core targets and active ingredients of the drug
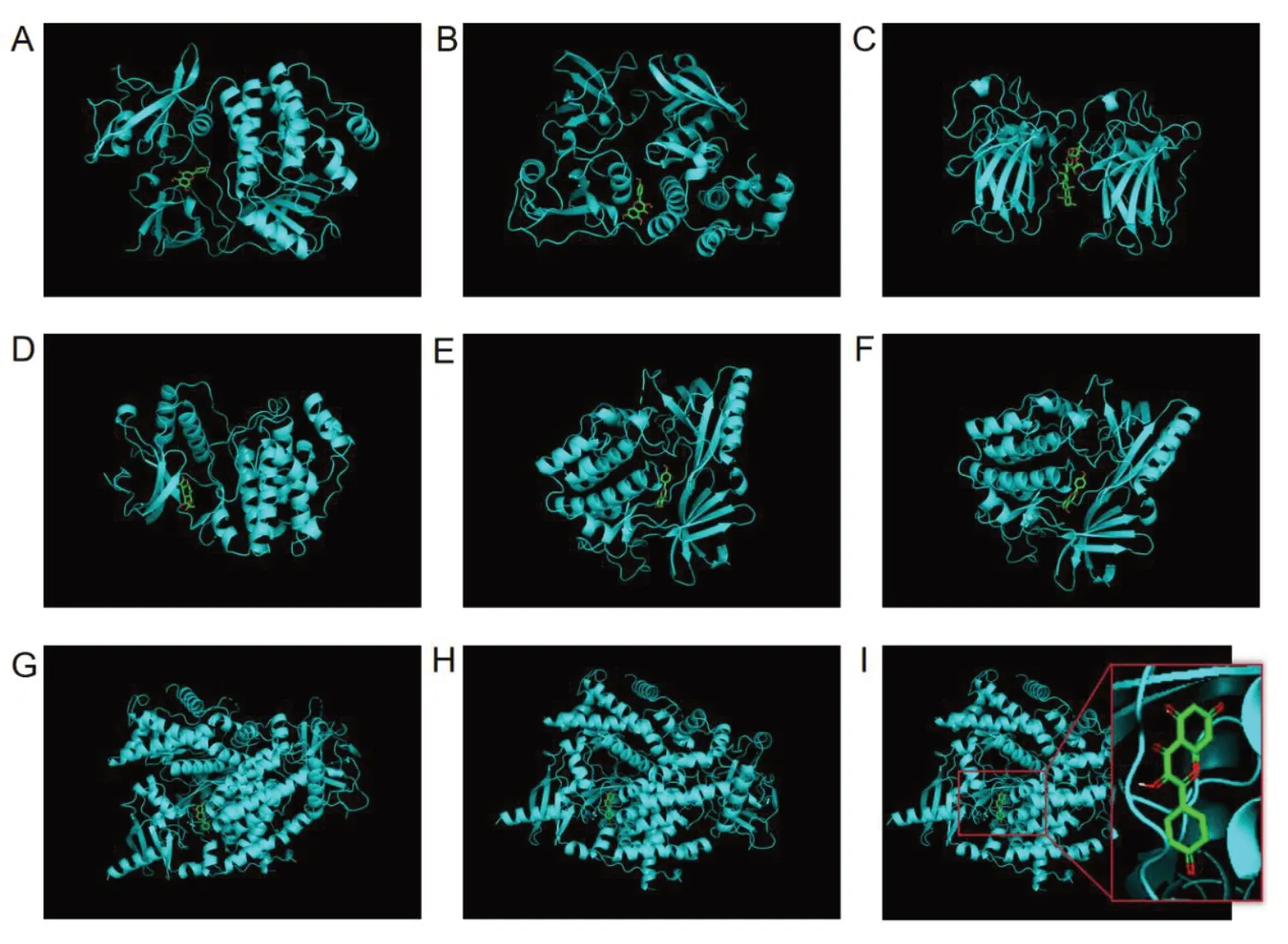
图8 核心靶点与莪术-三棱药物活性成分的分子对接模式Figure 8. Molecular docking patterns between core targets and active ingredients of Ezhu-Sanleng
3 讨论
中医药不仅在传统医学中占据重要地位,也在肿瘤防治中发挥着重要作用,深入研究和充分发挥中医药在PCa 治疗中的潜力,对于改善患者治疗效果和提高生存率有着重要意义[16-18]。现代药理研究表明,莪术-三棱药对含有多种抗肿瘤成分,可通过多种途径和靶点发挥抗肿瘤作用。既往研究显示,莪术-三棱药对在不同癌症中均表现出抗癌活性,其可以通过双去甲氧基姜黄素调节人子宫内膜癌细胞的代谢、增殖与凋亡来发挥抗子宫内膜癌的作用,也可通过减少TGF-β1诱导的Smad3 磷酸化水平的上调,并降低多种转录因子(Snail1、Snail2 和Twist1)的表达来影响三阴性乳腺癌上皮间质转化[19-20]。虽然近年来研究发现莪术-三棱药对在抗肿瘤方面具有积极作用,但莪术-三棱药对抗PCa 的机制并不明确,本研究通过网络药理学和分子对接技术探究莪术-三棱抗PCa 的有效活性成分及其与潜在靶点的相互作用。
本研究获取了莪术-三棱药对的活性成分,包括莪术双环烯酮、无患子皂苷B、花椒麻素、(2s)-3',4'-亚甲二氧基-5,7-二甲氧基黄酮、芹菜素、天人菊内酯、山奈酚、三棱酸、脱甲氧姜黄素等。山奈酚在肿瘤治疗方面具有潜在作用,其在人结肠癌HCT-116 细胞体外实验中通过参与调节肿瘤细胞氧化应激和诱导凋亡展现出抗癌潜力[21];在雄激素受体表达细胞和非雄激素受体表达细胞中均可抑制肿瘤增殖标志物Ki67 mRNA的表达[22-23];此外,山奈酚还可以通过调节雄激素受体信号通路来抑制人前列腺癌LNCaP 细胞的增殖[24];人宫颈癌体外细胞实验结果表明,山奈酚可通过阻断JAK2/STAT3 通路信号转导,从而抑制人宫颈癌HeLa 细胞的增殖、黏附及糖酵解等[25]。天人菊内酯通过上调p53 和增加Bax/Bcl-2比值触发线粒体介导的细胞凋亡途径,导致线粒体膜电位丧失,从而抑制人乳腺癌的发展[26];研究发现,天人菊内酯能够通过抑制NF-κB 显著降低COX-2、MMP-9、TWIST-1、Bcl-2等基因的表达水平,从而抑制肿瘤进展[27]。研究表明,无患子皂苷B 对肺癌细胞和肝癌细胞的增殖均有抑制作用,其通过阻滞细胞周期、上调Caspase-3 并下调NF-κB 的表达,抑制HepG2 人肝癌细胞的增殖并诱导其凋亡[28]。脱甲氧姜黄素也被发现可以抑制肿瘤增殖标志物Ki67 的表达,显著降低原位胶质瘤组织中p-AKT 和p-mTOR 的表达,展现出强大的抗肿瘤特性[29]。体外细胞实验发现芹菜素能够通过调节PI3K/AKT 信号通路抑制子宫内膜癌细胞HEC-1-B 细胞增殖、侵袭、迁移并促进其凋亡[30];裸鼠体内实验结果表明,芹菜素还可通过与CBP/PTX 疗法(卵巢癌临床一线化疗法)联合使用,降低上皮性卵巢癌细胞Caov-3细胞的迁移能力,限制其恶性发展[31]。这些成分可能是莪术-三棱抗PCa 的关键成分,为深入探究其疗效机制提供了线索。
SRC、TP53、MAPK3、MAPK1、STAT3 是度值最高的前5 种关键蛋白,是PPI 网络图中发挥关键作用的核心靶点。这些蛋白在应激和炎症反应中被诱导,参与调控细胞的增殖、分化、凋亡等细胞生物学行为。SRC 是一种原癌基因酪氨酸蛋白激酶,作为治疗PCa 的关键靶点之一,Saad等研究表明SRC 在推动细胞增殖、存活、迁移并促使向雄激素非依赖性生长的过程中发挥着重要作用[32]。TP53 在维护细胞基因组稳定性和抑制肿瘤发展中起着重要作用,在PCa 等多种癌症中TP53基因的突变或功能异常可能导致p53 蛋白的失活,从而使细胞失去对异常状况的监测和调控[33]。在细胞内信号通路中,MAPK(丝裂原活化蛋白激酶)在细胞增殖、分化、凋亡、血管生成和肿瘤转移方面发挥关键作用,可通过调节细胞周期相关蛋白的表达和激活细胞凋亡途径,抑制肿瘤细胞的无限增殖能力,使其进入细胞周期停滞或死亡[34]。STAT3 也是雄激素抵抗性PCa 治疗的重要靶点,与癌细胞存活、免疫抑制和肿瘤微环境中的持续炎症有关,异常激活的STAT3 与PCa 的恶性进展和转移有关,可能促进PCa 细胞的增殖,并影响肿瘤的侵袭和转移能力[35-36]。
GO 富集分析结果显示,莪术-三棱抗PCa的659 个潜在靶点主要通过影响蛋白质丝/苏氨酸激酶活性、蛋白质酪氨酸激酶活性、蛋白质丝氨酸激酶活性等分子功能,在膜微区域、蛋白激酶复合物、神经元细胞体等结构中调控肿瘤细胞的增殖、凋亡、迁移和信号转导。KEGG 对潜在靶点的分析显示,莪术-三棱可能通过神经活性配体-受体相互作用通路、PI3K-AKT 信号通路、钙信号通路等多种途径对PCa 产生治疗作用。据报道,神经活性配体-受体相互作用通路与结肠癌的预后与免疫治疗反应相关[37]。PI3K-AKT 信号通路在肿瘤细胞的存活、增殖、分化、迁移和代谢中起着关键作用[38]。在PCa 中,钙信号通路通过调节多种蛋白受体,促进LNCaP 细胞的凋亡。局部钙信号具有传递信息的能力,能够影响细胞内钙稳态产生并建立网络,用于整合肿瘤微环境条件,破坏PCa 网络中的关键节点[39]。
分子对接通过一种理论模拟的方法,模拟药物成分与靶点之间的相互作用,并预测其结合模式和亲和力,能够更好地理解药物的结合方式和结合强度[40]。基于网络药理学研究结果,本研究对莪术-三棱活性成分与PCa 靶点网络中的分子相互作用进行分子对接验证。核心靶点与莪术-三棱药对关键活性成分的分子对接模式图展示了SRC 与芹菜素、SRC 与山奈酚、TP53 与无患子皂苷B、MAPK1 与天人菊内酯、AKT1 与芹菜素、AKT1 与山奈酚、PIK3R1 与芹菜素、PIK3R1 与山奈酚的结合模式,所有结合能均小于-5.0 kcal·mol-1,进一步印证了这些核心靶点与药物活性成分之间的牢固结合,AKT1 与芹菜素的对接结果具有最低的结合能,表明结合最为稳定。
本研究使用生物信息学方法探讨莪术-三棱药对在治疗PCa 中的作用,存在一些局限性,如数据库数据的准确性和及时性需要科学验证,以及某些未经确认和未记录的药物成分或靶点可能未被纳入本研究。尽管本研究显示莪术双环烯酮、无患子皂苷B、花椒麻素、(2s)-3',4'-亚甲二氧基-5,7-二甲氧基黄酮、芹菜素、天人菊内酯、山奈酚、三棱酸以及脱甲氧姜黄素为莪术-三棱药对在治疗PCa 中最关键的药物活性成分,但它们并不能完全代表莪术-三棱药对,且莪术-三棱药对在治疗中存在配伍关系。因此,后续需进行药效学实验和分子生物学实验进一步验证本研究结果。
本研究通过网络药理学和分子对接的方法初步阐明了莪术-三棱抗PCa 的药物活性成分、关键靶点及作用机制,揭示了莪术-三棱通过莪术双环烯酮、无患子皂苷B、花椒麻素、(2s)-3',4'-亚甲二氧基-5,7-二甲氧基黄酮、芹菜素、天人菊内酯、山奈酚、三棱酸以及脱甲氧姜黄素等药物关键活性成分,调节细胞的增殖、凋亡、迁移和信号转导等相关通路中的SRC、TP53、MAPK3、MAPK1、STAT3、HSP90AA1、AKT1、PIK3R1、RHOA、GRB2 等核心靶点,呈现了多成分、多靶点相互作用的特性,为莪术-三棱治疗PCa 的深入研究提供了参考。

