外源钙缓解小麦幼苗盐胁迫的作用机制
焦进兰 王文文 介欣芮 王华忠 岳洁瑜
(天津师范大学生命科学学院 天津市动植物抗性重点实验室,天津 300387)
小麦作为第二大粮食作物,约占我国居民口粮消费总量的43%,在粮食安全中占有重要的地位。然而,小麦在生长发育过程中经常受到各种逆境胁迫而导致减产,盐胁迫就是其中之一[1]。近年来,土壤盐渍化问题在世界范围内广泛存在且日趋严重,提高盐渍化土地内粮食作物的耐性已迫在眉睫。盐胁迫会引起离子毒害、渗透胁迫、氧化损伤等[2]。渗透和离子胁迫会导致叶片生长缓慢并导致叶片过早衰老,从而导致植物光合作用受到抑制[3]。此外,盐胁迫下,植物细胞产生过量的活性氧(reactive oxygen species, ROS)破坏细胞组分,导致氧化损伤,损伤严重时,甚至导致植株死亡[4]。因此,解析小麦耐盐机制具有重要的现实意义。
植物在受到外界胁迫时,其自身会发生一系列反应来抵御胁迫,包括活性氧清除与降解、细胞凋亡与自噬等[5-6]。自噬是真核细胞内一种进化保守的自我消化机制,是负责将受损的细胞器、错误折叠的蛋白及其他大分子物质等运送至液泡(植物)或溶酶体(动物)降解并再利用的过程[7]。已有研究表明,自噬是盐胁迫下植物细胞维持细胞稳态的主要途径之一。正常水平的自噬是一种通过降解细胞内异常组分以维持细胞稳态的过程,但自噬过度上调则会引起自噬性细胞死亡(autophagic cell death),即II型细胞程序性死亡(programmed cell death, PCD)[8]。对植株来说,适度的细胞自噬可为其他细胞提供所需营养物质,帮助其他细胞维持正常的生理机能,或者用来修复逆境胁迫所带来的伤害等[9]。在烟草、拟南芥、水稻、小麦等植物上自噬相关基因(autophagy related gene, ATG)的鉴定和分析相继被报道,揭示自噬在植物应答逆境胁迫过程中发挥非常关键的作用,ROS的产生是植株抵御胁迫共有的关键过程[10-11]。但关于自噬与自噬性细胞死亡之间的相互转换关系,相关的调控信号途径等问题尚不清晰。
钙离子(Ca2+)作为植物体内的第二信使,在植物的生长发育和响应逆境胁迫中发挥重要的作用。非生物胁迫下,外源Ca2+的施用可改善胁迫环境对细胞生长发育的抑制,维持细胞功能和结构的完整性[12]。如CaCl2处理通过改善细胞膜的结构完整性来限制梨上褐斑的发展[13]。外源Ca2+处理增加了西兰花微绿叶菜的生物量,并延缓了其衰老[14]。在盐胁迫条件下,Ca2+诱导Ca2+通道阻碍Na+的吸收,维持植物的生长,同时还作为一种信号分子参与盐胁迫信号转导,调节相关基因的表达,从而提高植物耐盐性[15]。Ca2+通过降低植物根系对Na+的吸收量和向地上部的运输量,增加对K+、Mg2+、Ca2+的吸收量和运输量,降低盐胁迫下各器官Na+/Ca2+值、Na+/K+值[16]。在植物体内,Ca2+主要通过Ca2+信号感受蛋白传递胁迫信号,如钙调素(calmodulins,CaM)、钙依赖蛋白激酶(Ca2+-dependent protein kinases, CDPK)等,这些Ca2+感受器被复杂的基因家族编码,构成了复杂的信号传递网络[17]。当植物处于盐胁迫环境中,Ca2+通道蛋白作为重要的盐信号受体能迅速感知并使胞内Ca2+浓度急剧上升[18]。CDPK可直接被Ca2+信号激活,通过感知Ca2+浓度的变化向下游传递信号,诱导下游基因的表达,从而改变植株的理化性质,同时调节细胞自噬与凋亡,使植物对逆境胁迫进行适应和抵御[19]。研究表明,OsCPK12可以通过减少水稻ROS的积累来增加对脱落酸(abscisic acid, ABA)的敏感性并提高植株的耐盐性[20]。过表达VaCDPK20提高了拟南芥在冷冻和干旱处理条件下的耐性[21]。已有研究表明Ca2+信号对自噬发生过程的重要调控作用[22]。在一些生理和病理条件下,Ca2+诱导哺乳动物细胞自噬增加[23]。外源Ca2+通过提高梨的自噬活性和水杨酸水平,提高梨对多刺葡萄孢菌的抗性[24]。
Ca2+作为一种帮助植物更好适应盐胁迫的效应分子,目前,其对植物耐盐性调控作用的研究主要集中在生理学研究,Ca2+调控植物耐盐的作用机制还需要进一步研究。
本研究以河农6425品种小麦为材料,解析Ca2+在小麦幼苗响应盐胁迫中的作用及Ca2+在盐胁迫诱导的自噬中的调控作用,为进一步揭示植物盐胁迫应答机制提供分子证据。
1 材料与方法
1.1 材料
以小麦品种河农6425作为试验材料,该品种属于中早熟冬性小麦,生育期为249 d,有较强的抗倒伏性。在小麦生长至苗期的两叶一心时,对其进行处理。用150 mmol/L NaCl处理以创造小麦幼苗盐胁迫环境,NaCl处理浓度以50 mmol/L逐天递增至150 mmol/L,每天NaCl递增的浓度为50 mmol/L。以避免盐激效应对小麦幼苗生长造成影响。以CaCl2和LaCl3分别作为外源Ca2+和Ca2+抑制剂,对小麦幼苗进行处理。
1.2 方法
1.2.1 Ca2+及其抑制剂的浓度筛选 选取颗粒饱满、大小均匀的小麦种子,用蒸馏水浸种24 h,置于铺有两层纱布的培养盆中培养,期间定时浇水以确保种子能正常发芽生长。待小麦幼苗生长至一叶一心期,将其转移至1/10 Hoagland营养液中继续培养(表1)[1],至两叶一心期时,选取生长一致的小麦幼苗进行Ca2+及其抑制剂处理。设置0、1、5、10和20 mmol/L CaCl2浓度梯度,分别对正常生长小麦幼苗和盐胁迫小麦幼苗进行处理。基于前期试验,选用5 mmol/L LaCl3作为Ca2+抑制剂对正常生长小麦幼苗和盐胁迫小麦幼苗进行处理。

表1 营养液配置表Table 1 Nutrient solution formula
1.2.2 小麦幼苗形态观察及生长参数测定 观察小麦幼苗生长状况,待不同处理组小麦幼苗形态有明显差异时,用直尺测量小麦幼苗根长、叶长、叶宽、株高等生长参数,每组至少测量5株,并对不同处理组小麦幼苗进行取样拍照[1]。
1.2.3 叶绿素荧光参数测定 使用双通道调制叶绿素荧光仪测量不同处理组中小麦幼苗第三叶的叶绿素荧光参数,每组至少测量5株。叶片暗适应20 min后测量暗适应后的最小荧光值F0、光系统II(photosystem II, PSII)的最大光化学效率Fv/Fm、PSII的实际光能转化效率Y(II)、光合电子相对传递速率ETR、光化学淬灭值qP及非光化学淬灭值NPQ[1]。
1.2.4 二氨基联苯胺(diaminobenzidine, DAB)染色 参考实验室之前建立的方法[1]。取小麦幼苗第三叶叶片3-4 cm,去掉发黄叶尖,每组至少3个重复,置于1 mg/mL DAB染液中,抽真空20 min后,25℃避光染色13 h,然后,将叶片放进卡诺试剂(无水乙醇∶冰醋酸=3∶1)固定7 h。85%酒精60℃水浴脱色,直至叶片无色后放进叶保存液(75%乙醇+5%甘油+ddH2O)中4℃保存。取小麦幼苗根尖1-2 cm置于1 mg/mL DAB染液,25℃避光染色30 min,用ddH2O冲洗染液,结束染色,将其放进根保存液(50%乙醇+5%甘油+ddH2O)4℃保存。用体式显微镜(Nikon C-fled2, 日本)观察拍照。
1.2.5 氯化硝基四氮唑蓝(nitrotetrazolium blue chloride, NBT)染色 方法同1.2.4,将材料置于0.5 mg/mL NBT染液中,抽真空20 min,25℃避光染色10 h,置于卡诺试剂固定7 h,85%酒精60℃水浴脱色,至叶片无色,置于叶保存液,4℃保存。取小麦幼苗根尖1-2 cm置于0.5 mg/mL NBT染液25℃避光染色5-8 min,用ddH2O将染液冲洗干净,并置于根保存液,4℃保存。用体式显微镜(Nikon C-fled2,日本)观察拍照。
1.2.6 伊文思蓝染色 方法同1.2.4,将材料置于0.25%伊文思蓝染液25℃避光染色24 h,用ddH2O冲洗,放进煮沸的脱色液(无水乙醇∶甘油=9∶1)水浴脱色,至叶片底色变为白色,置于叶保存液4℃保存。取小麦幼苗根尖1-2 cm置于0.25%伊文思蓝染液中,25℃避光染色5-10 min,用ddH2O快速冲洗,并静置1 h去掉浮色后放进根保存液中4℃保存。用体式显微镜(Nikon C-fled2,日本)观察拍照。
1.2.7 过氧化物酶(peroxidase, POD)活性检测 采用POD活性检测试剂盒测定小麦幼苗中POD活力,参考过氧化氢氧化法,使用紫外分光光度计(UVmini-1240, 岛津)测定反应混合液在470 nm处的吸光值,计算POD活力。3次重复试验。
1.2.8 超氧化物歧化酶(superoxide dismutase, SOD)活性检测 采用SOD活性检测试剂盒测定小麦幼苗中SOD活力,参考还原氮蓝四唑法,用紫外分光光度计测定反应混合液在560 nm处的吸光值,计算得出SOD活力。3次重复试验。
1.2.9 过氧化氢酶(catalase, CAT)活性检测 采用CAT活性检测试剂盒测定小麦幼苗中CAT活性,用紫外分光光度计测定反应混合液在240 nm处的吸光值,计算得出CAT活力。3次重复试验。
1.2.10 超氧阴离子(O2·-)含量检测 采用O2·-含量检测试剂盒测定小麦幼苗中O·-含量,利用O·-22与盐酸羟胺反应生成NO2-,NO2-在对氨基苯磺酰胺和萘乙二胺盐酸盐的作用下,生成紫红色的偶氮化合物,在530 nm有特征吸收峰,通过酶标仪(Infinite M200 Pro,瑞士)测定A530即可计算得出O2·-含量。3次重复试验。
1.2.11 过氧化氢(H2O2)含量检测 采用H2O2含量检测试剂盒检测小麦幼苗中H2O2含量,利用酶标仪(Infinite M200 Pro,瑞士)测定反应混合液在波长415 nm处的吸光值,计算H2O2含量。3次重复试验。
1.2.12 叶绿素含量测定 采用95%乙醇提取法测定小麦幼苗中叶绿素含量[25]。称取小麦幼苗第三叶叶片0.2 g,加液氮研磨后放入10 mL离心管中,加入8 mL 95%乙醇于25℃避光放置12 h以充分提取叶绿素,之后4 500 r/min离心10 min,取上清,用紫外分光光度计分别测定波长663和645 nm时的吸光值,计算叶绿素含量。3次重复试验。
1.2.13 TUNEL染色检测小麦幼苗凋亡细胞 采用DeadEndTMFluorometric TUNEL System(Promega,美国)试剂盒检测小麦幼苗中凋亡细胞,分别用DAPI和PI染液对小麦幼苗叶片和根部组织进行复染后,使用正置荧光显微镜观察植物组织中细胞凋亡情况,并拍照进行计数统计。
1.2.14 MDC(monodansylcadaverine)染色检测小麦幼苗自噬活性 运用MDC染色检测小麦幼苗自噬活性[26]。取小麦幼苗根和叶片1-2 cm,蒸馏水洗净,浸没于染色液中,抽真空15 min后置于冰上黑暗染色30 min,用1×PBS清洗多余染色液结束染色。用共聚焦显微镜观察植物组织中自噬活性变化。
1.2.15 实时荧光定量PCR(RT-qPCR)检测 运用RT-qPCR检测小麦幼苗中各基因的表达量[6],提取小麦幼苗组织RNA,并反转录为cDNA,PCR扩增程序为95℃ 2 min;95℃ 15 s,60℃ 1 min,40个循环,以Tublin作为内参基因进行数据分析。各处理组进行3次重复试验。所用引物如表2。

表2 RT-qPCR引物Table 2 Primers used for RT-qPCR
2 结果
2.1 Ca2+缓解NaCl胁迫下小麦幼苗生长的浓度筛选
外源施加不同浓度CaCl2处理144 h后,与NaCl处理组相比,1、5、10和20 mmol/L CaCl2处理均显著提高小麦幼苗的耐盐性,其根长和叶宽均显著增加(图1-A-B)。其中10 mmol/L CaCl2处理缓解小麦幼苗耐盐性的效果最显著,根长、叶宽均显著增多,小麦幼苗长势最好(图1-C-D)。
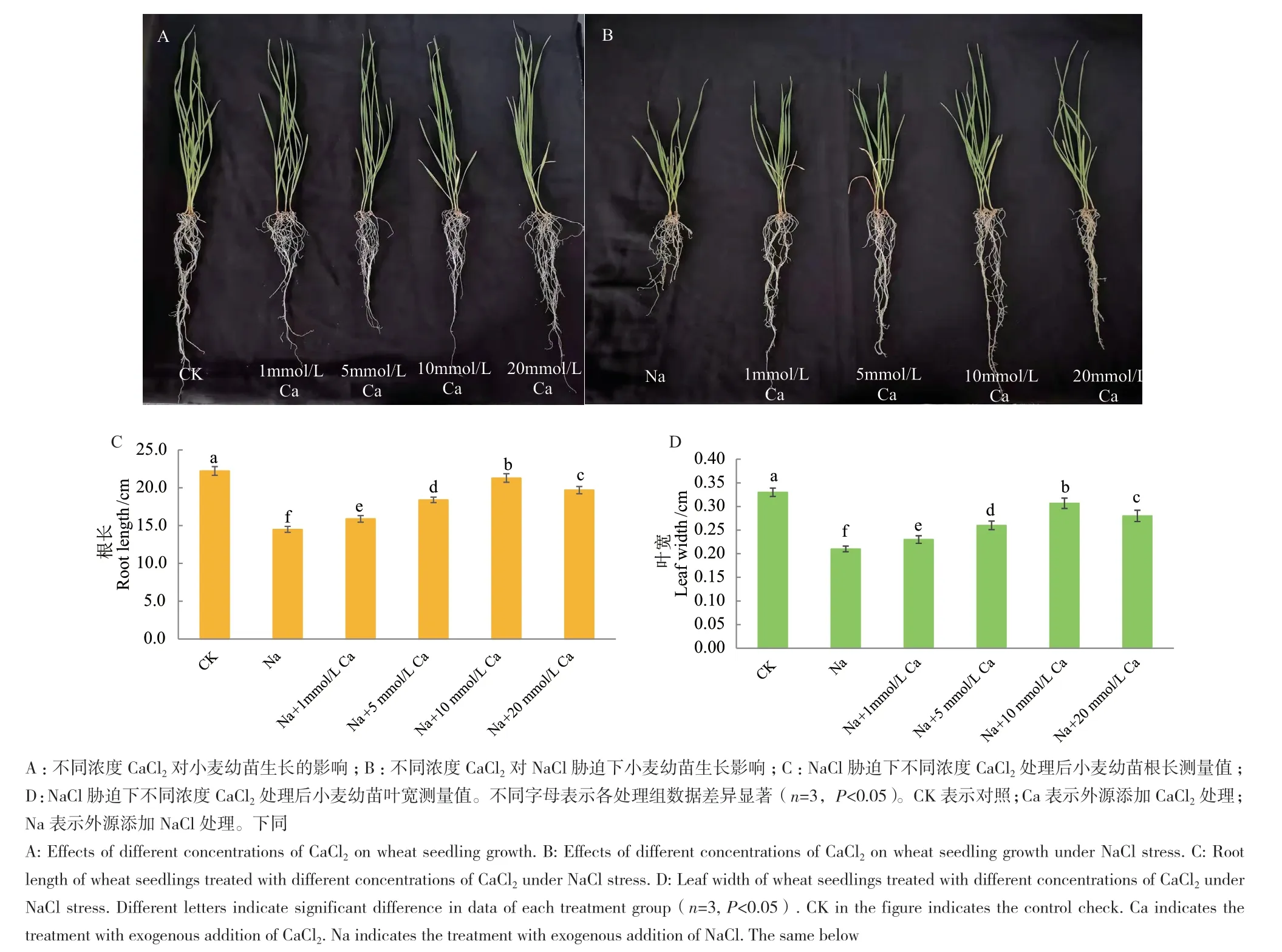
图1 不同浓度CaCl2对NaCl胁迫下小麦幼苗生长影响Fig. 1 Effects of different concentrations of CaCl2 on wheat seedling growth under NaCl stress
为了探究不同浓度CaCl2处理对小麦幼苗叶片组织中ROS的影响,分别用DAB和NBT染色检测H2O2和O2·-在小麦叶片中的累积情况。NaCl胁迫导致叶片组织中H2O2和O2·-积累量增多。不同浓度CaCl2处理后,NaCl胁迫导致的H2O2和O2·-积累量均有所减少,其中10 mmol/L CaCl2处理组中H2O2和O2·-积累量最少(图2-A-B)。
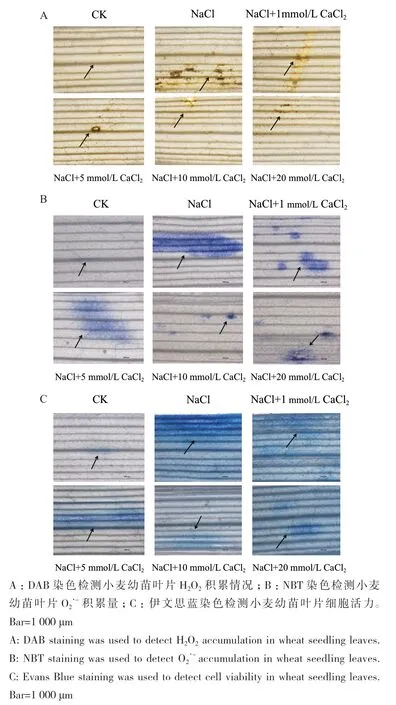
图2 NaCl胁迫对小麦幼苗叶片生长机理影响Fig. 2 Effects of NaCl stress on the growth mechanism of wheat seedling leaves
采用伊文思蓝染色法探究不同浓度CaCl2对小麦幼苗叶片细胞活力的影响。NaCl胁迫会导致叶片中死亡细胞增多,使细胞活力降低,分别添加1、5、10和20 mmol/L CaCl2处理后,叶片死亡细胞减少,其中,施加10 mmol/L CaCl2后,死亡细胞最少,叶片细胞活力最高(图2-C)。
综上,外源施加CaCl2对NaCl胁迫下小麦幼苗生长有促进作用,10 mmol/L CaCl2对NaCl胁迫的缓解效果最好。因此,选用10 mmol/L CaCl2作为外源施加Ca2+浓度。基于前期试验,选用5 mmol/L LaCl3作为Ca2+抑制剂。通过外源施加Ca2+及其抑制剂,以探究Ca2+调控小麦幼苗耐盐的作用机制。
2.2 外源Ca2+对NaCl胁迫下小麦幼苗生长的影响
外源施加10 mmol/L CaCl2和5 mmol/L LaCl3分别对正常及NaCl胁迫下小麦幼苗进行处理,处理144 h后观察到不同处理组间小麦幼苗生长状况出现显著差异(图3)。与对照组(CK)相比,NaCl处理后小麦幼苗生长状况较差,其生长指标叶长、叶宽、根长和株高均显著降低。NaCl胁迫下,外源Ca2+处理有助于缓解NaCl胁迫对小麦幼苗的危害,其根长、株高、叶长和叶宽均显著增加,但对正常生长小麦幼苗生长状况及生长指标根长、株高、叶长和叶宽均无明显影响;LaCl3处理后正常及NaCl胁迫下小麦幼苗生长状况均显著变差,其根长、株高、叶长和叶宽均显著降低(表3)。

图3 外源Ca2+对NaCl胁迫下小麦幼苗生长状况的影响Fig. 3 Effects of exogenous Ca2+ on the growth of wheat seedlings under NaCl stress
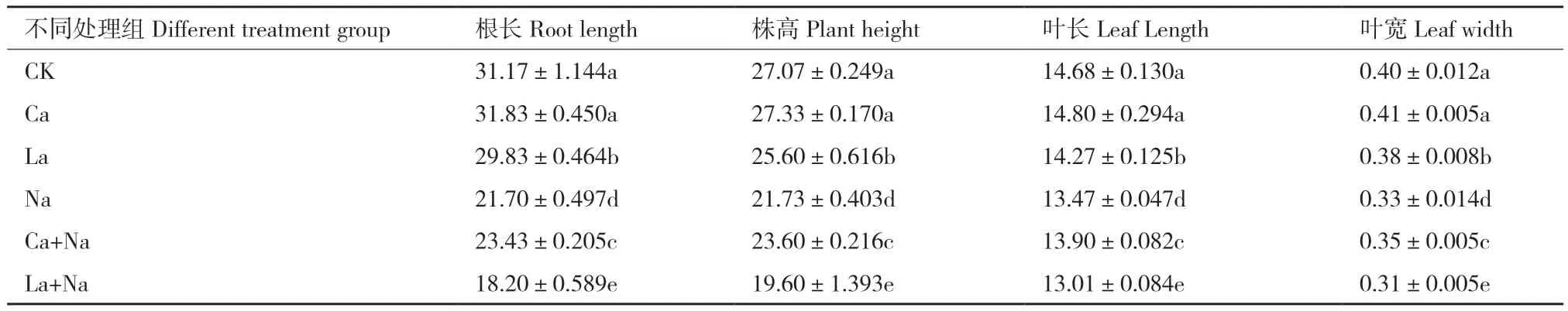
表3 外源Ca2+ 对NaCl胁迫下小麦幼苗根长、株高、叶长、叶宽的影响Table 3 Effects of exogenous Ca2+ on the root length, plant height, leaf length and leaf width of wheat seedlings under NaCl stress cm
2.3 外源Ca2+对NaCl胁迫下小麦幼苗TaCDPK27表达量的影响
CDPK作为钙依赖蛋白激酶,其基因表达量与植物体内Ca2+浓度有密切联系。外源施加CaCl2和LaCl3处理144 h后,通过RT-qPCR检测正常生长及NaCl胁迫下小麦幼苗根和叶片中TaCDPK27表达情况。与对照组相比,NaCl处理后小麦幼苗根和叶片中TaCDPK27表达量均显著上调;外源Ca2+处理促进NaCl胁迫下小麦幼苗根和叶片中TaCDPK27表达量显著上调,但对正常生长小麦幼苗根和叶片中TaCDPK27表达量无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组小麦幼苗根和叶片中TaCDPK27表达量均显著下调(图4)。
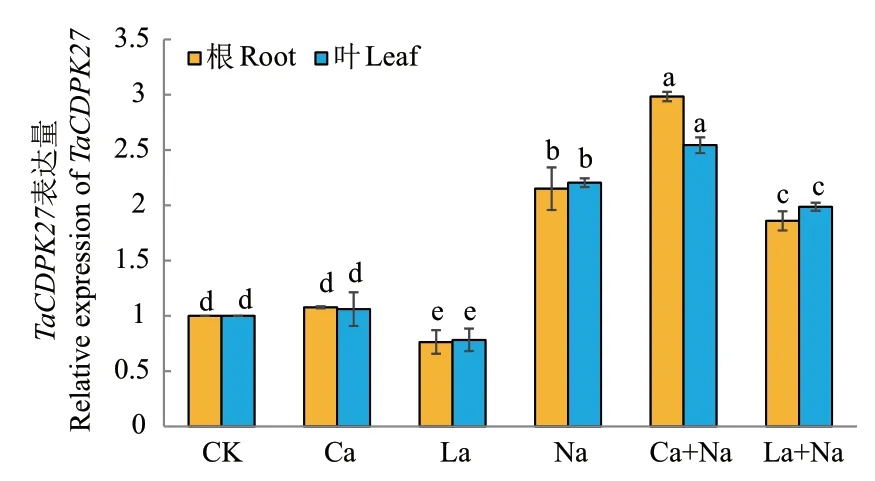
图4 外源Ca2+对NaCl胁迫下小麦幼苗根和叶片中TaCDPK27表达情况的影响Fig. 4 Effects of exogenous Ca2+ on TaCDPK27 expression in the roots and leaves of wheat seedlings under NaCl stress
2.4 外源Ca2+对NaCl胁迫下小麦幼苗细胞自噬活性的调控
2.4.1 MDC染色检测小麦幼苗细胞自噬活性 为探究NaCl胁迫对小麦幼苗细胞自噬活性的调控,通过MDC染色对细胞自噬活性进行持续检测。分别对NaCl处理0、3、6、12、24、48、72、96、120和144 h的小麦幼苗根进行自噬活性检测,结果(图5)显示,NaCl处理3 h小麦幼苗根细胞有自噬现象发生,到6 h自噬小体显著增多,NaCl持续处理12、24和48 h自噬小体无显著变化,自噬活性处于稳定状态,72 h自噬小体开始减少,到120 h自噬小体最少,自噬活性最低。然而NaCl继续处理144 h时,自噬小体显著增多,细胞自噬活性再次升高。鉴于NaCl处理6和144 h,小麦根中自噬小体显著增多,因此,选择这两个处理时间进一步检测Ca2+对NaCl胁迫下小麦幼苗细胞自噬活性的影响。
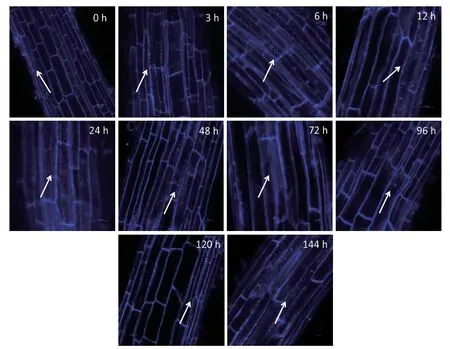
图5 MDC染色检测NaCl胁迫下小麦幼苗根中自噬小体(标尺=100 µm)Fig. 5 Autophagy activity of wheat seedling roots under NaCl stress detected by MDC staining(Bar=100µm)
为探究外源Ca2+对NaCl胁迫下小麦幼苗细胞自噬活性的调控,外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理6和144 h后,对小麦幼苗根进行MDC染色。NaCl处理6 h时,与对照组相比,NaCl胁迫下小麦幼苗自噬小体增多,自噬活性增强;外源施加CaCl2和LaCl3对正常生长小麦幼苗自噬活性无显著影响;对NaCl胁迫下小麦幼苗进行CaCl2处理后自噬小体显著增多,进行LaCl3处理后,自噬小体显著减少。说明外源Ca2+促进NaCl胁迫6 h小麦幼苗适度自噬,有助于细胞修复NaCl胁迫危害(图6-A)。NaCl处理144 h时,与对照组相比,NaCl胁迫下小麦幼苗根细胞自噬小体增多,自噬活性增强;外源施加CaCl2和LaCl3对正常生长小麦幼苗自噬活性无显著影响;对NaCl胁迫下小麦幼苗进行CaCl2处理后根自噬小体显著减少,进行LaCl3处理后,自噬小体显著增多(图6-B)。为进一步验证此结果,对处理144 h小麦幼苗叶片细胞进行自噬活性检测,不同处理组细胞自噬活性变化与根细胞变化趋势保持一致(图7)。即外源Ca2+处理减弱小麦幼苗根和叶片细胞由于NaCl胁迫导致的自噬活性异常升高。

图6 MDC染色检测外源Ca2+ 对NaCl胁迫下小麦幼苗根自噬活性影响(标尺=100 µm)Fig. 6 Effects of exogenous Ca2+ on the autophagy activities of wheat seedling roots under NaCl stress by MDC staining(Bar=100 µm)

图7 MDC染色检测外源Ca2+ 对NaCl胁迫144 h小麦幼苗叶片自噬活性的影响(标尺=100 µm)Fig. 7 Effects of exogenous Ca2+ on the autophagy activities of wheat seedling leaves under NaCl stress at 144 h by MDC staining(Bar=100 µm)
2.4.2 RT-qPCR检测外源Ca2+对NaCl胁迫下小麦幼苗根和叶片TaATGs表达量变化 与对照组相比,NaCl处理导致小麦幼苗根和叶片中,TaATG2、TaATG7、TaATG5、TaATG8和TaATG10表达量均显著上调。外源Ca2+处理导致NaCl胁迫下小麦幼苗TaATG2、TaATG7、TaATG5、TaATG8和TaATG10表达量均显著下调,但对正常生长小麦幼苗TaATG2、TaATG7、TaATG5、TaATG8和TaATG10表达量无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组中小麦幼苗TaATG2、TaATG7、TaATG5、TaATG8和TaATG10表达量均显著上调(图8)。结果表明,外源Ca2+能抑制NaCl胁迫下小麦幼苗TaATGs的过量表达。

图8 RT-qPCR检测外源Ca2+对NaCl胁迫下小麦幼苗根和叶片中TaATGs表达的影响Fig. 8 Effects of exogenous Ca2+ on TaATGs expression in the roots and leaves of wheat seedlings under NaCl stress by RT-qPCR
2.5 外源Ca2+对NaCl胁迫下小麦幼苗根和叶片细胞活力的影响
2.5.1 伊文思蓝染色检测小麦幼苗根和叶片细胞活力 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理144 h,利用伊文思蓝染色检测小麦幼苗根和叶片细胞死亡情况。小麦幼苗根和叶片中细胞死亡变化趋势一致。与对照组相比,NaCl胁迫下小麦幼苗根和叶片死亡细胞增多;外源Ca2+处理显著减少NaCl胁迫下小麦幼苗根和叶片死细胞数量,但对正常生长小麦幼苗根和叶片细胞活力无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组小麦幼苗根和叶片中蓝色区域变大,死亡细胞明显增多(图9)。
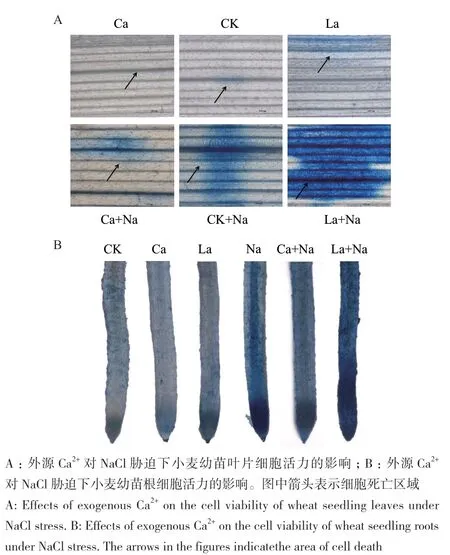
图9 伊文思蓝染色检测外源Ca2+对NaCl胁迫下小麦幼苗根和叶片细胞活力的影响(标尺=1 000 µm)Fig. 9 Effects of exogenous Ca2+ on cell viability in the roots and leaves of wheat seedlings under NaCl stress by Evans Blue staining(Bar=1 000 µm)
2.5.2 TUNEL染色检测外源Ca2+对NaCl胁迫下小麦幼苗根和叶片PCD的影响 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理144 h后,通过TUNEL染色检测小麦幼苗根和叶片PCD。小麦幼苗根和叶片PCD变化趋势一致。与对照组相比,NaCl胁迫导致小麦幼苗根和叶片PCD显著升高;外源Ca2+处理显著降低NaCl胁迫下小麦幼苗根和叶片PCD,但对正常生长小麦幼苗根和叶片PCD无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组小麦幼苗根和叶片PCD均显著升高(图10)。

图10 TUNEL染色检测外源Ca2+ 对NaCl胁迫下小麦幼苗根和叶片PCD的影响Fig. 10 Effects of exogenous Ca2+ on PCD in the roots and leaves of wheat seedlings under NaCl stress by TUNEL staining
2.6 外源Ca2+对NaCl胁迫下小麦幼苗根和叶片ROS的影响
2.6.1 DAB与NBT染色检测小麦幼苗根和叶片H2O2与O2·-积累 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理144 h后,分别用DAB和NBT染色检测H2O2和O2·-在小麦幼苗根和叶片中的累积情况。小麦幼苗根和叶片ROS累积变化趋势一致。与对照组相比,NaCl胁迫导致小麦幼苗根和叶片H2O2与O2·-累积量升高(图11);外源Ca2+处理显著降低NaCl胁迫下小麦幼苗根和叶片H2O2与O2·-的累积,但对正常生长小麦幼苗根和叶片H2O2与O2·-累积量无显著影响;外源施加LaCl3处理导致对照组和NaCl胁迫组小麦幼苗根和叶片H2O2与O2·-累积量均显著升高(图11)。

图11 DAB与NBT染色检测外源Ca2+对NaCl胁迫下小麦幼苗H2O2与O2·-累积量的影响(标尺=1 000µm)Fig. 11 Effects of exogenous Ca2+ on H2O2 and O2·- accumulation in wheat seedlings under NaCl stress by DAB and NBT staining(Bar=1 000 µm)
2.6.2 外源Ca2+对NaCl胁迫下小麦幼苗根和叶片H2O2与O2·-含量的影响 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理144 h后,对小麦幼苗根和叶片进行H2O2与O2·-含量检测。小麦幼苗根和叶片中H2O2、O2·-含量变化趋势一致。与对照组相比,NaCl胁迫导致小麦幼苗根和叶片H2O2与O2·-含量显著升高;外源Ca2+处理显著降低NaCl胁迫下小麦幼苗根和叶片H2O2与O2·-含量,但对正常生长小麦幼苗根和叶片H2O2与O2·-含量无显著影响;无论是对照组还是NaCl胁迫组,外源施加LaCl3处理后小麦幼苗根和叶片H2O2与O2·-含量均显著升高(图12)。
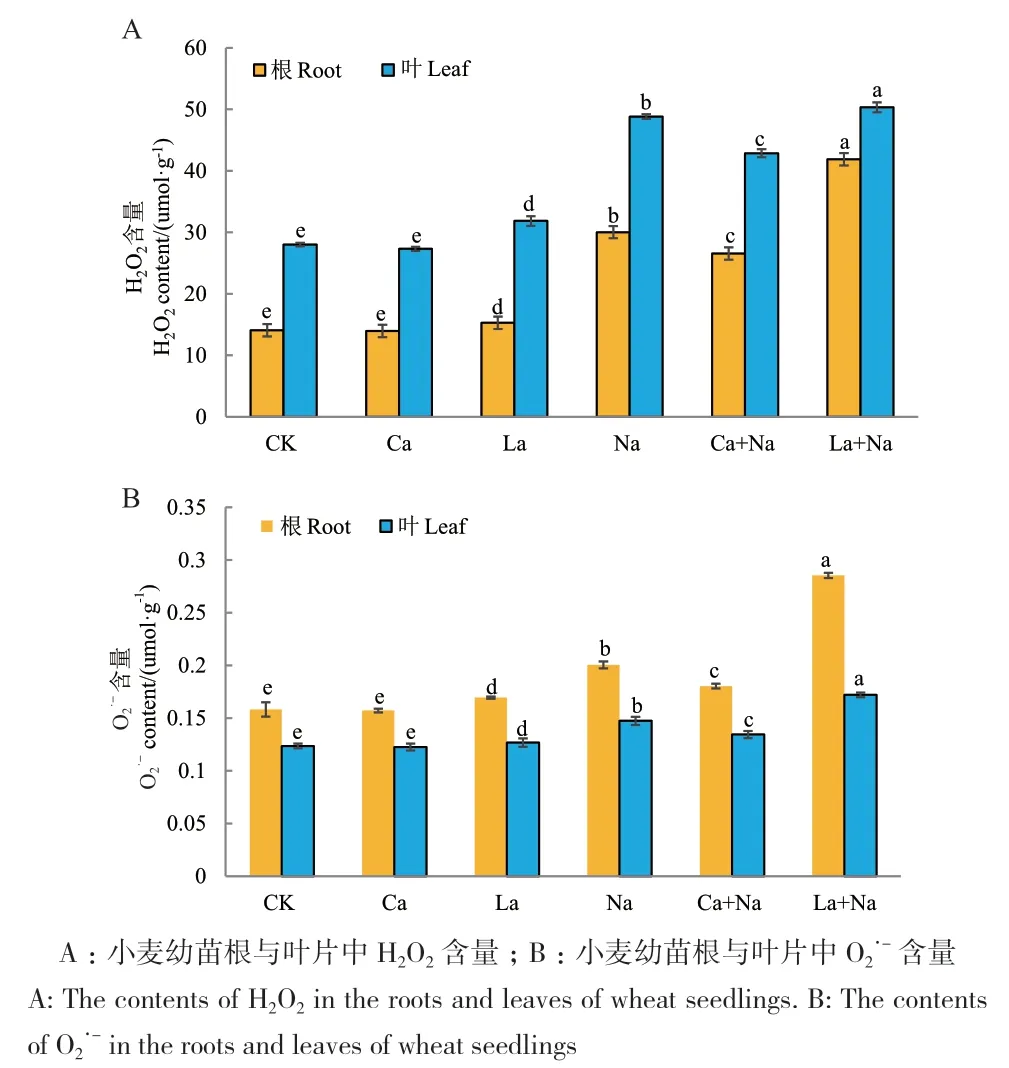
图12 外源Ca2+对NaCl胁迫下小麦幼苗根和叶片H2O2与O2·-含量的影响Fig. 12 Effects of exogenous Ca2+ on H2O2 and O2·- contents in the roots and leaves of wheat seedlings under NaCl stress
2.7 外源Ca2+对NaCl胁迫下小麦幼苗POD、SOD、CAT活性影响
外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗处理144 h后,检测小麦幼苗根和叶片POD活性。小麦幼苗根与叶片中POD活性变化趋势一致。与对照组相比,NaCl胁迫导致小麦幼苗根和叶片POD活性显著升高;外源施加CaCl2和LaCl3处理对正常生长小麦幼苗根和叶片POD活性无显著影响;外源Ca2+处理显著增加NaCl胁迫下小麦幼苗根和叶片POD活性,外源施加LaCl3处理则显著降低小麦幼苗根和叶片POD活性(图13)。

图13 外源Ca2+ 对NaCl胁迫下小麦幼苗根和叶片POD活性影响Fig. 13 Effects of exogenous Ca2+ on the POD activities of wheat seedlings under NaCl stress
小麦幼苗根与叶片中SOD、CAT活性变化趋势一致。与对照组相比,NaCl胁迫下小麦幼苗根和叶片SOD与CAT活性显著降低;外源Ca2+显著增加NaCl胁迫下小麦幼苗根和叶片中SOD与CAT活性,但对正常生长小麦幼苗根和叶片SOD、CAT活性无显著影响;外源施加LaCl3处理导致小麦幼苗根和叶片SOD、CAT活性显著降低(图14)。说明外源Ca2+处理增强NaCl胁迫下小麦幼苗抗氧化能力,减少NaCl胁迫对小麦幼苗的氧化损伤。
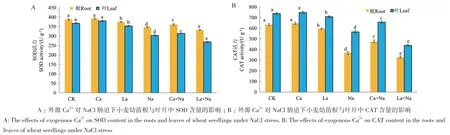
图14 外源Ca2+ 对NaCl胁迫下小麦幼苗SOD、CAT活性的影响Fig. 14 Effects of exogenous Ca2+ on the SOD and CAT activities of wheat seedlings under NaCl stress
2.8 外源Ca2+对NaCl胁迫下小麦幼苗PSII的影响
2.8.1 外源Ca2+对NaCl胁迫下小麦幼苗叶绿素荧光参数的影响 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗进行处理。在处理第5天和第10天(表4)分别测定不同处理组叶绿素荧光参数。不同处理组各项叶绿素荧光参数在处理第5天和第10天时变化趋势一致。与对照组相比,NaCl胁迫导致小麦幼苗叶绿素荧光参数Fv/Fm、Y(II)、qP、F0以及ETR均显著降低,使叶绿素荧光参数NPQ显著升高;外源Ca2+处理促进NaCl胁迫下小麦幼苗Fv/Fm、Y(II)、qP、F0以及ETR显著升高,导致叶绿素荧光参数NPQ显著降低,但对正常生长小麦幼苗叶绿素荧光参数无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组小麦幼苗各项叶绿素荧光参数变化与NaCl胁迫下各项参数变化趋势一致,即Fv/Fm、Y(II)、qP、F0和ETR均显著降低,叶绿素荧光参数NPQ显著升高。说明NaCl胁迫与LaCl3处理均降低小麦幼苗PSII活力,外源Ca2+处理能减弱NaCl胁迫对小麦幼苗PSII损伤。

表4 外源Ca2+对NaCl胁迫5 d和10 d小麦幼苗叶绿素荧光参数的影响Table 4 Effects of exogenous Ca2+ on the chlorophyll fluorescence parameters of wheat seedlings after 5 d and 10 d of NaCl stress
2.8.2 外源Ca2+对NaCl胁迫下小麦幼苗叶绿素含量的影响 外源施加CaCl2和LaCl3对正常生长及NaCl胁迫下小麦幼苗进行处理,在处理5和10 d分别取小麦幼苗进行叶绿素含量测定。结果(表5)显示,与对照组相比,NaCl胁迫后小麦幼苗叶绿素含量均显著降低;外源Ca2+处理显著增加NaCl胁迫下小麦幼苗叶绿素含量,但对正常生长小麦幼苗叶绿素含量无显著影响;外源施加LaCl3处理后,对照组和NaCl胁迫组中小麦幼苗的叶绿素含量均显著降低。

表5 外源Ca2+对NaCl胁迫下小麦幼苗叶绿素含量的影响Table 5 Effects of exogenous Ca2+ on the chlorophyll contents of wheat seedlings under NaCl stress
3 讨论
3.1 小麦幼苗对NaCl胁迫的生理响应及Ca2+缓解NaCl胁迫的生理机制
盐胁迫是严重影响作物生长及生产的主要非生物胁迫之一。当植物遭受盐胁迫时,其体内渗透压会产生变化,导致根吸水能力降低[27]。长时间的盐胁迫会抑制植物的离子转运和光合作用,最终造成叶片的衰老及死亡[28]。Ca2+作为植物体内第二大信使,广泛参与植物在各种生物胁迫和非生物胁迫下的信号传递,调控植物多种生理代谢过程[29]。NaCl胁迫能引起拟南芥幼苗体内胞质Ca2+浓度升高,Ca2+通道抑制剂LaCl3和Ca2+螯合剂EGTA均能抑制这种升高[30]。Ca2+信号被感受器感知后参与ABA信号转导途径,调节气孔运动以及NaCl胁迫相关基因的表达[31]。CDPK作为Ca2+感受器,可以直接被Ca2+激活,其表达量的变化可反映植物体内Ca2+浓度对胁迫的响应[32]。本研究结果显示,外源Ca2+可以缓解NaCl胁迫对小麦幼苗生长的抑制作用。NaCl胁迫下小麦幼苗根和叶片TaCDPK27表达量显著升高,且经CaCl2处理后其表达量同样具有上调趋势,而外源施加LaCl3处理后根和叶片TaCDPK27表达量显著下调。这些结果证明TaCDPK27参与调控外源Ca2+促进NaCl胁迫下小麦幼苗生长的过程。
NaCl胁迫下小麦的根和叶片中均产生过量ROS。其中H2O2和O2·-可以调节自噬和PCD[6]。H2O2和O2·-通过诱导自噬来缓解氧化胁迫。而植物体内的ROS产生的途径包括:来源于细胞膜结合的NADPH氧化酶和叶绿体[33]。Ca2+通过增强细胞膜通透性,加强细胞膜对离子的选择吸收能力,提高植物的抗氧化酶活性,降低ROS等有害物质对植物的伤害[34]。本研究也显示了相似的结论。外源Ca2+处理显著提高了NaCl胁迫下小麦幼苗中叶绿素含量以及促进光合作用的各种叶绿素荧光参数,增强其光合作用。同时,外源施加Ca2+导致NaCl胁迫下小麦幼苗中抗氧化酶SOD、CAT活性均显著升高,有效清除由于NaCl胁迫造成的ROS积累,降低NaCl对小麦幼苗的损害。这些结果暗示,Ca2+、NaCl胁迫引起的ROS积累,自噬、PCD和叶绿素荧光参数间存在复杂的内在联系。
3.2 外源Ca2+通过调控细胞自噬与PCD缓解NaCl胁迫对小麦幼苗的危害
细胞自噬是真核生物中高度保守的过程,通过该过程将细胞质中的异常细胞器或蛋白质隔离到双层膜的囊泡中,并传递到降解这些物质的细胞器中,从而达到回收大分子和确保细胞内稳态的目的[35]。逆境胁迫下,植物为维持体内稳态便会发生细胞自噬[36],但自噬活性异常升高会导致细胞死亡,降低植物体内细胞活力,增加PCD[37]。ATG在调控细胞自噬中具有重要作用。ATG能从自噬小体的形成、自噬活性监测等方面调控自噬活性。ATG2为定位于自噬前体液泡周围的点状蛋白,具有促进自噬小体延伸和闭合的作用;ATG7是自噬结合系统和自噬体形成所必需的蛋白,ATG10与ATG5同样作为参与自噬小体形成的关键因子之一,其表达量上调有助于促进细胞自噬[38];ATG8定位于自噬结构膜上,由于其特征性的自噬膜定位而成为监测自噬活性的重要靶标[39]。本研究中,NaCl胁迫导致小麦幼苗根细胞自噬,外源Ca2+处理能促进自噬以修复NaCl胁迫危害,维持细胞稳态;而长时间NaCl胁迫会导致小麦幼苗自噬活性异常升高,外源Ca2+通过抑制自噬活性异常升高以调控NaCl胁迫对小麦幼苗的危害。这一结果也通过小麦幼苗根和叶片关键TaATGs表达情况进行了验证,外源Ca2+处理能有效抑制由于NaCl胁迫144 h导致的小麦幼苗根和叶片中TaATG2、TaATG7、TaATG5、TaATG8和TaATG10表达量上调,从而降低细胞自噬活性,减少细胞凋亡。细胞中自噬活性升高会导致细胞凋亡[40]。
细胞凋亡是PCD的一种典型机制,在功能上与自噬不同[40]。在许多细胞类型和疾病条件下,激活自噬会抑制细胞凋亡,而抑制自噬则会激活凋亡过程[41]。在某些生理条件下,原本参与调节自噬的蛋白也可能诱导细胞凋亡。许多最终导致细胞凋亡的刺激也会在同一细胞中触发自噬。自噬首先发生,随着胁迫因子的持续存在,可能会导致细胞凋亡[35]。此结论在本研究中得到验证,当小麦幼苗持续遭受NaCl胁迫144 h时,根和叶片自噬活性异常升高导致细胞死亡,同时PCD也显著升高,细胞活力下降。外源Ca2+处理显著降低NaCl胁迫下小麦幼苗根和叶片死亡细胞及PCD。由于NaCl胁迫下小麦幼苗根和叶片细胞内Ca2+与Na+浓度增加,导致植株启动自身防御机制,发生细胞自噬,当NaCl胁迫持续144 h后,细胞内Na+持续积累,自噬活性异常升高,造成细胞死亡,且PCD升高,使小麦幼苗生长受到抑制;外源Ca2+对NaCl胁迫下小麦幼苗处理后,胞内Ca2+浓度升高导致其Na+浓度降低,NaCl对小麦幼苗的胁迫作用减轻,细胞内自噬小体适量减少,自噬活性降低,死亡细胞减少同时PCD下降,从而减弱NaCl胁迫对小麦幼苗的伤害。
4 结论
Ca2+通过调控小麦幼苗根和叶片的自噬水平限制PCD的规模,缓解NaCl胁迫对小麦幼苗的损伤。NaCl胁迫诱导小麦根和叶片自噬与Ca2+信号、氧化应激、光合反应之间存在着密切关系。