基于风水水肿大鼠模型的麻黄拆分组分的升降浮沉药性研究
张宇涵,徐瑞齐,曾梦楠,吴媛媛,叶珊,李本科,曹兵,冯卫生,夏永刚,郑晓珂(1.河南中医药大学,河南 郑州 450046;2.河南省中药开发工程技术研究中心,河南 郑州 450046;.黑龙江中医药大学,黑龙江 哈尔滨 150040)
升降浮沉是中药对疾病病势和病位所产生的作用趋向[1-2],是中药药性理论的重要组成部分。在中医药理论的指导下,构建符合现代科学认知规律的中药升降浮沉药性表征体系,阐释其科学内涵已经成为亟待解决的重要问题[3]。麻黄为麻黄科植物草麻黄(EphedrasinicaStapf)、中麻黄(EphedraintermediaSchrenk et C.A.Mey.)或木贼麻黄(EphedraequisetinaBge.)的干燥草质茎,具有发汗散寒、宣肺平喘、利水消肿的功效,常用于风寒感冒,胸闷喘咳,风水浮肿之症[4]。对麻黄进行本草考证[5-6]发现,历代中医药著作大多记载其药性“升浮”。本课题组前期对麻黄各化学拆分组分的四气五味药性进行了归属,麻黄生物碱组分味辛性温,而麻黄多糖组分味苦性凉(寒)[7-10]。一般认为,味属辛、甘,气(性)属温、热的药物多为升浮之性,味属苦、酸、咸,气(性)属寒、凉的药物多为沉降之性[11],由此推测麻黄生物碱药性属“升浮”,而多糖组分药性属“沉降”。目前尚未见有关麻黄升降浮沉药性物质基础的实验研究。因此,本研究拟基于课题组提出的中药升降浮沉药性理论的科学假说,开展麻黄各拆分组分对风水水肿大鼠模型的干预作用及药性归属研究,以期为阐明中药升降浮沉药性的科学内涵奠定实验基础。
1 材料
1.1 动物雄性SD 大鼠70 只,SPF 级,体质量180~220 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0011。本动物实验经河南中医药大学伦理委员会批准,动物伦理批文号:DWLL2018080003。
1.2 药物及试剂麻黄,购自鄂托克前旗九康中药材开发有限责任公司,经河南中医药大学董诚明教授鉴定为麻黄科植物草麻黄EphedrasinicaStapf 的干燥草质茎;通宣理肺丸(批号:19015355),北京同仁堂股份有限公司同仁堂制药厂。阿霉素(盐酸多柔比星,批号:2006E1),深圳万乐药业有限公司;肌酐(CER,货号:C011-2-1)、尿素氮(BUN,货号:C013-2-1)、尿蛋白(UP,货号:C035-2-1)、一氧化氮(NO,货号:A013-2-1)检测试剂盒,南京建成生物工程研究所;尿微量白蛋白(MAU,货号:EEL-R0025c)、免疫球蛋白E(IgE,货号:E-ELR0517c)、γ 干扰素(IFN-γ,货号:E-EL-R0009c)、白细胞介素4(IL-4,货号:E-EL-R0014c)、胃动素(MTL,货号:E-EL-R0639c)、生长抑素(SST,货号:E-EL-R00914c)、胃泌素(GT,货号:E-ELR0472C)ELISA 测定试剂盒,武汉伊莱瑞特生物科技股份有限公司;PE Annexin V 凋亡检测试剂盒(批号:559763),美国BD Biosciences 公司;DCFH-DA荧光探针(批号:CA1410),北京索莱宝科技有限公司。
1.3 仪器OFT-100 型大小鼠实验分析系统,成都泰盟软件有限公司;YLS-1B 型多功能大鼠自主活动记录仪、YLS-8A 型多功能诱咳引喘仪,济南益延科技发展有限公司;iMark 酶标仪,美国Bio-Rad 公司;Vevo®2100 型小动物多普勒超声诊断仪,加拿大VisualSonics 公司;大鼠代谢笼装置,江苏苏州冯氏实验动物有限公司;Flow Sight 单细胞分析仪,美国Merck 公司;KQ-500E 型超声波清洗器,昆山市超声仪器有限公司;Centrifuge 5810 小型高速低温冷冻离心机,德国Eppendorf 公司;TMC 恒温孵育器,合肥艾本森科学仪器有限公司。
2 方法
2.1 药物制备麻黄水煎液:麻黄水煎液剂量根据成人临床用量以体表面积率折算,大鼠的等效剂量为成人用量的28倍。取麻黄1 kg,加入10倍量蒸馏水,煎煮2 次,每次0.5 h,用16 层纱布过滤后,得麻黄水煎液;浓缩干燥后,计算浸膏提取率为15.9%。每次取4.46 g 浸膏配制60 mL 受试药液,每毫升药液相当于0.467 g 麻黄原药材。麻黄多糖和生物碱组分的拆分按照参考文献[4]中麻黄性味物质基础的拆分方法进行。麻黄生物碱组分(提取率为1.1%):取麻黄生物碱提取物308.88 mg 溶于60 mL 蒸馏水中。麻黄非生物碱组分(提取率为4.6%):取麻黄非生物碱组分1 291.68 mg 溶于60 mL 蒸馏水中。麻黄多糖组分(提取率为5.9%):取麻黄多糖组分1 656.72 mg 溶于60 mL 蒸馏水中。通宣理肺丸:取通宣理肺丸33.6 g,加入60 mL蒸馏水中,超声混匀。
2.2 模型复制、分组及给药将70 只SD 大鼠适应性喂养1 周后,按体质量随机挑选10 只作为正常组,其余大鼠作为造模组;造模组分别于第1、8 天尾静脉注射阿霉素4 mg·kg-1和3.5 mg·kg-1,正常组注射等量的生理盐水。将造模后的大鼠置于钢丝笼中,调节电扇风速为2.5 m·s-1,湿度为40%±5%,进行吹风刺激4 d,每天4~6 h;正常组大鼠置于钢丝笼中,不做吹风处理。造模组以大鼠出现四肢浮肿、恶风、弓背、毛松、喷嚏、流涕、小便减少等症状为造模成功[14-16]。将造模成功的大鼠随机分为模型组、生物碱组(51.48 mg·kg-1)、非生物碱组(215.28 mg·kg-1)、多糖组(276.12 mg·kg-1)、麻黄组(麻黄水煎液4 670 mg·kg-1)及通宣理肺丸组(阳性药组,4 326 mg·kg-1)。灌胃给药体积为10 mL·kg-1,正常组和模型组给予同体积蒸馏水,每日1 次,连续给药21 d,期间自由进食、饮水。
2.3 氨水诱咳实验观察大鼠咳嗽状况给药30 min后,将大鼠置于多功能诱咳引喘仪内,用25%氨水喷雾诱咳15 s 后取出,以大鼠腹肌收缩同时张嘴为标准,记录大鼠的咳嗽潜伏期及2 min 内的咳嗽次数。
2.4 汗腺分泌功能测定给药30 min后,以仰卧位固定大鼠,用棉签蘸取无水乙醇拭去大鼠足后跖污物及汗液;待无水乙醇挥发干燥后,均匀涂上和田-高原氏A 液(2 g 碘溶于100 mL 无水乙醇中);待其充分干燥后,再涂一层和田-高原氏B液(25 g可溶性淀粉溶于50 mL 蓖麻油中),及时观察足跖部紫色着色点的变化。
2.5 自主活动次数测定使用大鼠自主活动记录仪记录大鼠的自主活动次数,实验在安静的环境下进行。给药30 min 后,将大鼠放入暗箱内,适应5 min 后开始记录5 min内大鼠的自主活动次数。
2.6 睡眠时间测定每只大鼠腹腔注射10%水合氯醛溶液(300 mg·kg-1),以翻正反射消失作为入睡判断标准,以翻正反射再现为睡眠结束,计算大鼠的睡眠维持时间。
2.7 旷场实验评估大鼠自主活动情况在安静环境下将动物放入旷场活动实验系统的方箱底面中心,同时进行摄像和计时,5 min 后停止实验。在每次实验结束后,清理并擦拭方箱,以避免前一次实验留下的任何气味干扰下一次实验。实验结束后,量化处理大鼠运动总距离,评价大鼠的自主活动情况。
2.8 大鼠超声心动图检测采用小动物超声心动仪检测大鼠的心功能指标。将大鼠麻醉后以仰卧位固定于解剖板上,进行胸前脱毛;在大鼠胸前(心脏正上方)涂上适量超声耦合剂,将超声探头置于左侧胸部;取左室长轴切面,在B-Model 下调节图像深度,进行M-Model超声测量;取3个连续心动周期,测量心率(HR)、心输出量(CO)、左心室射血分数(LVEF)及左心室短轴缩短率(LVFS)的均值。
2.9 胃残留率、小肠推进率检测末次给药后,大鼠禁食12 h 后,再分别灌胃2 mL 半固体糊(0.5 g 羧甲基纤维素钠溶于100 mL 蒸馏水中,向其中加入10 g活性炭,搅拌均匀);30 min 后麻醉大鼠,开腹,结扎胃贲门和幽门后,取出胃及整段大小肠;测量幽门至回盲肠部全长,以及黑色半固体糊的推进距离;将胃切下后,测定胃全质量,然后沿胃大弯剪开胃体,洗去内容物后擦干,测定胃净质量。计算:小肠推进率(%)=推进距离/小肠全长×100 %;胃残留率(%)=[(胃全质量-胃净质量)/2 mL 半固体糊的质量]×100%。
2.10 样本收集及检测末次给药后,将大鼠置于代谢笼中(禁食不禁水),收集给药后12 h 的尿液;计量后分装于10 mL 离心管中,以3 500 r·min-1(离心半径=12.2 cm)离心10 min,留取上清液即为尿液样本。然后麻醉大鼠,暴露胸腔,剥离气管周围组织;将无菌24G 套管针轻轻插入气管内,使用棉线结扎;用1 mL 注射器吸取生理盐水(1 mL)注入肺部,并反复抽吸,将支气管肺泡灌洗液(BALF)置于离心管中,重复操作4 次;将BALF 以3 000 r·min-1(离心半径=12.2 cm)离心15 min,收集上清液。腹主动脉采血后,剖取心、肝、脾、肺、肾组织,称质量后计算各脏器系数。样本储存于-80 ℃备用。
严格按照试剂盒说明书步骤操作,分别检测尿液中UP、MAU 水平;BALF 中IL-4、INF-γ、IgE 水平;血清中CRE、BUN、NO 水平;血浆中MTL、GT、SST水平。
2.11 流式细胞术检测肺组织细胞凋亡及其活性氧(ROS)水平将新鲜的肺组织置于1.5 mL 离心管中,加入1 mL PBS,剪切成1 mm3小块;用PBS 洗涤2 次,并以4 ℃、1 500 r·min-1(离心半径=12.2 cm)离心2 min 后,弃去上清液。将切碎的肺组织用胰蛋白酶在室温下消化25 min,加入少量血清终止消化;使用PBS冲洗组织,并通过70 μm过滤器过滤收集细胞。严格按照试剂盒说明书步骤操作,使用PE Annexin V细胞凋亡检测试剂盒(Annexin V-PE/7-AAD双染法)检测肺组织细胞的凋亡情况;使用DCFHDA荧光探针检测肺组织细胞的ROS水平。
2.12 HE 染色法观察相关组织病理变化分别取大鼠右肺前叶、右肾组织、右侧腋下皮肤组织,于4%多聚甲醛溶液中固定24 h;经乙醇梯度脱水、二甲苯透明、石蜡包埋,切成3~5 μm 薄片;组织切片经二甲苯脱蜡、乙醇梯度洗脱后,常规HE 染色;无水乙醇洗脱细胞,二甲苯脱水透明,中性树胶封片;在光学显微镜下观察各组织病理变化并进行病理评分。
2.13 统计学处理方法采用SPSS 20.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用Dunnett-t检验;以P<0.05 为差异有统计学意义。
3 结果
3.1 麻黄拆分组分对风水水肿模型大鼠体质量及脏器系数的影响与正常组比较,模型组大鼠的体质量增长缓慢,肺脏、肾脏系数明显升高(P<0.05,P<0.01),心、肝、脾脏系数无明显差异(P>0.05);与模型组比较,各给药组大鼠体质量均有不同程度增长,但各组脏器系数无明显差异(P>0.05)。
3.2 麻黄拆分组分对风水水肿模型大鼠呼吸系统的影响
3.2.1 麻黄拆分组分对风水水肿模型大鼠咳嗽潜伏期及咳嗽次数的影响 结果见图1。与正常组比较,模型组大鼠的咳嗽潜伏期显著缩短(P<0.01),咳嗽次数显著增多(P<0.01)。与模型组比较,各给药组大鼠的咳嗽潜伏期显著延长(P<0.01),咳嗽次数显著减少(P<0.05,P<0.01),其中生物碱和多糖组分的效果接近麻黄。

图1 各组大鼠的咳嗽潜伏期及咳嗽次数(±s,n=6)Figure 1 Cough incubation period and cough frequency of rats in each group(±s,n=6)
3.2.2 麻黄拆分组分对风水水肿模型大鼠肺组织病理变化的影响 结果见图2。正常组大鼠的肺泡结构正常,肺泡壁完整,周围及腔内未见炎症细胞浸润。与正常组比较,模型组大鼠的肺泡壁增厚,肺泡上皮细胞发生脱落,且伴有明显的炎症细胞浸润,局部出现腔内血管扩张充血,病理评分显著升高(P<0.01)。与模型组比较,各给药组大鼠的肺泡壁肿胀减轻,肺泡内炎症细胞浸润及上皮细胞脱落现象有所缓解,病理评分显著降低(P<0.05,P<0.01),其中生物碱组分的改善效果最接近麻黄。

图2 各组大鼠的肺组织病理学观察(HE 染色,×200;±s,n=6)Figure 2 Lung histopathological observation of rats in each group(HE staining,×200;±s,n=6)
3.2.3 麻黄拆分组分对风水水肿模型大鼠BALF 中炎症因子水平的影响 结果见图3。与正常组比较,模型组大鼠BALF 中的IL-4、IgE 水平显著升高(P<0.01),IFN-γ 的水平显著降低(P<0.01)。与模型组比较,各给药组大鼠BALF 中的IL-4、IgE 水平显著降低(P<0.05,P<0.01),IFN-γ 的水平显著升高(P<0.05,P<0.01),其中生物碱组分的改善效果最接近麻黄。

图3 各组大鼠支气管肺泡灌洗液中的炎症因子水平(±s,n=6)Figure 3 Levels of inflammatory factors in bronchoalveolar lavage fluid of rats in each group(±s,n=6)
3.2.4 麻黄拆分组分对风水水肿模型大鼠肺组织细胞凋亡及ROS 水平的影响 结果见图4。与正常组比较,模型组大鼠肺组织细胞的凋亡率及ROS 水平显著升高(P<0.01)。与模型组比较,各给药组大鼠肺组织细胞的凋亡率及ROS 水平显著降低(P<0.01),作用效果为生物碱组分>多糖组分>非生物碱组分。

图4 各组大鼠肺组织细胞的凋亡情况及活性氧(ROS)水平(±s,n=3)Figure 4 Apoptosis and reactive oxygen species(ROS)levels of lung tissue cells in each group(±s,n=3)
3.3 麻黄拆分组分对风水水肿模型大鼠泌尿系统的影响
3.3.1 麻黄拆分组分对风水水肿模型大鼠发汗水平及排尿量的影响 结果见图5。与正常组比较,模型组大鼠的足趾汗腺着色点数无明显变化(P>0.05),排尿量显著降低(P<0.01)。与模型组比较,麻黄组、生物碱组、多糖组及通宣理肺丸组大鼠的足趾汗腺着色点数显著增多(P<0.05,P<0.01),麻黄组、生物碱组及通宣理肺丸组大鼠的排尿量显著增加(P<0.01)。HE 染色结果显示,正常组大鼠腋下皮肤可见正常腺体,腺体呈管状分布,汗管不扩张,汗腺上皮细胞排列紧密,未见分泌现象。在给予麻黄及生物碱组分干预30 min 后,观察到大鼠腋下皮肤汗腺导管及腺体扩张,空泡发生率较高,腺上皮细胞胞浆丰富,分泌旺盛;多糖组分次之,而非生物碱及通宣理肺丸的作用效果不明显。

图5 各组大鼠的发汗水平、排尿量及腋下皮肤组织病理切片(±s,n=6)Figure 5 The level of sweating,urine output and pathological section of axillary skin tissue of rats in each group(±s,n=6)
3.3.2 麻黄拆分组分对风水水肿模型大鼠肾损伤的影响结果见图6。与正常组比较,模型组大鼠血清CRE、BUN 水平及尿液UP、MAU 水平均显著升高(P<0.05,P<0.01)。与模型组比较,各给药组大鼠的血清CRE 水平无明显变化(P>0.05),尿液UP 水平显著降低(P<0.05,P<0.01);麻黄组、生物碱组、多糖组及通宣理肺丸组大鼠的血清BUN 水平及尿液MAU 水平显著降低(P<0.05,P<0.01)。HE 染色结果显示,正常组大鼠的肾小球结构清晰,细胞以规则、结构完整的方式排列,无明显病理变化。与正常组比较,模型组大鼠肾小球发生肿胀,肾小球基底膜及肾小囊增厚,压迫毛细血管袢,并与之发生粘连,肾小管扩张且排列紊乱,管腔内偶见蛋白管型,肾皮质或间质中偶见炎性细胞浸润。与模型组比较,麻黄及其生物碱组分可以不同程度改善风水水肿模型大鼠的肾脏病理变化,而多糖、非生物碱组分及通宣理肺丸改善效果次之。

图6 各组大鼠的血清、尿液生化指标及肾脏组织病理切片(±s,n=6)Figure 6 Serum and urine biochemical parameters and renal tissue pathological sections of rats in each group(±s,n=6)
3.4 麻黄拆分组分对风水水肿模型大鼠中枢系统的影响
3.4.1 麻黄拆分组分对风水水肿模型大鼠自主活动次数及睡眠时间的影响 结果见图7。与正常组比较,模型组大鼠的睡眠时间明显延长(P<0.05),自主活动次数显著减少(P<0.01)。与模型组比较,各给药组大鼠的自主活动次数显著增加(P<0.01),麻黄组、生物碱组及通宣理肺丸组大鼠的睡眠时间显著缩短(P<0.05,P<0.01)。
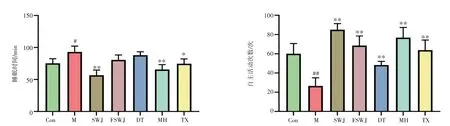
图7 各组大鼠的自主活动次数及睡眠时间(±s,n=5)Figure 7 The number of autonomic activities and sleep time of rats in each group(±s,n=5)
3.4.2 麻黄拆分组分对风水水肿模型大鼠活动状态的影响 结果见图8。与正常组比较,模型组大鼠的活动总距离显著缩短(P<0.01)。与模型组比较,麻黄组、生物碱组、多糖组及通宣理肺丸组大鼠的活动总距离显著延长(P<0.05,P<0.01)。其中生物碱组分的改善效果最为明显且接近麻黄,提示麻黄生物碱组分的药性偏升浮。

图8 各组大鼠的活动状态及活动总距离(±s,n=6)Figure 8 Activity state and total distance of activity of rats in each group(±s,n=6)
3.5 麻黄拆分组分对风水水肿模型大鼠消化系统的影响结果见图9。与正常组比较,模型组大鼠的胃残留率显著升高(P<0.01),小肠推进率及血浆MTL、GT 水平显著下降(P<0.01),血浆SST 水平无明显变化(P>0.05)。与模型组比较,麻黄多糖组大鼠的胃残留率显著降低(P<0.01),小肠推进率及血浆GT水平显著升高(P<0.01);非生物碱组大鼠的血浆SST 水平明显升高(P<0.05)。结果提示,麻黄多糖组分的药性偏沉降。
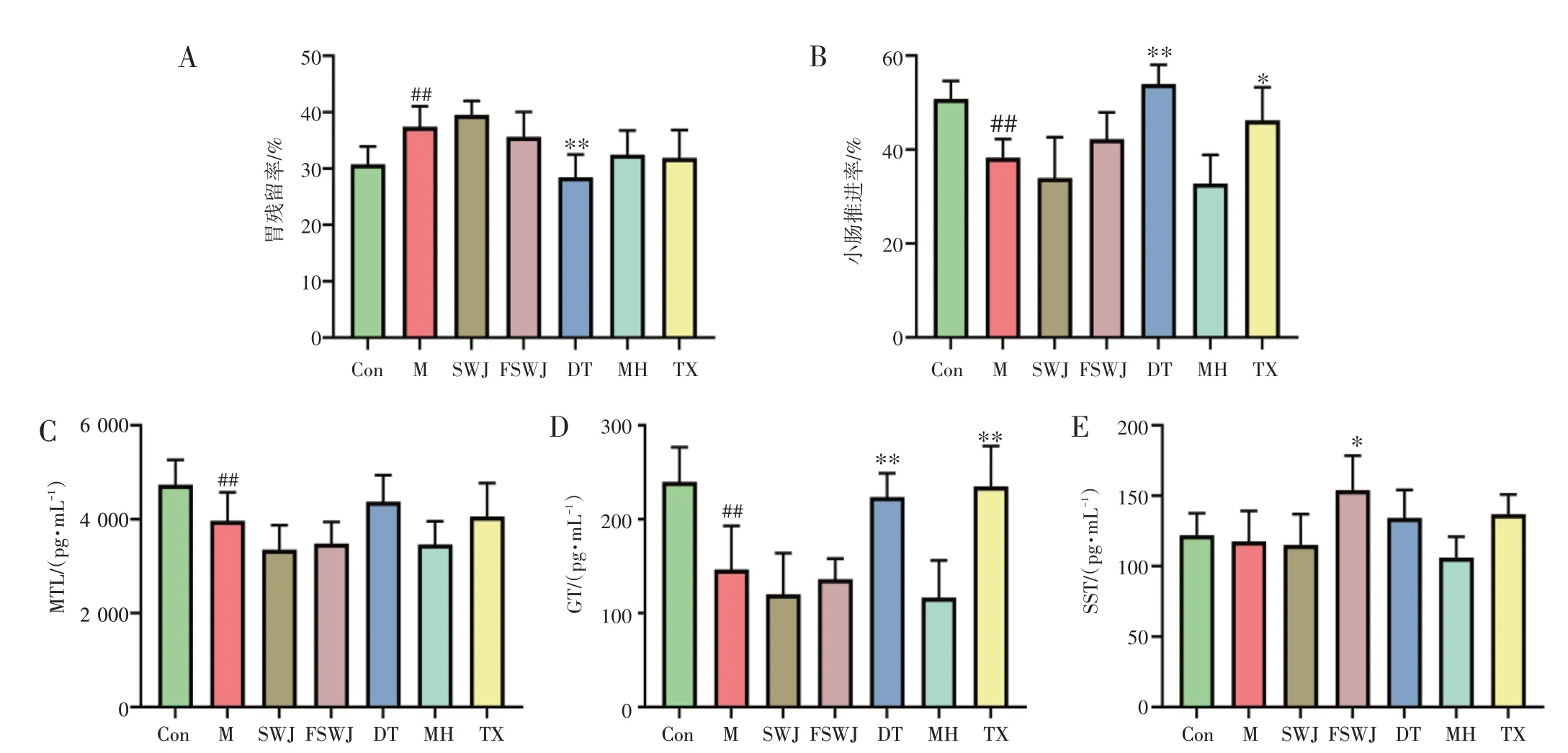
图9 各组大鼠的胃肠运动指标及血浆胃肠激素水平(±s,n=6)Figure 9 The gastrointestinal motility parameters and plasma gastrointestinal hormone levels of rats in each group(±s,n=6)
3.6 麻黄拆分组分对风水水肿模型大鼠循环系统的影响结果见图10。与正常组比较,模型组大鼠的血清NO 水平显著降低(P<0.01),心功能指标LVEF、LVFS 有下降的趋势,但差异无统计学意义(P>0.05)。与模型组比较,给药组大鼠的血清NO水平明显升高(P<0.05,P<0.01),生物碱组大鼠的心脏LVFS明显升高(P<0.05)。

图10 各组大鼠的血清NO 水平及心脏功能指标(±s,n=6)Figure 10 Cardiac function parameters and serum NO level of rats in each group(±s,n=6)
4 讨论
风水的病因病机是卫气不固,外感风邪,风邪犯肺。故肺的宣发肃降失常,导致营卫不和,进一步引起津液的布散失常,则产生“水肿”。《金匮要略》中记载:“诸有水者……当发其汗乃愈……当利小便乃愈”,以“发汗”和“利尿”为治疗原则。麻黄性温,味苦辛,具有“发汗解表,宣肺平喘,利水消肿”之功效,为“发汗解表之要药”,即麻黄的功效与风水水肿的治疗原则一致,并且符合“病位在表者宜升浮不宜沉降”的治疗原则,因此采用麻黄治疗风水水肿之症是可行的。通过查阅文献发现,升降浮沉药性与机体的五大系统(中枢系统、消化系统、呼吸系统、泌尿系统、循环系统)密切相关[12-13,17-18]。因此,本研究基于升降浮沉药性理论假说[3],设计了兼有表证的风水水肿大鼠模型,通过检测五大系统相关指标,同时选择以麻黄为主要调节气机药物的临床常用方剂通宣理肺丸为阳性对照药,观察了麻黄各组分对风水水肿模型大鼠的改善效果,从而明确麻黄升降浮沉药性的物质基础。
《景岳全书·肿胀》中指出:“凡水肿等证……其本在肾,其标在肺……故凡治肿者必先治水,治水者必先治气,若气不能化,则水必不利”[19-20]。而肺为水之上源,主气,司呼吸,既能宣发卫气,调节腠理开合,将代谢后的津液化为汗液排出体外;又能肃降肺气,将体内水液向下输送,经肾和膀胱的气化作用而生成尿液排出体外[21]。因此,当肺功能失调时,首先影响的是呼吸系统,其次还会影响泌尿系统。在本研究中,通宣理肺丸及麻黄生物碱、非生物碱和多糖三种组分均能不同程度地缓解模型大鼠的咳嗽症状,降低肺细胞凋亡及其ROS 水平,并且降低BALF 中炎症因子IL-4、IgE 水平,改善肺组织病理损伤状况,其中以麻黄生物碱组分的效果更接近麻黄。除此之外,研究还发现,生物碱组分能够增加风水水肿模型大鼠的排汗量和排尿量,具有显著的“发汗、利尿”功效,作用与麻黄相似;另外,生物碱和多糖组分还可以显著降低模型大鼠的血清BUN 及尿液UP、MAU 水平,显著改善大鼠的肾脏病理损伤,治疗水肿之症。结果提示,麻黄生物碱组分可能通过肺气宣发、发汗解表来改善风水水肿之症,“肺气宣发”有外行趋表,轻浮宣散之势,趋向于外;“发汗”功效在于疏风解表,趋势由内而外,均体现“浮”之药性。肺气不宣,吸气功能减弱,会导致供氧不足而呼吸短促,进而影响中枢系统的功能[22]。麻黄的3 种组分均可不同程度减少风水水肿模型大鼠的睡眠时间,增加自主活动次数和活动总距离,其中生物碱的作用最接近于麻黄。肺清肃之性不顺,影响肠道功能,进而会影响整个消化系统功能[23]。麻黄的多糖组分能显著降低风水水肿模型大鼠的胃残留率,提高小肠推进率以及血浆GT 水平;而生物碱组分在一定程度上表现出抑制胃肠运动,这可能与生物碱组分的升浮药性有关;多糖组分促进胃肠运动提示其有向下的作用趋势,表明多糖组分具有一定的沉降药性。麻黄生物碱组分可以升高风水水肿模型大鼠的LVFS,有改善其心脏功能的作用趋势,但整体效果不太明显。因此,麻黄可能通过发汗、利尿和改善肾脏损伤来治疗风水大鼠的水肿之症,其发挥“升浮”药性的物质基础可能是生物碱组分,发挥“沉降”药性的物质基础可能是多糖组分,二者组合到一起可同时体现升浮和沉降的药性,提示麻黄的升降浮沉药性是可拆分或组合的。
综上所述,麻黄生物碱组分可宣发肺气、发汗解表,作用趋向于外;能兴奋神经中枢,抑制胃肠运动,作用趋向于上。麻黄多糖组分可促进胃肠运动,作用趋向于下。结果表明,麻黄生物碱组分药性属“升”,多糖组分属“降”,同时可能也是麻黄发挥“宣发肺气、发汗解表、利水消肿”功效的物质基础。

