非小细胞肺癌患者衰弱特点及其影响因素
闫沛,张娟,杨卫华,殷鹏,王治海
(山西省肿瘤医院·中国医学科学院肿瘤医院山西医院·山西医科大学附属肿瘤医院:1药学部,3呼吸内科,太原 030013;2山西省中医院肾内一科,太原 030012;4山西省心血管病医院药学部,太原 030024)
局部晚期和转移性非小细胞肺癌(non-small cell lung cancer,NSCLC)具有高度异质性,预后也差,但基因组生物标志物靶向治疗显著提高了表皮生长因子受体(epidermal growth factor receptor,EGFR)突变阳性非鳞状 NSCLC的无进展生存(progression free survival,PFS),美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐奥希替尼用作一线治疗,尽管中位PFS达到18.9个月,耐药还是无法避免,NCT04304638试验研究结果表明酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)联合局部放疗可使Ⅳ期NSCLC寡转移患者PFS显著改善。50%以上的晚期肺癌发病年龄在65岁及以上,2022年国家癌症中心报告指出癌症新发病例峰值年龄为60~79岁。老年NSCLC患者不仅面临PFS和总生存(overall survival,OS)长短问题,还由于身体机能老化,器官功能衰退,合并其他慢性疾病导致生理储备能力下降、易损性增加,即处于衰弱状态,国内早有研究建议通过进行老年综合评估(comprehensive geriatric assessment,CGA)来鉴别该群体衰弱状况[1],作为选择后续个体化治疗方案的依据。CGA可评估老年人的肌少症、躯体和认知功能损伤、负性精神心理状态等老年综合征,旨在筛选出从个体化治疗方案中潜在获益的老年患者并对症干预、保护其功能。老年8项(geriatric 8,G8)筛查是专为老年癌症患者开发、对老年综合征快速评估以鉴别衰弱的工具。研究表明近50%治疗中老年癌症患者发生衰弱或处于衰弱前期,对其积极筛查、干预意义重大。
本研究旨在使用G8工具分析不可手术Ⅲ~Ⅳ期EGFR突变阳性非鳞状NSCLC老年患者联合治疗后发生衰弱的影响因素,为采取针对性治疗和康复措施延缓衰弱,最大化该群体自身功能的独立性提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2020年6月至2021年12月于山西省肿瘤医院首次进行序贯化放疗联合靶向治疗的Ⅲ期和局部放疗联合靶向治疗的Ⅳ期EGFR突变阳性、非鳞状NSCLC患者的临床资料,包括姓名、年龄、性别、文化程度、癌症病理分期、治疗方案、合并疾病(高血压、脑血管疾病、心肌梗死、糖尿病、慢性阻塞性肺疾病、肝脏疾病、消化道疾病、其他疾病);靶向维持治疗3个月后的血生化指标白蛋白(albumin,ALB)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、肌酐(creatinine,Cre)、胱抑素C(cystatin C,CysC)、疼痛数字评分(numerical rating scale,NRS)、经彩色多普勒超声或计算机断层扫描(computed tomography,CT)检查是否发生静脉血栓栓塞(venous thromboembolism,VTE)、深静脉血栓评分(Caprini)、抑郁筛查量表评分(patient health questionnaire 9,PHQ-9)及G8评分。根据G8评分(≤14分为衰弱,>14分为非衰弱),将患者分成衰弱组(197例)和非衰弱组(41例)。
纳入标准:(1)年龄≥65岁;(2)依据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版肺癌临床分期系统,通过增强CT或胸部增强核磁共振成像(magnetic resonance imaging,MRI)或纤维支气管镜或经皮肺叶穿刺取活检或抽胸水取脱落细胞经病理组织学检查,初次确诊为非鳞状NSCLC Ⅲ~Ⅳ期;(3)经免疫组织化学法检测EGFR基因19号外显子缺失突变,21号外显子L858R点突变;(4)只接受非手术治疗,Ⅲ期NSCLC一线方案序贯化放疗及维持至少3个月奥希替尼靶向治疗,Ⅳ期NSCLC靶向治疗方案同上,并依据个体情况及病灶数量、位置、大小联合进行常规分割或短期高剂量立体定向放疗(stereotactic body radiotherapy,SBRT),无论后期是否进行免疫治疗;(5)患者意识清楚,本人或家属能记录并叙述其自身精神心理状态、生活日常状况,自愿接受相关研究项目评估。排除标准:(1)合并或继发于其他恶性肿瘤;(2)既往有化疗史及禁忌证;(3)入院期间没有遵医嘱导致治疗中断;(4)治疗前已有VTE病史;(5)治疗后心肝肾功能严重异常或死亡;(6)随访中断致资料不完整无法完成评估;(7)患者因精神疾病无法准确完成评估。本研究获得山西省肿瘤医院伦理委员会批准(202211),研究对象均知情同意。
1.2 方法
1.2.1 治疗方案 EGFR突变阳性非鳞状不可手术Ⅲ期NSCLC治疗方案:患者进行序贯化放疗,先诱导化疗2周期。卡铂(齐鲁制药股份有限公司,H20020180)+培美曲塞(齐鲁制药股份有限公司,H20060672)静脉滴注,每个周期21d。具体用法为卡铂:药时曲线下面积(area under the curve,AUC)=5mg/(ml·min),d1;培美曲塞:500mg/m2,d1,共800~1000mg。放疗方案为对原发病灶进行根治性适形调强放疗(intensity-modulated radiation therapy,IMRT),总剂量60~66Gy,持续6~7周,共30~33次,每日常规分割照射1.8~2.0Gy/次。完成后再进行2周期化疗,方案同上。化放疗结束后口服甲磺酸奥希替尼(阿斯利康制药公司,HJ20170167,80mg/片)靶向维持治疗,每次80mg,1次/d。Ⅳ期NSCLC治疗方案:靶向治疗方案同上,寡转移患者同步对局限性病灶进行根治性SBRT,依据寡转移的位置、大小确定放疗方案;非寡转移患者同步进行个体化姑息放疗。
1.2.2 NRS评分 NRS使用一条等分成10段的直线,0到10分代表疼痛程度不同,由患者评估自身的疼痛。0分表示无痛,10分表示无法忍受的剧烈疼痛,分值越高,疼痛越剧烈。
1.2.3 Caprini量表 Caprini量表是重要的评估患者发生VTE风险的模型,包括一般资料、VTE病史、其他病史等40个风险因素,依据不同因素对发生VTE影响的不同,给每个因素从1~5分赋值,总分1~2分为低风险,3~4分为中风险,5~9分为高风险,>9分为极高风险。高风险及以上需联合药物预防和物理预防。
1.2.4 PHQ-9量表 PHQ-9由9个自评项目组成,每个项目按程度由轻到重分为“没有”“有几天”“一半以上时间”“几乎每天”,对应0~3分。总分越高,抑郁越严重,0~4分代表没有抑郁,5~9分代表可能有轻微抑郁,10~14分代表可能有中度抑郁,15~19分代表可能有中重度抑郁,20~27分代表可能有重度抑郁。
1.2.5 G8工具 G8能快速对老年癌症患者综合评估,反映其衰弱状态,可作为选择治疗方案及患者能否从中获益的依据。G8由营养状态、体质量下降、躯体活动能力、精神心理状态、体质量指数、服用药物数量、对自我健康评估、年龄8个项目构成,每个项目有2~4个条目,每个条目对应0~3分,代表损伤由重到轻,总分0~17分,临界值为14分,得分≤14分为功能受损,视为衰弱,分值越低,受损衰弱越严重,灵敏度为85%,特异度为65%。
1.2.6 质量控制 两名评估人员经培训熟悉问卷及评估工具,一人依纳入标准在患者靶向治疗3个月后对其或家属采取一问一答方式,另一人记录结果。另两名研究人员依据纳入名单查阅患者病历收集资料。本调查共完成244份问卷,6份因回答不完整或病历中就本研究关注的内容记录不全被剔除,最终回收238份问卷,回收率为97.5%。
1.3 统计学处理

2 结 果
2.1 两组患者基线资料比较
患者的年龄为(75.03±6.83)岁。衰弱组高龄、共病、Caprini评分高危及以上患者比例高于非衰弱组;合并VTE患者比例低于非衰弱组;抑郁评分、NRS评分、胱抑素C水平高于非衰弱组;G8评分水平低于非衰弱组,差异均有统计学意义(均P<0.05;表1)。
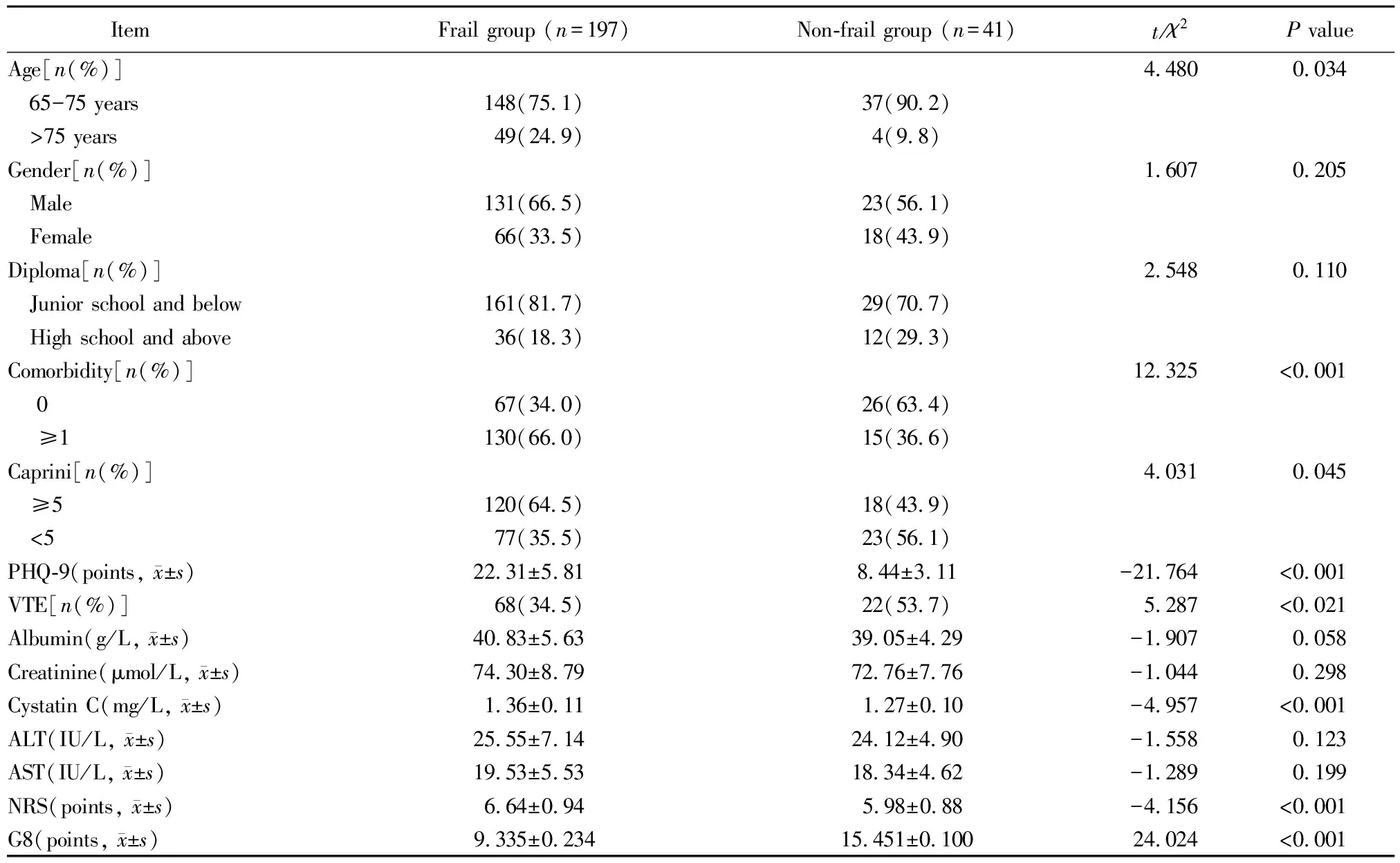
表1 两组患者基线资料比较
患者治疗前至少合并1种慢性病者145例,分别为高血压68例、心肌梗死36例、脑血管疾病28例、糖尿病32例、慢性阻塞性肺疾病13例、肝脏疾病8例、其他疾病7例。治疗后即本研究开始时合并发生VTE的病例90例(至少合并1处VTE),其中双上肢至少一侧发生深静脉血栓27例,双下肢至少一侧发生深静脉血栓46例,颈内静脉发生血栓32例,肺栓塞8例(表2)。
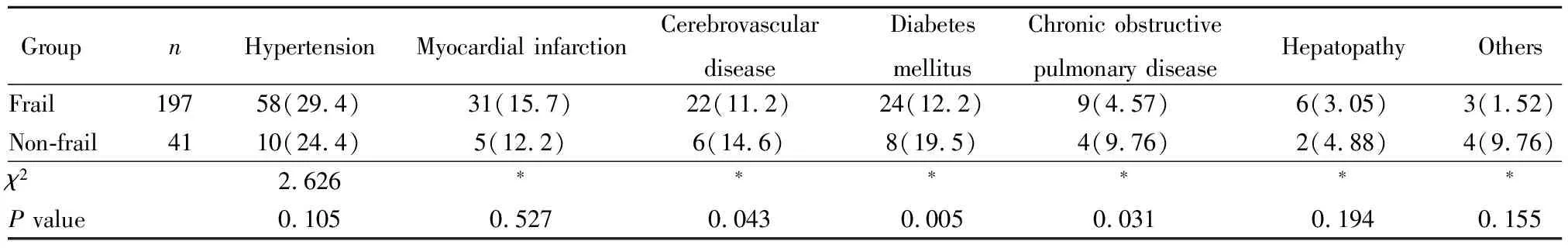
表2 两组合并慢性病情况比较
2.2 logistic回归分析老年NSCLC患者衰弱的影响因素
以衰弱状况为因变量(衰弱1,非衰弱0),以单因素分析中差异有统计学意义的变量为自变量,进行logistic回归分析,结果显示,年龄、抑郁评分、NRS评分、共病、胱抑素C及合并VTE为老年不可手术Ⅲ~Ⅳ期EGFR突变阳性非鳞状NSCLC衰弱的危险因素(表3)。
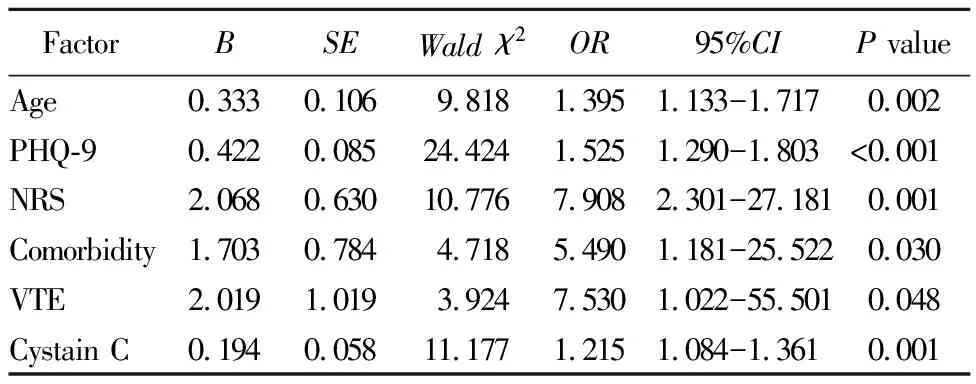
表3 logistic回归分析老年NSCLC患者衰弱的影响因素
3 讨 论
联合奥希替尼的治疗方案显著提高了局部晚期和转移性EGFR阳性非鳞状NSCLC患者的PFS,但除此以外的既往研究多关注治疗相关毒副作用,如间质性肺炎、凝血功能紊乱、血栓栓塞等,较少研究治疗后的衰弱综合征,其实老年癌症患者衰弱发生率较高。NCCN姑息治疗(V1.2021)指出晚期癌症患者在治疗中及以后存在快速进展的生理功能下降,包括肌少症、认知缺损和躯体活动能力严重降低、由疼痛、绝望、丧失社会身份等带来的精神、心理问题、共病导致多重药物治疗产生的肝肾功能损伤。NCCN生存者(V1.2020)主张对癌症治疗后进行CGA并尽早干预。NCCN老年肿瘤学(V1.2020)推荐用G8工具对老年癌症患者进行CGA。G8评分是影响70岁及以上老年肺癌患者总生存期的危险因素[2]。Cavusoglu等[3]研究显示G8对老年实体肿瘤患者衰弱和潜在肌少症的灵敏度达93.33%,特异度达86.89%,已广泛用于评估肺癌[2]、乳腺癌[4]老年患者生存状况。
增龄伴随各种损伤累积影响老年人机体多个系统,导致应激性下降,促进衰弱发生。陈菲菲等[5]研究发现,年龄是老年肺癌患者衰弱的危险因素。本研究结果也显示年龄是老年NSCLC患者衰弱的危险因素,年龄每增加1岁,衰弱风险增加1.395倍。Agemi等[2]研究表明80岁及以上的老年肺癌患者衰弱比例显著高于80岁以下,针对高龄患者采取保护措施延缓衰弱尤为必要。
抑郁是老年人发生认知障碍的危险因素[6],也是本研究中老年NSCLC患者衰弱的危险因素,与既往关于化疗癌症患者衰弱的研究结果一致[7]。Oude Voshaar等[8]研究中,患者较高的衰弱评分意味着更低的抑郁症缓解率。目前抑郁引发衰弱和二者互相影响的机制不明确,但二者存在共同的病理基础,如线粒体功能障碍、脑白质病变、慢性炎症等[9]。
Rodríguez-Sánchez等[10]研究中,老年人衰弱风险随疼痛强度和发生频率增高而上升,重度疼痛患者衰弱风险是轻度疼痛的2.39倍,本研究中疼痛是老年NSCLC患者衰弱的危险因素,可能与患者长期服用阿片类镇痛药[11]、机体对疼痛敏感性增加、耐受力下降并处于炎症状态导致血浆中C反应蛋白、白细胞介素-6(interleukin 6,IL-6)炎症因子升高[12]、血清皮质醇水平改变有关[13]。Chen等[14]研究结果显示慢性疼痛是衰弱的危险因素。缓解疼痛对改善该群体衰弱状况意义重大,韩晓燕等[15]已在化疗中联合125I放射性粒子植入达到该目标。
Salako等[16]研究中26.9%的癌症患者合并至少1种慢性非传染疾病(高血压、糖尿病、消化性溃疡等),本研究中共病是老年NSCLC患者衰弱的危险因素。Woo等[17]研究也显示共病和多重用药是导致老年患者衰弱的危险因素。《亚太区老年衰弱管理临床实践指南》[18]建议医师对70岁及以上、尤其共病导致多重用药的老年慢性病患者进行衰弱筛查、干预、管理,参考2019版Beers标准甄选治疗药物、优化治疗方案,使老年患者治疗收益最大化。
老年NSCLC患者肾功能同时存在生理和病理性减退,既往有关其衰弱与肾功能下降关系的研究较少,对二者关系的研究集中于慢性肾脏病患者[19]。宋良晨等[20]研究中,老年男性慢性肾脏病患者肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)<45ml/(min·1.73m2)的患者衰弱率比eGFR≥60ml/(min·1.73m2)的患者增加1.02倍,本研究中血清胱抑素C水平是老年NSCLC患者衰弱的危险因素,也表明老年患者衰弱与肾功能下降关系密切。
本研究中衰弱组合并VTE的患者比例明显高于非衰弱组,logistic回归分析显示合并VTE是老年NSCLC患者发生衰弱的危险因素。既往研究中靶向治疗是晚期肺癌并发VTE的危险因素[21],衰弱老年癌症患者与非衰弱者相比,VTE风险增加30%[22,23],这可能与衰弱者多个生理系统机能储备降低有关[22]。Soysal等[24]研究表明VTE风险增加也可能是由于衰弱者血管壁损伤,血小板计数、D-二聚体、IL-6升高,纤维原蛋白降解产物增多。积极监测该群体外周血凝血功能、炎症因子水平,针对性服用抗凝药物预防VTE发生,可降低衰弱风险。
国内对老年肺癌患者衰弱的研究较少,但衰弱是影响该群体生存期的重要因素。Dai等[25]meta分析显示,衰弱是肺癌患者死亡率和治疗毒性的重要预测因子,癌症和衰弱应被等同重视,辨识并科学干预管理衰弱不仅能维持其各项生理功能,还减轻患者家庭支出,提高生存质量。本研究仍存在单中心、没有在整个治疗期持续评估的不足,今后研究应使用改进的专业量表或新的生物标志物评估衰弱。García-Sánchez等[26]研究已通过雌激素酮、芳香化酶活性指数等生物标志物联合衰弱量表分析影响绝经后乳腺癌患者衰弱的影响因素,为今后研究提出方向。

