MsWRKY33转录调控MsACS2影响紫花苜蓿耐盐性的研究
李心 武敬也 陈菲儿 樊璐 马琳 王学敏

doi:10.11733/j.issn.1007-0435.2024.01.006
引用格式:
李 心, 武敬也, 陳菲儿,等.MsWRKY33转录调控MsACS2影响紫花苜蓿耐盐性的研究[J].草地学报,2024,32(1):54-65
LI Xin, WU Jing-ye, CHEN Fei-er,et al.Effects of Transcriptional Regulation of MsACS2 by MsWRKY33 on Salt Tolerance of Alfalfa[J].Acta Agrestia Sinica,2024,32(1):54-65
收稿日期:2023-05-29;修回日期:2023-10-29
基金项目:国家自然科学基金(31872410);财政部和农业农村部:国家现代农业产业技术体系(CARS-34);科技部、财政部、国家科技资源共享服务平台(NCGRC-2023-63)资助
作者简介:
李心(1998-),女,汉族,河南焦作人,硕士研究生,主要从事饲草遗传育种方向研究,E-mail:18513988633@163.com;*通信作者Author for correspondence,E-mail:wangxuemin@caas.cn;malin@caas.cn
摘要:乙烯作为重要的植物激素之一,在植物逆境胁迫应答中发挥重要作用。ACS基因是乙烯合成过程中的关键限速酶(ACC合成酶)基因,本研究通过探究紫花苜蓿MsWRKY33转录因子对ACS基因的调控关系,为MsWRKY33参与紫花苜蓿耐盐胁迫响应的具体调控机制奠定理论基础。利用同源克隆、载体构建、酵母单杂交、酵母双杂交、qRT-PCR等技术,验证MsWRKY33对AtACS2和MsACS2的转录调控,并对盐胁迫下转基因株系中MsACS2表达模式进行分析。结果显示:MsWRKY33转录因子可以与W-box元件特异性结合,且对AtACS2和MsACS2具有转录调控作用;MsWRKY33转基因株系中MsWRKY33基因的表达量显著高于对照,转基因株系中MsACS2的表达是在MsWRKY33基因大量表达后呈上升趋势,进一步说明紫花苜蓿MsACS2基因的表达可能受MsWRKY33转录因子的正向调控。因此,紫花苜蓿受到盐胁迫时可诱导MsWRKY33的表达,MsWRKY33转录因子通过正向调控MsACS2表达,可能影响乙烯合成,从而影响紫花苜蓿的盐胁迫响应。
关键词:紫花苜蓿;酵母单杂交;MsWRKY33;MsACS2;耐盐性
中图分类号:S541.9 文献标识码:A 文章编号:1007-0435(2024)01-0054-12
Effects of Transcriptional Regulation of MsACS2 by
MsWRKY33 on Salt Tolerance of Alfalfa
LI Xin, WU Jing-ye, CHEN Fei-er, FAN Lu, MA Lin*, WANG Xue-min*
(Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
Abstract:Ethylene,as one of the important plant hormones,plays an important role in plant stress response. The ACS gene is a key rate limiting enzyme (ACC synthase) gene in the ethylene synthesis process. In this study,we laid a theoretical foundation for understanding the specific regulatory mechanism of MsWRKY33 participating in salt-tolerant response of alfalfa by exploring the regulatory relationship of MsWRKY33 transcription factor on ACS gene. We used homologous cloning,vector construction,Y1H,Y2H,qRT-PCR and other techniques to verify the transcriptional regulation of MsWRKY33 on AtACS2 and MsACS2,meanwhile,analyzed the expression pattern of MsACS2 in transgenic lines under salt stress. The results showed that the MsWRKY33 transcription factor could specifically bind to the W-box element and had transcriptional regulatory effects on AtACS2 and MsACS2;The expression level of MsWRKY33 gene in the transgenic lines was significantly higher than that in the control. The expression of MsACS2 in transgenic lines showed an increasing trend after the large amount of MsWRKY33 gene expression,further indicating that the expression of MsACS2 gene in alfalfa might be positively regulated by the MsWRKY33 transcription factor. The results indicated that the expression of MsWRKY33 could be induced when alfalfa was subjected to salt stress. The MsWRKY33 transcription factor might affect ethylene synthesis and salt stress response of alfalfa by positively regulating the expression of MsACS2.
Key words:Alfalfa; Yeast One-Hybridization technique; MsWRKY33; MsACS2; Salt tolerance
紫花苜蓿(Medicago sativa L.)有“牧草之王”的美称,是全国乃至世界上种植面积最大的牧草,其产量和品质兼优,营养价值极高,具有改良土壤盐渍化[1-2]、丰富土壤有机质等功效。土壤盐渍化是影响作物产量和品质的主要非生物胁迫因子之一[3],目前,全世界超过1.0×109 hm2的土地受到盐碱地的影响,而中国的盐碱土面积也达到了1.0×108 hm2[4]。我国紫花苜蓿的产业发展深受土壤盐渍化的制约[5]。
乙烯被称为植物应激激素,植物在受到盐胁迫时体内会产生大量乙烯[6-7]。植物激素乙烯(ethylene)是1种气体小分子(C2H4),不仅参与植物的众多发育过程,如种子萌发、细胞伸长、组织分化、叶片和花的衰老脱落、果实成熟等[8-9],还参与植物对生物胁迫和非生物胁迫等多种应答反应[10-12]。乙烯合成有两个关键步骤:第1步是ACC合成酶(ACS)将s-腺苷-甲硫氨酸(SAM)转化为1-氨基-环丙烷-1-羧酸(ACC),第2步是ACC氧化酶(ACO)将ACC氧化裂解并生成乙烯[6,19-20]。ACS被认为是乙烯生物合成过程中的关键限速酶,所以ACC合成酶的活性直接关系到乙烯的含量,ACS的调控对乙烯的生物合成至关重要。拟南芥ACS5和ACS7基因在盐胁迫下均能受到显著诱导[5],烟草(Nicotiana tabacum L.)NtACS1基因在盐胁迫下也能被诱导表达[15],乙烯和乙烯前体物ACC能显著增加拟南芥的耐盐性[16]。乙烯可通过促进ROS的清除来调节植物对盐胁迫的应答,如乙烯通过影响RBOHF介导的ROS和Na+/K+平衡来提高拟南芥的耐盐性[17]。乙烯处理或EIN3的活化可以通过直接调控POD的表达来增强过氧化物酶的活性,从而阻止过量ROS的积累,提高了植物对盐胁迫的耐受性[18]。基因转录水平的调控是植物应答各种信号刺激的重要过程,当植物受到胁迫时,会产生一系列的信号激活特定转录因子与顺式作用元件结合从而启动基因的表达使植物对逆境做出反应[21]。
WRKY转录因子作为最大的转录因子家族之一,参与植物体内多种信号转导过程[22];WRKY转录因子蛋白家族所有成员都含有WRKY结构域,包括N端“WRKYGQK”序列和C端锌指型结构序列[23,24],根据WRKY结构域的数量和锌指结构的类型将WRKY转录因子分为3类[25]。在几乎所有受到WRKY转录因子蛋白调控的基因启动子区域中都能发现(T)(T)TGAC(C/T)这一保守结构,即为W-box。W-box是WRKY转录因子与目标基因特异性结合的区域,高度保守[24]。ACS2基因受到WRKY转录因子的调控,如Li等[26]通过ChIP-qPCR实验证明在拟南芥中WRKY33转录因子通过与ACS2和ACS6的启动子中的W-box结合从而调控ACS基因的表达;Chen等[27]通过ChIP实验证明在拟南芥中WRKY8转录因子可以与ACS6启动子中的W-box结合。
本课题在前期的研究中发现了1个包含2个WRKY结构域的紫花苜蓿WRKY33转录因子,该基因受盐胁迫诱导表达并过量累积,研究显示其可以通过与目标基因启动子区的W-box特异性结合,从而调控下游基因的表达[28];本研究前期通过构建过表达载体pCAMBIAI1300-MsWRKY33,利用农杆菌介导法获得过表达MsWRKY33紫花苜蓿株系,为了深入解析MsWRKY33参与紫花苜蓿耐盐胁迫的分子机制,我们利用RNA-seq技术对正常条件和盐胁迫条件下的非转基因(对照)和转基因株系进行了转录組分析。其中发现了1个ACS2类基因被显著上调。因此我们推测MsWRKY33可能通过转录调控激活ACS2基因的表达,从而影响植物体内乙烯的合成,进而可能参与紫花苜蓿对盐胁迫的响应。在植物受到盐胁迫时会诱导ACS基因表达以产生大量的乙烯,目前已有研究证明在拟南芥中WRKY转录因子可以通过与ACS基因启动子中W-box结合以诱导ACS的表达,如AtWRKY33可调控ACS2和ACS6基因的表达[26],AtWRKY8可调控ACS6的表达[27],AtWRKY29可调控ACS基因的表达[29],但在紫花苜蓿中却鲜有报道。我国紫花苜蓿产业深受土壤盐渍化制约,因此了解MsWRKY33对ACS基因的转录调控途径对于解析MsWRKY33转录因子参与紫花苜蓿耐盐胁迫的具体调控机制具有重要意义,也为紫花苜蓿耐盐性分子育种奠定了理论基础。本研究利用酵母单杂交技术验证MsWRKY33对ACS2的转录调控,旨在探究紫花苜蓿MsWRKY33转录因子调控MsACS2的机制,为紫花苜蓿耐盐性调控的分子机制解析奠定理论基础。
1 材料与方法
1.1 试验材料及试剂
紫花苜蓿‘中苜1号(Medicago sativa L.‘Zhongmu No.1)由中国农业科学院北京畜牧兽医研究所杨青川研究员惠赠;转基因MsWRKY33紫花苜蓿L3和L4是由本课题前期通过构建pCAMBIA1300-MsWRKY33过表达载体并利用农杆菌介导的方法转化‘中苜1号所获得的MsWRKY33紫花苜蓿转基因株系,保存于本实验室。KOD-Plus,TaKaRa LA Taq酶、总RNA提取试剂盒、FastKing1步法除基因组cDNA第1链合成预混试剂盒均购自北京天根生化科技公司,零背景pTOPO-Blunt Simple平末端克隆试剂盒、Axyprep DNA凝胶回收试剂盒、EZ-HiFi无缝克隆试剂盒、Dh5α感受态和限制性内切酶购自北京康润诚业生物科技有限公司。
酵母单杂交所用诱饵载体pHiSi、猎物载体pGADT7和酵母YM4271保存于中国农业科学院北京畜牧兽医研究所,各种酵母培养基均购自成都远诺天成科技有限公司,Y1HGold感受态细胞购自北京庄盟国际生物基因科技有限公司。
试验中所用引物的合成和测序工作由北京擎科生物科技有限公司完成。
1.2 AtACS2和MsACS2基因启动子的克隆及顺式作用元件分析
在拟南芥数据库中(https://www.arabidopsis.org/)查询AtACS2基因序列,使用Primer 5.0软件设计克隆引物AtACS2-PRO-F和AtACS2-PRO-R(表1),使用LA Taq酶以拟南芥DNA为模板进行PCR扩增;根据AtACS2基因序列在紫花苜蓿数据库(https://www.alfalfatoolbox.org/)中查找紫花苜蓿的同源基因MsACS2,使用Primer 5.0软件设计基因启动子克隆引物MsACS2-PRO-F和MsACS2-PRO-R(表1),使用LA Taq酶以紫花苜蓿‘中苜1号为模板进行PCR扩增。将扩增出的基因片段进行纯化回收并构建T载体,送至北京擎科生物科技有限公司测序。
将获得的AtACS2,MsACS2基因启动子序列利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/)在线网站进行顺式作用元件分析。
1.3 诱饵载体的构建
设计含有EcoRI和SacI酶切位点的引物W-box-F/R,该引物包含3个串联重复的W-box(TTGACT);根据AtACS2基因启动子序列利用Primer5.0软件设计含有EcoRⅠ和SacⅠ酶切位点的引物pHiSi-AtACS2-F/R,根据MsACS2基因启动子序列利用Primer 5.0软件设计含有XmaI和XhoI酶切位点的引物pAbAi-MsACS2-F/R(表1)。使用KOD-Plus酶以pTOPO-AtACS2和pTOPO-MsACS2载体为模板进行PCR扩增。将pHiSi载体用EcoRⅠ和SacⅠ酶进行双酶切,pAbAi载体用XmaI和XhoI酶进行双酶切,将得到的片段和线性化载体进行纯化回收,使用EZ-HiFi无缝克隆试剂盒进行连接,转化Dh5α,涂布于LB(Amp)抗性平板,经菌液PCR验证出阳性克隆并送擎科北京公司生物科技有限测序。
1.4 猎物载体pGADT7-MsWRKY33的构建
提取紫花苜蓿‘中苜1号的总RNA,将RNA反转录为cDNA。根据紫花苜蓿MsWRKY33(GenBank登录号KP642130.1)的cDNA序列利用Primer5.0软件设计含有BamHⅠ和SacⅠ酶切位点的引物AD-MsWRKY33-F/R(表1),以紫花苜蓿总cDNA序列为模板进行PCR扩增,pGADT7载体用BamHⅠ和SacⅠ进行双酶切,将得到的片段和线性化载体进行纯化回收后使用EZ-HiFi无缝克隆试剂盒进行连接,转化Dh5α,涂布于LB(Amp)抗性板,经菌液PCR验证阳性克隆并送北京擎科生物科技有限公司测序。
1.5 酵母单杂交验证MsWRKY33和W-box的结合关系
将pHiSi和pHiSi-W-box用XhoI线性化后转入YM4271酵母菌株并涂布于SD/-His缺性培养基平板上,30℃倒置培养3~7天后,挑取平板上阳性酵母单克隆接入至液体培养基SD/-His中,30℃ 200 rpm培养至OD600=0.8,然后将菌液依次稀释10-1,10-2分别点至不同浓度的3-AT的SD/-His平板上,筛选可以抑制其自激活性的3-AT浓度。
按照表2将猎物载体和诱饵载体的不同组合转入酵母YM4271中,涂布于SD/-Leu/-Ura选择培养基上,30℃倒置培養3~7天后,挑取酵母单克隆接入液体培养基SD/-Leu/-Ura中,30℃ 200 rpm培养至OD600=0.8,将菌液依次稀释10-1,10-2点至SD/-Leu/-Ura/-His平板(含可以抑制其自激活性的合适浓度的3-AT),观察酵母生长状况并拍照。
1.6 酵母单杂交验证MsWRKY33和AtACS2启动子的结合关系
将pHiSi-AtACS2(1 ng,使用前用XhoI线性化)用醋酸锂-PEG法转入酵母菌株YM4271,具体方法同1.5,然后将成功转入质粒的酵母菌液依次稀释10-1,10-2并点至不同浓度3-AT的SD/-His平板上,筛选其可以抑制其自激活的3-AT浓度。
将pGADT7,pGADT7-MsWRKY33和pHiSi,pHiSi-AtACS2以两两组合的方式共转酵母YM4271,将成功转入质粒的酵母酵母菌液依次稀释10-1,10-2点至SD/-Leu-His-Ura(加入能够抑制其相应载体本底表达的合适浓度的3-AT),30℃倒置培养3~7天,观察其酵母生长状况。
1.7 酵母单杂交验证MsWRKY33和MsACS2启动子的结合关系
将pAbAi-MsACS2质粒5 μg用BstBI酶切4~6 h,用胶回收试剂盒进行纯化回收,利用醋酸锂-PEG法转化至Y1HGold感受态细胞(购自北京庄盟生物科技有限公司)。然后将成功转入质粒的酵母菌液依次稀释10-1,10-2并点至不同浓度AbA SD/-Ura平板上,筛选可以抑制其自激活的AbA浓度。
将含有pAbAi-MsACS2的Y1HGold酵母菌株制成感受态细胞,然后将pGADT7和pGADT7-MsWRKY33利用醋酸锂-PEG法转入酵母感受态中,待缺性平板上长出3 mm酵母单克隆即为含pAbAi-MsACS2,pGADT7和pAbAi-MsACS2,pGADT7-MsWRKY33质粒的酵母菌株,然后将菌液依次稀释10-1,10-2并点至含有可以抑制其本底表达的合适浓度的AbA SD/-Ura-Leu平板上,30℃倒置培养3~7天,观察酵母生长状况并拍照。
1.8 NaCl处理下的下游基因表达量分析
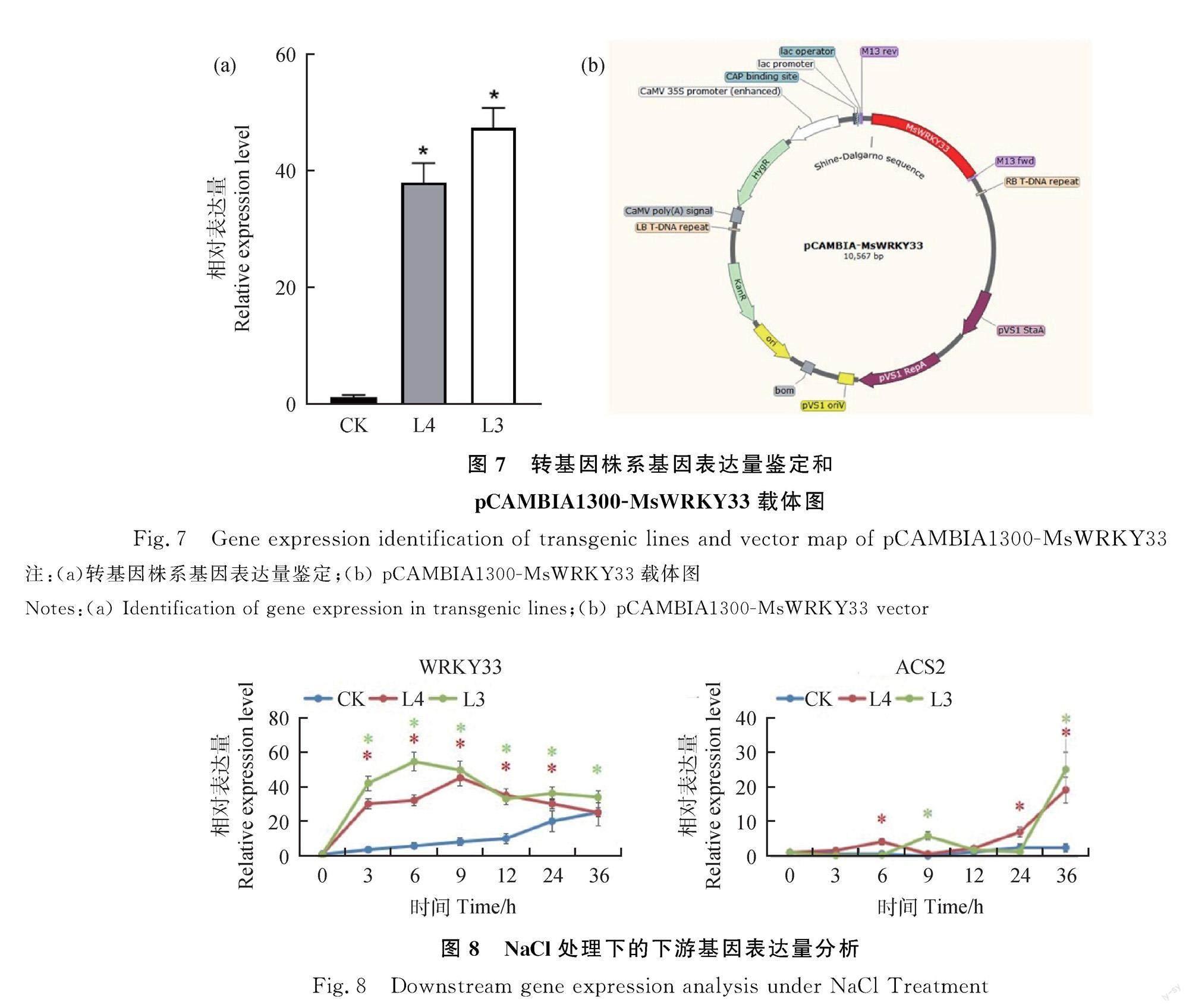
该课题前期通过构建过表达载体pCAMBIA1300-MsWRKY33,并利用农杆菌介导法获得过表达MsWRKY33紫花苜蓿株系L3和L4。取CK(非转基因株系),L3和L4(转基因株系)植株生长顶端叶片数片放于液氮冷冻并提取RNA,再将RNA反转录为cDNA,将得到的cDNA用无菌水进行稀释,使cDNA的终浓度至10 μg·μL-1,利用Primer 5.0软件设计特异性引物qMsWRKY33-F/R和Msactin-F/R(表1)。通过qRT-PCR对该课题前期保存的转基因MsWRKY33紫花苜蓿株系L3和L4进行基因表达量鉴定。
将MsWRKY33转基因株系(L3,L4)和非转基因株系(‘中苜1号)扦插扩繁,用塑料盖子覆盖3天后揭盖,等待生长3~4周后单株分苗,放置人工气候培养室中培养,刈割3~4次后选取长势一致的株系,统一浇200 mM NaCl溶液,在盐处理后的0,3,6,9,12,24和36 h对植株地上生长部分的叶片进行取样,每个时间点3次重复,液氮速冻,放于-80℃保存。
根据MsACS2和MsWRY33序列信息,设计qMsWRKY33-F/R,qMsACS2-F/R特异引物(表1)。按照总RNA提取试剂盒说明书提取样本RNA,利用FastKing1步法除基因组cDNA第1链合成预混试剂盒将RNA反转为cDNA。RT-PCR以cDNA(10 μg·μL-1)为模板,用GenStar公司的荧光定量试剂进行qRT-PCR扩增。以紫花苜蓿MsActin為内参基因,利用qRT-PCR法检测MsACS2和MsWRKY33在转基因株系和对照株系中的表达模式。扩增体系为:2×SYBR qPCR Mix 10 μL,F引物0.4 μL,R引物0.4 μL,cDNA 2 μL,ddH2O 7.2 μL;反应程序为:95℃预变性,60℃ 30 s,40个循环,分别设3个生物学重复,基因表达量的计算使用2-ΔΔCt法。
2 结果与分析
2.1 AtACS2和MsACS2基因启动子的克隆及其启动子中的顺式作用元件分析
在拟南芥网站(https://www.arabidopsis.org/)上查询基因AtACS2的启动子序列,在紫花苜蓿数据库中(https://www.alfalfatoolbox.org/)查找AtACS2的同源基因MsACS2序列,利用Premier 5.0软件设计基因启动子区域片段扩增引物(表1),经过PCR扩增后有清晰的条带(图1),且条带位置符合片段大小(AtACS2:2 013 bp;MsACS2:1 283 bp)。将扩增的条带进行切胶回收,胶回收后与pTOPO—Blunt-Simple载体连接,转化Dh5α感受态,挑选阳性克隆经测序均连接成功。
为了确定AtACS2和MsACS2潜在的生物学功能,将AtACS2和MsACS2基因启动子序列使用PlantCARE在线网站对基因启动子中的顺式作用元件进行预测(表3,表4)。两个基因的启动子中除了含有CAAT-box和TATA-box启动子必备核心元件、脱落酸响应元件ABRE和MYB识别元件外,还包括许多与植物抗逆有关的重要元件如GT1-motif防御应激元件TC-rich repeats,SA诱导元件As1/ocs,最重要的,包含能与MsWRKY33转录因子特异性结合的W-box元件,这说明AtACS2和MsACS2基因可能参与植物对逆境胁迫的响应,且这种响应可能受到WRKY转录因子的调控。
2.2 同源基因AtACS2,MsACS2蛋白序列比对
根据AtACS2基因序列在紫花苜蓿数据库中查找紫花苜蓿的同源基因MsACS2,使用DNAMAN软件对AtACS2和MsACS2基因的蛋白序列进行对比,AtACS2和MsACS2基因的蛋白序列相似度较高,AtACS2和MsACS2在氨基酸水平上相似度高达53.9%,说明AtACS2和MsACS2可能具有相似的生物学功能(图2)。
2.3 诱饵载体和猎物载体的构建
分别挑取pHiSi-AtACS2,pABAi-MsACS2和pGADT7-MsWRKY33单克隆菌斑进行菌液PCR验证,凝胶电泳结果显示扩增出的DNA片段大小与AtACS2,MsACS2和MsWRKY33基因片段大小相吻合(图3),经测序与序列对比分析后证明重组载体构建成功。
2.4 MsWRKY33与W-box结合活性分析
WRKY转录因子可以与靶基因启动子区域的W-box特异性结合,调控下游基因的表达,为证明MsWRKY33这一功能,本研究利用酵母单杂交技术开展了两者的结合活性分析。首先将W-box序列TTGACT设计合成3个串联重复序列,连接至pHiSi载体,并将构建成功的pHiSi-W-box载体转化至YM4271酵母感受态,将转化成功后的菌液点至不同浓度的3-AT SD/-His平板上,筛选可以抑制其本底表达的3-AT浓度,如图所示(图4a),菌液在3-AT浓度≤100 mM时可以正常生长,但在浓度达到150 mM后不能生长,因此确定可以抑制本底表达的3-AT浓度为150 mM。
进而,将pHiSi-W-box和pGADT7-MsWRKY33共转化至酵母YM4271,同时设置阴性对照组合:pHiSi+pGADT7,pHiSi+pGADT7-MsWRKY33,pHiSi-W-box+pGADT7,待转化成功后将酵母菌液点至含150 mM 3-AT浓度的SD/-His-Leu-Ura平板上。pGADT7-MsWRKY33与pHiSi-w-box共转化的酵母可以生长,而阴性对照组pHiSi+pGADT7,pHiSi-W-box+pGADT7,pHiSi+pGADT7-MsWRKY33酵母均无法生长。说明MsWRKY33转录因子能够与W-box顺式作用元件特异性结合(图4b)。
2.5 MsWRKY33与下游基因AtACS2启动子的结合活性分析
将pHiSi和pHiSi-ACS2转入酵母YM4271,将转化成功的酵母菌液点至不同浓度的3-AT SD/-His板上,筛选可以抑制其本底表达的3-AT浓度。结果显示,能够抑制pHiSi,pHiSi-ACS2本底表达的3-AT浓度分别为160 mM和80 mM(图5a)。再将pHiSi-ACS2与pGADT7-MsWRKY33共转至酵母YM4271,并同时将阴性对照组合:pHiSi+pGADT7,pHiSi+pGADT7-MsWRKY33,pHiSi-ACS2+pGADT7共转至酵母YM4271,将转化成功的酵母菌液点至加入其对应能够抑制其本底表达的合适浓度3-AT的SD-/His-Leu-Ura缺性培养基上,观察酵母生长情况。结果显示,转化组合pHiSi-ACS2+ pGADT7-MsWRKY33的酵母可以正常生长,而其余对照均无法生长(图5b),说明MsWRKY33转录因子可以与AtACS2的启动子特异性结合,MsWRKY33转录因子对AtACS2具有转录调控作用。
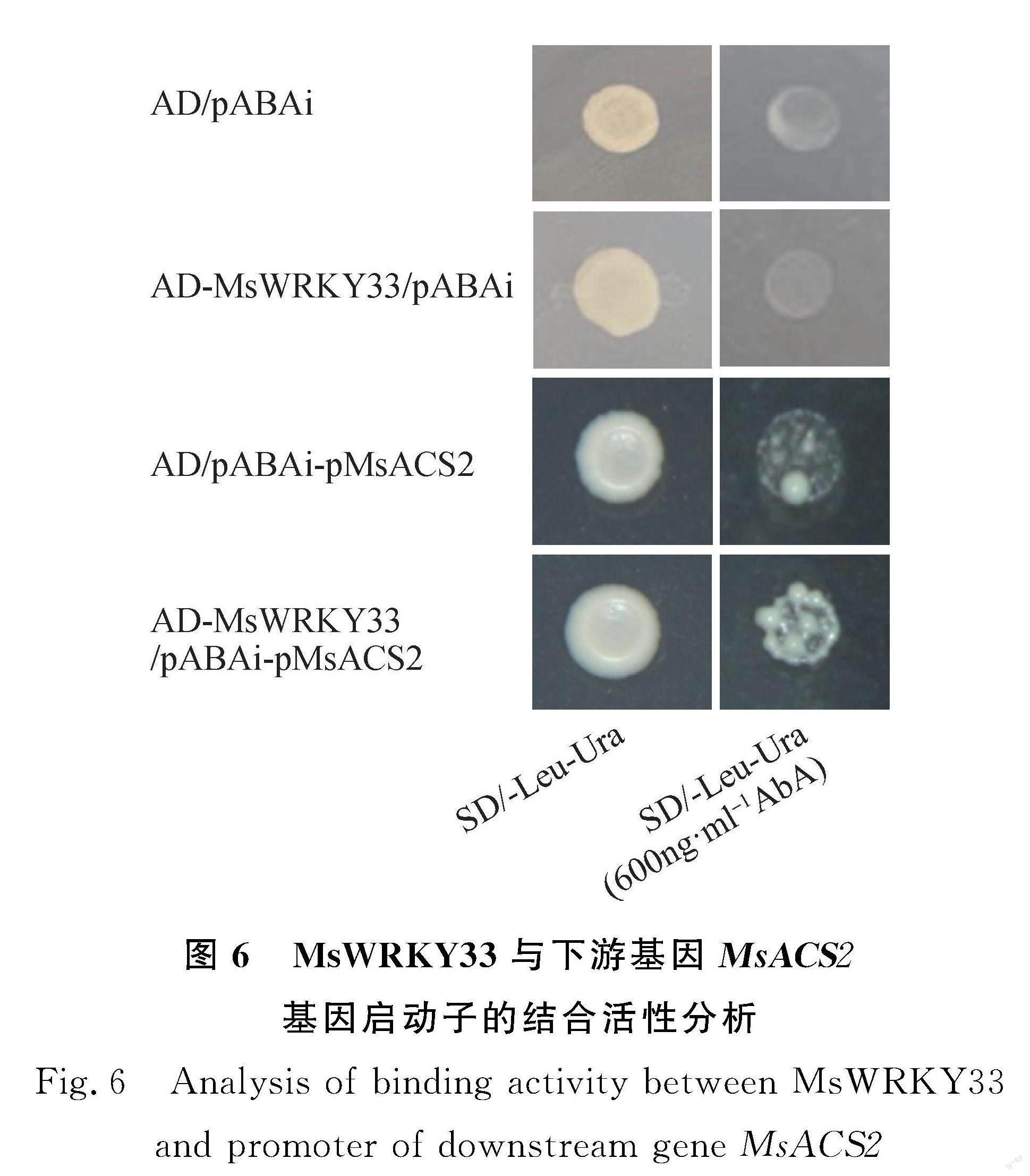
2.6 MsWRKY33与下游基因MsACS2启动子的结合活性分析
将pABAi-MsACS2转入Y1HGold酵母菌株,将转化成功的酵母菌液点至含不同浓度AbA的SD/-Ura平板上,筛选其可以抑制其本底表达的AbA浓度为600 ng·mL-1;再将pGADT7,pGADT7-MsWRKY33和pABAi,pABAi-MsACS2质粒以两两组合的方式共转化Y1HGold酵母菌株,将转化成功的酵母菌液点至含600 ng·mL-1 AbA的SD/-Ura-Leu平板上。其中,含AD/pABAi,AD-MsWRKY33/pABAi,AD/pABAi-pMsACS2重组质粒的酵母菌液在SD/-Leu-Ura上可以正常生长,在SD/-Leu-Ura(600 ng·mL-1 AbA)上无法生长,而含AD-MsWRKY33/pABAi-pMsACS2重组质粒的酵母菌液可以在SD/-Leu-Ura(600 ng·mL-1 AbA)上生长,说明MsWRKY33同样可以和MsACS2基因启动子结合从而调控其基因表达,也进一步说明MsACS2可能具有与AtACS2相近的生物学功能(图6)。
2.7 NaCl处理下的下游基因表达量分析
对该课题前期获得的转基因MsWRKY33紫花苜蓿株系进行表达量鉴定,qRT-PCR显示过表达株系L3和L4基因表达水平均显著高于紫花苜蓿‘中苜1号对照株系(图7)。为了进一步验证MsWRKY33与MsACS2基因的调控关系,利用实时荧光定量PCR的方法分析了200 mM NaCl處理下,MsWRKY33和MsACS2在CK(‘中苜1号)和MsWRKY33转基因株系L3和L4中的表达水平,发现MsWRKY33在CK,L3和L4株系中均能被诱导表达,但在盐处理的3~24 h内两个转基因株系的MsWRKY33表达水平均显著高于CK(图8)。CK株系中MsWRKY33表达水平呈逐渐上升趋势,而在转基因株系中呈先上升后下降的趋势,且在6 h时达到峰值。3个株系中MsACS2的表达水平在0~36 h内均呈现缓慢上升的趋势,在36 h时转基因株系L3和L4的MsACS2基因表达水平达到最高且显著高于CK。在转基因株系和对照株系受到盐胁迫后的36 h内,MsWRKY33的表达量一直处于高位,说明盐胁迫可以诱导MsWRKY33基因的表达,且转基因株系中的表达量显著高于对照株系;转基因株系在受到盐胁迫24 h后,ACS2基因表达量才逐渐上升,与此相比CK株系的ACS2基因表达水平一直处于低位,这说明了MsACS2基因可能受到MsWRKY33转录因子的调控。
3 讨论
3.1 MsWRKY33转录因子特异性结合W-box顺式作用元件
土壤盐渍化已经成为人们农业生产的重要阻碍因素,全球已有超过8亿的土地受到盐渍化的影响[4],中国的盐碱土面积也达到了1.0×108hm2[4]。紫花苜蓿是全国乃至世界范围内种植最多的牧草品种,主要分布在我国的西北、华北和东北等地,其分布区域和生长环境大都在土壤盐渍化严重的地区,因此,了解紫花苜蓿耐盐性的分子机制对于苜蓿品种的选育和农业的可持续发展具有重要意义。
转录因子在植物生长发育中扮演重要角色,WRKY转录因子作为植物体内重要的转录因子之一参与植物体生长发育过程及生物及非生物逆境响应[30],且研究表明WRKY转录因子与紫花苜蓿耐盐碱性相关[31]。在几乎所有受到WRKY蛋白调控的基因启动子区域中都能发现(T)TGAC(C/T)这一高度保守的W-box元件;W-box多存在于许多与植物防卫反应相关基因的启动子中[24]。ZmWRKY104通过与下游基因ZmSOD4启动子区W-box结合从而启动ZmSOD4基因的表达增强玉米(Zea mays L.)SOD活性,以更好地清除植物体内由于盐胁迫所产生的活性氧,从而增强了玉米的耐盐性[32]。PsnWRKY70与PsnNAM,PsnMYB和PsnGT1基因的启动子中W-box结合从而启动下游基因的表达来响应盐胁迫[33]。以上研究均揭示了WRKY转录因子的调控机制,即WRKY转录因子通过与下游靶基因的启动子区域的W-box结合从而调控其表达。本研究结果也表明紫花苜蓿MsWRKY33转录因子可以特异性的结合W-box顺式作用元件。
3.2 MsWRKY33转录因子可能正向调控MsACS2基因的表达
本课题前期对正常条件和盐胁迫条件下的对照株系和转基因株系的紫花苜蓿进行了转录组测序,其中发现有1个编码ACC合成酶(乙烯合成过程中的关键限速酶)ACS2基因显著上调。ACS(ACC合成酶)是乙烯合成途径中的关键限速酶,其活性直接影响到乙烯的生成量[34]。乙烯合成过程中的重要酶类ACS,ACO及乙烯在植物耐盐胁迫中起着重要作用。盐胁迫可以促进植物体内乙烯的合成,如在烟草中,盐处理能诱导NtACS1,NtACO1,NtACO2和NtACO3基因的表达[15-16],同时乙烯及乙烯前体ACC也能显著增加植物的耐盐性[16]。乙烯的动态平衡在盐胁迫应答中起着复杂的作用。因此,我们推测MsWRKY33通过转录调控ACS2基因的表达从而影响乙烯的合成,进而可能影响紫花苜蓿的耐盐性。
MsWRKY33转录因子可以与下游基因AtACS2启动子特异性结合,同源性分析结果显示,紫花苜蓿中的ACS2基因与AtACS2同源性高达53.9%,因此我们有理由相信MsACS2基因与AtACS2具有相类似的生物学功能。为了进一步确定MsWRKY33转录因子是否对紫花苜蓿ACS2同源基因也有调控作用,我们克隆了ACS2在紫花苜蓿中的同源基因MsACS2,并通过酵母单杂交验证了MsWRKY33对MsACS2也具有调控作用。本研究也证明了MsWRKY33转录因子可以特异性结合W-box顺式作用元件,而AtACS2和MsACS2基因启动子顺式作用元件分析发现两者都含有W-box元件,说明MsWRKY33转录因子可能是通过与AtACS2和MsACS2基因启动子中的W-box元件结合从而调控其基因表达。近年来,植物的遗传转化技术成为研究植物基因组学的强有力工具[35],基因的遗传转化技术比传统的杂交、回交等育种技术效率更高[36]。通过利用基因遗传转化技术研究苜蓿基因的功能,揭示基因的作用机制已成为研究前沿。TaACS2,TaACS7和TaACS8在TaWRKY51-RNAi株系中表达上调,而在TaWRKY51-OE株系中表达下调,说明TaWRKY51对TaACS2,TaACS7和TaACS8基因的调控是负向的[37]。在本研究中,转基因株系和对照株系受到盐胁迫后MsWRKY33基因表达量总体处于高位,而转基因株系在受到盐胁迫24 h后,ACS2基因表达量才逐渐上升,与此相比对照株系的ACS2基因表达水平一直处于低位,这可能是从MsWRKY33基因被盐诱导从而转录翻译为MsWRKY33转录因子蛋白,MsWRKY33转录因子蛋白转录调控ACS2基因这一过程需要时间,所以才导致ACS2基因表达较MsWRKY33出现滞后。因此,MsACS2基因可能受到MsWRKY33转录因子的调控且这种调控作用可能是正向的。
目前,已有研究证明WRKY转录因子可以调节ACS2基因的表达。AtWRKY33直接参与MPK3/MPK6级联下游ACS2和ACS6表达的激活,以响应病原体入侵[26];拟南芥AtWRKY29正调控ACS5,ACS6,ACS8,ACS11和ACO5基因的表达从而促进乙烯的合成[38];小麦(Triticum aestivum L.)TaWRKY51通过结合ACS基因启动区域的W-box顺式作用元件抑制ACS基因表达从而影响乙烯的合成,进而对小麦侧根的发育产生影响[37];拟南芥WRKY8通过直接调控ACS6基因的表達参与了植物对TMV-cg的防御反应[27]。本研究发现MsWRKY33可能通过与MsACS2基因启动子区的W-box结合从而调控其表达。现有研究大都集中在模式植物拟南芥的WRKY转录因子直接靶向调控乙烯合成的关键限速酶基因从而调控乙烯生物合成,探讨其在生物胁迫和植物生长发育方面的影响[26-27,37-38],而本研究旨在探究WRKY转录因子调控ACS基因从而影响乙烯生物合成,且乙烯可能参与苜蓿的耐盐胁迫进程,但乙烯参与紫花苜蓿盐胁迫的具体分子机制仍需进一步探究。
3.3 乙烯可能增强紫花苜蓿对盐胁迫的耐受性
乙烯是通过对ROS的清除以增强植物对盐胁迫的耐受性,如乙烯通过影响RBOHF介导的ROS和Na/K平衡来提高拟南芥的耐盐性[39];乙烯预处理或者EIN3(关于乙烯激活的转录因子)的活化能够直接转录调控POD的表达来增强过氧化物酶(POD)的活性以清除ROS,从而提高植物对盐胁迫的耐受性[40]。当紫花苜蓿受到盐胁迫时,MsWRKY33可能会通过转录调控MsACS2基因上调从而使乙烯的生物量增加,乙烯可能通过清除植物体内的ROS活性氧来增强紫花苜蓿的耐盐性,其具体机制仍需进一步探究。
4 结论
本研究克隆了AtACS2和MsACS2基因启动子,利用PlantCARE在线网站分析它们基因启动子顺式作用元件,发现其均含有与WRKY转录因子结合的逆境响应元件W-box;酵母单杂交实验证实了MsWRKY33可以与W-box顺式作用元件、AtACS2和MsACS2启动子特异性结合;qRT-PCR结果表明MsWRKY33基因能被盐胁迫诱导表达,且ACS2基因可能受到WRKY33转录因子的正向调控并诱导其表达。因此,紫花苜蓿在受到盐胁迫时可诱导体内MsWRKY33的表达,MsWRKY33可能通过与其下游基因MsACS2启动子中W-box元件结合进而正向调控其表达,影响乙烯合成,进而影响紫花苜蓿对盐胁迫的响应。
参考文献
[1]李雪,沙栢平,高雪芹,等. 不同紫花苜蓿种质材料萌发期耐盐性鉴定与综合评价[J]. 草地学报,2020,28(2):437-445
[2]王佳敏,柴润东,陈璐云,等. 29个紫花苜蓿品种种子萌发期耐盐性评价[J]. 草地学报,2023,31(9):2722-2729
[3]TUTEJA N. Mechanisms of high salinity tolerance in plants[J]. Methods Enzymol,2007(428):419-438
[4]MUNNS R,TESTER M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology,2008(59):651-681
[5]BEKKI A,TRINCHANT J C,RIGAUD J. Nitrogen fixation (C2H2 reduction) by Medicago nodules and bacteroids under sodium chloride stress[J]. Physiologia Plantarum,1987,71(1):61-67
[6]WANG KL-C,LI H,ECKER J R. Ethylene biosynthesis and signaling networks[J]. The Plant Cell,2002(14):S131-S151
[7]ABELES F B,MORGAN P W,SALTVEIT M E. Ethylene in plant biology[M]. San Diego:Academic Press,2012:
[8]TAKAHASHI H,IWASA T,SHINKAWA T,et al. Isolation and characterization of the ACC synthase genes from lettuce (Lactuca sativa L.) and the involvement in low pH-induced root hair initiation[J]. Plant Cell Physiology,2003,44(1):62-69
[9]TRUSOV Y,BOTELLA J R. Silencing of the ACC synthase gene ACACS2 causes delayed flowering in pineapple [Ananas comosus (L.) Merr.] [J]. Journal of Experimental Botany,2006,57(14):3953-3960
[10]WANG N N,SHIH M C,LI N. The GUS reporter-aided analysis of the promoter activities of Arabidopsis ACC synthase genes ACS4,ACS5,and ACS7 induced by hormones and stresses[J]. Journal of Experimental Botany,2005,56(3):909-920
[11]WI S J,PARK K Y. Antisense expression of carnation cDNA encoding ACC synthase or ACC oxidase enhances polyamine content and abiotic stress tolerance in transgenic tobacco plants[J]. Molecules and Cells,2002,13(2):209-220
[12]YOUNG T E,MEELEY R B,GALLIE D R. ACC synthase expression regulates leaf performance and drought tolerance in maize[J]. The Plant Journal,2004,40(2):813-825
[13]JOHNSON P R,ECKER J R. The ethylene gas signal transduction pathway:A molecular perspective[J]. Annual Review of Genetic,1998,32(1):227-254
[14]王娟,黃荣峰.乙烯调控植物耐盐性的研究进展[J].植物生理学报,2015,51(10):1567-1572
[15]ZAREMBINSKI T I,THEOLOGIS A. Ethylene biosynthesis and action:a case of conservation[J]. Signals and Signal Transduction Pathways in Plants,1994:343-361
[16]YANG S F,HOFFMAN N E. Ethylene biosynthesis and its regulation in higher plants[J]. Annual Review of Plant Physiology,1984,35(1):155-189
[17]CAO W,LIU J,ZHOU Q Y,et al. Expression of tobacco ethylene receptor NTHK1 alters plant responses to salt stress[J]. Plant Cell & Environment,2006,29(7):1210-1219
[18]ACHARD P,CHENG H,DE GRAUWE L,et al. Integration of plant responses to environmentally activated phytohormonal signals[J]. Science,2006,311(5757):91-94
[19]JIANG C,BELFIELD E J,CAO Y,et al. An Arabidopsis soil-salinity-tolerance mutation confers ethylene-mediated enhancement of sodium/potassium homeostasis[J]. The Plant Cell,2013,25(9):3535-3552
[20]PENG J,LI Z,WEN X,et al. Salt-induced stabilization of EIN3/EIL1 confers salinity tolerance by deterring ROS accumulation in Arabidopsis[J]. Plos Genetics,2014,10(10):e1004664
[21]杨致荣,王兴春,李西明. 高等植物转录因子的研究进展[J]. 遗传,2004,20(3):403-408
[22]RUSHTON P J,SOMSSICH I E,RINGLER P,et al. WRKY transcription factors[J]. Trends in Plant Science,2010,15(5):247-258
[23]GIACOMELLI J I,RIBICHICH K F,DEZAR C A,et al. Expression analyses indicate the involvement of sunflower WRKY transcription factors in stress responses,and phylogenetic reconstructions reveal the existence of a novel clade in the Asteraceae[J]. Plant Science,2010,178(4):398-410
[24]谢政文,王连军,陈锦洋,等. 植物WRKY转录因子及其生物学功能研究进展[J]. 中国农业科技导报,2016,18(3):46-54
[25]UIKER B,SOMSSICH I E. WRKY transcription factors:from DNA binding towards biological function[J]. Current Opinion in Plant Biology,2004,7(5):491-498
[26]LI G,MENG X,WANG R,et al. Dual-level regulation of acc synthase activity by mpk 3/mpk 6 cascade and its downstream wrky transcription factor during ethylene induction in Arabidopsis[J]. Plos Genetics,2012,8(6):e1002767
[27]CHEN L,ZHANG L,LI D,et al. WRKY8 transcription factor functions in the TMV-cg defense response by mediating both abscisic acid and ethylene signaling in Arabidopsis[J]. Proceedings of the National Academy of Sciences,2013,110(21):E1963-E1971
[28]MA L, LI X, ZHANG J, et al. MsWRKY33 increases alfalfa (Medicago sativa L.) salt stress tolerance through altering the ROS scavenger via activating MsERF5 transcription[J]. Plant, Cell & Environment, 2023,46(12):3887-3901
[29]WANG Z,WEI X,WANG Y,et al. WRKY29 transcription factor regulates ethylene biosynthesis and response in Arabidopsis [J]. Plant Physiology and Biochemistry,2023(194):134-145
[30]史书婷,龚小庆,邹养军. WRKY转录因子与植物逆境响应[J]. 中国生物化学与分子生物学报,2017,33(7):670-680
[31]李红,李波,邬婷婷,等. 紫花苜蓿耐苏打盐碱相关基因的转录组学分析[J]. 草地学报,2019,27(4):848-858
[32]YAN J,LI J,ZHANG H,et al. ZmWRKY104 positively regulates salt tolerance by modulating ZmSOD4 expression in maize[J]. The Crop Journal,2022,10(2):555-564
[33]ZHAO H,JIANG J,LI K L,et al. Populus simonii× Populus nigra WRKY70 is involved in salt stress and leaf blight disease responses[J]. Tree Physiology,2017,37(6):827-844
[34]王娟,黄荣峰. 乙烯调控植物耐盐性的研究进展[J]. 植物生理学报,2015,51(10):1567-1572
[35]NARUSAKA Y,NARUSAKA M,YAMASAKI S,et al. Methods to transfer foreign genes to plants[J]. Transgenic Plants-advances and Limitations,2012:32773
[36]SOMERS D A,SAMAC D A,OLHOFT P M. Recent advances in legume transformation[J]. Plant Physiology,2003,131(3):892-899
[37]HU Z,WANG R,ZHENG M,et al. Ta WRKY51 promotes lateral root formation through negative regulation of ethylene biosynthesis in wheat (Triticum aestivum L.) [J]. The Plant Journal,2018,96(2):372-388
[38]WANG Z,WEI X,WANG Y,et al. WRKY29 transcription factor regulates ethylene biosynthesis and response in Arabidopsis[J]. Plant Physiology and Biochemistry,2023(194):134-145
[39]JIANG C,BELFIELD E J,CAO Y,et al. An Arabidopsis soil-salinity-tolerance mutation confers ethylene-mediated enhancement of sodium/potassium homeostasis[J]. The Plant Cell,2003(25):3535-3552
[40]PENG J,LI Z,WEN X,et al. Salt-induced stabilization of EIN3/EIL1 confers salinity tolerance by deterring ROS accumulation in Arabidopsis[J]. Plos Genetics,2014,10(10):e1004664
(責任编辑 彭露茜)

