通过改良RAPD技术获得黑毛石斛、蜂腰石斛和石仙桃的3条SCAR新标记
梅志强,郭 侃,魏春莉,郑美玲,傅俊江
西南医科大学医学基础研究中心(泸州 646000)
随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)是一种应用广泛的技术,可以同时扩增大量位点,在30 年前被引入,后来发展为生物体的遗传表征。利用RAPD技术进行分子标记简单、快速、可靠,能有效检测多态性以及评估基因型之间的遗传多样性[1]。目前RAPD 分子标记技术被广泛地应用于动物[2]、植物[3-4]和微生物[5-8]物种鉴定、基因定位[9]研究领域。虽然RAPD 因其优点而广受欢迎,但它也有一些不可忽视的缺点,包括产量低和重现性差。傅俊江等[10]早期发现改良的RAPD 技术可以克服以上缺点,提高重复性和增加特异条带。该方法被广泛应用于多种药用植物的遗传多态性研究中[11-13]。
序列特征扩增区域(sequence characterized amplified regions,SCAR)是由RAPD分子标记技术发展而来的,其原理是利用特异性位点的聚合酶链式反应(polymerase chain reaction,PCR)标记,是一种有价值的分子生物学方法。利用SCAR标记,将分子分析简化为PCR分析,利用RAPD扩增的特定序列设计PCR引物,可对研究对象实现特异性PCR分子鉴定[14-18]。
石仙桃为兰科石仙桃属植物,是一种重要的中药材[19],主要分布于贵州、云南、福建、广东、广西等地,主要产于广东、福建等地[20]。石仙桃味甘、微苦,性凉,归肺、肾经,其药用价值丰富,具有清肺、养阴、利湿、消瘀和清热解毒等功效,临床用于治疗肺热咳嗽、慢性胃炎、眩晕、头痛等[21]。石斛是兰科三大属之一,蜂腰、黑毛均属于石斛种属,为传统贵重的药材[22],具有益胃生津,滋阴清热、抗癌防老等功效[23]。石仙桃和石斛形态相似,容易混淆,常通过形态观察区别,但容易出错,因此需要更加准确的分子鉴定方法。
市场上商品石斛种类繁多,与不少其他中药形态也很相似。售卖的石斛多为晒干制备好的中药饮片,仅通过形态观察无法区分。因而为保证药物质量,寻找一种能快速区分不同药材的方法对石斛及与其外形相似品种做出准确的鉴定十分有必要。本研究通过对多种草本植物进行RAPD扩增,找到3种中药药材具有特异性扩增条带后,通过切胶回收、克隆到T 载体中、PCR 扩增阳性克隆进行鉴定及测序后设计SCAR 标记引物,从而在分子水平上建立快速区分上述3 种中药药材的方法,分别用于鉴定蜂腰石斛、石仙桃、黑毛石斛,并保存在GenBank中。在GenBank数据库中对这3个核苷酸序列利用生物大分子序列比对搜索工具(basic local alignment search tool,BLAST)进行搜索,结果显示与其他物种的标记不一致,为今后该类重要药材样品的鉴定提供了依据,对石斛药材的鉴定和临床应用具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 材料来源 新鲜植株材料:蜂腰石斛、球花石斛、长苏石斛、黑毛石斛、玫瑰石斛、石仙桃、铜皮石斛、翅梗石斛来源于广西柳州,铁皮石斛来自安徽,金钗石斛来自四川泸州合江,植株由西南医科大学药学院中药资源与鉴定教研室张春教授鉴定。
1.1.2 试剂与仪器 2×MIX、Marker 等购自TaKaRa 生物技术有限公司;RAPD随机引物购自北京赛百盛基因技术有限公司;琼脂糖凝胶DNA回收试剂盒、EcoR I限制性内切酶(Promega 公司)、质粒小提试剂盒购自天根生化科技(北京)有限公司;琼脂糖、LB 培养基、AMP、X-gal、IPTG、10 mg/mL 溴化乙锭(EB)溶液、50 × TAE缓冲液均购于生工生物工程(上海)有限公司。试验所用仪器主要有:PCR梯度分析仪Mastercycler(Eppendorf,德国);凝胶成像仪(ChemiDocXRS Bio—Rad,美国);紫外分光光度计(U-3010);Thermo 高速离心机(Legend Micro21R);稳压稳流电泳仪(DYY-5,北京六一仪器厂);超低温冰箱(Thermo)等。
1.2 实验方法
1.2.1 基因组DNA提取 从中国不同地区共采集了10个样品:蜂腰、球花、长苏、黑毛、玫瑰、石仙桃、铜皮、翅梗、铁皮、金钗石斛。使用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)从新鲜叶片中提取基因组DNA。首先将植物材料固定在含有氯仿、PVP、2-羟基-1-乙硫醇(不含液氮)的固定溶液中,然后用二氧化硅(SiO2)研磨成小块进行DNA提取。通过0.8%琼脂糖凝胶电泳和分光光度法检查DNA质量。将所有DNA样本的最终浓度调整为10 ng/μL,并在-20 ℃下保存至使用。
1.2.2 改进的RAPD 扩增 使用来自北京赛百胜基因技术有限公司的随机RAPD引物A2(TGCCGAGCTG)、N2(ACCAGGGGCA)、A6(GGTCCCTGAC)扩增不同的DNA 样本。10 μL 的PCR 反应体系由5 μL 2 × Taq PCR Master Mix、1 μL 2.5 μM 引物、1.5 μL 基因组DNA和2.5 μL ddH2O 组成。扩增反应在PCR 机器“Applied Biosystems Veriti®96 Well Thermal Cycler”(美 国Life Technology)中进行,95 °C 初始变性90 s,然后进行40次如下循环:94°C变性40 s、36°C退火60 s,从退火到延伸的渐变率调整为0.125°C/s(5%渐变率)、72°C 延伸90 s,最后72°C延伸5 min。PCR产物在1.8%琼脂糖凝胶上进行电泳。
1.2.3 RAPD阳性DNA片段的分子克隆与鉴定 从琼脂糖凝胶中分别切下各个样本特异的条带,使用琼脂糖凝胶DNA 回收试剂盒进行纯化。纯化的DNA 片段通过TA克隆连接到pGM-T载体(编号VT202)(天根试剂,北京,中国)中,然后转化到DH5α大肠杆菌感受态细胞中。将重组克隆菌液均匀涂抹在含有氨苄西林(100 μg/μL)、X-gal(40 mg)和IPTG(160 μg)的LB琼脂平板上,37 °C 培养箱中培养过夜。采用蓝白斑筛选法,筛选出白色菌落。使用SP6/T7引物(SP6:5'-ATTA GTGACACTATAGA-3';T7:5'-TAATACGACTCACTAT AGG-3')进行PCR 扩增筛选。挑选白色菌落于20 μL水中,吹打混匀,然后吸取0.8 μL 菌液,加入以下反应体系:5 μL 2 × Taq PCR Master Mix、1 μL 2.5 μM 的SP6/T7 引物、3.2 μL ddH2O 组成。将白色菌落进行PCR 扩增,在95°C 下90 s,然后进行35 次循环:94°C变性40 s、58°C 退火30 s、72°C 延伸50 s,最后,72°C延伸5min。在1.5%琼脂糖凝胶上进行电泳,初步选取能够扩增出正确的插入片段的菌落。然后选出阳性菌落加入5 mL的含有氨苄青霉素(100 μg/μL)的LB液体培养基,37°C 摇床培养17 h,第二天提取质粒。提取的质粒加入EcoR I 限制性内切酶37°C 酶切3 h,然后电泳检测阳性克隆。
1.2.4 DNA 测序与生物信息学 利用T 载体测序引物的SP6,采用Sanger法对阳性克隆进行测序。为了去除载体序列并验证克隆的RAPD 片段序列是否新颖,使用在线程序BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)用于GenBank 数据库中不同物种的测序DNA克隆的同源性搜索。
1.2.5 SCAR 引物设计 通过使用在线程序Primer3对每个克隆的RAPD 片段的核苷酸序列设计SCAR 引物对,检测引物的质量。每个引物的序列、优化的PCR条件和扩增长度如表1所示。
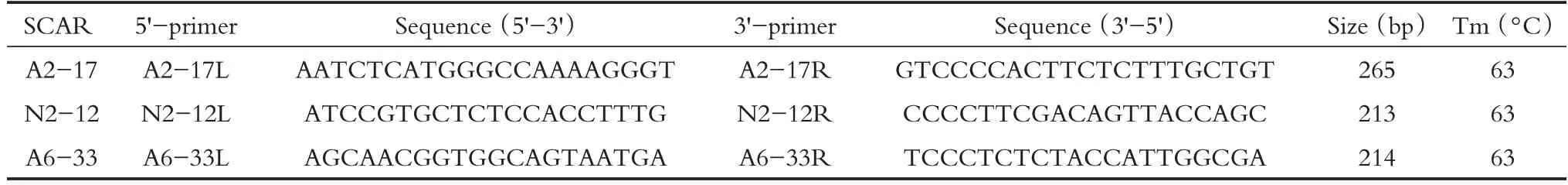
表1 针对特异片段的引物序列Table 1 Primer sequences for specific fragments
1.2.6 SCAR 标记的开发和分析 为了获得稳定的SCAR 标记,使用20 份DNA 样本作为模板进行PCR 扩增。它们是前面所述的10种不同的道地药材样品,以及枸杞、荔枝、银杏、青果、金银花、薄荷、赶黄草、当归、栀子花、赤芝各一个样品。10 μL PCR 反应体系如下:5 μL 2×Taq PCR Master Mix,1 μL 2.5 mM SCAR引物,1.5 μL 基因组DNA(10 ng),剩余体积2.5 μL ddH2O 补充。PCR 扩增在上述“Applied Biosystems Veriti®96 孔热循环器”中进行,初始预变性在95°C下进行90 s,然后在94°C变性40 s,在63°C下退火30 s,在72°C下延伸40 s,循环34 次,最后72 ℃延伸5 min。扩增的PCR产物在1.5%琼脂糖凝胶上分离。然后通过0.5 μg/mL溴化乙锭染色观察凝胶,最后使用ChemiDoc XRS(美国Bio-Rad)记录图像。
2 结果
2.1 RAPD扩增片段的克隆
选出3 条RAPD 引物(A2、A6、N2)对DNA 样品进行改进的RAPD 扩增,结果如图1 所示,其中黑色箭头表示引物N2(图1A)、A6(图1B)、A2(图1C)标记的条带。箭头所示的条带从琼脂糖凝胶上切下并进一步纯化,通过TA 克隆连接到T 载体。采用LB 琼脂平板蓝/白筛选法筛选阳性克隆(数据未显示)。然后使用实验提到的SP6/T7 引物,通过聚合酶链反应(PCR)扩增鉴定白色克隆菌落。在图2中,克隆A6-33在通道1中显示为预期插入的DNA片段,大小约为600 bp,克隆N2-12 在通道2 中显示为预期插入的DNA 片段,大小约为750 bp,克隆A2-17在通道3中显示为预期插入的DNA片段,大小约为750 bp,大小分别正确。故最终选择了A2-17、N2-12、A6-33。将所取特异性菌液置于37°C摇床过夜培养,第二天使用质粒小提试剂盒提取质粒DNA,分光光度法测取DNA 浓度和检测DNA 质量,然后使用酶切质粒再次验证,所获得的片段为如前所述的预期大小,如图3所示。
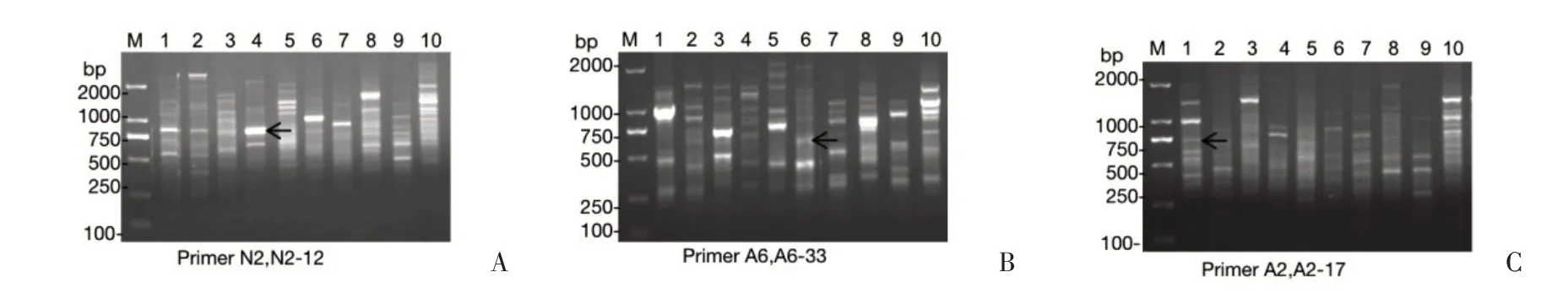
图1 使用不同的RAPD引物对DNA样本进行RAPD扩增Figure 1 RAPD amplification of DNA samples using different RAPD primers

图2 菌落PCR结果Figure 2 Colony PCR results
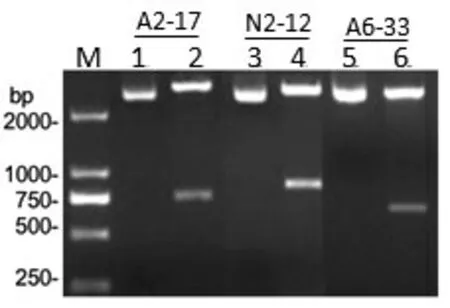
图3 DNA连接后阳性克隆的酶切鉴定Figure 3 Identification of positive clones after DNA ligation by enzymatic digestion from E.prostrate
2.2 特异性RAPD片段的测序和特性分析
2.2.1 克隆的RAPD 片段(A2-17、N2-12、A6-33)的测序 对上述3 个克隆的RAPD 片段(A2-17、N2-12、A6-33)测序(如图4 所示),然后用GenBank 数据库中的核苷酸序列进行BLAST 搜索,发现这3 个克隆与数据库中其他物种的同源性不显著。

图4 通过sanger测序获得克隆的核苷酸信息Figure 4 Sequencing result of the cloned nucleotides by Sanger sequencing
2.2.2 特异SCAR标记的鉴定 根据克隆序列,设计并合成了3对引物(见表1)。然后利用设计的SCAR引物对从收集的20 个不同物种或品种的样本中基因组DNA进行扩增,以检测扩增物种的特异性,即蜂腰石斛的特异标记A2-17、黑毛石斛的特异标记N2-12、石仙桃的特异标记A6-33。PCR扩增结果见图5。SCAR标记A2-17、N2-12、A6-33 的PCR 结果表明,在样品(通道1-20)中观察到具有预期大小的扩增产物而其他物种没有扩增。由此可确认特异性SCAR 标记已成功开发,并可在未来用于鉴定蜂腰石斛、黑毛石斛和石仙桃品种,以及区别以上品种和其它中药品种。
图5 A2-17、N2-12、A6-33的稳定RAPD-SCAR标记的开发Figure 5 Stable RAPD-SCAR marker development for A2-17,N2-12 and A6-33
3 讨论
中药道地药材的鉴定常用方法有:基源鉴定(DNA指纹图谱)、形状鉴定、显微鉴别和理化鉴定等方法。其他几种方法有的需要经验丰富的专家才能鉴定,有的实验方法繁杂。而DNA 标记技术,是非常准确和简易的方法。RAPD 是应用最早、最方便的一种DNA 标记技术[24],DNA 标记技术的发展彻底改变了基因组序列未知的物种和传统生物的遗传特征鉴定方法,已经成为植物学、动物学,甚至药物化学研究领域的宝贵工具。这种技术简单、经济且易于实施,并且不需要对目标物种进行完整的DNA 测序。该方法被广泛应用于不同产地药用植物的遗传多样性鉴定,如辣椒[1]、流苏石斛[3]和当归[4]等。但单独应用该技术由于RAPD引物较短,因此重复性和特异性差。当RAPD与SCAR结合时,可以提高稳定性和特异性,使形态相似但基因不同的药用植物的遗传鉴定更加高效。比如,利用RAPD分子标记的SCAR能够快速鉴定区分一些物种,如赶黄草[14]、栀子[15]、忍冬[25]、冬虫夏草[26]等。RAPD 与SCAR结合方法对于药用植物样本DNA 序列未知的物种也能快速鉴定,并且由于该方法的引物长度比RAPD 引物长度长,因此特异性更高。
本研究利用从中国不同地理位置采集的20 种植物标本,从这些植物中提取DNA生成了RAPD片段,并在T 载体中克隆,共筛选出3 条可用于鉴别黑毛石斛、蜂腰石斛、石仙桃的RAPD 引物,分别为N2-12、A6-33、A2-17,其中引物N2-12 在黑毛石斛中扩增出约750 bp 的特异性条带,A2-17 在蜂腰石斛中扩增出约750 bp的特异性条带,A6-33在石仙桃种属中扩增出约600 bp 的特异性条带。这3 对特异性SCAR 标记能高效、快速、准确的区分出上述3 个物种。所设计的3 对SCAR引物在3种道地药材中的扩增图谱单一,实验操作过程简单,实验成本较低,但鉴别高效、准确、快速。这些SCAR 标记的建立相较于传统形态学方法提供了更可靠的鉴别方法,可用于这几种道地药材的区分鉴定。目前获得了识别黑毛石斛、蜂腰石斛和石仙桃3种样本的特异SCAR标记,鉴定铁皮石斛和金钗石斛的SCAR 标记已经找到[27]。其他几种药用植物也可以用同样的方法获得相应特异引物。因此,本课题组会在后续的研究中继续扩增获得不同样本的特异片段,并克隆测序获得对应样本的特异引物。
4 结论
本研究利用SCAR 标记技术共筛选出N2-12、A2-17 和A6-33 3 条可用于鉴别黑毛石斛、蜂腰石斛和石仙桃的RAPD 序列,这3 对特异性SCAR 标记能高效、快速、准确的区分出上述3个物种。这些SCAR标记的建立为今后进行该中药道地药材样品的鉴定提供了实验依据。

