红掌组织培养和快速繁殖技术
周 静 周力行 周晓静 孙 欣 沈碧君 蒋亚华
(宿迁学院,江苏宿迁 223800)
红掌(Anthurium andraeanumLind.)是花烛属天南星科的一种多年生常青性草本植物,也称安祖花、花烛。因其色彩艳丽、花期持久和花型独特,深受人们喜爱。在红掌组织培养中,外植体的选择和处理是其组织培养的重要环节。目前组织培养研究选用的外植体以叶片、叶柄为主[1]。本研究选取红掌嫩叶作为试验材料,通过试验对比,探讨在不同生长因素影响下红掌生长状况,为红掌组织培养研究提供参考。
1 材料与方法
1.1 供试材料选择
选取株型大、花色鲜艳的红掌盆栽品种特伦萨作为供试品种。切取红掌基部新生幼嫩叶片,用自来水冲去杂质、洗净表面,再用流水冲洗30 min,沥干后移至超净工作台上。
1.2 外植体灭菌
在无菌环境下,将嫩叶、叶柄和茎段分成9组并编号,均用75%乙醇浸泡30 s,再用无菌水冲洗3次。然后将1—3 组用0.5% NaCIO 溶液分别浸泡6、8 和10 min;4—6 组用1.0% NaCIO 溶液分别浸泡6、8 和10 min;7—9 组用2.0% NaCIO 溶液分别浸泡6、8 和10 min。待各组时间到后,用无菌水冲洗5次,分别放入消毒瓶中备用[2]。
1.3 培养基配制
培养基分为诱导愈伤组织的培养基、增殖愈伤组织的培养基、诱导丛生芽的培养基和丛生芽生根的培养基。在每个培养基配制好后,进行湿热灭菌,灭菌条件如下:蒸气压0.105 MPa,温度121 °C,灭菌时间15 min。充分杀菌,减少组织培养时的污染[3]。
1.4 愈伤组织诱导
以红掌品种特仑萨的嫩叶、茎段及叶柄为材料,用于红掌组织培养的主要培养基包括MS、1/2 MS、N6 和B5 等。在这些培养基中,诱导红掌愈伤组织的最有效培养基是1/2 MS[4]。因此,以1/2 MS 为基础培养基,以6-BA 和2,4-D 为因子,进行了四级正交双因子检测,设计不同6-BA 和2,4-D 浓度的培养基配方进行试验。6-BA 浓度为0.2、0.5、0.8 和2.0 mg/L;2,4-D浓度为0.1、0.3、0.5和0.7 mg/L[5]。
在3 个重复中,每个处理组100 个外植体,共接种300 个外植体。培养30 d 后,统计愈伤组织的诱导情况并得出结论。
1.5 丛生芽诱导
将获得的愈伤组织在无菌条件下切成长约3 mm的小段,将每个小瓶中的15个接种处理组织接种到诱导丛生芽的培养基中,以诱导丛生芽的发生,通过观察丛生芽出芽率,比较不同激素比例对诱导发芽的影响。以MS为基础培养基,以6-BA和NAA为因子,建立三级两因子正交试验,6-BA 的浓度分别为0.3、0.5和0.7 mg/L,NAA浓度为0.1、0.2和0.3 mg/L[6]。
培养40 d后,统计合格丛生芽的数量,合格丛生芽判断标准为苗高≥1.5 cm,叶片≥3片,叶宽≥1.5 cm,叶片嫩绿。
1.6 丛生芽生根
诱导丛生芽获得大量丛生芽后,选取诱导的合格丛生芽无根苗,去掉黄叶和枯叶,将幼苗分别接种于不同浓度NAA的生根介质中,每瓶装15个丛生芽苗,并进行诱导。以1/2 MS作为基质,6-BA和NAA作为两因子进行正交试验。6-BA 浓度设计为0.3、0.5和0.7 mg/L。NAA浓度为0.1、0.2和0.3 mg/L。
培养14 d后,可见微量洁白的愈伤组织,当苗高4~5 cm 时,可见发达的主根和大量须根,一个月后统计其生根率。
1.7 培养条件优化
在每升培养基中加入30 g蔗糖和2 g植物凝胶,将培养物置于组培室中,温度为(25±1)℃,每天连续光照12 h,光照强度为1 500~2 100 lx。酸性或碱性过强均会对植株的生长造成较大的影响,而红掌的pH在5.6~5.8时较好。
组织培养期间,每3~5 d检查一次培养室,统计结果,并去除受污染的瓶苗。保持温度和光照。组培室每周用紫外灯照射一次,约30 min,地板每周用75%乙醇喷洒一次,降低培养环境的污染性。
2 结果与分析
2.1 不同消毒时间对叶片接种效果的影响
由表1 可知,随着消毒时间变长,叶片接种成活率先升高后下降,当用NaCIO 溶液浸泡8 min 时,接种成活率最高。当消毒时间小于8 min 时,会造成叶片杀菌不完全,导致污染率上升。当消毒时间大于8 min 时,死亡率大幅提升。因此,消毒时间选8 min最为适宜。

表1 不同消毒时间对叶片接种效果的影响
2.2 不同NaCIO溶液浓度对叶片接种效果的影响
由表2可知,随着NaCIO 溶液浓度的上升,成活率和污染率降低,死亡率上升。该结果表明,提高NaCIO 溶液浓度可以抑制污染,同时也会导致细胞组织死亡。因此,NaCIO 溶液浓度选用0.5%为宜。

表2 不同NaCIO溶液浓度对叶片接种效果的影响
2.3 不同激素浓度配比对红掌外植体愈伤组织诱导的影响
控制2,4-D 浓度不变,对比6-BA 浓度变化,其影响如表3 所示。6-BA 的浓度对愈伤组织的直径有更大的影响,其范围在0.2~1.8 cm。在6-BA 浓度为0.2~0.5 mg/L 时,随着6-BA 浓度的增加,愈伤组织的直径变大。当6-BA浓度超过0.5 mg/L后,直径略有下降,推测6-BA为0.5 mg/L时最适合愈伤组织生长。
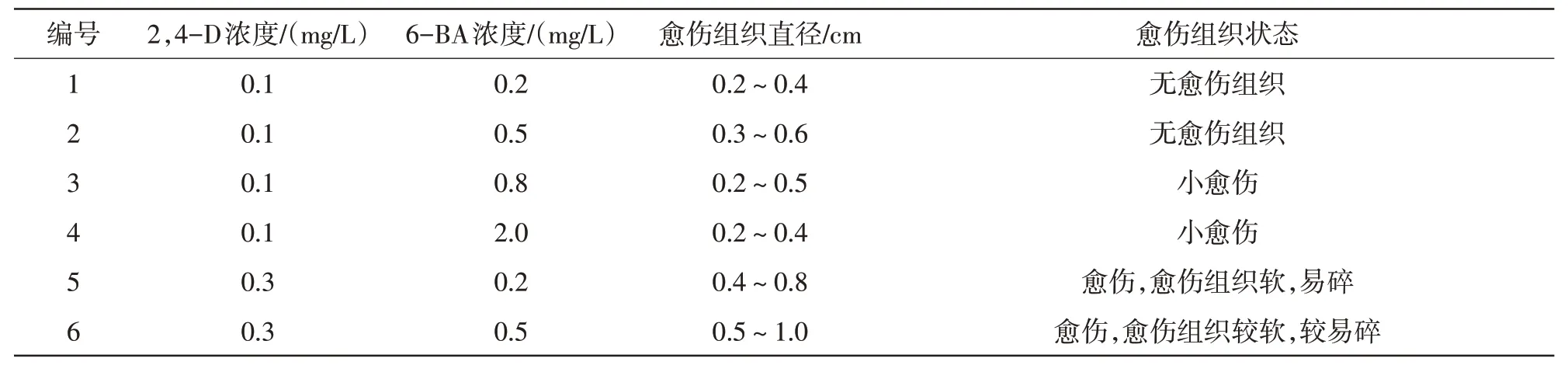
表3 不同激素浓度配比对红掌外植体愈伤组织诱导的影响
控制6-BA 浓度不变,2,4-D 浓度对愈伤组织状态的影响较大。2,4-D 浓度为0.1 mg/L 时,无愈伤组织或愈伤组织较小,愈伤组织诱导率低,质地较软,易碎,导致保花效果不明显。2,4-D 浓度为0.5 mg/L 时,愈伤组织质地坚硬且诱导成功率高,愈伤出现时间短。2,4-D 浓度超过0.5 mg/L后,会出现僵果和畸形果,外植体愈伤化,形态结构消失。
叶片在培养基(7)中培养10 d后,开始出现膨大现象,60 d即可诱导出愈伤组织,且诱导成功率高达98%。此时在其他培养基中叶片多膨大,边缘出现愈伤组织,对其继续培养,部分会出现干死或污染情况,诱导成功率为80%。从形态、质地和颜色等多方面综合考虑,以0.5 mg/L 6-BA+0.5 mg/L 2,4-D 为愈伤组织诱导培养基的最佳配比。
2.4 不同激素浓度配比对红掌丛生芽诱导的影响
控制NAA 浓度不变,对比6-BA 浓度变化,其影响如表4 所示。在6-BA 浓度为0.3~0.5 mg/L时,6-BA含量越高,愈伤组织分化数量越多,分化程度越高。当6-BA 浓度为0.5 mg/L 时,诱导率最高;浓度超过0.5 mg/L 后,丛生芽过多,导致养分不足,整体长势变差[7]。
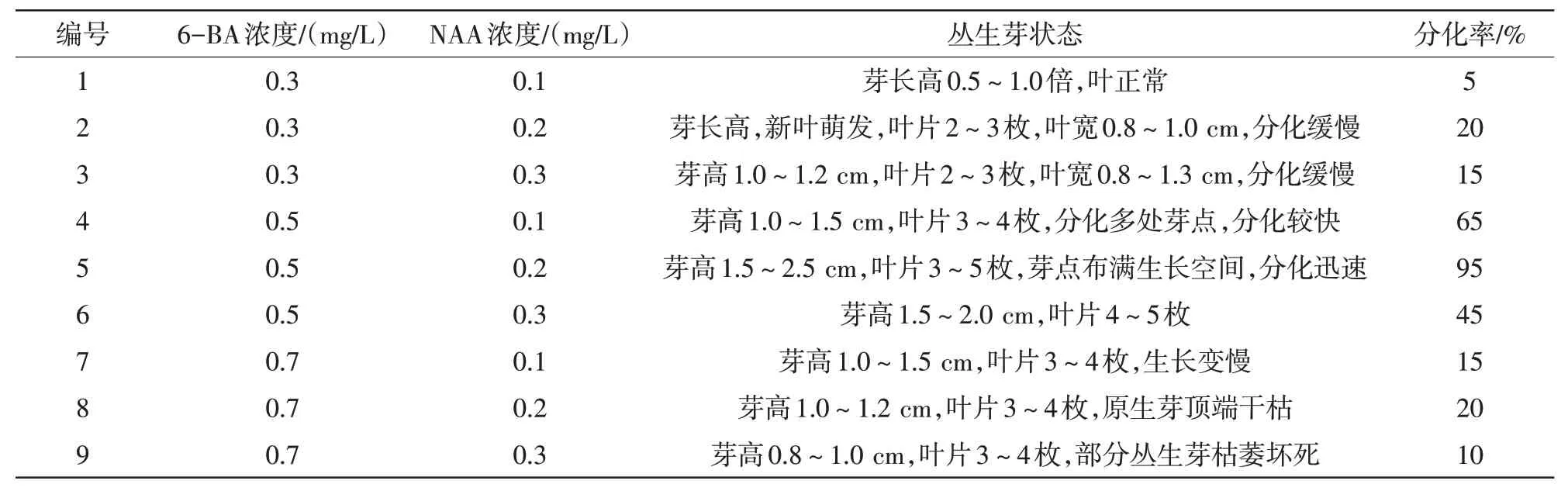
表4 不同激素浓度配比对红掌丛生芽诱导的影响
控制6-BA 浓度不变,NAA 变化时,NAA 在较低的浓度下,丛生芽诱导率较低。当NAA 浓度为0.2 mg/L 时,诱导率可达95%,且芽长势最好,芽高1.5~2.5 cm,叶片3~5枚,芽点布满生长空间,属于合格丛生芽。当浓度继续升高,丛生芽生根,会导致丛生芽畸形、枯萎坏死或停止生长[8]。
接入培养基40 d后观察,3组均有小芽生长,其中培养基(5)小芽最多。100 d 后3 组基本萌发完成,培养基(5)在3组中芽萌发率最高,长势最好,颜色最绿,芽最健壮,其余处理出现畸形、长势不佳、枯萎坏死或诱导率低等现象[9]。综上所述,0.5 mg/L 6-BA+0.2 mg/L NAA为诱导丛生芽的最佳浓度。
2.5 不同激素浓度配比对红掌丛生芽生根的影响
控制NAA 浓度不变,对比6-BA 浓度变化,其影响如表5所示。当6-BA 浓度为0.3 mg/L 时,根系较浅,芽瘦弱易折。当6-BA 浓度为0.5 mg/L 时,既能保证生根率,又不会对丛生芽形态造成影响。在6-BA 浓度为0.7 mg/L 时,芽有变形的趋势,生长潜力降低。推测是由于基质膨胀后附着的芽的内部运输组织的损失,导致大苗发育不良。因此,6-BA 的最佳浓度为0.5 mg/L。此时最适合丛生芽长出粗壮的根,方便之后对苗的移栽。

表5 不同激素浓度配比对红掌丛生芽生根的影响
控制6-BA 浓度不变,NAA 对丛生芽生长有较大影响。NAA深度为0.1 mg/L时,丛生芽生根率低。NAA浓度为0.2 mg/L时,丛生芽有气生根,但气生根愈伤化,有效苗比率低。NAA浓度为0.3 mg/L时,平均生根数量最多,平均根长最长。
将丛生芽导入生根培养基30 d 后,对其生长状况进行观察,发现有部分黄绿色的新根出现,此时培养基(6)生根最早,生根数最多。45 d 后再观察其生长状态,培养基(6)的生根率约为98%,平均根数为4.6条,平均根长为3.0 cm,根系旺盛,芽生长良好,呈绿色,其次为培养基(2)。因此,0.5 mg/L 6-BA+0.3 mg/L NAA是使丛生芽生根的最佳培养基浓度。
当组培幼苗生根后,将其从瓶子里拿出,用清水洗净根系的培养基,种植在草炭、蛭石和珍珠石(体积比为2∶2∶1)的混合基质中,然后用塑料膜覆盖,放在温室内,一天浇水2~3次,以保证基质的湿度。在幼苗初期要进行遮阴处理,并定期用百菌清溶液进行保护。15 d 后,幼苗的生长状况良好,逐步撤去覆盖的塑料膜,适当增加光照强度,直到光强达到2 500 lx,成活率达100%。
3 结论与讨论
该试验探究不同因素对红掌特仑萨叶片诱导丛生芽的影响,如培养基、激素以及消毒时间等,因此必须保持每个试验体在同一培养环境下。主导生态环境因子对诱导组织的分裂和分化起着非常重要的作用,如光照和温度等。光照对特伦萨愈伤组织有较好的刺激作用,有利于从愈伤组织中分化出绿色幼苗,在缺少光线的情况下,会产生发黄的幼苗[4],在补充光照后会恢复为绿色。在采光良好的培养室中,自然漫射光可满足要求。然而,在光线不足的培养室中,需要人工照明。因此,本试验使用日光作为额外的光源,在组培室中,植物每天在(25±1)℃下培养12 h,光照强度为1 500~2 100 lx。
红掌组织培养的外植体通常选用叶片、叶柄和茎等,其中叶片和叶柄使用较多。尽管红掌的离体茎段诱导成活率更高,但红掌茎段材料较少,且切割后易造成植株损伤。因此,本试验采用叶片作为外植体,相较于其他器官,其易于提取和处理,新形成的叶片杂菌较少,易于消毒[10]。
愈伤组织诱导是植物组织培养的一个重要技术,大多数植株在形成前都处于愈伤组织期。在外植体充分消毒、无细菌感染的基础上,使用不同激素配比的培养基,对愈伤组织培养会产生不同的影响。本试验选择6-BA 和2,4-D 作为愈伤组织培养的激素。6-BA 通过破坏顶端优势,促进细胞分裂和诱导新芽形成;2,4-D 具有促进细胞分裂的作用,使细胞壁变软和变松。2 种激素协同作用于外植体,促进愈伤组织形成与增殖。
本研究表明,0.5 mg/L 6-BA+0.5 mg/L 2,4-D为愈伤组织诱导培养基的最佳配比,此时愈伤组织质地坚硬,愈伤出现时间短。叶片培养10 d后,开始出现膨大现象,60 d即可诱导出愈伤组织,且诱导成功率高达98%。0.5 mg/L 6-BA+0.2 mg/L 2,4-D 为最佳愈伤组织增殖浓度,此时增殖系数高,且愈伤组织发育良好。
内源性植物激素的调节是成功诱导融合芽的一个重要因素。移植组织中不同的内源激素水平会导致最合适的外源生长介质的浓度变化。因此,不同类型和浓度的生长剂需要适应不同的植物组织培养。
在诱导试验中,分裂素和生长激素对红掌花序的分化起着重要作用。比例太低或太高均不利于萌发,影响植株的生长。研究显示,生长素NAA 在诱导丛生芽方面比IBA 更有效[7-8]。因此,本研究使用生长素NAA,当6-BA 为0.6 mg/L、NAA 为0.2 mg/L时,诱导出的丛生芽最佳,萌发率最高,长势最好,颜色最绿,芽最为健壮。当6-BA 为0.5 mg/L、NAA为0.3 mg/L 时,丛生芽生根最高,约为98%,平均生根数4.6条,平均根长3 cm,根系粗壮,芽生长好,颜色绿。
离体苗的快速繁殖及移栽技术是制约红掌产业发展的一个重要因素。而红掌组织培养技术受季节和环境影响较小,且对基质的要求较低,在生产上有较大的应用潜力,有利于提升花卉产业技术水平[9-10]。本研究探究了红掌特伦萨品种的丛生芽诱导与生根的技术,建立了完整的红掌组织培养体系,为红掌组织培养研究提供参考,助力红掌快繁技术的发展。

