龙芽草总黄酮的闪式提取工艺优化及提取物的抑菌和抗炎活性研究
杨 佳, 金哲勇, 姜 君, 金英花*
(1.延边大学 农学院; 2.延边大学 实验动物中心:吉林 延吉 133002)
龙芽草(AgrimoniapilosaLdb.)在民间亦被称为仙鹤草、脱力草和狼牙草,是蔷薇科多年生草本植物,在我国的传统医学中被尊为一味珍贵的中草药[1]。龙芽草中主要含有黄酮类、三萜类、鞣质类等活性成分,并含有钾、镁、铁、硫、磷等微量元素[2]。目前,龙芽草已被广泛应用于各种疾病的缓解与治疗中,如肿瘤、梅尼埃病、滴虫性阴道炎、咳血、腹泻等疾病[3-4]。近年来,关于龙芽草的研究主要集中在其活性成分及其在抗肿瘤和降血糖方面的药理作用。有文章报道,龙芽草富含丰富的黄酮类化合物[5]。研究发现,植物中的黄酮具有广泛的药理作用,其抑菌效果覆盖了多种细菌和真菌[6-8]。此外,黄酮类化合物通过调控炎症等相关信号通路展现出卓越的抗炎活性[9]。然而,尽管龙芽草在治疗疾病上的效果备受推崇,但其具体的活性成分与作用机制尚未得到深入的研究和解读,特定单一化合物的药理研究也相对有限。
传统的黄酮提取方法存在诸多限制,如酶解提取法提取化合物的过程中可能会破坏化合物的某些结构,从而影响到提取的最终结果[10]。而闪式提取法采用特殊的高速动态分子渗透与强烈振动原理来迅速破解植物细胞组织,这种方法确保了细胞内的有效成分能与提取溶剂充分作用,并使目标产物被迅速提取,其优势在于提取时间短、效率高,并能有效保证所提取的目标产物的结构完整度及生物活性[11]。
该研究采用了响应面法对龙芽草中的总黄酮提取工艺进行了优化,并进一步探索了其生物活性。该研究可为龙芽草在临床治疗上的应用以及未来的新药开发提供有力的理论支持,具有广阔的应用前景。
1 材料与方法
1.1 植物材料
龙芽草采自吉林省和龙头道镇,由延边大学金英花老师鉴定并提供,将其茎、叶、花穗烘干后进行试验。
1.2 试验菌株
金黄色葡萄球菌(Staphylococcusaureus,CGMCC1.282),购自中国微生物菌种保藏中心;沙门氏菌(Salmonellaenteritidis,CGMCC1.755),购自中国微生物菌种保藏中心; 铜绿假单胞菌(Pseudomonasaeruginosa,CGMCC1.596),购自中国微生物菌种保藏中心;李斯特菌(Listeriamonocytogenes,CGMCC1.7730),购自中国微生物菌种保藏中心; 大肠杆菌(Escherichiacoli,CGMCC1.8745),购自中国微生物菌种保藏中心; 蜡样芽孢杆菌(Bacilluscereus,CGMCC1.911),购自中国微生物菌种保藏中心。
1.3 试剂与仪器
二甲基亚砜(DMSO)(天津市科密欧化学试剂有限公司,天津,中国)、脂多糖(LPS)(L8274)(Sigma-Aldrich,America)、噻唑蓝(MTT)(Sigma-Aldrich,America)、DMEM(Thermo Fisher,America)、胎牛血清(FBS)(Thermo Fisher,America)、2,3,5三苯基氯化四氮唑(TTC)(北京索莱宝科技有限公司,北京,中国)、BCA protein assay kit(Thermo,America)、Anti-iNOS(ABN26)(Millipore,America)、COX-2(SC-1746)(Thermo,America)、β-actin(SC-1616)(Thermo,America)、二氧化碳培养箱(Thermo,America)、酶标仪(上海精密科学仪器有限公司,上海,中国)、电导率仪(上海精密仪器有限公司,上海,中国)、旋转蒸发器(北京博医康试验仪器有限公司,北京,中国)、恒温培养箱(上海昕仪仪器仪表有限公司,上海,中国)、闪式提取器(上海钒帜精密设备有限公司,上海,中国)、Western Blot电泳仪(Bio-Rad,America)、超净工作台(苏州苏洁净化设备公司,江苏,中国)、荧光显微镜(OLYMPUS,Japan)、高速冷冻离心机(SIGMA,Germany)。
1.4 方法
1.4.1 龙芽草总黄酮闪式提取工艺的优化研究
1) 单因素试验 ①提取时间的选择:取龙芽草粉末10 g,分别按照液料比30∶1 (mL∶g),加入70%甲醇溶剂于闪式提取器内,分别设定提取时间为30、40、50、60、70 s。②提取溶剂浓度的选择:取龙芽草粉末10 g,分别按液料比30∶1 (mL∶g),分别加入30%、40%、50%、60%、70%的甲醇溶剂进行提取,提取时间设定为之前所选择的最佳时间。③提取液料比的选择:取龙芽草粉末10 g,分别按照提取液料比10∶1、20∶1、30∶1、40∶1、50∶1 (mL∶g)进行提取,提取时间与提取溶剂浓度均设置为之前所选择的最佳提取条件。
2) 响应面优化在单因素试验的基础上,以提取时间、提取溶剂浓度、提取液料比为响应值,采用3因素3水平响应面分析法,通过Design-Expert.8.06分析软件对龙芽草总黄酮提取工艺进行优化,因素与水平设计见表1。

表1 响应面分析法的因素与水平
3) 总黄酮含量的测定
参考Siqun J[12]的方法,并稍加改动,以芦丁作为标准品,利用硝酸铝-氢氧化钠比色法测定提取物总黄酮的含量。
1.4.2 龙芽草提取物(APLE)抑菌活性研究
1) 最低抑菌浓度
采用2,3,5-三苯基氯化四氮唑(TTC)法测定APLE对金黄色葡萄球菌等的MIC[13]:在96孔板加入菌悬液,以DMSO作对照。每孔加入TTC溶液,通过观察是否有红色产生来确定不同菌种的最低抑菌浓度。
2) 菌生长测定
参考李丽等[14]的方法进行微生物生长曲线的绘制:取菌悬液加入锥形瓶中,处理组锥形瓶中分别加入浓度为MIC的APLE,对照组加入等量培养液。每隔0.5 h吸取1次菌悬液至比色皿中,用分光光度计在波长600 nm处测定其吸光值,绘制生长曲线。
3) 电导率测定
取50mL浓度为1×108CFU/mL的菌悬液于锥形瓶中。处理组锥形瓶中分别加入浓度为MIC的APLE,对照组加入等量培养液。使用电导仪每隔0.5 h测定菌悬液的EC值。
1.4.3 APLE抗炎活性研究
1) 细胞毒性检测
Raw 264.7细胞接种于96孔板后加入不同浓度的APLE,对照组加入细胞培养基(不含FBS的DMEM)。孵育24 h后弃去培养液,加入MTT于恒温培养箱孵育2 h后,弃去培养液,加入150 μL的DMSO,混匀,用酶标仪测量波长550 nm处的OD值,计算细胞活性。
2) NO的测定
将Raw 264.7细胞以2.5×105cells/孔/300 μL的密度接种于孔板中。空白组(不含FBS的DMEM)与LPS组分别加入DMEM每孔300 μL,试验组加入不同浓度的APLE(25、50、100 μg/mL)处理细胞1 h后,除空白组外加入6 μL的LPS(100 ng/mL)处理,37 ℃培养24 h后收集细胞上清液。使用NO标准品工作液(NO Stand)制作标准曲线。在96孔板中每孔加入50 μL上清液和Griess试剂(按1∶1比例),使用酶标仪在波长为550 nm处测定OD值,根据标准品OD值制作标准曲线,计算NO含量。
3) iNOS和COX-2 测定
样品前处理:将Raw 264.7细胞铺于6孔板中经LPS和APLE处理后,用提前预冷的PBS清洗细胞2次,每孔加入110 μL的RIPA对细胞进行裂解,裂解30 min,用细胞铲将全部细胞刮下并收集于1.5 mL离心管中(冰上操作),4 ℃,12 000 r/min 离心15 min,收集上清液,于-20 ℃冰箱保存,上清液为即总蛋白。采用蛋白质定量法(BCA)进行蛋白质定量,确保免疫蛋白印迹中上样量的准确性。
将收集的总蛋白与蛋白缓冲液4∶1混匀,使蛋白变性(100 ℃沸水煮5 min),立即将变性后的总蛋白液置于冰上冷却。首先进行检查装置的气密性,在玻璃板间隙加入已配置完成的10%分离胶,加入甲醇使下分层胶的气泡消失,等待15 min后弃去甲醇。随后灌注已配置好的5%浓缩胶,立即插入梳子(10孔),待其凝固后拔出梳子。组装电泳仪装置,加样,加入1×电泳缓冲液,Marker、总蛋白液。其中电泳条件为恒压120 V,90 min。电泳结束后,将PVDF膜甲醇中浸泡30 s,激活PVDF膜,再按照正极―海绵―滤纸―PVDF膜―胶―滤纸―海绵-负极的顺序组装,进行转膜(30 V,600 min)。转膜结束后,根据蛋白分子量标记并裁剪,用TBS-T清洗PVDF膜3次,每次10 min,使用10%脱脂牛奶封闭90 min后,4 ℃孵育稀释过一抗(1∶1 000)24 h后,回收一抗,加入二抗(1∶5 000),室温孵育90 min。加入配置的ECL化学显影剂,使用凝胶成像仪将其进行曝光成像。使用Image-J处理图像并分析其蛋白的相对表达量。
1.5 数据分析
每个试验组均设置3次重复,使用SPSS 25.0统计软件和 GraphPad Prism 9 软件分析所有数据,通过Duncan多重检验来进行方差分析,P< 0.05被认为具有统计学意义
2 结果与分析
2.1 APLE提取工艺研究
2.1.1 单因素试验
该研究利用闪式提取法对龙芽草进行提取,以总黄酮含量为评价指标。试验结果表明,最佳提取时间为40 s(图1)。最佳提取液料比为40∶1 (mL∶g)(图2),提取溶剂浓度为40%时,总黄酮含量最高(图3)。
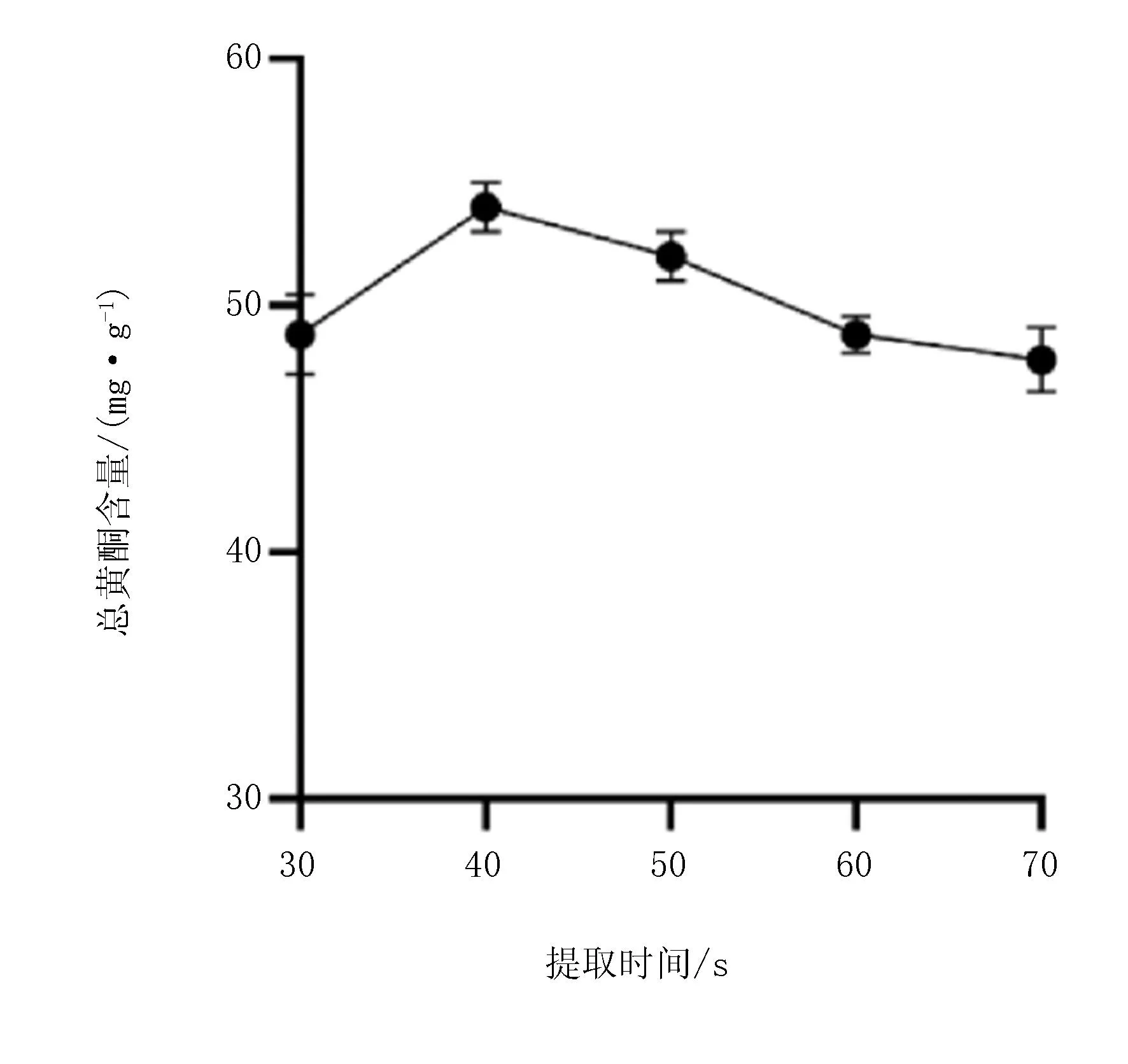
图1 提取时间对总黄酮含量的影响
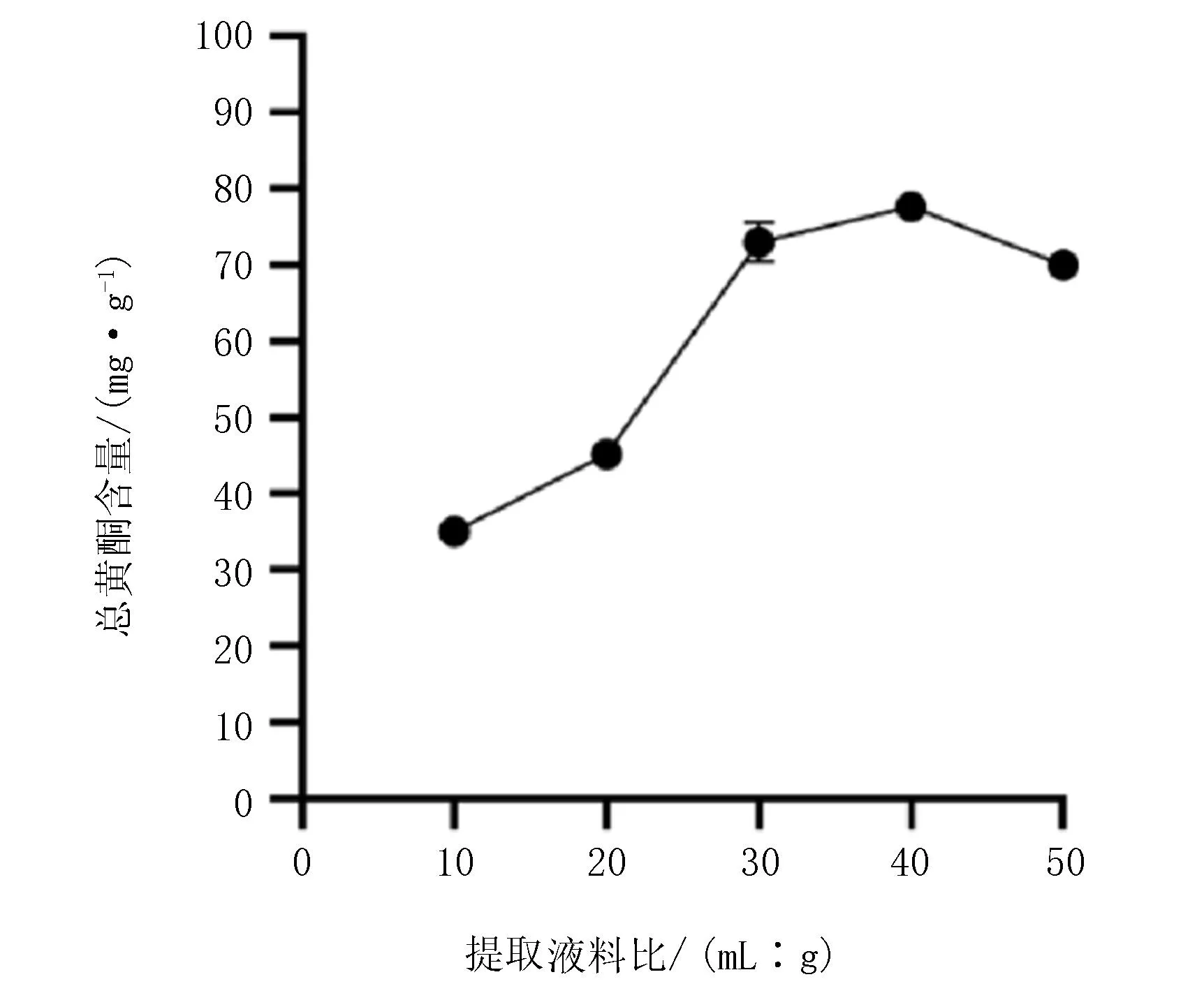
图2 提取液料比对总黄酮含量的影响

图3 提取溶剂浓度对总黄酮含量的影响
2.1.2 响应面试验
使用Design-Expert 8.0.6.1软件对表2进行回归拟合分析,可得到二次多项式方式回归模型为:
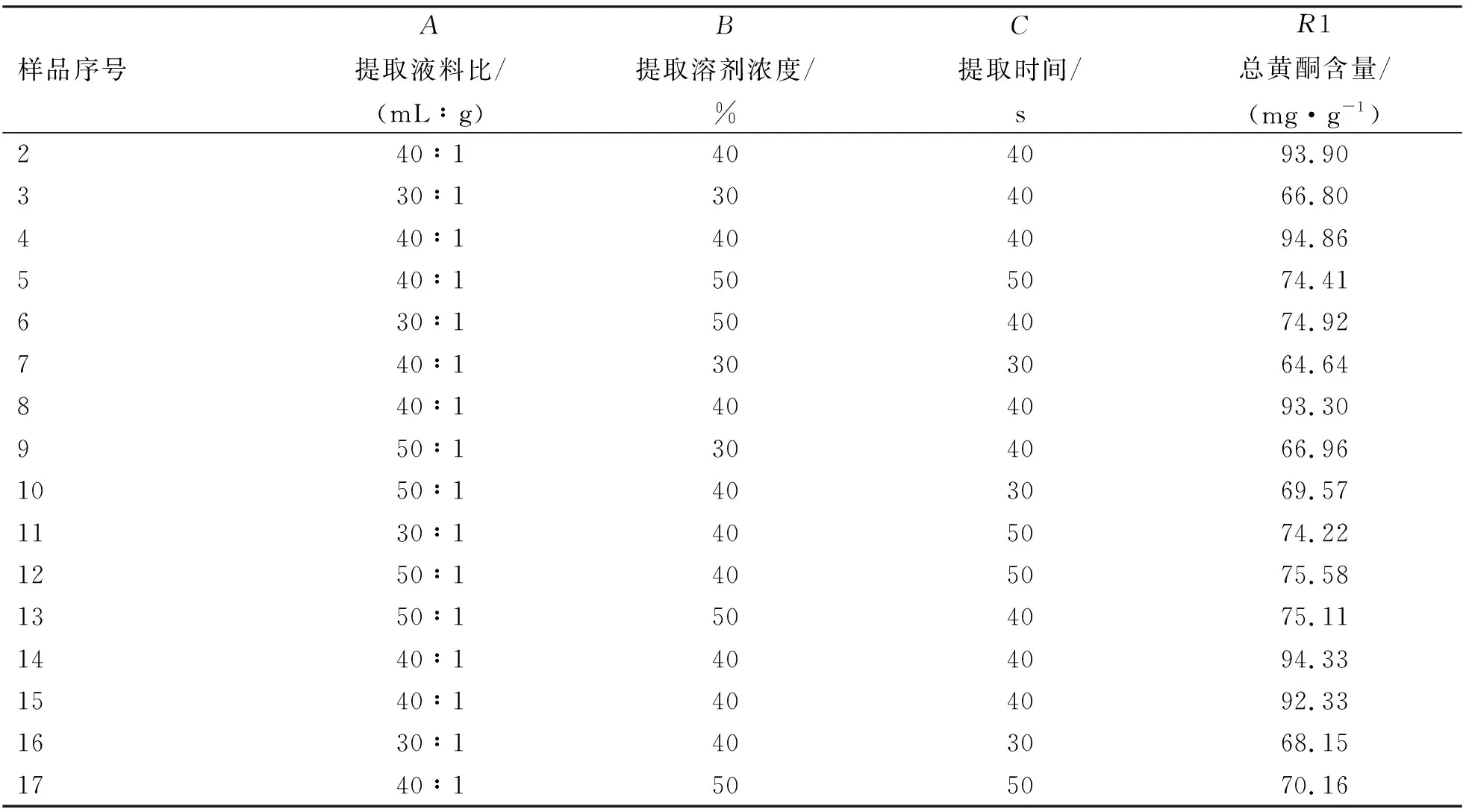
表2 响应面试验设计与结果
R1=93.743 36+0.389 77A+3.419 12B+2.565 95C+0.007 14AB-0.013 40AC-0.645 1BC-10.542 85A2-12.251 95B2-11.322 90C2.
式中,R1为总黄酮含量(mg/g);A为提取液料比,B为提取溶剂浓度,C为提取时间。
由回归模型进行方差分析结果可知,该模型回归显著(P<0.01),失拟项(P=0.255 3)不显著,表明自变量与响应值之间的模型关系显著,说明回归方程与实际情况拟合良好,可以用此模型来分析和预测提取结果(表3)。

表3 回归模型显著性与方差分析
由软件分析得到二维等高线图及三维响应曲面(图4-6),通过等高线和响应面图直观地反应了提取液料比、提取溶剂浓度和提取时间之间的相互作用对龙芽草提取物总黄酮含量的影响。响应面的最高点所对应的影响因素数值可以看作提取龙芽草提取物总黄酮的最佳提取条件;结果显示,通过Box-Behnken试验设计法得到了与实际情况相符合的回归模型。如表3的方差分析结果所示,提取溶剂浓度对提取物总黄酮含量的影响最大,其次是提取时间,提取液料比对提取物总黄酮含量的影响最小。提取液料比、提取溶剂浓度、提取时间每2个因素之间(AB、AC、BC)均无显著性交互作用。
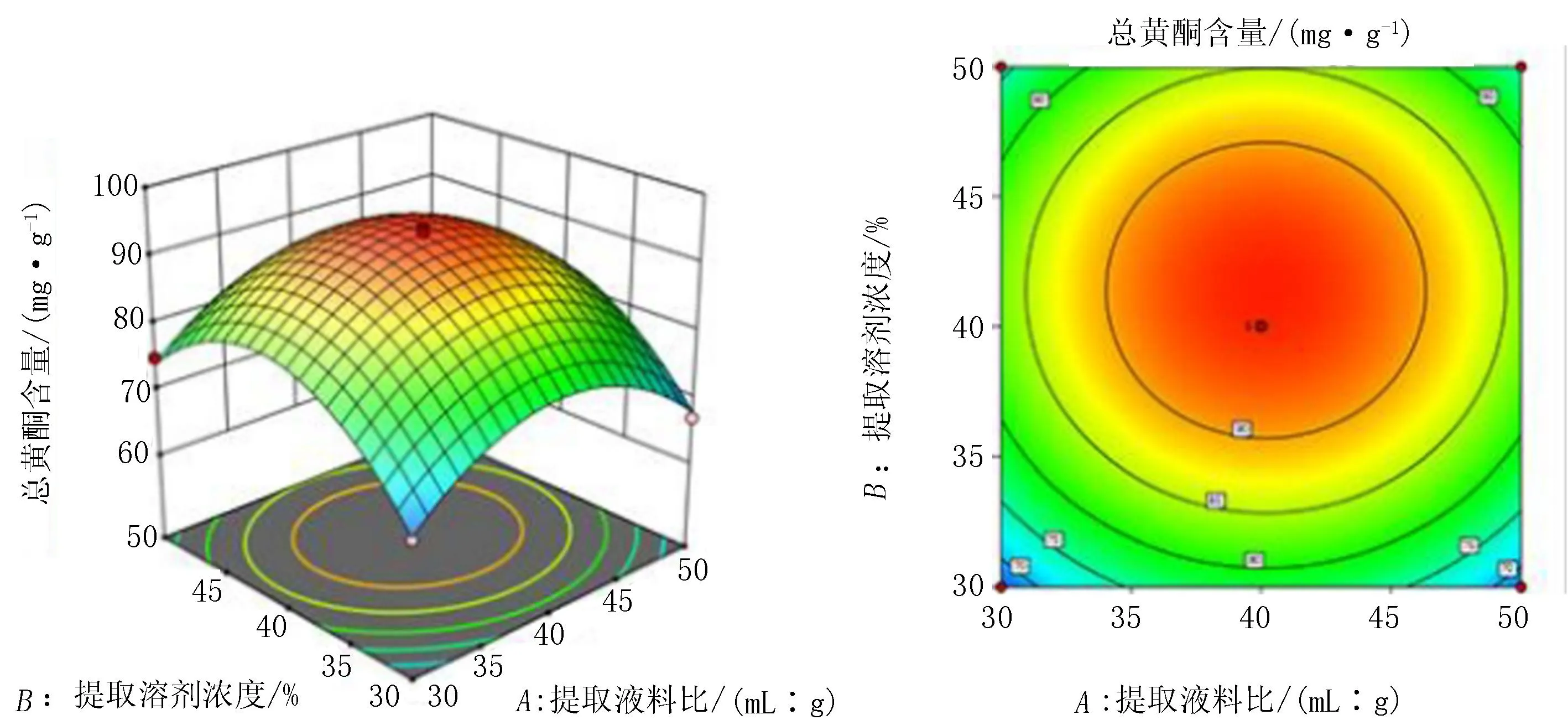
图4 提取溶剂浓度和提取液料比交互作用的响应面和等高线图

图5 提取溶剂浓度和提取时间交互作用的响应面和等高线图
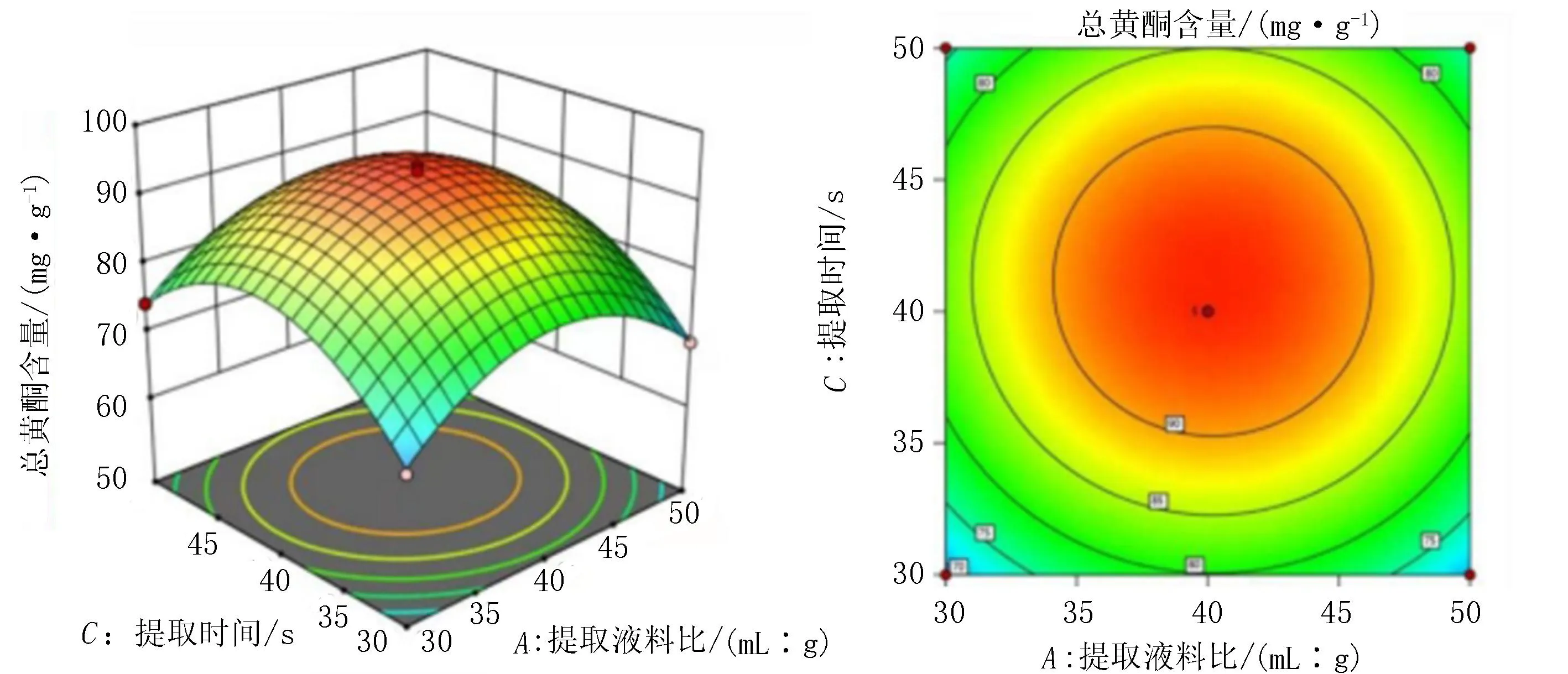
图6 提取液料比和提取时间交互作用的响应面和等高线图
利用Design-Expert 8.0.6.1软件分析模型,发现龙芽草提取物总黄酮的最佳提取条件为:A提取液料比为40.19∶1 (mL∶g),B提取溶剂浓度为41.37%,C提取时间为41.09 s。此时龙芽草提取物总黄酮含量最大,为95.12 mg/g。进行3次独立重复试验,对此结果进行验证,测得平均提取物总黄酮含量为(94.25±0.005) mg/g,试验值与理论值误差较小,所以采用响应面分析法优化得到的提取条件参数准确可靠,具有较实用的价值。
2.2 抑菌活性
APLE对6种试验菌的最低抑菌浓度(MIC)如表4所示。在0.5~64 mg/mL浓度范围内,APLE对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、李斯特菌的MIC值均为32 mg/mL,沙门氏菌的MIC值为16 mg/mL,蜡样芽孢杆菌的MIC值为4 mg/mL,说明提取物对蜡样芽孢杆菌的抑菌作用最强,其次是沙门氏菌。因此,在进一步的试验中,对提取物处理后的蜡样芽孢杆菌和沙门氏菌生长变化情况及电解质释放情况进行了调查。
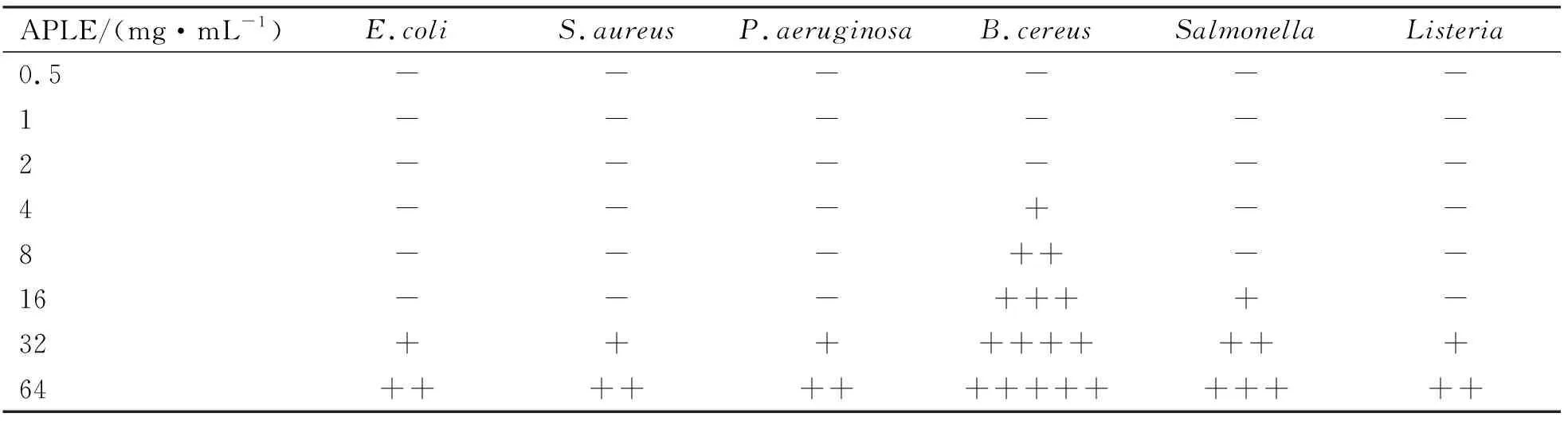
表4 APLE的最低抑菌浓度
APLE对蜡样芽孢杆菌与沙门氏菌生长的影响由图7可知,APLE对蜡样芽孢杆菌和沙门氏菌生长有明显抑制作用,在培养初期(0~1 h),对照组与APLE处理组无显著差异。但在培养1 h后,对照组的蜡样芽孢杆菌和沙门氏菌进入对数生长期,OD600快速上升,但APLE处理组的OD600上升速度缓慢,这表明APLE处理后的蜡样芽孢杆菌与沙门氏菌生长受到了抑制。
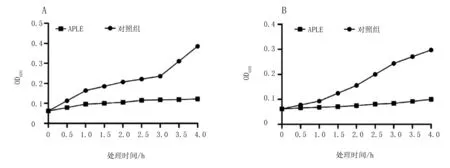
注:A为蜡样芽孢杆菌;B为沙门氏菌
菌悬液中电导率的大小与细胞膜的完整性呈正相关,当细菌细胞膜遭到破坏时,细胞膜通透性增加,引起胞内电解质外泄,使胞外电导率上升。由图8可见APLE作用前后细菌培养基中电导率的变化。在培养过程当中,对照组培养液的电导率变化不明显,相较于对照组中蜡样芽孢杆菌和沙门氏菌培养基中电导率,试验组培养基中的电导率显著高于对照组,且随时间变化逐渐上升,并且在5 h的试验过程中未见变缓趋势。这说明龙芽草黄酮破坏了细胞膜的完整性,使胞内电解质渗出,进而导致菌体培养液的电导率升高,但样品对细胞膜的破坏不够彻底,进而导致细菌还在以一定速率增长或样品对细胞膜的破坏较慢导致其呈现逐渐上升趋势。
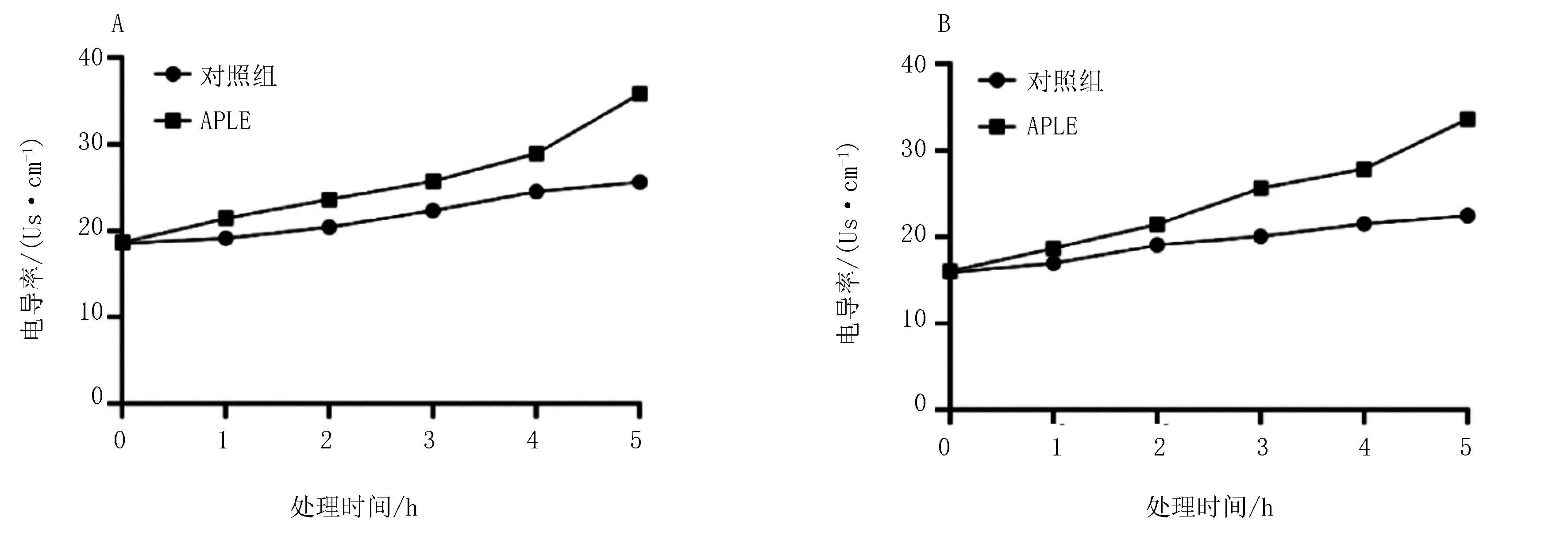
注:A为蜡样芽孢杆菌;B为沙门氏菌
2.3 抗炎活性
为筛选后续抗炎试验中的安全用药浓度,分别使用1.56、3.13、6.25、12.5、25、50、100、200、400 μg/mL的APLE对Raw 264.7细胞进行处理,24 h后用MTT法检测细胞活力,如图9所示,APLE浓度低于200 μg/mL时,对细胞活性没有影响,因此,采用25、50、100 μg/mL作为后续试验药物浓度。
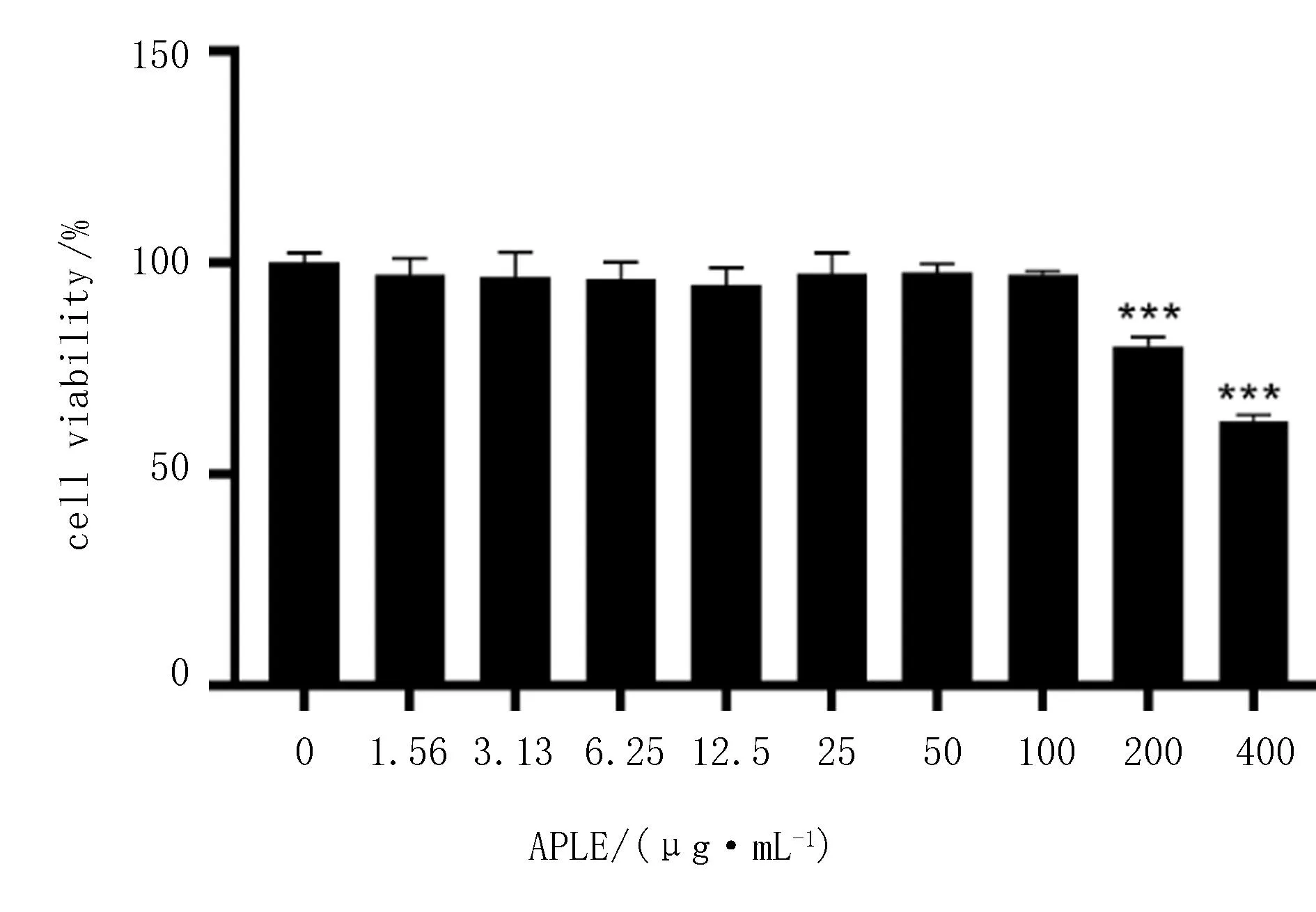
注:与空白组相比,***P<0.001。
为探究APLE对LPS诱导的Raw264.7的NO是否具有抑制释放的作用,使用不同浓度APLE(25、50、100 μg/mL)处理细胞,结果如图10所示,经LPS(200 ng/mL)刺激后,显著促进了细胞中NO的释放量,而经过APLE处理后细胞的NO释放量与未经处理的细胞相比,具有显著的抑制作用,且呈现一定的浓度依赖性。
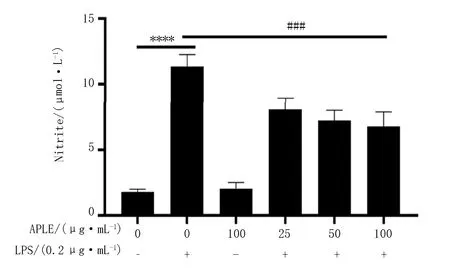
注:与空白组相比,****P<0.000 1;与LPS组相比:###P<0.001。
使用Western Blot法检测iNOS、COX-2的表达量。如图11(A)所示,经LPS处理后,细胞中的iNOS、COX-2表达量均呈现明显的上升趋势,而经APLE处理后,细胞中的iNOS、COX-2表达量均有显著下降,经Image J进行灰度统计,结果如图11(B)所示,APLE对iNOS、COX-2的表达量的呈现浓度依赖性的抑制效果。

注:与LPS组相比,**P<0.01,***P<0.001。
3 讨论与结论
不同的提取条件会对提取物中总黄酮含量产生不同程度的影响,当液料比为10∶1 (mL∶g)时,总黄酮含量偏低,可能是因为提取溶剂过少,样品不能够完全被提取;随着液料比的提高,总黄酮含量显著上升;当液料比高于40∶1 (mL∶g)时,总黄酮含量降低,可能是由于某些醇溶性物质与黄酮存在竞争关系,影响总黄酮的浸出,导致其含量下降[15];当提取溶剂的浓度达到40%时,所得总黄酮含量最高,而随着提取溶剂浓度进一步升高,黄酮含量降低,这可能是由于随着提取溶剂浓度升高,龙芽草中其他醇溶性物质含量有所上升,使得总黄酮含量下降[16]。
近年来,植物提取物的抑菌和抗炎症活性已成为研究领域的热点。王彩霞等[17]发现,在2 mg/mL浓度下,厚朴(Houpoeaofficinalis) 和麻叶菊(Indocypraeamontana) 提取物对葡萄座腔菌具有较好的抑菌活性,抑制率分别达到 95.80%和78.31%;高语[18]研究了独活、薄荷等35味中药的抑菌活性,发现35味中草药均具有一定的抑菌作用。其中,新疆产秦艽、玫瑰和沙棘对革兰氏阳性菌、革兰氏阴性菌具有显著的抑菌能力,甘草对革兰氏阳性菌具有较强抑菌作用。该试验发现,APLE对6种供试菌种均有一定的抑菌活性;其中,APLE对蜡样芽孢杆菌与沙门氏菌的抑菌活性最强。通过检测样品菌悬液中电导率与蛋白质含量的变化,发现胞内电解质大量泄露,这说明龙芽草抑制细菌增殖的机制可能与增加了微生物壁膜通透性有关[19]。
有研究发现,总黄酮具有抗炎作用,其作用机制主要包括影响前列腺素和NO的产生、产生抗炎细胞因子、抗氧化平衡和调节氧化应激等方面[20-21]。晏俊玲等[22]利用超声提取法提取出苦笋总黄酮,发现NO抑制率随总黄酮浓度的升高而增大,当苦笋总黄酮提取浓度达到1.20 mg/mL时,NO抑制率最大,达到93.94%,表明在此浓度下苦笋总黄酮能够较好抑制LPS诱导的小鼠腹腔巨噬细胞中NO的产生,同时可推测苦笋总黄酮具有一定的抗炎效果。赵双双等[23]以巨噬细胞RAW 264.7为试验细胞株,通过检测NO浓度评估无舌川西小黄菊的抗炎效果,发现无舌川西小黄甲醇提取物和乙酸乙酯萃取物均有显著的抗炎作用。该研究通过Western Blot法检测APLE对LPS诱导的Raw 264.7细胞中的iNOS与COX-2在蛋白水平表达的影响,发现APLE能够显著抑制iNOS与COX-2的表达,从分子和蛋白的角度进一步证实了APLE对LPS诱导的Raw 264.7细胞损伤具有一定的保护作用。综上所述,APLE在开发天然抑菌剂方面具有良好的应用前景,而对其具体作用机制与抑菌活性成分有待进一步研究。

