小分子药物治疗糖尿病肾病的药理作用研究进展
徐静鸽,张之钰,武佳慧,王丹,吴昱铮,刘梦扬,王涛,陈倩
天津中医药大学 组分中药国家重点实验室,天津 301617
糖尿病肾病是糖尿病最严重的微血管并发症之一,是导致终末期肾病的主要原因之一,也是导致心血管疾病发生的独立危险因素,能够增加患者的死亡风险[1-2]。糖尿病肾病的主要病理变化包括肾小球基底膜增厚、系膜扩张、结节性肾小球硬化、出球小动脉和入球小动脉管壁玻璃样变、足细胞损伤、肾小管上皮-间充质细胞转化和细胞外基质的进行性积累以及肾小管间质出现空泡、排列松散导致肾纤维化等。临床上将预估肾小球滤过率和尿白蛋白排泄作为未进行肾活检的糖尿病患者的糖尿病肾病的诊断依据[3]。
糖尿病肾病的病理机制复杂,长期高血糖是重要诱因。患者的血糖持续保持高水平会导致代谢紊乱、血流动力学异常、肾素-血管紧张素-醛固酮系统(RAAS)激活,引起脂肪酸蓄积、氧化应激、炎症因子释放,使肾脏中生长因子、血管活性激素、细胞因子和趋化因子水平增加[4-5]。目前糖尿病肾病的一线治疗方案主要是控制血糖、血脂和血压,临床多采用二甲双胍和血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体阻滞剂(ARB)等RAAS抑制剂治疗糖尿病肾病。
由于高血糖因素在糖尿病肾病发病机制中起关键作用,目前针对糖尿病肾病患者的管理更侧重于严格的血糖管理,如新型降糖药物钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂、胰高血糖素样肽-1(GLP-1)受体激动剂和二肽基肽酶-4(DPP-4)抑制剂等已投入临床使用,并在治疗过程中对肾脏、心血管表现出一定的保护作用[6-7]。但单一的降糖治疗对肾脏功能的改善仍存在不足。所以,未病先防、已病防变是糖尿病肾病临床治疗亟需突破的瓶颈。小分子药物是化学合成的活性物质,通常相对分子质量小于1 000,其发挥作用的实质是药物与靶蛋白之间的相互作用。大部分的小分子药物能够穿透细胞膜靶向细胞内蛋白,且具口服的生物利用性,其中许多优势使得小分子药物在治疗上有着无可取代的地位[8]。当前,针对性小分子药物的研发不仅需要不断完善糖尿病肾病的病理机制研究,也需要针对不同药物的起效靶点、合理用药。小分子药物可通过改善血流动力学、抗炎、抗氧化、抗肾间质纤维化等多种途径发挥防治糖尿病肾脏病的作用。本文综述了多种小分子药物防治糖尿病肾病的药理作用及其机制,旨在为早期干预或延缓糖尿病肾病进展的治疗和联合用药提供思路。
1 改善血流动力学
高血糖诱导的内皮功能障碍增加了血管对氧化应激和其他应激源的敏感性。由高血糖引起的内皮功能障碍和随后的微血管稀疏会减少血流量,增加耗氧量,最终导致缺氧。反过来,肾脏缺氧诱导血流、代谢和肾小球新血管生成的代偿性变化,机体最终是不适应这些变化,进而对肾脏造成损伤。RAAS 是一种激素级联反应,在动脉压、组织灌注和细胞外容量的动态平衡控制中起重要作用,RAAS 阻滞剂可以通过降低肾小球内压力来减少蛋白尿,也可以预防肾脏炎症和纤维化。此外,醛固酮通过激活还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶和血清糖皮质激素诱导激酶-1(SGK-1)诱导活性氧(ROS)的产生,进而产生炎症因子,导致肾小管间质和肾小球炎症和纤维化。血管紧张素II(Ang II)是一种内源性血管收缩剂,优先收缩肾小球游离小动脉,从而增加肾小球松弛率[9-10]。盐皮质激素受体在RAAS 中也起着重要作用。糖尿病肾病患者显示盐皮质激素活性增加,这可能是由循环醛固酮水平增加、皮质醇活性改变或盐皮质激素的局部表达增加引起的。
非奈利酮是非甾体类、选择性盐皮质激素受体拮抗体,用于Ⅲ~Ⅳ期慢性肾脏病或伴有严重升高的白蛋白尿2 型糖尿病的治疗,与安慰剂相比,在短期试验中可降低白蛋白尿,并延缓肾小球滤过率的下降速度,同时非奈利酮还能够降低慢性肾脏病的进展和发生心血管事件的风险(NCT02545049、NCT02540993)。近年来非奈利酮的有效性和安全性已逐步得到证实,目前已作为慢性肾脏病治疗指南推荐药物,可用于糖尿病肾病的治疗[11-12]。
依普利酮是一种特异性盐皮质激素受体,醛固酮与盐皮质激素受体结合,在调节水、盐代谢和血压中发挥作用。依普利酮已用于急性心肌梗死后充血性心衰和抗充血的治疗。在1 项随机、单盲研究中发现依普利酮联合雷米普利可减少糖尿病肾病患者的蛋白尿、降低蛋白尿肌酐比值。有实验证实,在对2 型糖尿病伴有蛋白尿患者的ACEI 治疗中加入依普利酮也可以改善蛋白尿(NCT01807221、NCT00315016)[13-14]。
2 抗炎
目前,普遍认为炎症信号通路的激活所引起肾损伤是糖尿病肾病发生、发展的重要病理机制。晚期糖基化终末产物是由高糖后的非酶糖基化反应产生的,在肾小球基底膜和系膜细胞中积累,促进糖尿病肾病进展。机制上,血管中晚期糖基化终末产物沉积、晚期糖基化终末产物受体和晚期糖基化终末产物之间的相互作用引起Toll 样受体(TLR)激活,启动巨噬细胞M1 型极化、浸润,同时作用于调节元件抑制蛋白(IκB)和IκB 激酶(IKK),使核因子-κB(NF-κB)进入细胞核后被激活,进而刺激促炎因子和趋化因子如肿瘤坏死因子-α(TNFα)、白细胞介素(IL)-1β、IL-6、单核细胞趋化蛋白-1(MCP-1)等的核转录水平,加重糖尿病肾病患者肾脏炎症损伤[15]。
甲基黄嘌呤衍生物己酮可可碱是一种非特异性磷酸二酯酶抑制剂,能够激活蛋白激酶A(PKC),抑制IL-6、TNF-α 等炎症因子产生,1 项己酮可可碱联合RAAS系统阻断治疗糖尿病肾病患者的临床试验表明,己酮可可碱可减轻蛋白尿,并减缓肾小球滤过率下降速度。己酮可可碱降低Ⅲ~Ⅳ期慢性肾脏病糖尿病患者血清TNF-α 水平,增加Klotho 水平,这种有益作用可能与抗炎和抗白蛋白尿作用有关(NCT03625648)[16]。可见己酮可可碱有望应用于针对炎症损伤引起的糖尿病肾病治疗。
糖尿病肾病患者肾脏组织样本转录组学分析发现几种Janus 激酶信号转导器和转录激活因子的表达量显著增加。JAK1 和JAK2 靶向抑制剂巴西替尼是一种口服小分子抑制剂,已发现对慢性炎症疾病具有显著作用。在1 项针对2 型糖尿病患者的II 期随机对照临床试验中显示(NCT01683409),与安慰剂组相比,巴西替尼能够减少蛋白尿,降低血浆炎症因子TNF-α[17]。因此JAK/STAT 通路有望成为改善肾功能进行性衰退的治疗靶点。
内皮素-1(ET-1)是一种有效的血管收缩肽,可以与ETA 和ETB 两种不同的受体结合。ETA 具有促进血管收缩、炎症、纤维化和细胞增殖的作用,而ETB 是其生理拮抗受体。ET-1 可以激活免疫细胞、内皮细胞和系膜细胞,激活NF-κB 通路,上调黏附因子和细胞因子的基因转录。在临床前研究发现,内皮素受体拮抗剂可以降低肥胖小鼠的肾损伤和巨噬细胞浸润,并降低炎症生物标志物[18]。1 项Ⅲ期临床研究发现,ETA 拮抗剂阿曲生坦减少了2型糖尿病患者的蛋白尿,但增加了心血管事件和死亡的发生风险。排除心血管高危风险患者后,阿曲生坦依然会增加患者外周水肿的发生风险。除了单用阿曲生坦外,与SGLT2 抑制剂合用会叠加肾脏的保护作用,并减少心血管疾病负担[19]。
慢性肾脏病和糖尿病肾病的氧化应激与一氧化氮(NO)、环鸟苷酸(cGMP)的生成和可溶性鸟苷酸环化酶(sGC)信号通路降低相关。sGC 激活剂可增加sGC 对NO 的敏感性,增加cGMP 的产生,从而增强糖尿病肾病患者体内的NO-sGCcGMP 信号,以达到减轻肾脏炎症和纤维化的目的。虽然在临床前研究中sGC 激活剂疗效较好,目前在临床研究中,sGC 激活剂对降低慢性肾脏病伴2 型糖尿病患者的蛋白尿还未有很好的效果[20]。
硝克柳胺是一种新型香豆素-阿司匹林衍生物,在临床前研究中,可通过减少蛋白尿和血尿素氮,增加肌酐清除率,改善肾小球硬化,显著减缓糖尿病肾病进展,其已知的分子机制包括阻断晚期糖基化终末产物的形成和降低血压,目前已进入中国糖尿病肾病的临床试验阶段,是一种有前途的肾脏保护剂[21]。司维拉姆是一种市售的非钙和非磷黏合剂,以非离子交换形式吸附无机磷酸盐,降低血液磷水平。研究表明,司维拉姆降低晚期糖基化终末产物的吸收。在1 项前瞻性临床研究中,比较了司维拉姆和碳酸钙对糖尿病肾病患者Ⅱ~Ⅳ期的疗效,结果显示司维拉姆降低晚期糖基化终末产物和促炎因子表达(NCT00967629)[22-23]。因此,司维拉姆可能对糖尿病肾病患者有肾脏保护作用。
巨噬细胞迁移抑制剂调节糖皮质激素介导的免疫抑制,在细胞存活信号转导中发挥显著作用。巨噬细胞迁移抑制剂在不同自身免疫性疾病中的进一步具体功能正在研究,巨噬细胞迁移抑制剂靶向的生物治疗正在早期临床试验中。巨噬细胞迁移抑制剂激活1 个由CD74 配体结合蛋白和CD44 信号转换器组成的多组分受体。CD74 信号通路导致细胞外信号调节激酶1/2(ERK1/2)的磷酸化,并通过JUN 激活域结合蛋白-1(JAB1)介导的持续激活[24]。动物实验证明巨噬细胞迁移抑制因子拮抗剂ISO-1 降低db/db 小鼠蛋白尿,巨噬细胞活化和上皮-间质转化[25]。这种效应可能是由于抑制了糖尿病肾病中巨噬细胞的活化,巨噬细胞迁移抑制因子拮抗剂可以作为糖尿病肾病的潜在治疗策略。
3 抗氧化
持续的高血糖会诱导肾脏细胞生成大量ROS,同时降低抗氧化酶活性,引起氧化应激反应,加剧肾脏损伤。ROS 会激活肾脏组织和系统中多个细胞因子和生长因子,如p38 丝裂原活性蛋白激酶(p38MAPK)、转化生长因子-β1(TGF-β1)、结缔组织生长因子(CTGF)等,进而导致肾小球硬化和肾小管间质纤维化,并通过促进脂质过氧化、DNA 损伤和线粒体功能紊乱等进一步促进糖尿病肾病的发生、发展[26]。氧化应激反应是多种糖尿病肾病发病机制相互作用的结果,同时激活其他致病通路。因此,抑制氧化应激反应可作为糖尿病肾病多靶点协同治疗的枢纽。
甲基巴多索酮是一种Nrf2 激活剂,在1 项针对2 型糖尿病和Ⅳ期慢性肾脏病患者的III 期临床试验中,与安慰剂组相比,甲基巴多索隆不能降低心血管疾病死亡的风险,这导致甲基巴多索酮还未有新进展(NCT01351675)[27]。可知甲基巴多索酮可以通过激活Nrf2 改善氧化应激,但作为治疗糖尿病肾病的潜在靶点药物需要进一步的临床试验。
在糖尿病肾病动物实验中,鲁伯斯塔特异性抑制蛋白激酶Cβ(PKCβ),发现其可改善肾小球高滤过,减少蛋白尿,缓解肾小球系膜扩张、肾小球硬化和肾小管间质纤维化[28]。1 项多中心Ⅲ期随机对照试验发现,与安慰剂组相比,糖尿病周围神经病变患者的蛋白尿肌酐比值降低,肾小球滤过率升高,同时目前鲁伯斯塔完成糖尿病性黄斑水肿的Ⅲ期临床试验(NCT00133952)[29],这表明鲁伯斯塔可以通过抑制氧化应激延缓糖尿病肾病的进展。
4 抗肾间质纤维化
肾脏纤维化是糖尿病肾病晚期常见的病理变化,也是促进肾脏损伤不可逆进展的重要因素。严重或持续性损伤后纤维化基质沉积,持续性的纤维化会损害组织结构和器官功能,最终导致肾功能衰竭[30]。研究表明,多种信号通路级联反应参与肾纤维化过程,干预特定靶点和通路预防纤维化的发生、延缓肾纤维化进程是保护糖尿病肾病患者的重要手段之一。TGF-β 信号通路在糖尿病肾病的肾纤维化过程中起到关键性作用。TGF-β 作为纤维化的关键介质,通过激活典型的(基于Smad)和非典型的(非Smad)下游信号通路和多种细胞因子等刺激细胞外基质的产生和抑制细胞外基质的降解来介导促纤维化作用[31]。通过阐明糖尿病肾病中肾纤维化的相关途径,总结已有靶向保护药物和有待研发的新药,为阻止、延缓乃至逆转肾纤维化进展的临床研究提供新的治疗干预思路。
目前已证实,糖尿病患者和糖尿病肾病患者中TGF-β1 水平均升高,并在细胞外基质蓄积、诱发炎症和瘢痕形成中起重要作用。TGF-β 抑制剂在糖尿病动物实验中被发现可以减少纤维化。吡非尼酮是一种抗纤维化药物,作为上市药物广泛用于特发性肺纤维化的临床治疗。但目前研究发现,吡非尼酮可在肾脏中发挥抗纤维化作用。吡非尼酮通过在体内和体外拮抗TGF-β 来减轻间充质细胞转化和肾纤维化,在1 项小型随机双盲对照试验中证实吡非尼酮的受试者在治疗6 个月后的平均肾小球滤过率显著高于安慰剂受试者(NCT00063583)[31]。
细胞周期蛋白与细胞周期蛋白依赖性激酶是调控不同细胞周期的关键组合。罗可维汀是一种抑制周期蛋白依赖性激酶的嘌呤类似物,可通过阻断糖尿病肾病中的MAPKp38 通路来预防肾小管间质纤维化[32]。细胞凋亡信号调节激酶1(ASK1)是丝裂原活化蛋白激酶家族的成员,ASK1 活化导致末端MAPK 的下游活化激酶p38 和c-Jun N-末端激酶(JNK)促进炎性细胞因子的产生,促进凋亡和纤维化,增加异常细胞增殖,导致代谢紊乱[33]。司隆色替是一种高选择性和强效的口服型ASK1 抑制剂。在1 项II 期临床试验中,评估司隆色替在中期至晚期糖尿病肾病患者中的安全性和有效性,结果显示司隆色替可抑制肌酐分泌,并且在4~48 周时,与安慰剂相比,司隆色替高剂量组的肾小球滤过率下降率降低18%,推测司隆色替减缓糖尿病肾病的进展(NCT02177786)[34]。GS-444217 是一种口服的ATP 竞争性ASK1 抑制剂,在啮齿动物模型中可显著抑制ASK1 的活性,减少肾脏进行性炎症和纤维化,改善肾小球滤过率,减少肾小管损伤。司隆色替联合血管紧张素转换酶抑制剂依那普利使用时,可进一步减少蛋白尿和促进肾小球硬化消退[34]。结果表明ASK1是肾脏疾病的重要靶点,并促进ASK1抑制剂治疗糖尿病肾病的临床开发。
5 结语
糖尿病肾病发病机制复杂,靶向治疗糖尿病肾病的信号通路较多,且各种信号通路之间存在一定的关联和串扰,因此整理了多种代表性小分子药物防治糖尿病肾脏病的药效/作用机制(表1)。基于科学研究和临床发现,调节炎症反应已成为延缓糖尿病肾病的潜在策略。主流治疗方法是通过抑制TLR、NF-κB 等信号通路,进而下调促炎细胞因子、趋化因子,如TNF-α、IL-6、MCP-1 表达,最终改善糖尿病肾病患者的炎症情况,减少肾脏损伤。反过来,晚期糖基化终末产物/RAGE 诱导的氧化应激和炎症进一步增强了糖尿病情况下晚期糖基化终末产物的生成。使用药物阻断晚期糖基化终末产物信号通路、激活抗氧化通路可预防高血糖诱导的晚期糖基化终末产物积累和过度ROS 引起的肾损伤。持续的严重炎症会导致上皮-间充质转化、内皮-间充质转化,成纤维细胞被激活。活化的内在肾细胞分泌细胞因子进一步促进肌成纤维细胞的形成。这些过程涉及多种信号通路,包括TGF-β、JAK/STAT 信号通路等。药物靶向上述信号通路可阻断肾细胞的间充质细胞转化以及胶原蛋白和纤维连接蛋白的表达,进而减少细胞外沉积,缓解肾纤维化(图1)。因此,需要深入挖掘并总结导致糖尿病肾病发生、发展的致病因素,为临床选用小分子靶向药物进行干预和治疗提供新思路。
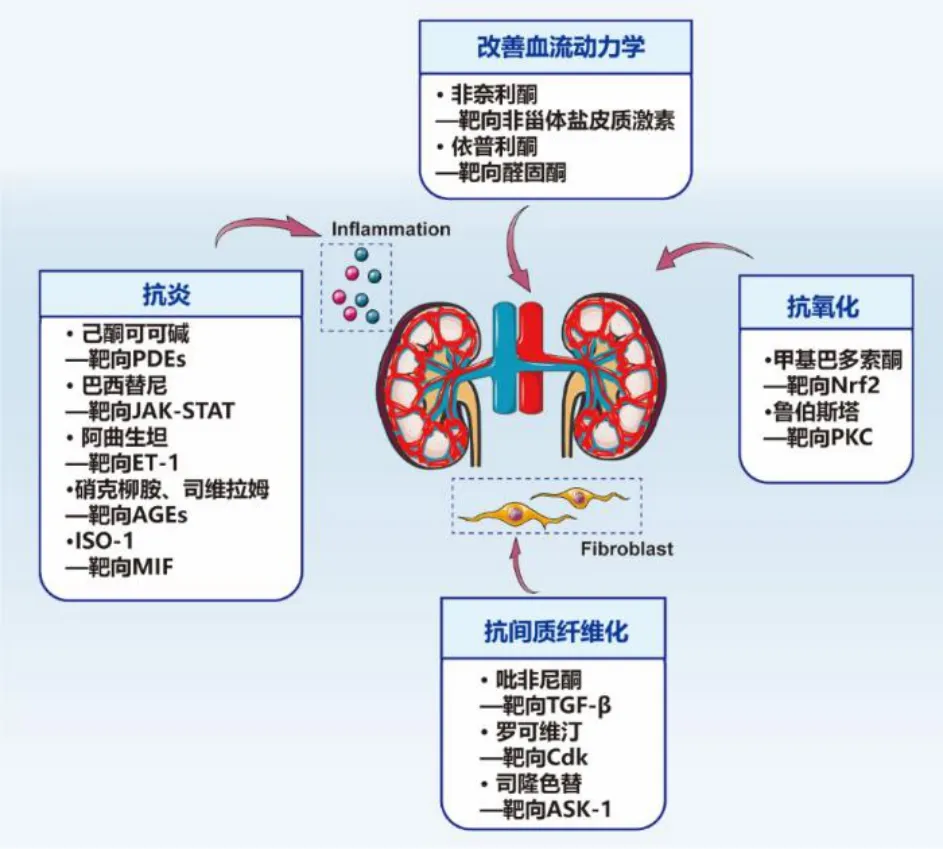
图1 代表性小分子药物防治糖尿病肾脏病的作用Fig.1 Mechanism of representative small molecule drugs against diabetes kidney disease

表1 代表性小分子药物防治糖尿病肾脏病的药效/作用机制Table 1 Efficiency/mechanism of representative small molecule drugs against diabetes kidney disease
一些有前途的小分子靶点药物正在出现,以保护糖尿病患者的肾功能,这些临床进展将为肾功能逐渐丧失导致健康状况不佳和生活质量下降的患者带来希望。目前这些新疗法正在评估临床相关肾脏终点的大规模随机对照试验,如肾小球滤过率降低50%或是否需要启动肾脏替代治疗。其中一些药物,由于其作用方式,也可能有利于由糖尿病肾病以外的病理过程引起的蛋白尿肾病患者。考虑到未得到满足的需求,临床医生无疑会倾向使用这些新疗法,并将在肾脏终点事件之前,在慢性肾病患者中启用这些小分子药物,以获得其他临床收益,如降低心血管事件风险。基于在研阶段的已取得成果,相信随着研究的加深以及新技术的涌现,糖尿病肾病能够得到更好的临床诊断和防治,为糖尿病肾病患者带来福音。
利益冲突所有作者均声明不存在利益冲突

