长链非编码RNA Linc00467在肿瘤中的作用研究进展
张文青,何迎春综述 王贤文审校
长链非编码RNA(long non-coding RNA,lncRNA)是一种新型低编码潜能的、长度超过200个核苷酸的内源性RNA,与调控肿瘤细胞增殖、转移以及免疫监视等多种生物学功能相关,其可在转录水平或转录后影响基因的表达,进而影响肿瘤细胞的恶性过程[1]。Linc00467是一种新发现的lncRNA,在多种肿瘤中呈异常高表达,并广泛参与肿瘤的增殖、转移和耐药[2-3]。其对肿瘤发生发展具有明显促进作用。但调控机制和研究现状尚未有明确的概括和总结。因此,文章对Linc00467在人体恶性肿瘤中的作用及其机制研究进展进行综述,以期对其有更全面深入的了解。
1 Linc00467概述
Linc00467是一种新发现的lncRNA,位于1q32.3,有4个转录本,全长3 508 bp[4]。作为竞争性内源RNA(competitive endogenous RNA,ceRNA),Linc00467可通过与某些miRNA的竞争性抑制,调节下游靶向编码基因,形成Linc00467—miRNA—mRNA的调控轴,通过调控p53、NF-kb-p65、EZH2等重要信号通路分子[2,5-6],Linc00467对肿瘤发生发展具有明显促进作用。除此之外,Linc00467通过调控相关分子广泛参与基因修复、铁死亡、EMT,肿瘤免疫、泛素化、甲基化以及能量代谢过程[6-12],对多种肿瘤细胞具有相当程度的促癌作用。Linc00467有望成为肿瘤诊断、治疗和预后的新型生物标志物。
2 Linc00467在肿瘤中的作用机制
2.1 作为ceRNA调控miRNA miRNA是一类由内源基因编码的非编码RNA分子,其可以与mRNA的3’UTR相互作用使mRNA去甲基化和失稳。作为ceRNA,Linc00467可以像分子海绵一样在细胞质中吸附miRNA并降低其活性,间接上调其下游靶基因的表达。多项研究结果表明,Linc00467可以作为ceRNA在不同的肿瘤中调控不同的miRNA及其靶基因参与肿瘤恶性进程,见表1。
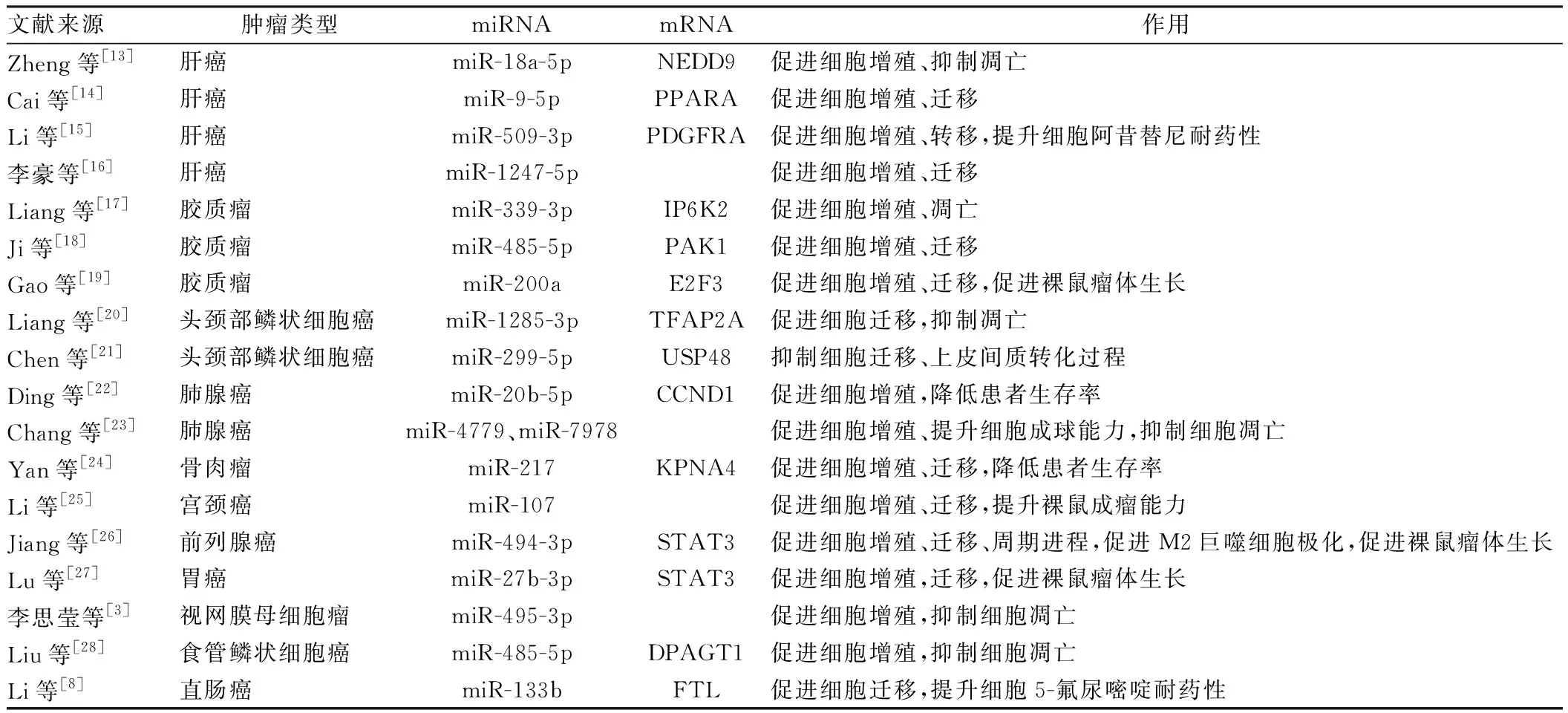
表1 Linc00467在多种肿瘤中的分子作用机制
除作为ceRNA调控miRNAs(如miR-217)外,Linc00467还可作为“分子诱饵”和引导型lncRNA直接结合NF-kb-p65 mRNA以及NF-kb-p65蛋白,通过促进NF-kb-p65的核易位来激活NF-κB信号通路[2]。总之,Linc00467通过对特定蛋白、miRNAs及其靶基因的调控,对肿瘤细胞的恶性过程具有重要作用。
2.2 维持肿瘤细胞增殖 细胞不受控制的增殖,是肿瘤发生发展过程中的核心要素。研究发现,Linc00467在诸多肿瘤中均存在高表达,并可明显地促进肿瘤细胞的恶性增殖过程。高表达的Linc00467可通过促进整联蛋白β3(recombinant integrin beta 3,ITGB3)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达,同时抑制caspase-3表达,通过核苷酸和碱基切除修复,以及不匹配修复等多途径参与DNA修复,并通过调控细胞周期相关蛋白(cyclins、CDK等),将DNA代谢与细胞周期进展相协调,进而提升肿瘤细胞的增殖和生存力水平[7,29]。Ding等[22]利用生物信息学分析预测,并采用荧光素酶报告基因分析证实,Linc00467可调控miR-20b-5p与CyclinD1 3’-UTR区域结合,加强肺腺癌中G1/S-特异性周期蛋白-D1(CyclinD1)的表达,并促进CyclinD1与细胞分裂蛋白激酶6(CDK6)形成CyclinD1—CDK6复合体,推进肿瘤细胞由G1期向S期的进程[30-31]。总之,Linc00467可调控ITGB3、cyclins等蛋白,通过基因修复、促进细胞周期进程等多种方式维持肿瘤细胞恶性增殖,为肿瘤这类恶性增殖疾病的诊断和治疗提供了新的靶点。
2.3 抑制肿瘤细胞死亡 细胞增殖和死亡之间的平衡被打破,是肿瘤细胞得以存活并不断恶化发展的关键。p53作为抑癌基因,是维持细胞正常代谢的关键要素,除可阻止细胞非正常增殖外,p53还可引导细胞走向凋亡,而一旦p53基因损伤或突变就可能引发细胞癌变[32]。Zhang 等[5]通过RNA结合蛋白免疫沉淀(RIP)和染色质免疫沉淀(ChIP)分析证实,Linc00467可与DNA甲基转移酶1(DNMT1)结合,通过稳定其表达,并使之结合到p53启动子区域抑制转录,使得原本的平衡向抑制凋亡倾斜。另外,在p53参与肿瘤细胞凋亡研究的过程中,Koldobskiy等[33]发现肌醇6磷酸激酶-2(IP6K2)可能通过选择性地减少p21等的表达来促进依赖p53的凋亡。目前虽不能直接证明Koldobskiy等的推测,但IP6K2已被报道受Linc00467调控,并参与抑制肿瘤细胞凋亡的过程。Linc00467可否经IP6K2调控p53促进肿瘤细胞凋亡值得进一步研究。
铁死亡是新发现的一种细胞程序性死亡模式。其中,铁蛋白轻链(ferritin light chain,FTL)作为机体最主要的铁储存仓,可通过促进铁水合物成核,在铁成核和蛋白质稳定性中起作用,从而使铁蛋白具有铁排毒和铁储备的双重功能[34]。p53基因作为抑癌基因,能够抑制铁调节蛋白(iron regulatory protein,IRP)的活性,通过降低细胞膜表面转铁蛋白受体1(transferrin receptor 1,TFR1)表达,进而促进细胞内铁蛋白的合成,通过限制细胞铁代谢来抑制肿瘤细胞生长[35]。另外,NF-κB信号通路也与铁死亡密切相关。而Linc00467则可参与调节FTL、p53、NF-kb-p65表达[2,5,8],但关于lincRNA与铁死亡关系的研究还不够丰富,Linc00467与铁死亡的直接关系目前更是尚未涉及。
综合以上研究可以发现,Linc00467抑制p53表达与肿瘤细胞凋亡、铁死亡具有密切关系,另外。Linc00467还可能与p53参与的甲基化泛素化过程有关(Linc00467参与甲基化泛素化过程在2.6中阐释),目前关于p53抑制肿瘤恶性行为的研究是丰富的,但关于Linc00467与p53的研究可能不止局限于此,Linc00467可能成为抑制p53作用的重要靶点,但其中的作用机制还值得深入研究。
2.4 促进肿瘤侵袭转移 肿瘤细胞通过上皮细胞向间质细胞转变(EMT)失去已分化细胞特征增强转移能力,并通过破坏基底膜屏障以侵入血管或淋巴管,进而实现恶性程度的升级。在此过程中,E-钙黏蛋白(E-cadherin)的缺失和N-钙黏蛋白(N-cadherin)上调是其转移能力增强的标志,基质金属蛋白酶(MMP-2、MMP-9等)的上调则可催化Ⅳ型胶原蛋白溶解破坏基底膜屏障[36]。目前已经证实,Linc00467可通过多种方式调控以上相关蛋白表达并降低上皮屏障的完整性和增强细胞转移能力。如Linc00467可上调泛素特异性蛋白酶-48(ubiquitin-specific protease 48, USP48)表达水平增强肿瘤坏死因子受体相关因子2(TNF receptor-associated factor 2, TRAF2)稳定性、增强EMT过程的必要启动剂高迁移率族AT Hook蛋白1(high mo-bility group AT-hook 1, HMGA1)表达等[37-39]。另外,Linc00467还可通过miR-128-3p/VEGFC轴促进血管生成[39],以及结合NF-kb-p65 mRNA、NF-kb-p65蛋白促进NF-kb-p65的核易位来激活NF-κB信号通路,以促进肿瘤细胞的迁移侵袭过程[2]。此提示Linc00467对肿瘤转移的促进作用可能与促进血行转移密切相关,为后续的肿瘤转移靶向治疗和预后指标研究提供了理论依据。
调味增强子同源物2(enhancer of zeste homolog 2,EZH2)作为关键的表观遗传调节剂和EMT诱导剂,通过其SET结构域催化组蛋白H3中的Lys-27三甲基化来抑制其靶基因的转录,可促进癌细胞EMT和转移过程。研究发现,lncRNA ANCR可通过降低EZH2稳定性来发挥乳腺癌进展和转移的重要作用[40]。类似地,高表达的Linc00467可募集EZH2,通过下调Dickkopf 同源物1(Dickkopf homolog 1, DKK1)表达激活Wnt/b-catenin信号通路[9]、与EZH2结合到抑癌基因HtrA丝氨酸肽酶3(HtrA serine peptidase, HTRA3)的启动子位置等方式促进肿瘤细胞迁移侵袭[6]。张硕稳等[41]通过对109例乳腺癌患者进行随访并进行组织检测发现,Linc00467高表达患者3年内复发转移率升高,此提示Linc00467有作为乳腺癌复发转移的生物学指标的潜力。
综上,Linc00467主要通过调控USP48、EZH2以及NF-κB信号通路等促进肿瘤转移过程。除直接促进肿瘤细胞迁移侵袭外,Linc00467还参与肿瘤微环境的改变促进肿瘤转移的进程(Linc00467与肿瘤微环境的关系在2.6中阐释),针对Linc00467调控相关因子以及调控肿瘤微环境参与EMT过程的作用值得深入研究。
2.5 提升肿瘤细胞耐药性 目前,常规放化疗仍是肿瘤治疗的主要手法,而耐药性的出现是肿瘤细胞对抗治疗的关键。在此过程中,Linc00467可作为ceRNA经miR-363调控ABC超家族蛋白(ABCB1、ABCC1、ABCG2)表达、与胰岛素样生长因子-2 mRNA结合蛋白3(insulinlike growth factor 2 mRNA binding protein 3, IGF2BP3)结合、作用于下游靶基因(CDK1和CDC45)等方式促进耐药[42-43]。IGF2BP3作为mRNA定位、稳定性和翻译控制的转录后调控因子,在Linc00467促进肿瘤细胞耐药过程中具有重要作用。当IGF2BP3表达升高时,可使ABCG2以及CD133的表达增加促进耐药。另外,IGF2BP3还可与CD44结合、ABCB1的m6A修饰区域结合促进其稳定性和表达,通过外排放化疗药物以获得多药耐药性[44-47]。另外,饶春宝等[48]发现Linc00467与IGF中的另一成员胰岛素样生长因子结合蛋白2(insulin-like growth factor binding protein 2, IGFBP2)也具有潜在的结合能力。IGFBP2作为一种细胞自主性因子,其高表达也往往与肿瘤细胞耐药性相关[49]。综上,Linc00467促进肿瘤耐药的相关机制可能与miR-363调控的ABC超家族蛋白关系密切,开发靶向Linc00467药物,并进行靶向药物与放化疗药物的联合研究,可能有助于解决当前放化疗相关耐药的问题。
2.6 其他作用 在肿瘤发展过程中,肿瘤细胞可通过多种方式改变周围微环境以有利于自身发展,其中,M1型巨噬细胞可诱导炎性反应消除肿瘤细胞,而M2型巨噬细胞则是拮抗炎性反应促进肿瘤进展,肿瘤微环境中M1/M2比例失调在肿瘤发生发展、免疫逃避及转移耐药过程中发挥关键作用[50-51]。研究发现,Linc00467可能是抗肿瘤免疫的负调节剂,它通过抑制CD8+、CD4+T细胞等免疫细胞的浸润来促进肿瘤进展[10]。另外,在肺腺癌中Linc00467会被巨噬细胞摄取,并会在肺腺癌细胞作用下发生极化,转变为M2型巨噬细胞诱导巨噬细胞极化,进而促进肺腺癌细胞的增殖能力[52]。这表明Linc00467在对肿瘤微环境的调控中具有研究潜力,Linc00467可能是促使巨噬细胞M2型极化的直接靶点。但目前对此研究尚未深入,Linc00467在肿瘤微环境以及诱导巨噬细胞极化中的作用机制还值得深入挖掘。
另外,研究发现Linc00467还与泛素化甲基化有关。在缺乏基因毒性应激的情况下,p53可结合到DNA甲基转移酶1(DNA- methyltransferase 1, DNMT1)启动子的共有位点,从而阻止DNMT1 基因的表达[53-54]。Linc00467则可调控DNA甲基化过程,通过与DNMT1结合到p53启动子区域反转p53对于DNMT1的作用并抑制细胞凋亡[5]。另外,Linc00467还通过DNMT1进行Reprimo启动子的甲基化,通过下调Reprimo促进胃癌的生长和转移[11],参与DNA甲基化的EZH2也受其调控[6]。研究发现,泛素特异性蛋白酶-48(ubiquitin-specific peptidase 48, USP48)能够通过与Mdm2相互作用进而促进Mdm2对p53的泛素化降解,并通过与p53的氮端结合阻断p53的转录活性[55],Linc00467则可上调USP48表达水平,并还可通过降低TRAF2的稳定性促进肿瘤细胞恶性进程[37]。总之,Linc00467对甲基化和泛素化过程具有重要调控作用,且p53可能是其一关键节点。但作为维持甲基化的DNMT1与在CpG位点引入甲基的DNMT3a和DNMT3b是如何作用,Linc00467在其中是否具有作用,以及Linc00467对于去甲基化的TET家族又具有何种作用还值得进行研究。
除了调节下游基因的表达水平,Linc00467还鲜有蛋白质编码RNA的功能,Ge等[12]发现,Linc00467还可编码微肽ASAP与ATP合酶亚基(ATP5A、ATP5C)结合,通过促进ATP合酶活性,线粒体以及整个肿瘤细胞的ATP产能得以提升。虽然目前对Linc00467的研究主要集中在其与miRNA或蛋白质的相互作用上,但其编码的小肽对细胞增殖的作用也值得研究。
3 小结与展望
肿瘤作为恶性增殖细胞,维持恶性增殖是其最主要的特征,为满足增殖需求,一方面其需要维持快速增殖同时对抗死亡,另一方面则需要拓展新的发展领地。研究已经证实,Linc00467与各种肿瘤的恶性进展和不良预后有关,其高表达可促进细胞增殖、抑制细胞凋亡和提升肿瘤耐药性保持其恶性增殖状态,又可通过促进肿瘤侵袭和迁移开辟新的恶性增殖过程,而沉默Linc00467则产生相反的效果。此外,LncRNA在血浆中具有很高稳定性,已有研究表明Linc00467可以作为急性骨髓性白血病诊断和治疗的标志物[56]。因此,研究患者血液或其他体液中Linc00467的表达水平有利于评估其作为肿瘤早期诊断和预后的生物标志物,靶向沉默Linc00467可能是一种合适的治疗策略,但仍需要更多的研究来验证这一点。
在肿瘤中,Linc00467可通过多种调节机制发挥作用。作为诸多miRNAs的ceRNA,Linc00467通过海绵吸收这些miRNAs,可改变下游基因的表达水平。另外,Linc00467还可通过与某些蛋白质相互作用、调节经典信号通路发挥促进肿瘤恶性进程的作用。但部分研究者只研究了Linc00467对体外肿瘤细胞的作用,却并未深入研究其机制,更未对其发现进行进一步的体内验证,虽确定了其对肿瘤细胞的抑制作用,却也具有一定的局限性。另外,Linc00467还参与调控肿瘤微环境、泛素化、甲基化、ATP生成等方面促进肿瘤恶性进展。总之,Linc00467对促进肿瘤细胞恶性生物学行为具有不可否认的作用,但研究者大多对其机制研究不够深入,Linc00467对于各肿瘤恶性行为的相互作用研究也不够全面,对此或许值得不断深入研究探讨。

