NRG1、HER3在前列腺癌组织中的表达及其与临床病理特征和预后的关系
王潇然,陆巍,于欣,王永杰,王勇,廉吉虎,李震霄,宋海涛
前列腺癌(prostate cancer,PC)是男性常见恶性肿瘤,2018年全球PC新发病例达128万例,死亡36万例[1]。目前PC的临床治疗策略包括等待观察、根治性切除术及根治性放疗等[2]。PC治疗方式不当、治疗不足或治疗过度均会严重影响患者生活质量及死亡率。因此,有必要探索能够评估PC预后的肿瘤标志物。神经调节蛋白1(neuregulin-1,NRG1)是一种细胞膜表面糖蛋白,介导细胞—细胞信号传导,在器官系统的分化发育中发挥关键作用[3]。近年来发现,由于DNA结构重排导致NRG基因融合,引起NRG蛋白表达升高,能够促进肺癌、乳腺癌等恶性肿瘤的增殖和转移,是潜在的肿瘤标志物及治疗靶点[4]。人表皮生长因子受体3(human epidermal growth factor receptor 3,HER3)属于受体酪氨酸激酶家族成员,能够与表皮生长因子结合形成异二聚体,激活下游信号传导,导致膀胱癌、乳腺癌细胞的恶性增殖和转移[5-6]。目前,PC中NRG1、HER3的表达及临床意义报道较少。本研究通过免疫组化检测PC中NRG1、HER3的表达,探讨两者与临床病理特征及预后的关系,报道如下。
1 资料与方法
1.1 临床资料 选取2015年2月—2020年2月吉林省人民医院泌尿外科诊治PC患者96例,年龄45~79(63.15±6.19)岁,病程3天~2个月;既往史:有吸烟史44例,高血压史24例,糖尿病史9例;术前前列腺特异抗原(prostate specific antigen,PSA)≥20 μg/L者51例,<20 μg/L者45例;采用Gleason评分系统进行病理分级,>7分者39例,≤7分者57例;TNM分期:Ⅰ~Ⅱ期60例,Ⅲ期36例。本研究经医院伦理委员会审核批准(2023045),患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①均接受根治性手术,术后病理明确为PC;②初次治疗,无内分泌治疗及放疗等;③体能状况良好,KPS评分>80分;④临床资料完整。(2)排除标准:①预期寿命<10年;②合并其他恶性肿瘤;③术前盆腔CT、MR检查或ECT提示存在肿瘤淋巴结转移或远处器官转移;④合并严重慢性基础疾病,不能耐受手术或麻醉。
1.3 观测指标与方法
1.3.1 NRG1、HER3检测:留取术中获取的PC癌组织和癌旁组织,常规10%中性甲醛固定12 h,石蜡包埋,切片层厚5 μm,65℃烤片2 h。免疫组化染色步骤按照试剂盒(北京中杉金桥公司,货号SAP9100)说明书进行。NRG1、HER3单克隆抗体购自美国Abcam公司,货号ab217805、ab255607。DAB显色5 min,苏木素复染5 min,盐酸酒精分化5 s,中性树脂封片。日本奥林巴斯公司CX31型显微镜下(200倍)随机选取5个视野,行半定量染色评分。染色强度:细胞内未见染色评0分,浅黄色或黄色评1分,棕黄色评2分。阳性细胞数目占总细胞数目的百分比:≤25%评0分,26%~50%评1分,≥51%评2分。上述两项评分乘积<2分定义为阴性,≥2分评为阳性。
1.3.2 随访:PC患者出院后开始随访,采用门诊和电话方式进行,术后第1年每1~3个月随访1次,以后每3~6个月随访1次,随访内容包括体格检查、血清PSA、盆腔MR等。记录患者有无复发、转移及死亡等。肿瘤进展定义为随访过程中连续2次检测血清PSA>0.2 μg/L(生化复发)、肿瘤局部临床复发、远处转移或患者死亡。无进展生存时间为自确诊至发生肿瘤进展的时间。随访截止至2023年3月1日,随访终点为肿瘤进展或随访结束。
1.4 统计学方法 采用SPSS 24.0统计软件分析数据。计数资料以频数或率(%)表示,比较采用χ2检验;Pearson卡方检验分析NRG1、HER3表达与临床病理特征的关系;Kaplan-Meier法对PC患者无进展生存率进行分析,绘制生存曲线;多因素Cox风险回归模型进行多因素预后分析。P<0.05为差异有统计学意义。
2 结 果
2.1 组织中NRG1、HER3表达情况 PC癌组织中NRG1、HER3棕黄色阳性染色定位于细胞浆和细胞膜。PC癌组织中NRG1、HER3阳性率分别为78.13%(75/96)、75.00%(72/96),高于癌旁组织NRG1、HER3阳性率6.25%(6/96)、8.33%(8/96),差异均有统计学意义(χ2=101.670,87.771,P均<0.001),见图1。
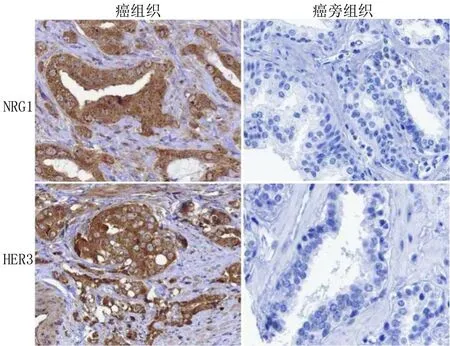
图1 PC患者癌和癌旁组织中NRG1、HER3表达(免疫组化染色,×200)Fig.1 Expression of NRG1 and HER3 in cancer and adjacent tissues of PC patients (immunohistochemistry, × 200)
2.2 癌组织NRG1、HER3表达在PC患者不同临床病理特征中比较 TNM分期Ⅲ期、Gleason评分>7分及术前PSA水平≥20 μg/L患者癌组织中NRG1、HER3阳性率分别大于TNM分期Ⅰ~Ⅱ期、Gleason评分≤7分及术前PSA水平<20 μg/L,差异具有统计学意义(P均<0.05)。见表1。
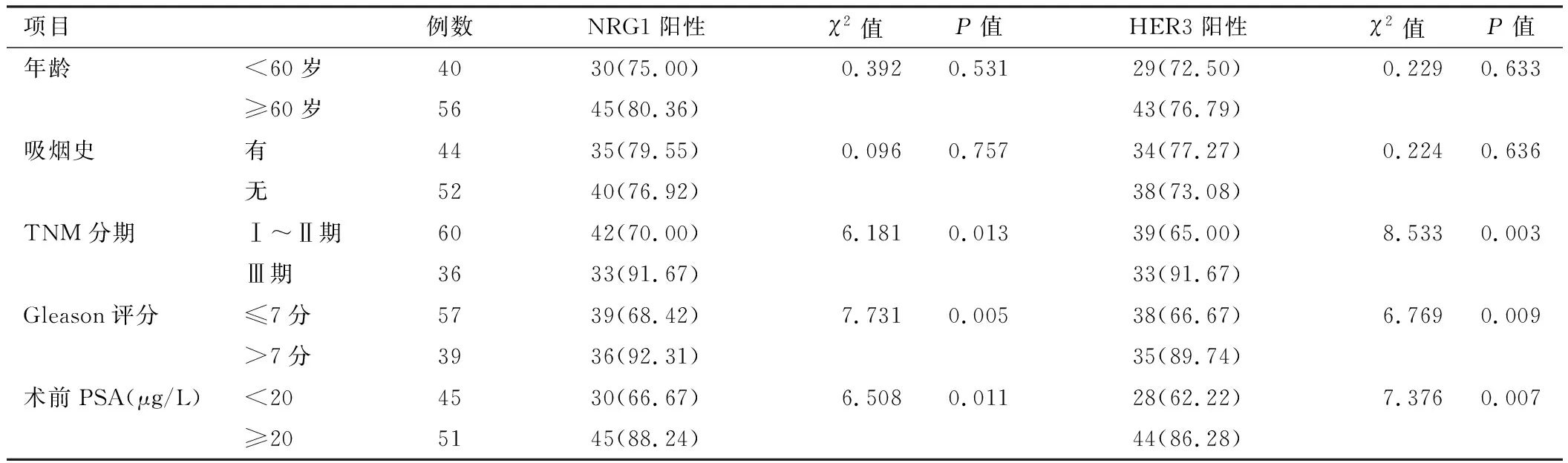
表1 PC癌组织中NRG1阳性、HER3阳性表达在不同临床病理特征中比较 [例(%)]Tab.1 Comparison of NRG1 positive and HER3 positive expression in different clinical and pathological characteristics in PC cancer tissues
2.3 癌组织NRG1、HER3表达对PC患者预后的影响 96例PC患者随访中失访2例,进展26例,3年无进展生存率为72.92%(70/96)。NRG1阳性组和阴性组3年无进展生存率分别为68.00%(51/75)、90.48%(19/21),HER3阳性组和阴性组3年无进展生存率分别为66.67%(48/72)、91.67%(22/24)。NRG1阳性组、HER3阳性组3年累积无进展生存率分别低于NRG1阴性组、HER3阴性组,差异均有统计学意义(Log-rankχ2/P=4.267/0.039,5.499/0.019),见图2。
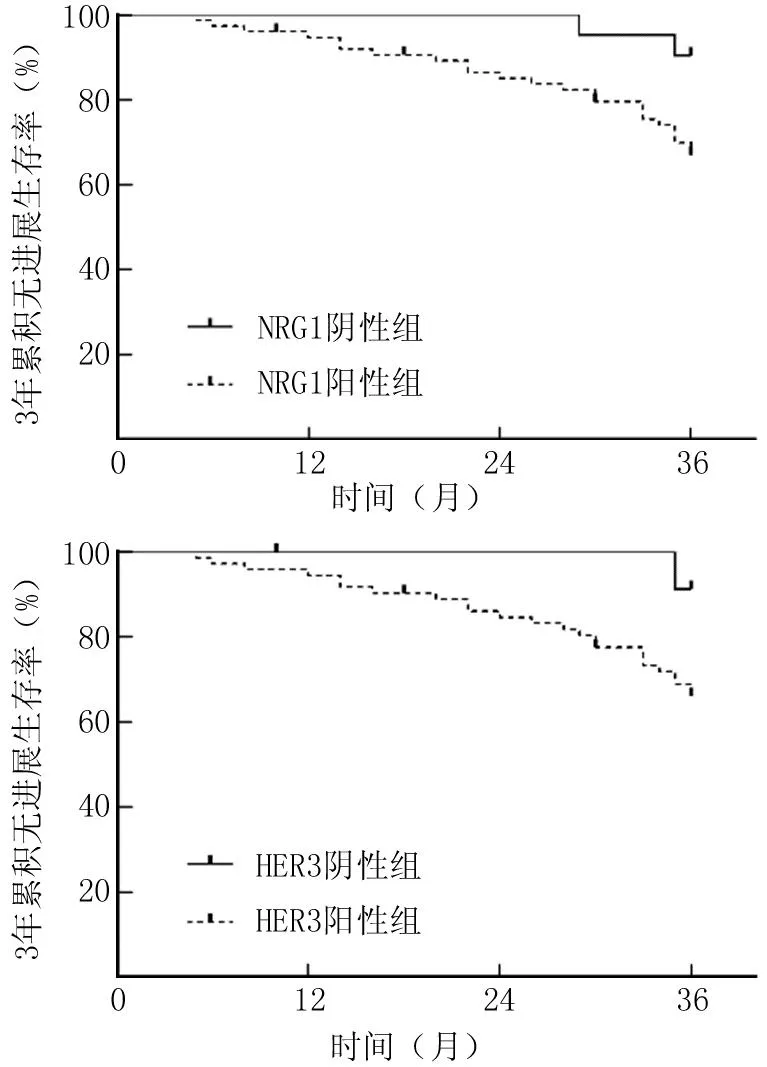
图2 Kaplan-Meier曲线分析癌组织NRG1、HER3表达对PC患者预后的影响Fig.2 Kaplan Meier curve analysis of the impact of NRG1 and HER3 expression in cancer tissue on the prognosis of PC patients
2.4 多因素Cox回归分析影响PC患者预后的因素 以PC患者预后为因变量(1=进展,0=未进展,t=时间),纳入年龄(1=≥60岁,0=<60岁)、吸烟史(1=有,0=无)、TNM分期(1=Ⅲ期,0=Ⅰ~Ⅱ期)、Gleason评分(1=>7分,0=≤7分)、术前PSA(1=≥20 μg/L,0=<20 μg/L)、NRG1(1=阳性,0=阴性)、HER3(1=阳性,0=阴性)为自变量,进行多因素Cox回归分析,结果显示:TNM分期Ⅲ期、Gleason评分>7分、术前PSA≥20 μg/L、 NRG1阳性、HER3阳性是影响PC患者预后的独立危险因素(P<0.01),见表2。
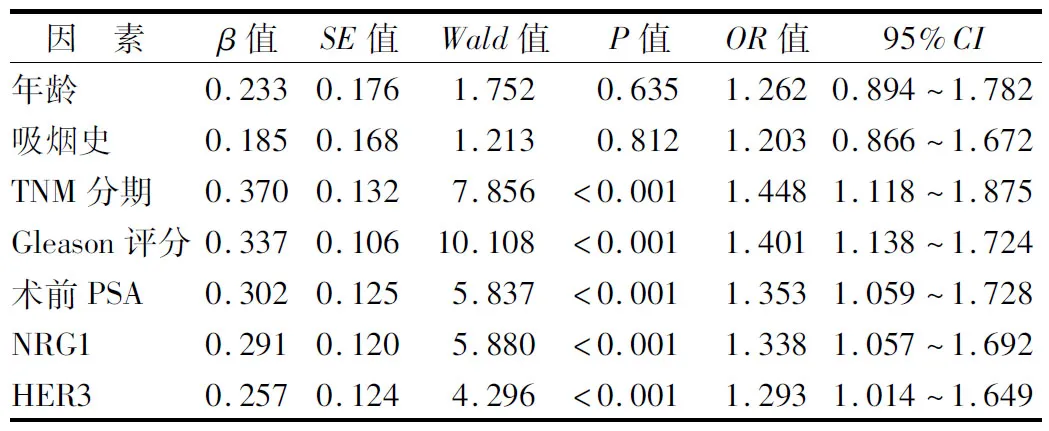
表2 PC患者预后的多因素Cox比例风险回归模型分析Tab.2 Multivariate Cox proportional risk regression model analysis for the prognosis of PC patients
3 讨 论
PC是中国男性泌尿生殖系统最常见的恶性肿瘤,人口标化发病率为6.59/10万,人口标化病死率为2.61/10万[7]。PSA是早期筛查PC最常用的血清标志物,在PC早期诊断及预后风险分层评估中具有重要的参考价值[8]。但PSA具有前列腺器官特异性但并非前列腺癌特异性生物标志物,其表达水平不仅在前列腺增生、前列腺炎等前列腺良性疾病中均可升高,还受到直肠指检、射精及导尿等因素的影响[9]。因此,有必要积极探索PC的疾病机制,寻找能够预测PC临床转归的生物标志物。
NRG1编码基因位于人类8号染色体,编码产生的NRG1蛋白在结构上具有表皮生长因子结构域,膜结合形式蛋白能水解为游离形式[10]。研究发现,NRG1能结合和激活周围细胞表面的HER3和HER4,活化下游Yes相关蛋白、丝裂原活化蛋白激酶信号通路,发挥促进肿瘤细胞增殖的效应[11]。本研究中,PC癌组织中NRG1表达升高,与不良临床病理特征有关,表明NRG1能促进PC肿瘤的发生发展。PC中NRG1的表达升高与NRG1基因重排及肿瘤微环境中肿瘤相关成纤维细胞分泌NRG1增多有关。有研究报道,肺癌、肾癌及前列腺癌等恶性肿瘤中均存在NRG1基因重排的现象,引起NRG1的异常表达上调,NRG1与其他融合伴侣包括CD74、SDC4等形成融合蛋白,激活磷脂酰肌醇3激酶/AKT信号通路,促进肿瘤细胞侵袭和转移[12]。另外,PC肿瘤微环境中的肿瘤相关成纤维细胞也能够分泌产生NRG1,NRG1能通过旁分泌途径,结合激活相邻PC肿瘤细胞表面的HER3受体,促进肿瘤过度增殖[13]。本研究中,NRG1阳性PC患者无进展生存预后较差,提示NRG1是新的评估PC预后的肿瘤标志物。笔者分析,一方面是NRG1的表达升高能够增加肿瘤细胞的侵袭和转移能力,术中难以彻底切除肿瘤微小病灶,造成术后复发或转移。另一方面,NRG1阳性的PC肿瘤细胞术后抗雄激素治疗耐药性较强,肿瘤术后容易复发。有学者在PC小鼠模型和前列腺癌类器官培养中发现,肿瘤相关成纤维细胞能够分泌产生NRG1,能够诱导PC肿瘤细胞抗雄激素治疗的耐药性形成及雄激素抵抗的发生,予以NRG1抗体进行治疗,则能够重新恢复PC肿瘤细胞对抗雄激素治疗的敏感性[13]。因此,NRG1的表达上调促进PC肿瘤的发生发展,可能是新的评估PC预后的肿瘤标志物。
HER3是表皮生长因子受体家族第三成员,由于HER3缺乏关键催化残基不能催化其他激酶,既往认为是其他家族成员的信号传导底物[14]。近年来发现,HER3激酶区域具有变构激活功能,能够与HER2形成异源二聚体,促进HER2阳性乳腺癌增殖、转移[15]。本研究中,PC癌组织中HER3表达升高,与不良临床病理特征有关,提示HER3促进PC的肿瘤发生发展。PC中HER3的表达上调与红细胞凝集素的表达调控有关。研究发现,红细胞凝集素能够以自分泌的方式促进HER3的表达及磷酸化激活,促进PC肿瘤细胞中磷脂酰肌醇3激酶/Akt信号通路的过度活化,导致肿瘤恶性增殖[16]。Lee等[17]报道,G蛋白偶联受体也可通过反式激活HER3,进一步活化丝裂原活化蛋白激酶及蛙皮素受体,促进肿瘤恶性增殖、转移及耐药性形成。本研究中,HER3阳性PC患者预后较差,表明检测PC癌组织中HER3的表达有助于评估患者临床预后。分析其原因,HER3阳性的PC肿瘤细胞增殖转移能力较强,肿瘤细胞对抗雄激素等药物治疗的耐药性较强,导致患者不良预后。研究表明,肿瘤中HER2/HER3异源二聚体的形成能够降低肿瘤细胞对帕妥珠单抗治疗的敏感性,促进肿瘤脑转移的发生[18]。有研究证实,HER3特异性抑制剂或靶向HER3的抗体药物偶联物U3-1402均能够显著抑制去势抵抗性前列腺癌肿瘤类器官的恶性增殖和转移[19]。本研究中,PC癌组织中NRG1和HER3表达呈显著正相关,表明PC中两者存在协同促癌的作用。这与既往研究发现的NRG1能够结合并激活HER3,然后HER3与HER2形成异源二聚体,激活下游增殖信号通路的报道结果一致[13, 20]。因此,以NRG1/HER3为靶点的治疗是潜在的PC治疗方案,值得临床深入研究。
综上所述,PC癌组织中NRG1、HER3表达升高,NRG1,HER3表达与Gleason评分、TNM分期及术前PSA水平有关,均参与PC的肿瘤进展。NRG1阳性、HER3阳性PC患者的无进展生存预后较差,是影响PC患者无进展生存预后的独立危险因素,是新的PC预后相关肿瘤标志物。本研究也存在一定的局限,本研究样本量及随访时间有限,并且未能对NRG1、HER3的具体作用机制进行实验研究,有待今后进行深入的基础和临床研究进一步探索。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王潇然、陆巍:设计研究方案,实施研究过程,论文撰写;于欣、王永杰:提出研究思路,分析试验数据,论文审核;王勇、廉吉虎:实施研究过程,资料搜集整理,论文修改;李震霄:进行统计学分析;宋海涛:论文撰写

