谷胱甘肽酵母水解物对干露胁迫下凡纳滨对虾肝胰腺糖代谢相关基因的影响
陈建东,张 玲,程 涛,胡祥娜,杨 凡,易建华,杨志龙,李兆文,谭北平,迟淑艳,曹爱巧
(1.广东海洋大学水产学院水产动物营养与饲料实验室,广东 湛江 524088;2.深圳市质量安全检验检测研究院,广东 深圳 518055;3.安琪酵母股份有限公司湖北省酵母功能重点实验室,湖北 宜昌 443003)
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,有生长速度快、肉质细嫩和适应能力强等优点[1-2],已成为全球最主要的养殖甲壳类动物之一。在捕捞和无水运输时,凡纳滨对虾会遭遇干露。干露是对虾在自然环境、繁殖或运输等过程常见的问题[3],但会造成对虾的低氧胁迫,引起氧化应激,扰乱内源性稳态,对肝胰腺组织细胞造成损伤[4],导致对虾死亡和肉质下降[5]。因此,提高对虾抵御干露胁迫的能力对于提高鲜虾产品品质有重要意义。
谷胱甘肽,L-γ-谷氨酰-L-胱氨酰甘氨酸,是一种三肽类物质,普遍分布在活细胞中[6],主要有还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)两种形式[7],在水产养殖中应用广泛。研究表明,饲料中添加GSH 可提高草鱼(Ctenopharyngodon idella)[8]、大菱鲆(Scophthalmus maximus)[9]、虹鳟(Oncorhynchusmykiss)[10]、吉富罗非鱼(Oreochromis niloticus)[11]、中华绒螯蟹(Eriocheir sinensis)[12]和凡纳滨对虾[13]的生长性能、抗氧化能力及免疫力。酵母水解物含有β-葡聚糖、GSH、核苷酸和甘露寡糖等免疫刺激物质[14],作为原料或饲料添加剂可改善养殖动物生长性能、抗氧化能力、非特异性免疫及缓解炎症[15-17]。添加16.2 g/kg 的酵母水解物可使凡纳滨对虾获得最佳的生长;添加到50 g/kg也不会对凡纳滨对虾的生长产生负面影响,并可有效提高对副溶血性弧菌(Vibrio parahaemolyticus)的抵抗力[18];补充酵母水解物还可提高凡纳滨对虾消化酶活性以及抵抗低盐胁迫的能力[14,19]。本研究探讨富含谷胱甘肽的酵母水解物在凡纳滨对虾饲料中的使用效果,主要关注其对干露胁迫下的凡纳滨对虾肝胰腺糖代谢相关基因的影响,为谷胱甘肽酵母水解物在水产养殖中的应用提供参考。
1 材料和方法
1.1 实验设计和饲料配制
以基础饲料(鱼粉质量分数17.7%)为对照组,在基础饲料中分别按质量分数0%、0.3%、0.5%、0.7%、0.9%、1.1%的比例添加谷胱甘肽酵母水解物(含质量分数5%的GSH,安琪酵母股份有限公司),分别记为G0、G0.3、G0.5、G0.7、G0.9、G1.1。饲料原料粉碎后过孔径180 μm 的筛,所有原料混匀,制成粒径为1.0、1.5 mm 的颗粒饲料,自然风干至水分质量分数约10%,分装密封后置于-20 ℃冰箱中存放待用。实验饲料组分和营养水平见表1。
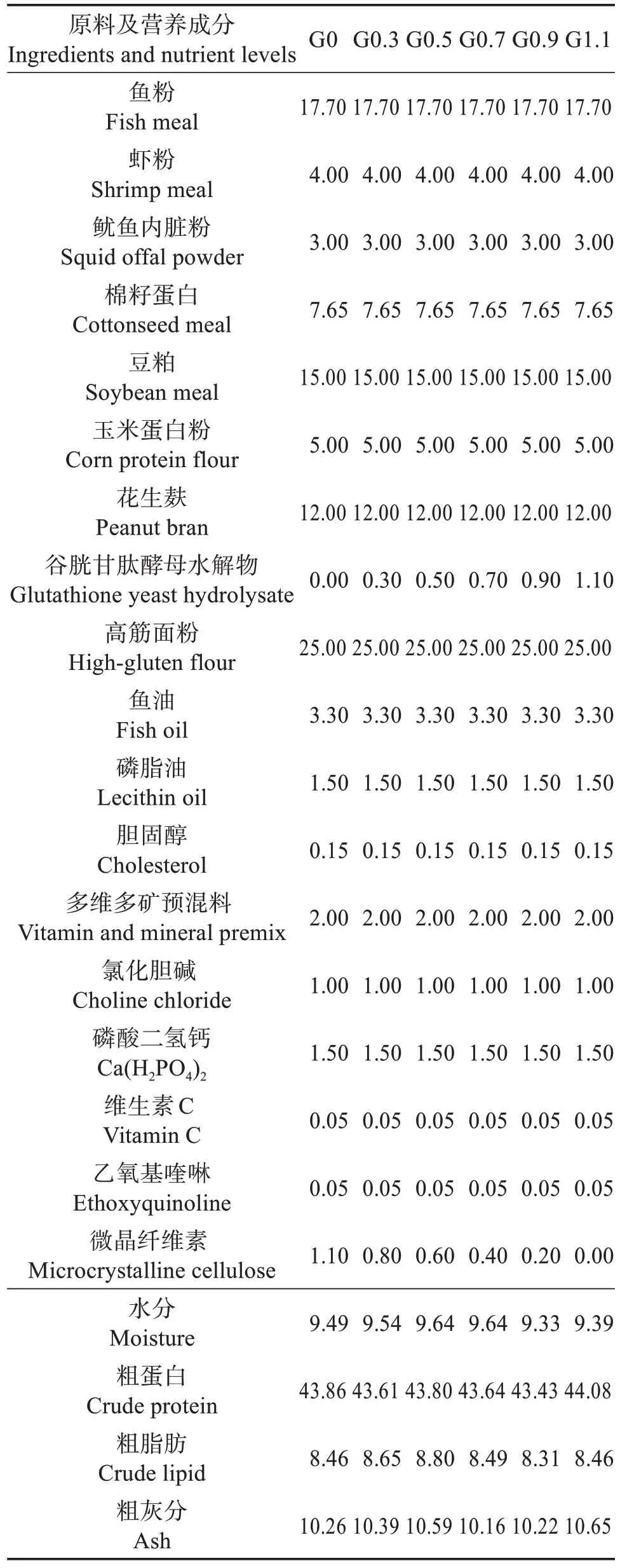
表1 实验饲料组分质量分数Table l Mass fraction of ingredient of experimental diets%
1.2 实验动物饲养管理
在实验开始前,用商品饲料饲喂实验虾(湛江国联水产种苗科技有限公司),暂养2 周后,禁饲24 h,挑选出活力强、规格均匀、初始体质量(0.24±0.01)g 的幼虾,随机分配于6 个处理组,每处理3 重复(0.3 m3玻璃钢桶),每桶30 尾虾。投喂实验饲料养殖4 周。每天7:00、11:30、16:30、21:00 各投喂1次,每天投喂40 min 后检查摄食情况,根据对虾摄食情况及天气情况调整投喂量。养殖期间每天换水量近50%,水温28~31 ℃,盐度10~12 g/L,pH 值7.5~8.3,溶氧质量浓度大于5 mg/L,氨氮质量浓度小于0.03 mg/L。
1.3 样品采集及分析
在养殖实验结束时,所有虾禁饲24 h,计数、称质量,计算凡纳滨对虾的增重率(WGR)、特定生长率(SGR)和饲料系数(FCR)。每个重复取4 尾对虾的肝胰腺组织于RNA later中,检测干露胁迫前凡纳滨对虾肝胰腺相关基因的表达。
从每个重复中随机取对虾10 尾,在阴暗处(室温26 ℃,湿度85%)干露30 min。取4 尾对虾肝胰腺组织于RNA later中,检测干露胁迫后凡纳滨对虾肝胰腺相关基因的表达。
1.4 肝胰腺相关基因的表达分析
用Trizol Reagent(TransGen Biotech,中国)提取肝胰腺的总RNA,用分光光度计(ND-2000,Nano-Drop Technologies,Wilmington,美国)评估RNA 质量。将合格的RNA 作为反转录模板,使用Evo M-MLV RT Mix 试剂盒(湖南艾科瑞生物工程有限公司)合成cDNA。用SYBR Green Premix Pro Taq HS qPCR试剂盒II(湖南艾科瑞生物工程有限公司)进行实时定量PCR(Roche LightCycler®480),分析缺氧诱导因子1(HIF-1α)、葡萄糖转运蛋白1(GLUT1)、己糖激酶(HK)、果糖磷酸激酶(PFK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、琥珀酸脱氢酶(SDH)、苹果酸脱氢酶(MDH)和细胞色素氧化酶(CCO)等基因的相对表达。10 μL 反应体系包含cDNA 模板1 μL,正反向引物各0.5 μL,2 × SYBR®Green Pro Taq HS Premix II 5 μL,无菌双蒸水3 μL。反应条件为:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环。用β-actin作参考基因,2-ΔΔCT方法用于计算基因的表达水平。用于qRT-PCR分析的引物见表2。
1.5 统计分析
数据用平均值± 标准误表示,采用SPSS 21.0软件进行数据分析和统计,先对数据作单因素方差分析,若组间差异显著,再用Tukey’s 检验进行多重比较,同一处理组干露胁迫前后进行t-检验,显著性水平α为0.05。
2 结果
2.1 谷胱甘肽酵母水解物对凡纳滨对虾生长性能的影响
由图1 所示,各处理组之间的凡纳滨对虾增重率、特定生长率和饲料系数无显著差异(P>0.05),表明饲料中添加不同水平谷胱甘肽酵母水解物对凡纳滨对虾生长性能无显著影响。
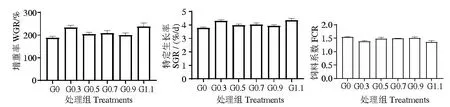
图1 谷胱甘肽酵母水解物水平对凡纳滨对虾生长性能的影响Fig.1 Effect of glutathione yeast hydrolysate on growth performance of Litopenaeus vannamei
2.2 干露胁迫对凡纳滨对虾肝胰腺HIF-1α 表达的影响
如图2所示,在干露胁迫前,各处理组之间的凡纳滨对虾肝胰腺HIF-1α基因的表达差异不显著(P>0.05)。在干露胁迫后,G0 组的凡纳滨对虾肝胰腺HIF-1α基因的表达显著上调(P<0.05)。

图2 在干露胁迫前后凡纳滨对虾肝胰腺HIF-1α基因的表达Fig.2 Expression of hepatopancreatic HIF-1α genes in Litopenaeus vannamei before and after air exposure
2.3 干露胁迫对凡纳滨对虾肝胰腺糖酵解关键基因表达的影响
如图3 所示,关于对虾肝胰腺GLUT1基因表达,在干露胁迫前,G0 组显著低于G0.5 和G0.9 组(P<0.05);在干露胁迫后,各处理组之间差异不显著(P>0.05);同一处理组在干露胁迫前后均未呈现显著差异(P>0.05)。干露胁迫前后各处理对虾肝胰腺HK和PFK基因的表达未产生显著影响(P>0.05)。G0 组对虾肝胰腺PFK基因表达在干露胁迫后显著上调(P<0.05)。在干露胁迫前,各处理组间对虾肝胰腺PK基因的表达差异不显著(P>0.05);在干露胁迫后,G0 组对虾肝胰腺PK基因的表达量显著高于G1.1组(P<0.05),但与其他处理组相比差异不显著(P>0.05)。在干露胁迫前,各处理组间对虾肝胰腺LDH基因的表达差异不显著(P>0.05);在干露胁迫后,G0 组对虾肝胰腺LDH基因显著上调(P<0.05),且显著高于其他处理组(P<0.05)。
2.4 干露胁迫对凡纳滨对虾肝胰腺三羧酸循环及氧化磷酸化关键酶基因表达的影响
如图4所示,关于对虾肝胰腺SDH基因的表达,在干露胁迫前,各处理组间差异不显著(P>0.05);在干露胁迫后,G0 和G1.1 组均下调(P<0.05),G0组表达量显著低于G0.3、G0.5和G0.7组(P<0.05)。肝胰腺MDH基因的表达,在干露胁迫前,各处理组差异不显著(P>0.05);在干露胁迫后,G0组显著下调(P<0.05),且显著低于G0.3、G0.5、G0.7 和G0.9组(P<0.05)。对虾肝胰腺CCO基因的表达,在干露胁迫前,G0 组低于G0.3 和G0.7 组(P<0.05),但与其他组相比差异不显著(P>0.05);在干露胁迫后,G0、G0.3和G1.1组均显著下调(P<0.05),G0组的表达量显著低于G0.5和G0.7组(P<0.05)。

图4 在干露胁迫前后凡纳滨对虾肝胰腺SDH、MDH和CCO基因的相对表达量Fig.4 Relative expression of hepatopancreatic SDH,MDH and CCO genes in Litopenaeus vannamei before and after air exposure
3 讨论
一般来说,能量代谢是细胞和生物体的主要生理过程。环境胁迫可影响机体能量代谢乃至生存。无水运输时的干露胁迫是甲壳类动物养殖中的典型胁迫,会导致其脱水及缺氧,甚至死亡[20]。在缺氧环境下水生动物会由有氧呼吸代谢转变为无氧呼吸代谢,产生能量以维持机体正常生命活动[21],但无氧代谢途径产生能量效率较低,不能提供足够的能量来维持有氧消耗。缺氧可导致甲壳类动物行为、生理、细胞和分子层面的变化,具体取决于缺氧的持续时间和严重程度[22]。
肝胰腺是对虾主要能量代谢器官[23]。HIF-1 由HIF-1α和HIF-1β亚基组成的异二聚体,在肝胰腺调节能量供应和消除缺氧引起的有害物质方面发挥重要作用。HIF-1α 感知细胞中的氧气[24],对于维持正常的细胞功能以应对缺氧至关重要[25]。干露胁迫会诱导日本囊对虾(Marsupenaeus japonicus)肝胰腺HIF-1α基因的表达[26];HIF-1α基因的高表达意味着凡纳滨对虾耐缺氧的能力较差[27]。在干露胁迫前,各处理组间凡纳滨对虾肝胰腺HIF-1α基因的表达无显著差异,干露胁迫引起凡纳滨对虾的缺氧应激反应,诱导基础饲料组的凡纳滨对虾肝胰腺HIF-1α基因的显著上调,而谷胱甘肽酵母水解物处理组的凡纳滨对虾肝胰腺HIF-1α基因表达未发生显著变化。干露胁迫诱导机体内自由基产生增加,引起氧化应激[28],机体为抵御氧化应激需要消耗大量ATP,从而使ATP 含量迅速降低[29]。机体为维持能量供应消耗大量氧气以加快能量代谢,产生ATP,从而导致肝胰腺中的氧气含量迅速降低,诱导HIF-1α基因上调。GSH 为抗氧化剂,其巯基官能团可与自由基反应,缓解机体产生ATP 来抵御氧化应激,减少氧气消耗。GSH 还有维护电子传递、保持有氧呼吸代谢速率的功能[30]。因此,本研究凡纳滨对虾摄食富含谷胱甘肽的酵母水解物,有效地减少了凡纳滨对虾肝胰腺的氧化应激,使其仍可维持较强的有氧呼吸代谢,因而未显著诱导HIF-1α基因的上调,从而提高凡纳滨对虾耐缺氧能力。
HIF-1α 还是重要的转录分子,HIF-1α 可诱导凡纳滨对虾PFK[31]及LDH[32]基因的上调,HIF-1α 高表达的细胞中糖酵解水平明显增加[33]。无水保活运输时的干露状态也会使凡纳滨对虾的糖酵解加快[34]。HK、PFK和PK是糖酵解关键限速酶,均受转录水平的调控[34]。缺氧可诱导凡纳滨对虾肝胰腺PFK基因的表达[31],本研究中,干露胁迫可诱导基础饲料组凡纳滨对虾肝胰腺PFK基因的显著上调,增强干露胁迫条件下凡纳滨对虾的糖酵解途径。然而,谷胱甘肽酵母水解物处理组的凡纳滨对虾肝胰腺HK、PFK及PK基因未发生显著的上调,其肝胰腺HIF-1α基因同样未受到干露的显著影响,表明谷胱甘肽酵母水解物可较好地维持凡纳滨对虾的有氧呼吸代谢。
SDH 和MDH 是三羧酸循环中的关键酶,在细胞能量代谢中起重要作用[35]。本研究中,各处理组凡纳滨对虾肝胰腺SDH和MDH基因表达在干露胁迫前无显著差异;但干露胁迫后,基础饲料组凡纳滨对虾肝胰腺SDH和MDH基因显著下调,三羧酸循环减弱,添加质量分数0.3%~0.9%谷胱甘肽酵母水解物可减缓凡纳滨对虾肝胰腺SDH和MDH基因因干露胁迫诱导的下调。此外,SDH 还是电子传递链的起始酶[21],影响氧化磷酸化,反映有氧呼吸代谢的水平。在干露胁迫条件下中华绒螯蟹的肝胰腺SDH 活性下降[36],阻碍了电子传递,影响氧化磷酸化,降低有氧呼吸代谢水平。细胞色素氧化酶(CCO)是电子传递链的末端酶,是有氧呼吸的限速酶[37]。干露胁迫诱导基础饲料组的凡纳滨对虾肝胰腺CCO基因的显著下调,阻碍了电子传递,降低有氧呼吸代谢速率,添加质量分数0.5%~0.9%谷胱甘肽酵母水解物可减缓因干露胁迫诱导的SDH和CCO基因的下调,维持电子传递,使凡纳滨对虾保持较强的有氧呼吸代谢,产生能量,抵御干露胁迫。
LDH 是糖酵解途径的末端酶,还是连接三羧酸循环的关键环节,在无氧条件下,LDH 的诱导表达可催化丙酮酸转化为乳酸,并产生少量ATP 为机体提供能量,是无氧呼吸代谢的关键酶[38-39]。干露胁迫可诱导基础饲料组凡纳滨对虾肝胰腺LDH基因的表达显著上调,增强机体的无氧代谢途径,表明凡纳滨对虾依赖糖酵解途径补偿干露胁迫引起的能量供应不足。无氧代谢途径增强会导致对虾的肝胰腺和肌肉产生大量的乳酸[39-40],降低肌肉细胞的pH 值,低pH 激活ATP 酶,加速ATP 的分解,直到ATP 完全消失[41]。若ATP 分解速率超过合成速率,会导致肌原纤维中肌球蛋白和肌动蛋白无法分离,形成不可扩展的肌动球蛋白,导致肌肉僵硬[41],最终影响肌肉品质。GSH 可降低缺氧胁迫诱导的细胞LDH 活性[42],添加谷胱甘肽酵母水解物处理组凡纳滨对虾肝胰腺LDH基因的表达在干露胁迫前后无显著差异,这说明添加谷胱甘肽酵母水解物有助于凡纳滨对虾维持较强的有氧呼吸代谢,维持基本的生理代谢,更好地抵御干露胁迫。
本研究主要在基因表达层面关注谷胱甘肽酵母水解物对凡纳滨对虾干露急性应激条件下肝胰腺能量代谢的变化,未能进一步观察肝胰腺结构上的变化。此外,由于缺少凡纳滨对虾血清生化相关指标导致无法进一步探讨代谢基因表达的变化与生化响应的关联,这是本研究的不足之处。
4 结论
干露胁迫下,凡纳滨对虾肝胰腺中的HIF-1α、PFK和LDH基因显著上调,有氧呼吸代谢相关基因(SDH、MDH和CCO)显著下调,凡纳滨对虾肝胰腺的有氧呼吸代谢减弱,无氧呼吸代谢增强。摄食含有适量谷胱甘肽酵母水解物的饲料可使凡纳滨对虾在干露胁迫的条件下仍维持较强的有氧代谢,为机体提供能量,抵御干露胁迫。

