448?nm蓝光照射致ARPE-19细胞坏死性凋亡研究
马琼 徐天池 康宏向


摘 要:长期超风险限值蓝光照射可能导致视网膜变性疾病,而视网膜色素上皮损伤是视网膜光损伤的关键来源。本研究探讨了448 nm蓝光对人视网膜色素上皮细胞的损伤作用及凋亡方式。25 mW/cm2蓝光照射ARPE-19细胞3、6、9、12 h,照后即刻采用钙黄绿素乙酰甲酯染色检测细胞活性,并在照后24 h采用逆转录-聚合酶链反应(RT-PCR)检测坏死性凋亡相关基因表达,同时采用蛋白质免疫印迹法(Western blot)检测坏死性凋亡和DNA损伤标志蛋白表达。9 h和12 h照射组细胞形态发生显著变化,表现为细胞肿胀、间隙增大、漂浮细胞增多、细胞碎片增加;蓝光照射3~9 h后RIPK1、RIPK3 mRNA表达量较正常组出现明显升高,且在照射9 h时达到最大值;蓝光照射6~12 h后RIPK1、RIPK3、P-MLKL坏死性凋亡蛋白标志物的表达量随蓝光照射时间增加而明显升高,并在照射12 h时达到最高值;蓝光照射3~12 h后DNA损伤标志物γ-H2AX蛋白表达量明显升高,并在照射12 h时达到最高值。蓝光照射9 h坏死性凋亡相关基因表达量达到最大,照射12 h基因表达明显下降但坏死性凋亡相关蛋白表达量累积到最大,这提示25 mW/cm2蓝光照射9~12 h可诱导ARPE-19细胞发生坏死性凋亡,并表明DNA損伤程度与细胞坏死性凋亡发生可能存在关联。
关键词:蓝光;ARPE-19细胞;坏死性凋亡;DNA损伤;光化学损伤
中图分类号:Q28 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.006
A Study on the Necroptosis of ARPE-19 Cells Induced by 448 nm Blue Light
MA Qiong1, XU Tianchi1, 2, KANG Hongxiang1*
(1. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Science, Beijing 100850, China; 2. College of Life Sciences, Hebei University, Baoding 071000, China)
Abstract: Long-term blue light exposure beyond the risk limit is an important factor that causes retinal degenerative diseases, and damage to the retinal pigment epithelium is the key source of retinal light damage. In this study, we investigated the damaging effects of 448 nm blue light on human retinal pigment epithelial (ARPE-19) cells and the mode of apoptosis. ARPE-19 cells were irradiated with 25 mW/cm2 blue light for 3, 6, 9 and 12 hours, and cell activity was detected immediately by Calcein AM staining 24 h after irradiation. RT-PCR was used to examine the expression of necrotic apoptosis related genes 24 hours after irradiation, and the Western blotting was used to examine the expression of necroptosis-related and DNA-damage related proteins. The cell morphology changed significantly in the 9-hour and 12-hour groups, the cells swelled, the intercellular space was enlarged, and a large number of cell fragments and non-adhesive cells were observed. Compared with the normal group, the expression levels of the necroptosis-related genes RIPK1 and RIPK3 were significantly higher 3~9 hours after blue light irradiation, and reached the maximum value at 9 h. The expression levels of necroptosis-related proteins RIPK1, RIPK3, P-MLKL markers significantly increased with the increase of irradiation time after 6~12 h blue light irradiation, and reached the highest value at 12 h. The expression level of DNA damage-related γ-H2AX protein increased significantly after 3~12 h blue light irradiation, and reached the highest value at 12 h. The expression of necroptosis-related genes reached the maximum after 9 hours of blue light irradiation, while the expression of necroptosis-related proteins reached the maximum after 12 hours irradiation. It was speculated that 25 mW/cm2 blue light irradiation for 12 h may cause the necroptosis in ARPE-19 cells, and the degree of DNA damage may be related to the occurrence of necroptosis.
Key words: blue light; ARPE-19 cells; necroptosis; DNA damage; photochemical damage
(Acta Laser Biology Sinica, 2023, 32(1): 036-042)
隨着LED光源在人们日常生活中的广泛应用和使用功率的快速提高,其对人体可能带来的潜在危害越来越受到人们的关注[1-3]。LED光源中波长400~480 nm蓝光对人眼损伤最为严重[4-5]。蓝光对眼部组织的光损伤可引起干眼症、白内障、年龄相关性黄斑变性等疾病[6]。近几年来,国内外大量文献表明,蓝光长期暴露后会引起视网膜色素上皮(retinal pigment epithelium,RPE)细胞或感光细胞损伤,损伤形式主要以光化学损伤为主,严重时引起细胞凋亡或死亡[7-10]。而近几年新发现的坏死性凋亡方式是否参与蓝光诱导的RPE细胞死亡尚不清楚。RPE细胞经4.5 mW/cm2蓝光照射6 h后细胞内超微结构发生了显著性变化,主要表现为细胞器肿胀、胞浆减少、线粒体空泡样改变及肿胀、细胞核内异染色质减少固缩、常染色质分散[11],这些细胞形态学变化与坏死性凋亡极其相似。坏死性凋亡信号调控机制复杂且精密,其中肿瘤坏死因子受体参与的信号通路研究较为清晰[12]。为了预防视网膜退行性疾病的产生及减轻或消除视网膜光损伤相关的视觉功能障碍,有必要阐明蓝光照射后RPE细胞具体的程序性死亡方式及相关机制。本研究通过448 nm蓝光照射人视网膜色素上皮细胞ARPE-19,采用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和蛋白免疫印迹法(Western blot)对坏死性凋亡标志物受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)、受体相互作用蛋白激酶3(receptor-interacting protein kinase 3,RIPK3)、底物混合谱系激酶样蛋白(mixed lineage kinase domain-like protein,MLKL)表达量进行检测,以探讨蓝光照射是否会诱导ARPE-19细胞发生坏死性凋亡。另外,本研究还通过检测DNA损伤标志物蛋白γ-H2AX表达量变化来分析蓝光照射是否会引起细胞DNA损伤,并初步探索其与细胞坏死性凋亡的关系,最终为深入研究视网膜蓝光损伤和疾病防治提供新思路和理论基础。
1 材料与方法
1.1 ARPE-19细胞培养
人视网膜色素上皮细胞株(ARPE-19细胞)购自中国科学院上海细胞库官网,使用含10% 胎牛血清(fetal bovine serum,FBS)的DMEM/F12培养基,置于37℃、5% CO2 培养箱中培养。
1.2 主要试剂与耗材
本试验需要的主要试剂和耗材,如表1所示。
1.3 蓝光照射装置
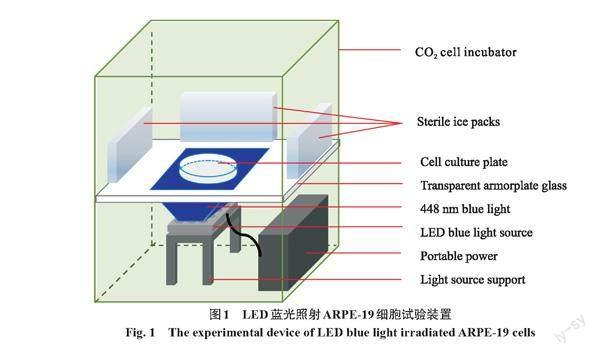
CO2细胞培养箱加入定制的蓝光照射装置,如图1所示,LED蓝光光源放置在培养箱下层,LED尺寸为14 cm×11 cm,峰值波长为448 nm,半峰全宽为18 nm,使用移动电源供电,上下移动透明钢化玻璃板以固定蓝光照射细胞的垂直距离,细胞培养板放置在光源中心正上方,蓝光从下向上照射细胞,并在培养箱四周放置无菌冰袋以确保培养箱内温度稳定在37℃左右。
1.4 蓝光照射细胞方法
ARPE-19细胞接种于10 cm培养皿中,细胞密度为每毫升106个,放入细胞培养箱中孵育12 h,待细胞生长状态良好后,将细胞培养板放置于蓝光照射装置中进行蓝光照射,采用功率计控制细胞培养板处功率,根据细胞板面积设定蓝光照射强度为25 mW/cm2,且按蓝光照射时间不同分为5组,分别为0、3、6、9和12 h组,其中0 h组为正常组(未进行蓝光照射)。
1.5 活细胞染色检测细胞活性
无色的钙黄绿素乙酰甲酯进入细胞后可以被活细胞内的酯酶断裂成发出强绿色荧光的钙黄绿素,用于活细胞检测,且该染色试剂的毒性很低,基本不会对细胞造成损伤。蓝光照射3、6、9和12 h后,即刻吸去培养基,在正常组和照射各组中各加入200 μL配制好的钙黄绿素乙酰甲酯工作液,细胞培养箱孵育20 min,PBS缓冲液洗净未进入细胞的染色试剂,在荧光显微镜下观察细胞荧光染色情况,活细胞有绿色荧光,死细胞则无。
1.6 RT-PCR检测坏死性凋亡相关基因表达水平
ARPE-19细胞经25 mW/cm2蓝光照射3、6、9和12 h后再培养24 h,在冰盒中使用细胞刮刀快速收集正常组和照射各组培养皿上的贴壁细胞,同时将培养基中漂浮细胞一并收集于预冷的PBS缓冲液中;提取细胞RNA,使用超微量分光光度计测定RNA浓度,使OD260 nm/OD280 nm值为1.8~2.0,–80℃保存。
引物设计:参考引物库检索核苷酸序列,并委托生工生物工程有限公司合成引物,信息见表2。
cDNA反转录:在冰盒上建立反转录反应体系(总体积为20 μL),如表3所示。涡旋混匀,PCR仪进行扩增得到cDNA模板,反应温度为37℃反应15 min、85℃反应5 s,4℃暂时保存。
PCR:建立PCR反应体系(总体积为25 μL),如表4所示。按如下程序进行PCR扩增。1)预变性:95℃、30 s;2)PCR反应:39个循环(95℃、5 s;60℃、30 s;72℃、10 min) ;3) 溶解曲线:65~95℃,每0.5℃读板一次并停5 s。采用??Ct法进行相对定量分析:公式F=2–??Ct,其中?Ct=Ct(目的基因)–Ct(管家基因),??Ct=?Ct光照组–?Ct对照组。
1.7 Western blot印迹法检测坏死性凋亡相关蛋白表达水平
ARPE-19细胞经25 mW/cm2蓝光照射3、6、9和12 h后再培养24 h,正常组和照射各组使用预冷PBS收集细胞,加入150 μL 放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液(含1%蛋白酶和磷酸酶抑制剂),提取细胞总蛋白并制备蛋白样品,二辛可宁酸测定法(bicinchoninic acid assay,BCA)测定细胞蛋白浓度;上样与电泳:蛋白样品直接上样到十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)加样孔,恒压条件下80 V电泳30 min,待蛋白预染marker条带基本分离,电压调为120 V,继续电泳约60 min,待溴酚蓝接近胶底端附近即电泳结束;转膜:采用聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),使用Bio-Rad标准湿式转膜装置,转膜电流为300~400 mA,转膜时间为30~60 min;封闭:转膜完成后,三乙醇胺缓冲盐水溶液-吐温缓冲液(Tris buffered saline with Tween 20,TBST)清洗2次,每次5 min,加入快速封闭液并充分覆盖全膜,置摇床上缓慢摇动,室温封闭5 min; 一抗孵育:分别加入RIPK1、RIPK3、P-MLKL、MLKL和γ-H2AX一抗抗体(按照体积比为1:1 000的比例稀释),置摇床上缓慢摇动,4℃孵育过夜,TBST漂洗3次;二抗孵育:加入二抗(辣根酶标记山羊抗兔lgG),置摇床上缓慢摇动,室温孵育2 h,TBST漂洗3次;显影:使用显影定影试剂盒进行蛋白显影;定量分析:使用Image J 软件定量分析目的蛋白条带的积分吸光度(integrated absorbance,IA),目的蛋白相对表达量为IA(待测蛋白)/IA(内参)比值,试验重复3次,计算平均值。
1.8 统计学分析
SPSS软件进行数据处理,数据表示为平均值±标准差(x±s),采用双尾t检验进行统计分析,P<0.05表示具有统计学意义上的差异。
2 结果与分析
2.1 蓝光照射后ARPE-19细胞的活性变化
ARPE-19细胞经25mW/cm2蓝光照射3~12 h,细胞染色结果如图2所示:未照射组细胞贴壁良好,基本为绿色荧光的活细胞;3 h和6 h照射组细胞形态开始变模糊,而且6 h组开始出现细胞空隙,存在部分未染色死细胞;9 h和12 h照射组细胞形态发生显著变化,细胞肿胀,细胞间隙增大,漂浮细胞数量显著增多,细胞碎片增加,并观察到大量未染色死細胞。前期15 mW/cm2蓝光照射ARPE-19细胞试验结果显示,照射3~12 h后再培养24 h,各照射组细胞形态基本恢复到正常水平,且各组之间未见明显差异;然而25 mW/cm2蓝光照射3~12 h,各组细胞形态差异明显,故25 mW/cm2可作为后续蓝光细胞光损伤模型的辐照剂量。
2.2 蓝光照射对ARPE-19细胞坏死性凋亡标志物mRNA表达的影响
ARPE-19细胞经25 mW/cm2蓝光照射3~12 h,RT-PCR检测坏死性凋亡相关基因表达水平结果如图3所示:1)未照射组RIPK1、RIPK3 mRNA均低表达,Ct值分别为35.49和38.50,并将两者表达量归一化处理,即表达量为1;
2)与未照射组比较,蓝光照射3~9 h后细胞内RIPK1 mRNA表达量明显升高(P<0.05或P<0.001),且9 h照射组达到最大值,而蓝光照射12 h后RIPK1 mRNA表达量出现明显下降(P<0.001);3)蓝光照射3~12 h后细胞内RIPK3 mRNA表达量先增加后降低,但均明显高于未照射组,且9 h照射组达到最大值(P<0.05或P<0.001)。
2.3 蓝光照射对ARPE-19细胞坏死性凋亡标志物蛋白表达的影响
ARPE-19细胞经25 mW/cm2蓝光照射6~12 h,Western blot印迹检测细胞坏死性凋亡相关蛋白表达水平结果如图4所示。蓝光照射6、9 和12 h后细胞内坏死性凋亡相关的RIPK1、RIPK3和P-MLKL蛋白相对表达量均随着照射时间增加而增大,且均明显高于未照射组水平(P<0.001);同时,各照射组MLKL蛋白相对表达量出现升高,但无统计学意义。以上结果表明,蓝光照射可诱导ARPE-19细胞发生坏死性凋亡。
2.4 蓝光照射对ARPE-19细胞DNA损伤标记物γ-H2AX蛋白表达的影响
ARPE-19细胞经25 mW/cm2蓝光照射3~12 h,Western blot印迹检测DNA损伤相关蛋白表达水平结果如图5所示。蓝光照射3~12 h后细胞内γ-H2AX蛋白相对表达量均显著升高(P<0.01),均明显高于未照射组水平,且12 h照射组γ-H2AX蛋白相对表达量达到844.40±71.77,约为正常组的4倍。以上结果表明,蓝光可诱导ARPE-19细胞发生DNA损伤。
3 讨论
RIPK1、RIPK3和MLKL是细胞产生坏死性凋亡的主要标志物,其作用的主要过程是肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)与肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)结合后,TNFR1募集TNFR1相关死亡结构域蛋白(TNF receptor 1-associated death domain protein,TRADD)、肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor related factor 2,TRAF2)和Fas相关死亡结构域蛋白(Fas-associated death domain protein,FADD)并形成复合物,随后RIPK1从细胞膜上解离出来进而转变为促死亡蛋白[13]。然后,根据外刺激条件不同,RIPK1调控下游相关信号路径,引发细胞两种凋亡方式,即凋亡或坏死性凋亡。若RIPK1募集pro-Caspase-8并使其活化,则发生细胞凋亡[14];若胞内Caspase-8被抑制,则招募RIPK3形成RIPK1-RIPK3复合体,复合体随后募集MLKL并使其磷酸化为P-MLKL,最终引发坏死性凋亡[15]。MLKL蛋白磷酸化后引起细胞钙离子内流,磷脂酰丝氨酸从膜内侧翻转到膜表面,最终导致质膜的完整性丧失,细胞死亡[16-17]。在形态学上,坏死性凋亡主要表现为胞膜穿孔,渗透压升高导致细胞变圆和线粒体肿胀,核染色质缺失,细胞膜发生爆炸式破裂。试验中观察到蓝光照射后细胞变圆、肿胀等与坏死性凋亡相类似的形态学变化。本试验结果表明:ARPE-19细胞经25 mW/cm2蓝光照射6~12 h后RIPK1、RIPK3、P-MLKL蛋白标志物的表达量随蓝光照射时间增加而明显升高,并在照射12 h时达到最高值;同时,RT-PCR的试验结果发现,蓝光照射3~9 h后RIPK1、RIPK3 mRNA表达量出现明显升高,且在照射9 h时达到最大值,但在照射12 h时表达量出现下降。以上结果表明,蓝光照射9 h时坏死性凋亡相关基因表达量达到最大,而照射12 h时基因表达明显下降而坏死性凋亡相关蛋白表达量累积到最大,提示25mW/cm2蓝光照射9~12 h可能诱导ARPE-19细胞发生坏死性凋亡。
DNA双链断裂被认为是电离辐射致细胞杀伤、染色体变异及细胞癌变或死亡最严重的损伤之一。细胞对DNA双链断裂最开始的修复途径之一就是产生γ-H2AX,然后γ-H2AX与细胞修复相关因子结合,对DNA双链断裂进行修复[18]。曹忠琦[19]在研究黍子过氧化物酶(proso millet peroxidase,PmPOD)对结直肠癌细胞DNA损伤和坏死性凋亡机制中发现,黍子过氧化物酶、坏死性凋亡抑制剂和抗氧化剂共同处理可以有效抑制结直肠癌细胞的坏死性凋亡,但却不能抑制结直肠癌细胞DNA双链断裂,并证实了DNA双链断裂是细胞产生坏死性凋亡的前提条件。本试验通过检测蓝光照射后DNA损伤标记物γ-H2AX蛋白表达量来观察蓝光照射后ARPE-19细胞DNA损伤情况,结果表明,蓝光照射3~12 h后细胞内γ-H2AX蛋白相对表达量明显升高,且在照射12 h后达到最大,提示25 mW/cm2蓝光照射可诱导ARPE-19细胞发生DNA损伤。进一步分析发现,蓝光照射12 h后细胞坏死性凋亡、DNA损伤标记物蛋白表达量都达到最大值,因此推测DNA损伤程度与细胞坏死性凋亡发生可能存在关联,然而两者相互关系及其具体机制仍需进一步探索。因此,蓝光对ARPE-19细胞损伤结果有助于阐明蓝光对眼睛的潜在安全危害,为蓝光安全应用提供基础,并为蓝光诱导的视网膜变性疾病提供潜在的治疗靶点。
参考文献(References):
[1] LI B, ZHANG W, LI Z, et al. Research on application of LED navaid lighting in airfield area of civil airports[C]. IOP Conference Series: Materials Science and Engineering, 2018, 392(6): 062109.
[2] 邹波. 新型LED背光源技术与应用实践研究[J].电子测试, 2017(16): 124-125.
ZOU Bo. New LED backlighting technology and applied practice research[J]. Electronic Test, 2017(16): 124-125.
[3] 欒超, 胡煜, 陈崑, 等. 308 nm SQ LED光与308 nm准分子光治疗面部白癜风的疗效及安全性回顾性研究[J]. 中华皮肤科杂志, 2022, 55(1): 16-19.
LUAN Chao, HU Yu, CHEN Kun, et al. Efficacy and safety of 308 nm SQ light-emitting diode light and 308 nm excimer light in the treatment of facial vitiligo: a retrospective study[J]. Chinese Journal of Dermatology, 2022, 55(1): 16-19.
[4] JAADANE I, BOULENGUEZ P, CHAHORY S, et al. Retinal damage induced by commercial light emitting diodes (LEDs)[J]. Free Radical Biology and Medicine, 2015, 84: 373-384.
[5] 成知函. 蓝光与眼睛[J]. 中国眼镜科技杂志, 2019, 3: 110-112.
CHEN Zhihan. Blue light and eyes [J]. China Glasses Science-Technology Magazine, 2019, 3: 110-112.
[6] ZHAO Z, ZHOU Y, TAN G, et al. Research progress about the effect and prevention of blue light on eye[J]. International Journal of Ophthalmology, 2018, 11(12): 1999-2003.
[7] 徐志刚, 符俊达, 吕淑慧, 等. 不同光量子数蓝光长时间间断照射对豚鼠屈光发育及视网膜损伤作用[J]. 眼科新进展, 2016, 36(1): 15-18.
XU Zhigang, FU Junda, LYU Shuhui, et al. Effects of different quantum number of blue light irradiation on refractive development and retinal damage in guinea pigs[J]. Recent Advances in Ophthalmology, 2016, 36(1): 15-18.
[8] 杨戴帝, 孙汝许, 陈雪, 等. 蓝光照射对小鼠视网膜形态和功能的损伤作用[J]. 中华实验眼科杂志, 2020, 38(1): 10-15.
YANG Daidi, SUN Ruxu, CHEN Xue, et al. Damage of blue-light exposure to retinal morphology and function in mice[J]. Chinese Journal of Experimental Ophthalmology, 2020, 38(1): 10-15.
[9] 李慧丽, 陈治威, 孙小红, 等. 455~470 nm波长的面阵蓝光对SD大鼠视网膜组织结构的影响[J]. 国际眼科杂志, 2020, 20(2): 234-237.
LI Huili, CHEN Zhiwei, SUN Xiaohong, et al. Effect of 455~470 nm array blue light on retinal tissue structure in SD rats[J]. International Journal of Ophthalmology, 2020, 20(2): 234-237.
[10] 杨娇, 张雅琴, 张黎, 等. 叶黄素对大鼠视网膜LED蓝光损伤的保护作用[J]. 中国食物与营养, 2020, 26(6): 54-58.
YANG Jiao, ZHANG Yaqin, ZHANG Li, et al. Protective effect of lutein against blue light-induced retinal damage in rat[J]. Food and Nutrition in China, 2020, 26(6): 54-58.
[11] 俞永珍. 蓝光诱导人视网膜色素上皮细胞损伤及其线粒体机制的体外研究[D]. 广州: 广州中医药大学, 2015.
YU Yongzhen. Study on the damage of human retinal pigment epithelium cells induced by blue light irradiation and mitochondria-participated mechanism in its mitochondrial mechanism in vitro[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2015.
[12] PASPARAKIS M, VANDENABEELE P. Necroptosis and its role in inflammation[J]. Nature, 2015, 517(7534): 311-320.
[13] OFENGEIM D, YUAN J. Regulation of RIP1 kinase signalling at the crossroads of inflammation and cell death[J]. Nature Reviews Molecular Cell Biology, 2013, 14(11): 727-736.
[14] WANG L, DU F, WANG X. TNF-alpha induces two distinct caspase-8 activation pathways[J]. Cell, 2008, 133(4): 693-703.
[15] NEWTON K, WICKLIFFE K E, DUGGER D L, et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis[J]. Nature, 2019, 574(7778): 428-431.
[16] GONG Y N, GUY C, CRAWFOED J C, et al. Biological events and molecular signaling following MLKL activation during necroptosis[J]. Cell Cycle, 2017, 16(19): 1748-1760.
[17] GONG Y N, GUY C, OLAUSON H, et al. ESCRT-III acts downstream of MLKL to regulate necroptotic cell death and its consequences[J]. Cell, 2017, 169(2): 286-300.
[18] 王依朝, 樊麗, 王红霞, 等. γ-H2AX、53BP1及RAD51焦点用于分析DNA双链断裂损伤[J]. 生物学杂志, 2020, 37(1): 16-19.
WANG Yichao, FAN Li, WANG Hongxia, et al. γ-H2AX, 53BP1 and RAD51 foci analysis for monitoring DNA double-strand breaks[J]. Journal of Biology, 2020, 37(1): 16-19.
[19] 曹忠琦. 黍子过氧化物酶诱导结直肠癌细胞DNA损伤和坏死性凋亡[D]. 太原: 山西大学, 2019.
CAO Zhongqi. DNA damage and necroptosis induced by PmPOD in colorectal cancer cells[D]. Taiyuan: Shanxi University, 2019.
收稿日期:2022-11-30;修回日期:2023-01-05。
基金项目:国家自然科学基金项目(81901907)。
作者简介:马琼,实验师,主要从事激光生物学研究。
* 通信作者:康宏向,副研究员,主要从事激光生物学研究。E-mail: khx007@163.com。

