激光散斑对比成像技术在血流监测中的应用
郭乐 海热古吐逊 周嘉琪 张学良 努尔尼沙阿力甫


摘 要:激光散斑对比成像(LSCI)是一种以宽视场方式监测血流速度的非扫描光学成像技术。LSCI技术具有高时间-空间分辨率、快速实时成像、非接触式、仪器结构简单、无需造影剂等优势。本文简要介绍了LSCI的基本原理,概述了反射式LSCI和透射式LSCI两种结构,综述了LSCI在皮肤血流、大脑皮层和视网膜血流等生物医学应用中的最新研究进展,并对其发展前景做了进一步展望,为血流监测提供理论依据和实践指导。
关键词:激光散斑对比成像;组织灌注;血流速度;血流监测;血流微循环
中图分类号:R318;TN249 文獻标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.002
Application of Laser Speckle Contrast Imaging on Blood Flow Detection
GUO Lea, TUXUN Hairegub, ZHOU Jiaqib, ZHANG Xueliangb, ALIFU Nuernishab*
(Xinjiang Medical University a. Institute of Public Health, Xinjiang Medical University;
b. School of Medical Engineering and Technology, Urumqi 830011, China)
Abstract: Laser speckle contrast imaging (LSCI) is a non-scanning optical imaging technique with wide field of view for monitoring blood flow velocity. LSCI technology has advantages of high temporal-spatial resolution, fast real-time imaging, non-contact, simple structure, and no contrast agent. Here we briefly introduced the basic principles of LSCI, structures of reflective-detected LSCI and transmissive-detected LSCI. In addition, this paper reviewed the latest research progress of LSCI in biomedical applications such as skin blood flow, cerebral cortex and retinal blood flow, and makes further prospects for its development, provide theoretical basis and practical guidance for blood flow monitoring.
Key words: laser speckle contrast imaging; tissue perfusion; blood flow velocity; blood flow monitoring; blood microcirculation
(Acta Laser Biology Sinica, 2023, 32(1): 008-014)
血管及血流微循环与生命活动息息相关,生物体内不同的血流以及微循环过程往往对应着不同的生理和病理状态[1]。临床医学上,血管中血流状态变化的监测对眼科疾病、脑中风、动脉硬化、老年痴呆及肿瘤等[2]疾病的早期诊断及术后跟踪起着非常关键的作用。目前,可用的微循环成像技术包括激光多普勒血流测定法(laser doppler flowmetry,LDF)、磁共振成像(magnetic resonance imaging,MRI)、光声层析成像、正电子发射计算机断层成像(positron emission computed tomography,PET)、光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)和射线照相技术等[3]。OCTA是一种无标签的三维成像方式,可以对组织的内在光学散射特性进行可视化[4]。OCTA因其无需外源性造影剂就可以提供高分辨率和高对比度的血管造影图像,被证明是一种有效的高分辨率活体内成像工具,并被适用于人体组织样本的切除和临床模型[5]。得益于上述优势,OCTA成为近年来发展起来的新兴无创、快速准确、高分辨率的血流成像技术[6]。然而,上述技术都存在一些局限性,例如:LDF用于测量不同血管的血流深度,但扫描时间较长[7];射线照相技术虽然可以产生三维空间信息,但监测脑血流速度变化的时间分辨率较低[8];正电子发射计算机断层成像和磁共振成像能够实现脑血流(cerebral blood flow,CBF)成像,但无法提供令人满意的时间和空间分辨率[9]。
作为一种全场光学成像技术,激光散斑对比成像(laser speckle contrast imaging,LSCI)具备良好的空间和时间分辨率,尤其在脑皮层血流、皮肤局部血流、视网膜微血管的实时微循环成像方面受到了广大科研人员的青睐。LSCI技术诞生于上世纪90年代中期。世界上第一台商业化的LSCI仪器于2007年由英国Moor公司研制成功,成为临床科研领域提供微循环血流全视野的成像监测工具[10]。20世纪80年代初,Fercher和Breiers[11]首次将其用于视网膜血管血流监测。LSCI系统的工作原理是激光光束照射生物组织表面,产生一种称为散斑的随机干涉效应,通过散斑图像被光学成像系统送入计算机后进行伪彩色和散斑对比度计算处理,展现出生物组织的清晰血管形态轮廓和血流的二维分布模式等变化信息[12-13]。LSCI主要集中于散斑图案的统计分析,使用这些斑点统计数据可以准确地估计血流图和组织灌注量[14]。LSCI技术的血流成像分析方法具有非直接接触性、高时间分辨率、高空间分辨率及可连续监测[15]等优点。LSCI技术用于观察手术过程中不同操作引起的血液动力学的动态变化,同时测量血管内壁的有效流通直径,并通过与LDF结合来实时监测血流量的变化情况,计算获得精确血流量,为临床提供参考。
1 LSCI技术的基本原理及两种结构
1.1 基本原理
根据动态光散射理论可知,在动态散斑结构的每个点上测量图像像素的模糊度,通常以散斑对比度为中心,使用以下公式计算动态散斑的对比度:
K==(1)
式中K为散斑对比值,σ为散斑强度波动的标准差,I为动态生物散斑的瞬时强度,〈I〉为随时间变化的平均值。国外研究人员根据样品背向散射光的相关时间τc与相机曝光时间T的比值,推导出K的公式如下:
K= [1-exp(-)](2)
式中T为散斑成像曝光时间,τc为去相关时间。此外,用公式(2)表示时间平均散斑图中的散斑对比度,可以表示为曝光时间T和公式(3)的函数。
Vc=(3)
其中Vc为散射体的平均速度,λ为相干源的光学波长。
1.2 LSCI两种结构的对比分析
LSCI系统分为反射式和透射式两种。图1分别显示了传统反射式LSCI和透射式LSCI(transmissive-detected laser speckle contrast imaging,TR-LSCI)成像系统的示意图。对于TR-LSCI,激光二极管安装在支架上,并由电流控制器和温度控制器控制。激光二极管发出的光照射在样品下方,光束穿过整个样品并通过立体显微镜收集。相反,对于常规LSCI,激光二极管在样品上方倾斜照射,激光束被样品表面散射并进入立体显微镜。
常规的LSCI采用反射检测模式,已广泛应用于微循环的基础研究[16],其功能与一系列临床症状高度相关,如糖尿病[17]、缺血性中风[18]、冠心病[19]和外周动脉疾病[20]。通过基于手术的开放式颅骨窗口、变薄的颅骨窗口和无手术的颅骨光学清除窗口等,使用传统的反射式LSCI技术可清楚地观察到皮质血流分布[21]。除此之外,通过皮褶室窗口和皮肤光学清除窗口,传统LSCI还可以提供具有单个血管分辨率的皮肤血流成像图[22]。然而,如果没有上述窗口,光线将会穿透深层血管以上的上层组织,在此过程中,光强不断衰减,使得上层的静态斑点强度远远大于深层目标的动态斑点信号,最终导致传统LSCI技术在监测深层组织中的动态散斑信号分辨率极低,甚至无法监测到血流。此外,传统LSCI即使通过头骨和皮肤窗口,也只能在浅层提供可接受的分辨率。
为了克服上述问题,研究人员进一步寻找解决方案,初步结果表明,改变入射光的方向可能有助于提取深层组织信息,观察到透射式LSCI在小鼠后肢血流成像图上显示出比传统反射式LSCI更好的成像对比度和分辨率,甚至可以在没有其他辅助手段的情况下展示人类手指关节的微血管功能成像[23]。但是,透射式LSCI用于深层组织血流监测的机制尚不清楚。华中科技大学朱丹教授团队[24]系统地证明了透射式LSCI在深层组织血流成像中的潜力。通过模拟,他们发现,来自目标层的光信号与来自整个组织的光信号的比率,可能是决定成像质量的一个重要因素。由于光在反射模式下衰减很快,当从表面穿透高度散射的组织时,到达浅层的光更强,探测器接收之前的二次衰减更小,因此,浅层的成像质量可能是理想的,而当感兴趣的区(region of interest,ROI)位于深层时,成像质量会迅速下降。相反,对于透射模式,虽然监测到来自较深层的信号的二次衰减光照更强,但是到达深层的光也比浅层强,这使得深部组织的成像质量也更加清晰。这项工作比较了反射式LSCI和透射式LSCI在生物成像中的性能,为研究人员选择合适的成像技术获得更高的深层组织成像质量提供指导,对活体微循环研究具有重要意义。
2 LSCI在血流成像中的应用
LSCI技术能够实现实时、快速的高分辨率血流成像,而仪器能够对血流进行非接触的全场成像,因此,不需要任何扫描就能用于大量的血流成像中。以下重点介绍LSCI技术在视网膜、皮肤和大脑等3个血流成像方面的应用。
2.1 皮肤血流灌注成像
对皮肤灌注的全场监测是LSCI最早的用途之一。尽管LSCI能够量化毛细血管的整体灌注,但通常很难监测皮肤中单个血管的流量[25]。葡萄酒色斑(port-wine stains,PWS)又称鲜红斑痣,是发病率最高的血管畸形。目前的一线治疗方案为脉冲染料激光(pulsed dye laser,PDL),然而其疗效不尽如人意[26]。
最近Wen等[27]采用4种无创诊断技术,包括VISIA-CR?系统、皮肤镜、高频超声(high-frequency ultrasound,HFUS)和LSCI,以获得PWS患者血卟啉单甲醚光动力疗法(hematoporphyrin monomethyl ether photodynamic therapy,HMME-PDT)前后皮损和周围正常皮肤的皮肤颜色、皮肤厚度、血管形态、血管分布和血液灌注的标准影像学数据。他们得出结论,VISIA-CR?系统不仅可用于观察PWS的可见病变,也可用于观察不可见病变。此外,HMME-PDT后消退的病变也可以通过VISIA-CR?系统进行客观描述。皮肤镜在PWS的临床分类中发挥着重要作用,包括评估HMME-PDT后的血管损伤,指导治疗剂量的调整,以及选择治疗的结束点。HFUS和LSCI都可用于协助HMME-PDT的治疗反应评估。
2.2 视网膜血管血流成像
视力损害或丧失是世界范围内的一个重大健康问题。约80%的视力损害可以通过早期诊断和治疗而预防[28]。最新的研究發现,近视眼的视网膜、脉络膜的功能结构发生明显改变,如视网膜厚度变薄、视网膜血管分支复杂性降低、血管密度下降、脉络膜厚度减少等[29-30]。
在描述大鼠视网膜的试验研究中,Srienc等[31]将LSCI和共聚焦显微镜结合,监测视网膜血管中光诱导的血流变化。这种双重成像技术可以使研究者用LSCI监测血流的同时,刺激视网膜上的光感受器,用共聚焦显微镜测量血管直径。他们发现,闪烁的光使视网膜小动脉扩张,并引起视网膜血流速度增加,且时间进程相似。此外,激光刺激诱发局部血流速度增加。这些增加的空间分布取决于对视网膜小动脉和小静脉的位置刺激。以上结果表明,毛细血管对局部神经元活动基本无反应,血流动力学反应主要由小动脉介导。利用LSCI对视网膜血流进行成像,在阐明介导视网膜功能充血的机制和表征视网膜病理过程中血流变化方面具有重要意义。Feng等[32]设计并构建了一种高效、可扩展的视网膜成像仪器。该仪器集成了结构和功能性视网膜成像技术,包括MSI、视网膜血氧饱和度和LSCI。LSCI可以在不需要外源性造影剂的情况下清晰地观察视网膜及脉络膜血管血流,并且可以提供血流的时间分辨率,从视网膜血管中产生心脏脉冲波形。
该技术可以在简化的临床工作流程中快速获得结构性MSI图像、视网膜血氧儀和LSCI血流信息[33],而不需要患者在不同仪器之间转换。这些进展可以减少临床应用的障碍,加速使用MSI、视网膜血氧仪和血流LSCI进行诊断、监测和阐述疾病发病机制的研究。由于许多系统性疾病如糖尿病和高血压与视网膜病理学和功能改变相关[34],该技术可能增强对这些疾病的检测,并有助于理解发病机制。
2.3 脑皮层血管血流成像
2.3.1 缺血性脑卒中
中风是一种高死亡率的脑血管疾病,与世界范围内的多种长期残疾相关[35],除静脉溶栓(intravenous thrombolysis,IVT)和机械血栓切除术外,缺乏有效的治疗方法[36]。虽然在中风发作后4.5 h内应用IVT,缺血半暗带组织可能会被挽救,但IVT的早期再通率仅为30%[37]。此外,约有50%的患者由于再通时梗塞核心较大而不能通过机械血栓切除术得到治愈[38]。
Bo等[39]在大鼠局灶性脑缺血后,通过光驱动泵调节半影神经元将质子转出或转入神经元。通过中性红荧光成像细胞内pH值,并用LSCI监测在缺血后24 h和48 h获得的对后肢电刺激的整体CBF反应,以评估神经功能。缺血后48 h的评估行为和组织学结果包括未经基因修饰的对照组。这些结果表明,在急性缺血阶段,通过光遗传学将质子从半暗带神经元转位来对抗细胞内的酸中毒,可以诱导缺血性脑损伤后的保护。Wang等[40]将LSCI和光学固有信号成像技术与实验室设计的颅骨窗植入相结合,通过测量伴随神经活动的脑氧代谢率(cerebral metabolic rate for oxygen,CMRO2),应用前爪刺激来评估功能变化,研究AUDA(administration of 12-3-adamantan-1-yl-ureido-dodecanoic acid)对急性缺血性中风的神经保护作用。试验的成像结果如图2所示。这些结果表明,AUDA影响了缺血性损伤初期的抗炎作用,恢复了神经元的氧气代谢率和组织活力。AUDA引发的新生血管恢复了CBF,可能有助于在中风后第3天减少缺血性梗死。此外,半影区的星形胶质细胞可能在保护神经元免受凋亡性损伤方面发挥重要作用。
2.3.2 偏头痛
偏头痛是目前全球最常见的神经系统疾病,其患病率高达15%[41],也是造成全球神经功能障碍负担的最大因素[42]。神经网络高兴奋性和谷氨酸释放增强与常见形式的偏头痛以及家族性偏瘫偏头痛(familial hemiplegic migraine,FHM)的发病机制有关[43-44]。
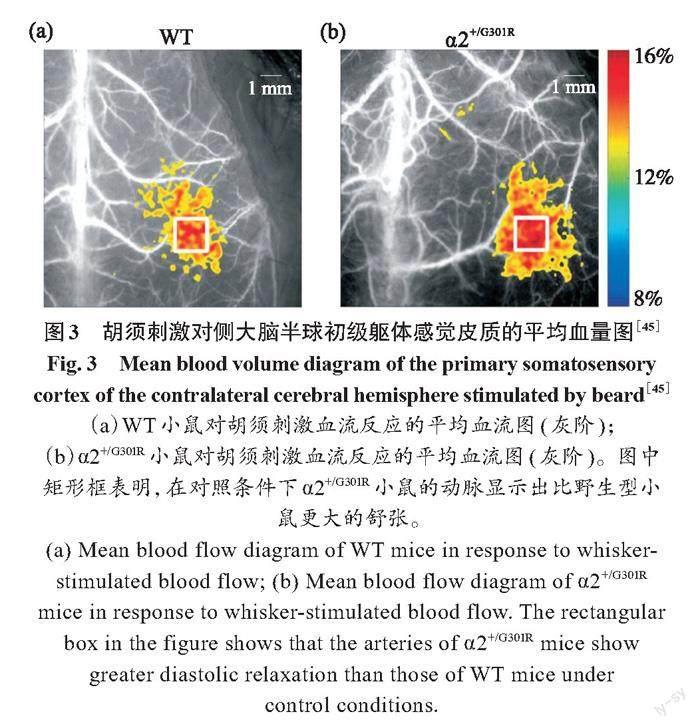
Staehr等[45]通过LSCI评估脑血流,在2型家族性偏瘫偏头痛(familial hemiplegic migraine type 2,FHM2)发作的初始阶段提出了一种脑灌注不足的新机制。该机制表明,cSrc激酶的α2异构体的依赖性调节解释了脑动脉平滑肌细胞收缩机制的Ca2+敏感性。研究表明,该信号通路对大脑动脉收缩性具有重要意义,但对大脑外系统血管的意义较小。最近,Staehr等[46] 发现,携带其中一种突变的杂合子小鼠(α2+/G301R mice)显示出脑血管张力升高,这表明低灌注可能导致局部代谢物浓度升高。他们使用LSCI对α2+/G301R和匹配野生型(wild type,WT)小鼠的神经血管进行耦合,在脑切片中,评估了神经元组织、星形胶质细胞端足和平滑肌细胞对神经元刺激的实质小动脉直径和细胞内Ca2+的变化。结果如图3所示。研究表明,与WT小鼠相比,胡须刺激诱导α2+/G301R的体感皮层的血液灌注增加,即充血反应。与WT小鼠相比,神经元兴奋与α2+/G301R脑切片中的小动脉扩张有更大的实质关系。
2.3.3 阿尔兹海默症
流行病学、临床和试验研究以及越来越多的证据,使人们认识到微血管功能障碍对老年患者认知损伤(vascular cognitive impairment,VCI)和阿尔兹海默症(Alzheimer disease,AD)的发生起着关键的作用[47]。神经血管耦合对脑血流量的瞬间调节对维持健康的认知功能具有重要作用。LSCI作为一种分辨率高、快速成像、以微创的手法展示局部脑血管灌注变化的有力成像技术,为监测脑血流灌注量瞬时变化提供了良好的有效值。Tarantini等[48]通过LSCI测量两组年迈小鼠经对侧胡须刺激后引起的CBF反应,来评估神经血管耦合。他们发现,AD小鼠的神经血管偶联反应明显受损。这些发现与SS-31对年迈动物培养的脑微血管内皮细胞线粒体产生活性氧和线粒体呼吸的保护作用相平行。以上结果如图4所示,AD组小鼠的CBF波动显著低于野生型对照组,进而验证了线粒体氧化应激减弱对衰老过程中的神经血管耦合反应产生了有益的影响。
3 总结与展望
在过去的几十年中,LSCI因具有优异的空间和时间分辨率,在血流和组织血管监测领域成为一种非常强大的可视化成像技术。本文综述了LSCI的基本原理和两种结构的对比,分别阐述了LSCI技术在皮肤血流、大脑皮层和视网膜等临床中的应用。虽然LSCI作为一种无创方式用于监测全场相对血流速度,但监测深层组织血流速度时还是存在一些局限性。例如,因激光在深层组织的多次散射导致分辨率下降,特别是在高倍率成像时,一些血管失焦,通常不能在整个视野上显示清晰的图像。因此,研发以LSCI为核心技术的多模态生理和病理参数检测系统成为当前临床医学的迫切需求。
LSCI还可以与其他成像技术相结合形成多模态系统,如内源性光学成像、相干层析成像和荧光光学成像等,从而达到优势互补,同时得到一系列更全面的生理参数。为了更早满足临床应用的需求,LSCI装置需向小型化、集成化、多模态、多参数测量发展,同时,需开发更加便携式的激光散斑皮质血流动力学监测工具,以进一步加强对手术中的流程和操作的深入了解。随着可视化成像技术的不断发展,许多研究人员都在关注这一成像领域。基于斑点的分析仍然是组织灌注和微血管特性的领先技术之一,其在血流成像领域的应用将会更为广泛。
参考文献(References):
[1] 张锦德, 檀邹, 林黎升, 等. 激光散斑成像在血流监测中的研究进展[J]. 中国激光医学杂志, 2016, 25(5): 233-241, 244-245.
ZHANG Jinde, TAN Zou, LIN Lisheng, et al. Recent advances in monitoring blood flow with laser speckle imaging [J] . Chinese Journal of Laser Medicine & Surgery, 2016, 25(5): 233-241, 244-245.
[2] CORDOVIL I, HUGUENIN G, ROSA G, et al. Evaluation of systemic microvascular endothelial function using laser speckle contrast imaging [J] . Microvascular Research, 2012, 83(3): 376-379.
[3] 邬丹丹, 姚康, 管凯捷, 等. 基于激光散斑衬比成像技术的脑血流分析[J]. 光学精密工程, 2020, 28(11): 2411-2420.
WU Dandan, YAO Kang, GUAN Kaijie, et al. Cerebral blood flow analysis based on laser speckle contrast imaging technology [J] . Optics and Precision Engineering, 2020, 28(11): 2411-2420.
[4] HUANG D, SWANSON E A, LIN C P, et al. Optical coherence tomography [J] . Science, 1991, 254: 1178-1181.
[5] KUT C, CHAICHANA K L, XI J, et al. Detection of human brain cancer infiltration ex vivo and in vivo using quantitative optical coherence tomography [J] . Science Translational Medicine, 2015, 7: 1-10.
[6] KATTA N, ESTRADA A D, MCELROY A B, et al. Laser brain cancer surgery in a xenograft model guided by optical coherence tomography [J] . Theranostics, 2019, 9(12): 3555.
[7] 孔平, 楊晖, 郑刚, 等. 激光散斑血流成像技术研究新进展[J]. 光学技术, 2014, 40(1): 21-26.
KONG Ping, YANG Hui, ZHENG Gang, et al. Advances in laser speckle flowgraphy technique [J] . Optical Technique, 2014, 40(1): 21-26.
[8] 李晨曦, 陈文亮, 蒋景英, 等. 激光散斑衬比血流成像技术研究进展[J] . 中国激光, 2018, 45(2): 92-101.
LI Chenxi, CHEN Wenliang, JIANG Jingying, et al. Laser speckle contrast imaging on in vivo blood flow: a review [J] . Chinese Journal of Laser, 2018, 45(2): 92-101.
[9] 常雪娇, 吕亮, 向艳, 等. 近视眼视网膜和脉络膜厚度及血流的研究进展[J] . 华中科技大学学报医学版, 2021, 50(6): 793-799.
CHANG Xuejiao, LYU Liang, XIANG Yan, et al. Research progress of retinal and choroidal thickness and blood flow in myopia [J] . Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2021, 50(6): 793-799.
[10] 刘昭君, 郑益政, 孔毅. 激光散斑血流成像仪监测小鼠三氯化铁血栓模型[J] . 药物生物技术, 2020, 27(3): 205-210.
LIU Zhaojun, ZHENG Yizheng, KONG Yi. Laser speckle contrast imaging monitor thrombosis in a ferric chloride-induced mouse model [J] . Pharmaceutical Biotechnology, 2020, 27(3): 205-210.
[11] BREIERS J D, FERCHER A F. Retinal blood-flow visualization by means of laser speckle photography [J] . Investigative Ophthalmology Visual Science, 1982, 22(2): 255-259.
[12] 王淼, 洪嘉馳, 周非凡, 等. 激光散斑成像技术在脑科学研究中的应用[J] . 生物化学与生物物理进展, 2021, 48(8): 922-937.
WANG Miao, HONG Jiachi, ZHOU Feifan, et al. Application of laser speckle contrast imaging in research on brain science [J] . Progress in Biochemistry and Biophysics, 2021, 48(8): 922-937.
[13] AMINFAR A, DAVOODZADEH N, AGUILAR G, et al. Application of optical flow algorithms to laser speckle imaging [J] . Microvascular Research, 2018, 122: 52-59.
[14] VAZ P G, HUMEAU-HEURTIER A, FIGUEIRAS E, et al. Laser speckle imaging to monitor microvascular blood flow: a review [J]. IEEE Reviews in Biomedical Engineering, 2016, 9: 106-120.
[15] LIU C, KILIC K, ERDENERR S E, et al. Choosing a model for laser speckle contrast imaging [J] . Biomedical Optics Express, 2021, 12(6): 3571-3583.
[16] MENNES O A, NETTEN J J V, BAAL J G V, et al. Assessment of microcirculation in the diabetic foot with laser speckle contrast imaging [J] . Physiological Measurement, 2019, 40(6): 065002.
[17] FENG W, LIU S, ZHANG C, et al. Comparison of cerebral and cutaneous microvascular dysfunction with the development of type 1 diabetes [J] . Theranostics, 2019, 9(20): 5854-5868.
[18] SCHRANDT J, KAZMI S S, JONES T A, et al. Chronic monitoring of vascular progression after ischemic stroke using multiexposure speckle imaging and two-photon fluorescence microscopy [J] . Journal of Cerebral Blood Flow & Metabolism, 2015, 35(6): 933-942.
[19] SOROP O, WOUW J, DRIE R, et al. Coronary microvascular dysfunction results in impaired coronary flow reserve and altered oxygen balance in a swine model of INOCA with multiple risk factors [J] . European Heart Journal, 2020, 41(2): ehaa946.3781.
[20] ANDERSON C P, PEKAS E J, PARK S Y. Microvascular dysfunction in peripheral artery disease: is heat therapy a viable treatment [J] . International Journal of Environmental Research and Public Health, 2021, 18(5): 2384.
[21] DUNN A K, BOLAY H, MOSKOWITZ M A, et al. Dynamic imaging of cerebral blood flow using laser speckle [J] . Journal of Cerebral Blood Flow & Metabolism, 2001, 21(3): 195-201.
[22] KELLY A, PAI A, LERTSAKDADET B, et al. Microvascular effects of pulsed dye laser in combination with oxymetazoline [J]. Lasers in Surgery and Medicine, 2020, 52(1): 17-22.
[23] DUNN J F, FORRESTER K R, MARTIN L, et al. A transmissive laser speckle imaging technique for measuring deep tissue blood flow: an example application in finger joints [J] . Lasers in Surgery and Medicine, 2011, 43(1): 21-28.
[24] LI D Y, XIA Q, YU T T, et al. Transmissive-detected laser speckle contrast imaging for blood flow monitoring in thick tissue: from monte carlo simulation to experimental demonstration [J] . Light Science Application, 2021, 10(1): 241.
[25] COUTURIER A, BOUVET R, CRACOWSKI J L, et al. Laser speckle contrast imaging as a better tool to access the cutaneous microcirculation: reproducibility and comparison to laser doppler imaging in animal models [J] . Archives of Cardiovascular Diseases Supplements, 2020, 12(2/4): 208-209.
[26] 張玙嫣, 马刚, 林晓曦. 葡萄酒色斑的光动力治疗进展[J] . 中国激光医学杂志, 2020, 29(5): 266-273.
ZHANG Yuyan, MA Gang, LIN Xiaoxi. Research in photodynamic therapy for port-wine stains [J] . Chinese Journal of Laser Medicine & Surgery, 2020, 29(5): 266-273.
[27] WEN L, ZHANG Y, ZHANG L, et al. Application of different noninvasive diagnostic techniques used in hmme-pdt in the treatment of port wine stains [J] . Photodiagnosis and Photodynamic Therapy, 2019, 25: 369-375.
[28] OKUNO T, SUGIYAMA T, TOMINAGA M, et al. Effects of caffeine on microcirculation of the human ocular fundus [J] . Japanese Journal of Ophthalmology, 2002, 46(2): 170-176.
[29] MAYSS A S, NOPASAK P, RPSA D M, et al. Quantitative oct angiography of the retinal microvasculature and the choriocapillaris in myopic eyes [J] . Investigative Ophthalmology & Visual Science, 2017, 58(4): 2063-2069.
[30] WU H, ZHANG G, SHEN M, et al. Assessment of choroidal vascularity and choriocapillaris blood perfusion in anisomyopic adults by SS-OCT/OCTA [J] . Investigative Ophthalmology & Visual Science, 2021, 62(1): 8.
[31] SRIENC A I, KURTH-NELSON Z L, NEWMAN E A. Imaging retinal blood flow with laser speckle flowmetry [J] . Frontiers in Neuroenergetics, 2010, 2: 1-10.
[32] FENG X, YU Y, ZOU D, et al. Functional imaging of human retina using integrated multispectral and laser speckle contrast imaging [J] . Journal of Biophotonics, 2022, 15(2): e202100285.
[33] KAZMI S M, RICHARDS L M, SCHRANDT C J, et al. Expanding applications, accuracy, and interpretation of laser speckle contrast imaging of cerebral blood flow [J] . Journal of Cerebral Blood Flow and Metabolism, 2015, 35(7): 1076-1084.
[34] VINNETT B A, KANDUKURI J, MSE C L, et al. Dynamic alterations in blood flow in glaucoma measured with laser speckle contrast imaging [J] . Ophthalmology Glaucoma, 2022, 5(3): 250-261.
[35] BENJAMIN E J, MUNTNER P, ALONSO A, et al. Heart disease and stroke statistics-2019 update: a report from the American heart association [J] . Circulation, 2019, 139(10): e56-e528.
[36] SMITH W S, SUNG G, SAVER J, et al. Mechanical thrombectomy for acute ischemic stroke: final results of the multi merci trial [J] . Stroke, 2008, 39(4): 1205-1212.
[37] SENERS P, TURC G, MAIER B, et al. Incidence and predictors of early recanalization after intravenous thrombolysis: a systematic review and meta-analysis [J] . Stroke, 2016, 47(9): 2409-2412.
[38] GOYAL M, MENON B K, VAN ZWAM W H, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials [J] . The Lancet, 2016, 387(10029): 1723-1731.
[39] BO B, LI Y, LI W, et al. Optogenetic translocation of protons out of penumbral neurons is protective in a rodent model of focal cerebral ischemia [J] . Brain Stimulation, 2020, 13(3): 881-890.
[40] WANG H L, CHEN J W, YANG S H, et al. Multimodal optical imaging to investigate spatiotemporal changes in cerebrovascular function in auda treatment of acute ischemic stroke [J] . Frontiers in Cellular Neuroscience, 2021, 15: 655305.
[41] LINDE M, GUSTAVSSON A, STOVNER L J, et al. The cost of headache disorders in Europe: the eurolight project [J] . European Journal of Neurology, 2012, 19(5): 703-711.
[42] CHEN W T, LIN Y Y, FUH J L, et al. Sustained visual cortex hyperexcitability in migraine with persistent visual aura [J] . Brain: A Journal of Neurology, 2011, 134(Pt 8): 2387-2395.
[43] JENSEN R, STOVNER L J. Epidemiology and comorbidity of headache [J] . Lancet Neurology, 2008, 7(4): 354-361.
[44] MOSKOWITZ M A, BOLAY H, DALKARA T. Deciphering migraine mechanisms: clues from familial hemiplegic migraine genotypes [J] . Annals of Neurology, 2004, 55(2): 276-280.
[45] STARHR C, HANGAARD L, BOUZINOVA E V, et al. Smooth muscle Ca2+ sensitization causes hypercontractility of middle cerebral arteries in mice bearing the familial hemiplegic migraine type 2 associated mutation [J] . Journal of Cerebral Blood Flow and Metabolism, 2019, 39(8): 1570-1587.
[46] STAEHR C, RAJANATHAN R, POSTNOV D D, et al. Abnormal neurovascular coupling as a cause of excess cerebral vasodilation in familial migraine [J] . Cardiovascular Research, 2020, 116(12): 2009-2020.
[47] TARANTINI S, FULOP G A, KISS T, et al. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimers disease using functional laser speckle contrast imaging [J] . Geroscience, 2017, 39(4): 465-473.
[48] TARANTINI S, VALCARCEL-ARES N M, YABLUCHANSKIY A, et al. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice [J] . Aging Cell, 2018, 17(2): e12731.
收稿日期:2022-10-25;修回日期:2022-11-07。
基金項目:国家自然科学基金项目(82202220,62035011);省部共建中亚高发病成因与防治国家重点实验室开放课题(SKL-HIDCA-2022-3);新疆医科大学省部共建中亚高发病成因与防治国家重点实验室资助项目(xyd2021Y005)。
作者简介:郭乐,硕士研究生。
* 通信作者:努尔尼沙·阿力甫,副教授,主要从事生物医学光学方向的研究。E-mail: nens_xjmu@126.com。

