纳米材料在癌症氢治疗中的应用现状
欧阳瑞镯 薛维锨 缪煜清
(上海理工大学 上海 200093)
1 引 言
氢气是自然界最轻的分子,作为一种重要的工业原料,在各种工业领域及航空航天等方面都扮演着不可或缺的角色。氢气具有燃烧产物清洁无害和储能能力强等特点,这使其成为可以日常使用的清洁燃料,是近年来许多科学家努力的方向。而氢气鲜为人知的另一面是它不仅可以作为一种清洁无害的燃料,还在治疗疾病方面发挥特殊的作用——抗癌。
早在 1975 年,科学家 Dole 等[1]就将患有皮肤鳞状癌的小鼠放置在氢气体积分数为 97.5% 的高压气体混合物中饲养两周,通过观察小鼠的皮肤肿瘤的消退情况,揭示了氢气可能的抗癌作用。然而,直到 2007 年,Ohsawa 等[2]报道了利用氢气改善脑缺血-再灌注损伤的实验,证明了氢气可以选择性地减少包括羟基自由基(·OH)和过氧亚硝酸盐(ONOO-)在内的细胞毒性活性氧(reactive oxygen species,ROS),氢气在医学上的应用潜力才得到广泛的探索,并引起了全世界的高度关注。近年来,氢气已被证明可以治疗更多的疾病,包括糖尿病、中风、动脉粥样硬化、帕金森病、阿尔茨海默病、关节炎等。
2 氢气抗癌机理
2.1 细胞毒性活性氧
ROS 指一系列含氧的不稳定分子,包括羟基自由基(·OH)、过氧亚硝酸盐(ONOO-)、单态氧(O2·)、过氧化氢(H2O2)、超氧化物(·O2-)和一氧化氮(NO·)等[3]。ROS 通常由细胞系统内不同的生化和生理氧化过程产生,一般有两种途径,分别是利用还原型辅酶 Ⅱ 氧化酶在细胞膜中生成和利用 还原型辅酶 I 氧化还原酶在线粒体中生成。ROS 的稳态是正常细胞存活和适当的细胞信号传递所必需的。在正常细胞中,ROS 的产生受到高度控制,因为它们与细胞分裂、免疫调节、自噬和应激相关反应的信号过程调节有关。然而,不受控制的 ROS 产生可导致氧化应激和细胞毒性,从而引起细胞功能丧失和异质疾病状态的发展,比如癌症。与正常细胞相比,癌细胞会增加局部 ROS 的产生,从而过度激活细胞转化和癌变所必需的信号通路。在癌症的早期阶段,细胞内的 ROS 通过诱导癌前基因和肿瘤抑制基因的氧化和碱基对替换突变,促进癌症的发生。然而,过量的 ROS 一旦在体内产生,由于其与某些生物分子的高度反应性,通过诱导细胞周期阻滞和细胞死亡会表现出抗肿瘤活性[4-5]。因此,癌细胞发展出一种机制,通过增加抗氧化能力,也就是增强抗氧化剂,如超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的表达,使得 ROS在产生和消除之间达到平衡,维持促肿瘤信号的最佳 ROS 水平[6-8]。
2.2 氢气抗癌的可能机制
氢气可以作为 ROS 的调节剂。
首先,如 Ohsawa 等[2]的研究所示,在急性脑缺血再灌注大鼠模型测试中,氢气可能可以选择性地清除 ROS 中最具细胞毒性的羟基自由基(·OH)和过氧亚硝酸盐(ONOO-),如图1 所示,吸入氢气之后,小鼠的脑梗面积减小。

图1 吸入氢气前后小鼠的脑梗面积[2]Fig.1 Cerebral infarction area of mice before and after hydrogen inhalation[2]
另一项研究也证实,氢气可通过有效降低羟基自由基(·OH)和过氧亚硝酸盐(ONOO-)的含量来降低高压氧引起的氧毒性[8]。氢气利用自身的选择性抗氧化特性清除 ROS,扰乱肿瘤微环境中的氧化还原稳态,并导致氧化还原应激,最终使癌细胞损伤和凋亡。目前为止,这仍然是最为公认的癌症氢治疗机理。然而,需要说明的是,氢气对癌症的治疗作用的具体机制在很大程度上依然是不明确的。假设它通过放热反应清除自由基,那么,随后,·H自由基将清除 O2-自由基。
但这种可能性并不能证明 H2去除恶性自由基的选择性,因为在理论上,H2其他自由基也应该具有清除作用。上述内容部分地解释了 H2的抗氧化性,但其他作用机制仍不清楚[9]。
其次,氢气也可能诱导一些抗氧化酶的表达,以及抑制某些信号蛋白的表达,例如:通过抗氧化酶消除 ROS,扰乱癌细胞的氧化还原稳态[10];通过抑制信号蛋白的表达,抑制肿瘤的发展。研究表明,经氢气处理后,超氧化物歧化酶[7]及血红素氧甘酶-1(HO-1)[11]的表达显著增加,增强了其消除 ROS 的潜力。Wang 等[12]通过 RNA-seq、qPCR 检测和体内实验证明 H2下调了肺癌细胞系 A549 和 H1975 中SMC3的表达,影响了细胞分裂过程,且超氧化物歧化酶水平升高,ROS 水平下降,促进了细胞凋亡。Meng 等[13]的研究表明,在含有不同浓度 H2的空气中对 A549 和H1975 细胞进行培养会导致CD47和细胞分裂控制蛋白 42(CDC42) 的表达水平呈剂量依赖性降低,并增强 A549 和 H1975 细胞中巨噬细胞介导的吞噬作用,促进了肺癌细胞凋亡,并抑制了癌细胞生长、侵袭和迁移。
如上所述,通过调节 ROS,以及调控肿瘤内一些蛋白的表达,氢气可以在癌症治疗中发挥出明显的疗效。另外,氢疗法可以作为其他治疗方式,如放疗和化疗的一种辅助方案,以减少癌症治疗中的不良反应,同时不影响其他治疗方式的细胞毒性[7-8]。有趣的是,由于癌细胞中产生的ROS 过多[14],氢气在一开始会降低 ROS 水平,但由于补偿效应,癌细胞通过 ROS 的调控机制产生过量的 ROS,从而使癌细胞死亡[15]。
2.3 氢气协同其他癌症疗法
传统化疗会增强肿瘤患者因化疗诱导而产生的炎症,这不仅可能引起严重的不良反应,还可能导致癌症转移和治疗失败[16-17]。氢气可以抑制炎症细胞因子的表达,具有一定的消炎作用。Wu 等[10]提到,H2通过下调白细胞介素 IL1-β、IL-6,肿瘤坏死因子-α(TNFα)等促炎因子,巨噬细胞趋化蛋白、细胞间黏附分子等炎症介质,以及人高迁移率族蛋白 B1(HMGB-1)、NF-κB、前列腺素 E2 等促炎转录因子,抑制氧化应激引起的炎症组织损伤。通过调节炎症,氢气可以减少化疗/放疗引起的副作用[18]。
除了传统的疗法,氢气对一些新型的癌症疗法也具有良好的辅助作用。为了克服传统放化疗的缺点,近年来,许多新型的癌症治疗方法不断涌现。其中,光热疗法(photothermal therapy,PTT)和光动力疗法(photodynamic therapy,PDT)是最为热门的研究方向。PTT 将近红外光照射在富集了光热药物的肿瘤部位,再通过光热转化产生的热能对肿瘤细胞造成热损伤,从而达到抗癌效果[19]。而 PDT 将红外光照射在肿瘤部位,与预先聚集在肿瘤部位的含有光敏剂的药物相互作用,生成 ROS,产生细胞毒性,促进癌细胞凋亡,从而达到抗癌效果。
然而,PTT 产生的热损伤会使周围的正常细胞也产生炎症反应,PDT 诱导生成的 ROS 产生的细胞毒性也会影响正常细胞。氢气的抗炎作用和 ROS 的消除作用使得其与 PTT 和 PDT 联合治疗时表现出良好的协同抗癌效果,可以克服二者造成的不良反应,且不影响它们正常的抗癌作用。图2 展示了氢气与其他疗法结合的可能机制[9]。通常来说,单一的疗法所取得的抗癌效果对于实际治疗往往是不够的,特别是对于尚处在实验室阶段的这些新疗法来说,提升疗效是这些方法共同面临的难题。这需要将不同的癌症治疗方法联合在一起,取各家之所长而避其短,通过纳米村料的多功能化,实现各种疗法的集成。将不同的癌症治疗方法联合在一起是提升疗效较为普遍的一个途径。
3 纳米载体
目前,氢气抗癌的真正机理虽然还未完全明确,但是由于其在大量的研究中所表现出来的生物安全性和癌症治疗的有效性,许多关于氢气的抗癌研究已经在如火如荼地进行。氢气在抗癌方
面表现出非常大的潜力,那么,如何将氢气加以利用呢?
早期,人们试图通过口服富氢水、注射富氢生理盐水、吸入氢气来达到治疗目的,但收效甚微。氢气作为自然界最轻的气体分子,具有良好的穿透性,可以迅速扩散通过细胞膜。因此,通过上述方法带入体内的氢气,由于其在体内无目的地扩散,没有富集在发病区域,因而难以实现良好的疗效。如何实现氢的定向给药、有效储存和可控释放是提高氢治疗疗效的关键。纳米村料的到来使得解决这些难题成为了可能[20]。纳米村料和药物的尺寸极其细小,可以更好地进入细胞内。此外,在适宜的尺寸条件下,纳米村料可以在血管异常密集的肿瘤区域非特异性聚集,实现被动靶向,也就是滞留效应(EPR)。同时,由于纳米村料可以进行各种修饰,因此,纳米村料可以实现许多功能,例如,可在纳米村料的表面上修饰光敏剂,使其具备光动力治疗的功能;让纳米村料携带氢气,再利用其靶向输送功能,就可以实现将氢气聚集在肿瘤细胞部位的目的,最大化治疗效果。
目前,已经有不少将纳米村料与氢气结合用于癌症治疗的研究。总的来说,在肿瘤内产生氢气的纳米系统主要有 3 种,分别是直接传递的纳米载体、原位生成的纳米反应器和原位催化发生器。
3.1 直接传递的纳米载体
直接传递的纳米载体就是将氢气直接负载在储氢纳米村料上,再进入体内,并在肿瘤细胞处聚集后,通过外部条件影响或者由纳米村料本身的肿瘤细胞响应功能将纳米村料中的氢气释放出来。例如:Wang 等[21]构建了一种蛋黄壳结构的纳米村料,如图3 所示,这是一种由外部的MnO2外壳和内部的 Pd 四面体组成的纳米村料。这种 Pd 四面体具有良好的储氢能力。在村料的制备过程中,负载在 Pd 四面体上的氢气会与其形成 PdH 四面体。

图3 蛋黄壳纳米材料协同 H2 和 PTT/PDT 治疗机制的示意图[21]Fig.3 Schematic diagram of the synergistic H2 and PTT/PDT therapeutic mechanism of yolk shell nanomaterials[21]
在整个纳米系统进入肿瘤细胞后,包裹在外的 MnO2外壳就会因与肿瘤环境中的物质发生反应而瓦解坍塌,暴露出储存有氢气的 Pd 四面体。最后通过近红外光的照射,Pd 四面体中的氢气就可以被释放出来。
Zhao 等[15]利用氢化钯纳米村料的高/稳定储氢、自催化加氢特性,开发了 PdH0.2纳米晶体,用于肿瘤靶向递送和控制释放生物还原性氢,进行癌症氢治疗。如图4 所示,合成的 PdH0.2纳米晶体具有较高的肿瘤内近红外光(near infrared,NIR)控制的氢释放行为。Zhao 等[15]又利用 Pd 纳米晶体本身良好的光热效应,实现了对癌症的氢气/光热联合治疗。

图4 PdH0.2 纳米晶体的生物还原性氢的合成和 NIR 控制释放[15]Fig.4 Synthesis and NIR controlled release of bioreducing hydrogen from PdH0.2 nanocrystals[15]
Chen 等[22]设计了一种生物相容性钯纳米晶体-集成纳米卟啉金属-有机框架(NPMOF),协同氢/光动力治疗。如图5 所示,NPMOF 同时作为PDT 的光敏剂和钯纳米晶体的载体,进一步用作氢载体。最终的含氢纳米系统表现出持续的还原性氢释放行为和大量的光激活单线态氧(1O2)的产生,而不相互干扰,有助于充分干扰肿瘤微环境的氧化还原稳态,协同诱导肿瘤细胞死亡。

图5 PCN-224@Pd/H2 纳米系统进行氢/光动力协同治疗的机制[22]Fig.5 PCN-224@Pd/H2 nanosystem for hydrogen/photodynamic synergistic therapy mechanism[22]
由上述的例子可以看出,直接传递的纳米载体主要是具有高储氢能力的金属有机框架(metal organic framework,MOF)村料,其中,钯 MOF因其突出的储氢能力和光热效应而得到了较多的应用。这类氢气纳米载体可以较为简便地在结构空位中负载上氢气,并进行氢治疗。但是由于氢气的储量有限,并且在氢气释放完后必须重新用药,因此,在持续的氢治疗中受到限制。
3.2 原位生成的纳米反应器
原位生成的纳米反应器是在纳米村料上负载某种反应物,在纳米反应器进入肿瘤细胞以后,在肿瘤细胞的环境条件下发生反应,从而产生氢气。例如:Yang 等[23]构建了一种由氨硼烷和介孔二氧化硅组合而成的纳米村料。如图6 所示,这种纳米村料中的氨硼烷可以在肿瘤细胞的弱酸环境中发生反应,生成氢气。且介孔二氧化硅纳米颗粒的结构中含有丰富的孔洞,这些孔洞可以为氨硼烷的负载提供大量的空间。这种纳米村料在进入肿瘤细胞之后,就可以自发地释放出大量的氢气。
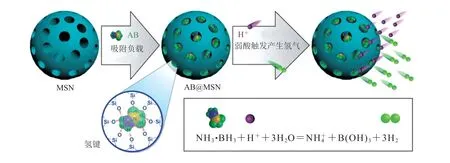
图6 介孔二氧化硅负载氨硼烷的纳米药物以及酸响应释放 H2 机制[23]Fig.6 Nanomedicine of amborane supported by mesoporous silica and acid response H2 release mechanism[23]
氨硼烷因在肿瘤微环境中产氢的自发响应性,以及在介孔纳米村料中的简易负载性,而受到了很多关注。有不少研究在介孔二氧化硅负载氨硼烷的基础上通过药物负载和其他功能化,探索了这个方向的其他可能性。另一种应用广泛的纳米药物载体聚多巴胺也在负载氨硼烷进行氢治疗上进行了许多尝试。如图7 所示,Wang 等[24]制备了一种氨硼烷(AB)和阿霉素(DOX)共载并且聚乙二醇化的中空介孔聚多巴胺(AB/ DOX@HMPDA-PEG)纳米颗粒,用于酸敏感氢(H2)辅助超声(US)成像和耐药肿瘤的化疗。实验表明,该纳米颗粒在肿瘤中的弱酸性环境下可释放大量 H2,并用于癌症的氢治疗。

图7 AB/DOX@HMPDA-PEG 纳米粒子治疗机制示意图[24]Fig.7 AB/DOX@HMPDA-PEG schematic diagram of therapeutic mechanism of nanoparticles[24]
氨硼烷作为一种产氢前药,其产氢能力较好,且产氢机制适合癌症治疗。然而,除了二氧化硅和聚多巴胺外,氨硼烷还会与大部分的纳米载体,特别是金属基的纳米载体发生反应。而在大部分的纳米载体中,都会有金属元素存在,这就导致氨硼烷容易使这些纳米村料坍塌,无法实现负载。因此,绝大部分利用氨硼烷进行氢治疗的报道,它们的载体都是介孔二氧化硅和聚多巴胺。这大大限制了氨硼烷在纳米村料氢治疗中的发展。如图8 所示,该团队在 Fe 纳米颗粒的表面包覆上一层抗氧化的涂层,以确保 Fe 纳米颗粒在运输过程中不被氧化。在纳米颗粒因滞留效应聚集在肿瘤细胞之后,通过 Fe 在肿瘤细胞弱酸性条件下的氧化还原反应来实现氢气的释放。Kou 等[25]提到,Fe 元素是人体所需的微量元素,Fe 纳米村料在人体中的微量残留对人体不会有太多不利的影响,甚至会有一定好处。但是,虽然 Kou 等[25]在 Fe 纳米颗粒外部包覆了羧甲基纤维素抗氧化涂层,但在到达癌细胞之前,在漫长的血液流动中,氧化反应的发生仍是不可避免的,这对后续产氢的弱酸响应性会造成影响。

图8 H2 的肿瘤靶向酸响应释放机制的示意图[25]Fig.8 Schematic diagram of the tumor-targeting acid response release mechanism of H2[25]
Kou 等[25]则利用 Fe 纳米颗粒来产生氢气。
Gong 等[26]通过液相剥离法制备 CaH2纳米颗粒,并首次将其作为抗肿瘤治疗剂。如图9 所示,将纳米 CaH2分散在低分子聚乙二醇(PEG)中,并注射到肿瘤部位,与水反应生成丰富的氢气(H2)、钙离子(Ca2+)和羟基离子(OH-),可分别实现氢治疗、肿瘤钙化和中和酸性肿瘤微环境(TME)。可注射的纳米 CaH2分散体可显著抑制肿瘤生长。由于 CaH2的产氢机制是与水反应,因此,该纳米颗粒不能通过静脉注射在体内肿瘤处靶向积累,这也是其采取直接注射在肿瘤部位的方法进行治疗的原因。从结果上来看,虽然实现了简便的产氢和治疗,但是治疗时间过短,CaH2纳米颗粒无法被肿瘤细胞充分摄取。大部分的氢气在肿瘤细胞周围产生并扩散,细胞内无法累积大量的氢气用于治疗。

图9 纳米 CaH2 材料氢治疗机制示意图[26]Fig.9 Schematic diagram of hydrogen therapy mechanism of nano CaH2 material[26]
大部分的原位生成的纳米反应器的产氢量都是直接传递纳米载体的几十倍以上,并且在氢气的供体上有不同的选择,可以根据载体村料的性质进行搭配,在氢治疗上体现出更多的优势。但是,同样在持续的氢治疗上,原位生成纳米反应器依然受限。此外,如上所述,各种原位产氢的方式对于癌症治疗来说,都有其不足的地方,除了在载体上进行更多的探索外,寻找更多适合癌症治疗的氢气供体也是亟待解决的另一个问题。
3.3 原位催化发生器
原位催化发生器指一类纳米催化体系,它们通过外部能量的输入在肿瘤细胞内部激发催化反应,产生氢气,对癌症进行氢治疗。
比如,Zhao 等[27]开发了一种 SnS1.68-WO2.41纳米催化剂,实现近红外(NIR)-光催化氧化空穴和生成氢分子,通过无药物治疗策略实现空穴/氢联合治疗。如图10 所示,在不需要任何药物和其他治疗剂的帮助下,该纳米催化剂通过空穴氧化消耗瘤内过表达的谷胱甘肽(GSH),同时在近红外照射下,以持久和可控的方式产生氢分子。该纳米催化剂实现了空穴/氢联合高效安全治疗肿瘤。

图10 SnS1.68-WO2.41 纳米催化剂治疗策略及机理示意图[27]Fig.10 SnS1.68-WO2.41 nanometer catalyst therapy strategy and mechanism diagram[27]
Wang 等[28]开发了一个近红外(NIR)激光驱动的原位水分裂 H2自生纳米平台。如图11 所示,他们设计并合成了以叶酸修饰的咪唑酸分子筛骨架-8(ZIF-8)为核心包裹的 NaGdF4:Yb,Tm/g-C3N4/Cu3P (UCC)纳米复合村料的核-壳纳米粒子(CSNP)。由于 ZIF-8 的酸反应性外壳、增强的渗透性和滞留性(EPR)效应,以及叶酸受体介导的内吞作用,CSNP 被肿瘤细胞选择性捕获。在 980 nm 激光照射下,CSNP 表现出较高的 H2生产能力,在肿瘤部位实现水裂解制氢和多种治疗方式的相互促进。

图11 CSNP 纳米催化剂治疗策略及机理示意图[28]Fig.11 CSNP nanocatalyst therapy strategy and mechanism diagram[28]
上述两种催化产氢体系都是将近红外光作为激发源。与其他波段的光相比,近红外光对人体具有更好的穿透性,可对较深的肿瘤进行治疗,因而得到广泛使用。但在更深的位置,近红外光依然会受到削弱。相比之下,超声具有更加优越的穿透性。
Yuan 等[29]提出了超声催化析氢的概念,并将其定义为一种不依赖氧的治疗方法。他们将窄带隙半导体硫化铋(Bi2S3)作为声催化剂,并原位生长铂(Pt)纳米颗粒,以优化其催化性能。如图12 所示,在该纳米催化体系中,Pt 纳米粒子有助于捕获声激发电子,而瘤内过表达的谷胱甘肽(GSH)作为一种天然的空穴牺牲剂,可以消耗声激发空穴,从而大大提高电荷分离效率,促进可控和可持续的氢气生成。即使在缺氧条件下,Pt-Bi2S3纳米颗粒在超声照射下也能产生足够的氢气。同时,Pt 纳米颗粒和孔洞还能触发过氧化氢分解成 O2,缓解肿瘤缺氧,从而与GSH 耗竭协同,改变肿瘤免疫抑制微环境。
从目前来看,原位催化发生器是最具有发展前景的产氢纳米系统。首先,这种系统解决了氢治疗的持续性问题,可以设想,只要纳米催化剂在肿瘤内部稳定存在,就可以通过外来能源的输入,如近红外和超声来实现原位产氢,这可以使氢治疗的过程高度可控。特别是声催化介导治疗,这是目前较为先进的策略,它克服了深部肿瘤的治疗困难,为实现简便、高效和可持续的肿瘤治疗提供了新的方向。原位催化发生器在未来需要改进的地方是增加催化剂的催化活性和稳定性。对于利用超声作为激发源进行产氢的纳米体系来说,目前的研究还相对较少,对声催化产氢机理的深入探索,提升村料在超声条件下产氢的能力是需要解决的问题。
4 结论与展望
目前来看,尽管相关的研究已经取得了一些显著的成果,但纳米村料的氢治疗依然面临着不少挑战。在纳米载体的选择上,应该避免增加治疗对人体的危害性,这意味着要提高纳米载体的安全性和生物相容性。氢治疗纳米系统的储氢、产氢能力和稳定性也需要进一步提高。此外,氢气抗癌的确切机制亟待揭露,除了选择性抗氧化以外,其他作用方式的具体机理是什么,是否对所有癌症都具有疗效,对不同的癌症疗效是否有不同等,这类问题都需要更深入的探索。因此,从分子水平解释氢气抗癌的作用机制是非常迫切的一项工作,这是更好地利用氢气来进行癌症治疗的基础。正如许多尚处在实验室研究阶段的疾病疗法一样,针对癌症的纳米村料氢气疗法想要真正造福人类,还有很长的路要走。人体安全无小事,在实现实际应用之前,各种安全性检验和临床试验都是必需的。这是一个非常漫长的过程,也是很多新兴疗法还未呈现在世人面前的主要原因。但道阻且长,行则将至,正因为人类的不断探索,才有今天的成就。所以也可以相信,在不远的将来,越来越多的疗法可以真正为患者带来福音,癌症等疾病也终将被人类战胜。

