秋水仙素对不同葡萄多倍体诱导的影响
刘牧青,马岩,谢洁,韩宁,代玲敏*
(1.齐鲁工业大学(山东省科学院)生物工程学院,山东济南 250353;2.滨州医学院药学院,山东烟台 264003)
植物的染色体加倍是通过增加优势等位基因数量和降低有害隐性等位基因的影响,进而提高植物活性并增强植物的适应性[1-3]。植物多倍体常表现出器官(如花、果实、种子、叶、茎和根等)的巨大性[4]。通过种植多倍体植物,能够减少农业生产的投入(化肥、植物生长调节剂等),增加产量和经济收入,因此多倍体育种是经济作物重要的育种方式之一[5]。此外,植物多倍体可以自然形成,主要是通过不同倍性亲本间杂交或形成配子时染色体数目未减少来实现[4,6]。但是植物自然多倍体发生概率小,生长进程缓慢,仅有15%的被子植物以多倍体形式存在[7]。相比之下,使用秋水仙素(Colchicine)、安磺灵(Oryzalin)、甲基胺草磷(Amiprophosmethyl)、氟乐灵(Triflralin)、拿草特(Pronamide)等抗有丝分裂药剂能够加速植物多倍体的形成进程,因此被广泛应用于人工诱导多倍体的研究[8]。
秋水仙素是从百合科秋水仙中提取的一种天然生物碱[9],能够与细胞中微管蛋白结合,通过阻碍细胞有丝分裂过程中维管形成的方式阻止细胞染色体在分裂后期向细胞两极移动[10],细胞周期结束时胞质分裂的失败将导致两组染色体留在一个细胞内,使得细胞停留在分裂中期,形成多倍体[5,11-12]。早在1938年,秋水仙素即应用于植物染色体加倍研究[13]。目前,秋水仙素应用于多种作物的多倍体培育中,包括葡萄、苹果、柑橘、枇杷等[14-17],已成功育得约46种多倍体植物[18]。
多倍体葡萄具有果粒大、产量高、适应性强、种植广泛等特点[19],因此多倍体育种是重要的育种手段。器官再生和体细胞胚再生是葡萄两种再生途径[20]。为研究秋水仙素处理对不同葡萄外植体成活率的影响,采用器官再生途径的不定芽、体细胞胚再生途径的胚性愈伤和体细胞胚为外植体,进行秋水仙素诱导。
秋水仙素诱导葡萄产生多倍体时,受秋水仙素浓度、处理时间、葡萄品种及外植体类型的影响[5,14]。本研究采用不同秋水仙素浓度,对不同葡萄品种的茎尖等外植体进行诱导,以研究不同品种适宜的多倍体诱导方法。同时采用流式细胞仪和染色体技术方法,对诱导获得的再生苗进行染色体数目鉴定,并比较不同倍性葡萄植株的形态特征和气孔等的差异。
1 材料与方法
1.1 植物材料与培养条件
本实验室前期使用‘5BB’‘红宝石无核’‘金星无核’‘阳光玫瑰’‘白奥林’和‘藤稔’葡萄的花器官诱导胚性愈伤组织,但葡萄体细胞胚途径的诱导受基因型影响大,仅‘5BB’砧木品种成功诱导出胚性愈伤[21]。因此本研究中采用前期实验室诱导保存的‘5BB’不定芽、胚性愈伤组织和体细胞胚为外植体,经不同浓度秋水仙素分别处理1、2、3 d后再培养6个月,以确定适宜秋水仙素处理的外植体类型。
在前期通过对‘红宝石无核’‘金星无核’‘阳光玫瑰’‘藤稔’和‘白奥林’5个葡萄品种的单芽茎段进行初代组织培养,以获得的不定芽为材料,探究秋水仙素处理对不同品种不定芽再生的影响。葡萄组培苗于温度25±1 ℃、16/8 h光周期和光照强度2000 Lx无菌条件下培养。
不定芽培养基为1/2MS+0.2 mg·L-16-BA+0.15 mg·L-1IBA+20 g·L-1蔗糖+7 g·L-1琼脂。胚性愈伤组织和体细胞胚培养基为MS+60 g·L-1蔗糖+1 g·L-1活性炭+3 g·L-1植物凝胶。培养基用2 mol·L-1NaOH溶液调整pH为6.0,121 ℃灭菌30 min。
1.2 秋水仙素处理
配制秋水仙素浓度分别为100、250 、500 mg·L-1的固体培养基,外植体分别在不同浓度秋水仙素培养基上各培养1、2、3 d。其中,100 mg·L-1秋水仙素处理1、2、3 d,简写为1-1、1-2和1-3;250 mg·L-1秋水仙素处理1、2、3 d,简写为2-1、2-2和2-3;500 mg·L-1秋水仙素处理1、2、3 d,简写为3-1、3-2和3-3。秋水仙素处理后,外植体用无菌水冲洗3次,转至不含秋水仙素的固体培养基中培养。外植体每4周继代一次,直至长成完整新植株,统计外植体存活率。
1.3 葡萄倍性分析
由于本试验中获得的‘5BB’等品种的再生苗长势较弱,因此选取长势较好的100 mg·L-1秋水仙素处理1 d后的19个‘红宝石无核’不定芽染色体加倍的无菌苗进行染色体数目鉴定。取其生长点下方第2、3片幼叶,使用流式细胞仪(Partec,德国)检测,检测方法参照Xie等[14],未处理的‘红宝石无核’叶片为对照。选取再生植株茎尖,用1%纤维素酶和10%果胶酶酶解、Carnoy I溶液固定并分散、压片,使用改良苯酚品红溶液染色15 min后于显微镜下观察得到具体染色体数目。
1.4 ‘红宝石无核’再生植株形态特征和叶绿素含量分析
选取4周苗龄的无菌苗,观察并检测植株和根系的生长情况,并分别选取其生长点下方第4片叶,检测叶片大小和叶绿素相对含量(参照SPAD-502P,日本,使用说明书);检测生长点下方第3~4节的节间长度和粗度。
1.5 ‘红宝石无核’再生植株气孔分析
选取苗龄4周的无菌苗生长点下方第4片叶,撕取下表皮,显微镜下观察下表皮气孔的大小和数量。以上试验均重复3次。
1.6 数据统计与分析
数据用SPSS 21.0统计软件分析方差,选用Oneway ANOVA进行单因素方差分析。结果用平均值±标准误表示,显著性水平设置为0.05。
2 结果与分析
2.1 秋水仙素处理后的成苗率及成苗时间
秋水仙素处理后‘5BB’不定芽、胚性愈伤组织和体细胞胚再生成苗情况见图1。从3种外植体的成活率统计结果发现,不定芽存活率受抑制程度最大,其次为体细胞胚;胚性愈伤组织存活率受抑制程度最小;秋水仙素浓度越高、处理时间越长,外植体存活率越低(图2A)。秋水仙素处理后,外植体再生成苗过程受抑制,成苗用时较对照显著升高。不定芽作为外植体,秋水仙素处理后成苗时间用时最短,为5周,而胚性愈伤和体细胞胚的成苗用时分别为22周和20周(图2B)。不定芽易诱导获得,并且将其作为外植体进行秋水仙素诱导处理后成苗迅速,操作简便,因而不定芽可以作为外植体用于葡萄染色体加倍研究。
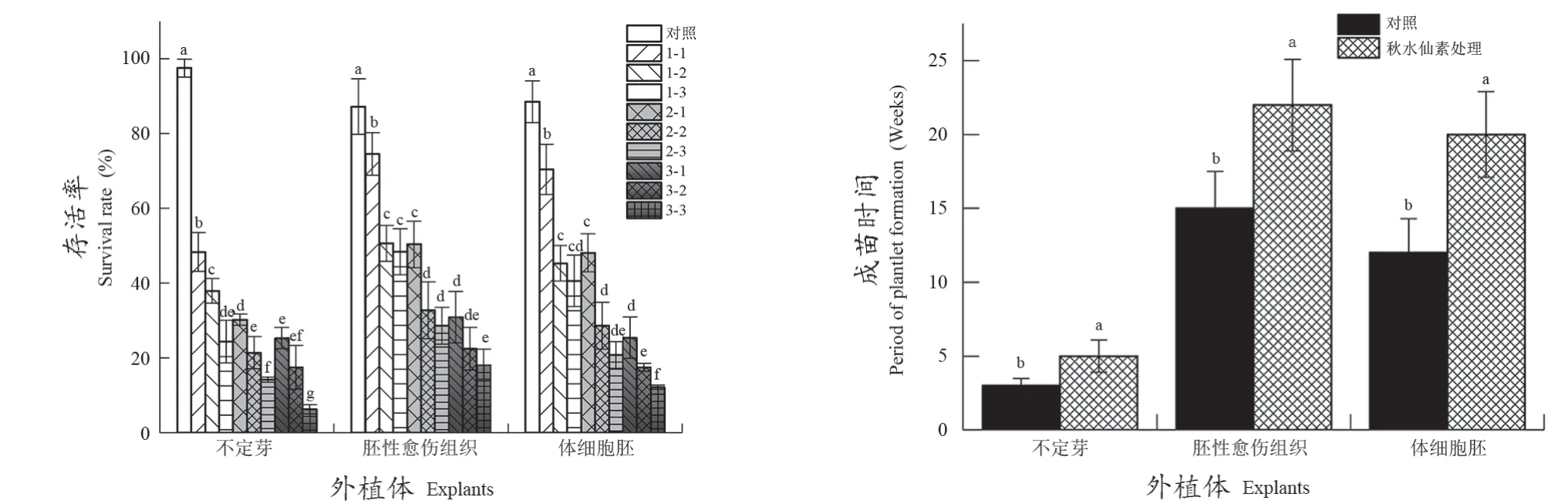
图2 不同秋水仙素处理时‘5BB’葡萄外植体存活率和成苗时间Figure 2 Survival rate and period of plantlets of '5BB' explants regenerated after treated with colchicine
2.2 不同葡萄品种不定芽秋水仙素染色体加倍成活率
不同基因型葡萄的不定芽在秋水仙素影响下,存活率呈下降趋势,且各品种间具体表现略有差异(图3)。秋水仙素处理1~2月后,‘红宝石无核’‘阳光玫瑰’和‘藤稔’存活率下降幅度小,而‘金星无核’和‘白奥林’存活率下降幅度大;处理6个月后,秋水仙素浓度越高、处理时间越长,5个品种的存活率均达到最低水平。不同葡萄品种中,‘白奥林’不定芽存活率差异较小,而其余品种的差异较大。秋水仙素浓度为100 mg·L-1、处理时间为1 d时‘红宝石无核’‘阳光玫瑰’‘白奥林’和‘藤稔’葡萄存活率最高,而在250 mg·L-1秋水仙素处理1d时,‘金星无核’存活率最高。

图3 不同鲜食葡萄不定芽秋水仙素处理后存活率Figure 3 Survival rate of adventitious buds from diあerent table grape varieties treated with colchicine
2.3 秋水仙素处理后葡萄染色体数目鉴定
流式细胞仪结果显示,‘红宝石无核’二倍体葡萄的标准峰出现在100。与对照比较,秋水仙素处理后,染色体加倍检测表明,送检的19个株系中有2个株系最高峰右移,证明秋水仙素处理后,再生的葡萄出现染色体数目增加。后续操作中进一步确认再生葡萄染色体的具体数目后发现,再生葡萄中包括具有48条染色体的植株1株、具有58条染色体的植株1株,具有112条染色体的植株1株,其余16个株系为二倍体,染色体加倍率为15%。
2.4 秋水仙素处理后葡萄形态特征和叶绿素含量分析
为研究染色体数目加倍对‘红宝石无核’形态或生理的影响,对染色体数目分别为38(二倍体)、48、58、112的株系进行形态特征和叶片叶绿素相对含量分析。结果表明,随着染色体数目的增加,植株生长速度更快,根系更发达。同时,染色体数目增加后,植株叶片大小和叶绿素含量、节间长度、根系质量略高于二倍体对照植株;其中,染色体数目为112的葡萄植株叶片大小和叶绿素相对含量、节间长度、根系质量显著高于对照。但其茎粗与对照差异不显著(表1)。
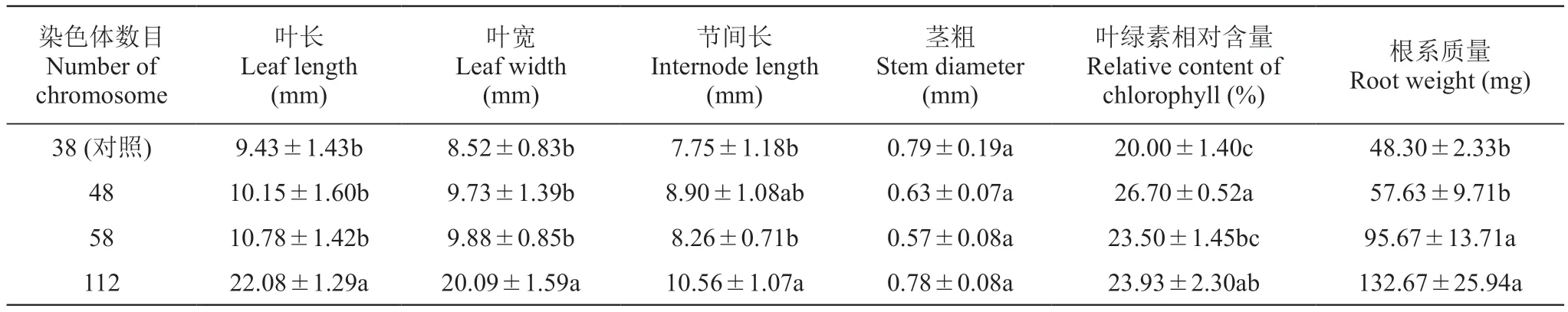
表1 ‘红宝石无核’秋水仙素处理后再生苗形态特征和叶绿素含量分析Table 1 Morphological characteristics and chlorophyll content analysis of regenerated seedling of 'Ruby Seedless' with colchicine treatment
2.5 秋水仙素处理后葡萄叶片气孔观察
为进一步验证染色体数目增加后对葡萄性状的影响,对‘红宝石无核’葡萄叶片下表皮气孔进行观察。结果发现,与二倍体对照相比,染色体数目增加后,‘红宝石无核’葡萄叶片下表皮气孔密度降低,但气孔体积较大(图4)。

图4 ‘红宝石无核’秋水仙素处理后再生苗叶片气孔特征Figure 4 Stomatal characteristics of regenerated seedling leaf of'Ruby Seedless' treated with colchicine
3 讨论与结论
秋水仙素能够抑制生长旺盛、细胞分裂活跃的植物幼嫩部位的细胞有丝分裂,实现植物染色体加倍[22]。秋水仙素的浓度、处理时间、外植体类型等均影响多倍体的诱导效果[5]。由于与植物微管蛋白亲和力较差,秋水仙素处理浓度在0.05%~1%[5,14]。有研究表明,秋水仙素对植物有毒害作用,随着秋水仙素浓度增高和处理时间延长,植物外植体存活率降低[23-24],本试验的研究结果与其一致。
植物不同部位用秋水仙素处理后的效果不同[14]。不定芽、胚性愈伤组织和合子胚等常作为外植体,用于葡萄多倍体诱导[25-26]。合子胚是葡萄有性繁殖后代,性状与亲本间存在差异,生产上应用较少。本试验采用‘5BB’葡萄的花器官诱导得到的体细胞胚作为外植体,研究其与不定芽、胚性愈伤组织等受秋水仙素的影响。结果表明,秋水仙素处理后,胚性愈伤存活率较高,不定芽和体细胞胚存活率抑制效果更显著,试验结果与Xie等[14]较一致,可能与胚性愈伤组织活性较高有关。此外,秋水仙素处理后明显减缓了葡萄植株再生速度,胚性愈伤组织和体细胞胚再生成苗速度远远小于不定芽。另外,不定芽的诱导不受季节限制,易获得,且操作简便,因此不定芽成为葡萄多倍体诱导的较适宜的外植体。不同葡萄品种的不定芽用秋水仙素处理后的表现也不同。植物用秋水仙素处理后,致死率在25%~50%以上,植物染色体变异率高[27]。本研究中,秋水仙素处理后,不同葡萄品种再生率在5%~70%,证明试验中秋水仙素处理浓度和处理时间较适宜,可产生较高的突变率。
流式细胞仪是一种鉴定植物染色体倍性的常用方式,该方法具有速度快、操作简便的特点,但是不能准确得到染色体的具体数目。相比之下,染色体计数虽耗时费力,但结果较准确[28]。本研究采用流式细胞仪和染色体计数方法检测‘红宝石无核’不定芽再生植株染色体倍性,染色体加倍的再生苗中出现倍性嵌合植株和6倍体植株,表明染色体部分加倍或过度加倍,诱导过程中出现混合倍体的现象[26],此结果与前人研究一致。不定芽再生植株过程属于器官发生途径,再生植株是由多层细胞分化而来,故在秋水仙素处理时不定芽容易产生混合倍体,从而影响再生植株的均匀多倍体化[28-29]。染色体加倍后,植物形态特征和气孔特征会发生变化,因多倍体葡萄较二倍体葡萄表现出叶片大、节间长、气孔更大、气孔密度较小的特点[30-31]。本研究发现,过度加倍的葡萄植株叶片大小、叶绿素相对含量、节间长度显著高于二倍体植株。
本研究利用不同浓度秋水仙素诱导葡萄外植体,确定了本研究中最适合的葡萄属植物多倍体育种的外植体类型为不定芽、秋水仙素最佳诱导浓度为100 mg·L-1、处理时长宜为1 d。探究了秋水仙素对不同鲜食品种存活率的影响,在秋水仙素处理1—2月后,‘金星无核’和‘白奥林’存活率下降幅度大;而在秋水仙素不同浓度及处理时间的条件下,‘白奥林’不定芽存活率差异较小,而其余品种不定芽差异较大;并发现‘红宝石无核’染色体加倍后,过度加倍致使葡萄植株形态特征、气孔特征发生明显变化。

