混合菌剂对葡萄白粉病发生及叶际微生物多样性的影响
杜鸿燕,何涛,陈吉越,胡祥,史亮涛,刘海刚,杨顺林*,杜飞*
(1.云南省农业科学院热区生态农业研究所,云南元谋 651300;2.云南农业大学教育部农业生物多样性与病害控制重点实验室/农业生物多样性应用技术国家工程研究中心,云南昆明 650201)
云南是我国鲜食葡萄的重要产区,2021年全省葡萄栽培面积3.93万 hm2[1-2]。在葡萄种植过程中,由白粉菌目钩丝壳属葡萄白粉菌(Uncinula necator(Schw.)Burr.)引起的白粉病,会导致葡萄叶片黄化、脱落,严重时导致树体停止生长[3],给生产带来巨大损失。随着避雨栽培面积加大,不同地区的白粉病也有加重的趋势,影响了云南葡萄产业的发展。
目前葡萄病害的防治仍以化学药剂为主,腈菌唑和吡唑醚菌酯均具有低毒、广谱、高效等特点[4-5]。解淀粉芽孢杆菌为有益菌,能诱导植物产生抗性,增加与植物抗病性相关的酶活性[6]。然而,在使用单一菌剂防治葡萄白粉病时,由于菌剂的广谱性,常产生特异性脱靶作用,对葡萄叶际微生物产生严重影响,因此,在施用农药时结合不同类型药剂并科学合理地混用一些生防菌剂,可促进植物生长,增强植物抗性[7-9]。有研究发现,使用农药后能在科和属水平上降低叶际细菌群落的相对丰度,这与和植物生长及营养补充功能相关的某些菌群变化有关[10],频繁使用异菌脲也会对植物叶际及根际微生物群落结构造成显著影响[11],但关于施用混合菌剂对葡萄叶际微生物影响的研究鲜有报道。
近年来,研究叶际微生物多样性大多采用高通量测序方法,与传统的微生物研究方法相比,基于Illumina高通量测序能更全面地反映微生物在不同水平上的相对丰度及变化情况,结合生物信息学、人工可控的植物-微生物互作系统等方法,能为现代农业中通过调控微生物群落的变化,促进植物健康状况提供更多依据。刘利玲[12]采用基于16S rRNA和ITS1基因的MiSeq高通量测序技术发现,青杨雌雄株具有不同的叶际微生物菌群和显著富集的菌群。杨蕾等[13]利用高通量测序技术对有青苔病症和无病症的柑橘叶际真核生物的群落结构组成多样性及差异进行了研究,发现优势门为链形植物门(Streptophyta)、子囊菌门(Ascomycota)等。
在微生物多样性的研究中,可以通过单样本的多样性(Alpha多样性)分析反映微生物群落的丰富度和多样性。群落丰富度(Community richness)的指数有:Chao、Ace;群落多样性(Community diversity)的指数有:Shannon、Simpson。Shannon是用来估算样本中微生物多样性的指数之一,它与Simpson多样性指数类似,常用于反映群落Alpha多样性,Shannon值越大,说明群落多样性越高。Simpson也是用来估算样本中微生物多样性的指数之一,由Edward Hugh Simpson于1949年提出,在生态学中常用来定量描述一个区域的生物多样性,Simpson指数值越大,说明群落多样性越低。
本文将化学菌剂和生防菌剂合理混用后,采用Illumina高通量测序技术结合生物信息学对葡萄叶际微生物群落的结构及功能进行研究,并在田间进行病害调查,计算病情指数及混合菌剂防效,旨在明确混合菌剂农药对葡萄叶际微生物群落结构及白粉病发生的影响,以期为混剂农药研发、合理施用及生防菌的筛选提供理论依据。
1 材料与方法
1.1 材料
供试材料为树龄11年的‘红地球’葡萄,在简单的避雨栽培模式下,主要病害为葡萄白粉病和霜霉病,近五年内除了在这两种病害的发病期施用预防治疗药剂外,未施用过其他农药。供试药剂主要有40%腈菌唑(Myclobutanil)悬浮剂(江苏耘农化工有限公司),25%吡唑醚菌酯(Pyraclostrobine)悬浮剂(江苏剑牌农化股份有限公司),解淀粉芽孢杆菌微生物叶面肥(有益微生物≥10亿 cfu•mL-1,云南省微生物发酵工程研究中心有限公司)。
供试仪器主要有电动农药喷雾器(20 L,潍坊鑫浩德机械有限公司)、超净工作台(V1500V010810JU,苏州佳宝净化工程设备有限公司)、高速冷冻离心机(5430 R,Eppendorf Centrifuge)、超声波清洗机(SY3100DH,40 KHz,上海声源超声波仪器有限责任公司)、高通量组织破碎仪(Wonbio-96c,上海万柏生物科技有限公司)。
1.2 方法
1.2.1 试验方法
试验于2020年8月在云南农业大学现代科研教学实践中心(103°40'E,25°23'N,海拔1920 m)葡萄基地进行,采用随机区组设计,设置混合杀菌剂(SW)处理:3000倍吡唑醚菌酯+3000倍腈菌唑+100倍解淀粉芽孢杆菌,无菌水(CK)处理为对照,设置每小区面积为40 m2,3个重复。2020年8月19日首次喷药,之后每7 d施药1次,共3次。采用小型喷雾器进行喷施,均匀喷洒在叶片上,每小区用药量为3.6 mL吡唑醚菌酯+1.8 mL腈菌唑+27 mL解淀粉芽孢杆菌,杀菌剂混合方式及用量经田间筛选[16]。
1.2.2 样品的采集及前处理
于第3次施药24 h后取样并进行病害调查,以随机均匀取样为原则,每个处理选择6株长势相似的葡萄树,采集朝向、大小、离地面高度均一致,新梢第7~8片无雨滴露珠的叶片,每处理6个重复,保存于50 mL无菌离心管中,并立即置于干冰盒中带回实验室。将采集的叶片样品取出,在无菌超净工作台中加入10 mL·g-1PBS缓冲液(0.1 mol·g-1,pH=8.0),在40 KHz下超声15 min,涡旋10 s(20 ℃,200 r·min-1),重复润洗2次,然后将各样品的2次洗脱液(20 mL)收集至离心管中,离心(4 ℃,13000 r·min-1)10 min,弃上清液,收集沉淀。
1.2.3 葡萄叶际微生物总DNA提取与PCR扩增
将收集的沉淀取出,用Mp Fast DNA®Kit(6560-200)试剂盒抽提DNA,并用1%的琼脂糖凝胶电泳和Nano Drop 2000检测提取的DNA的质量。细菌采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对V3-V4可变区进行扩增,真菌采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对ITS1区进行PCR扩增,引物为上海美吉生物医药科技有限公司合成。
20 µL扩增体系:4 µL 5×FastPfu缓冲液、0.4 µL聚合酶FastPfu、2 µL dNTPs(2.5 mmol·L-1)、0.8 µL上游引物(5 µmol·L-1)、0.8 µL下游引物(5 µmol·L-1)、1 µLDNA模板(10 ng·µL-1),ddH2O补足至20 µL。PCR扩增程序:95 ℃预变性3 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,10 ℃保存,扩增后的DNA经纯化混匀后送上海美吉生物医药科技有限公司测序,每个处理测定6个样品。
1.2.4 Illumina Miseq测序数据处理及比对
使用Fastp软件对原始序列数据进行质控,使用Flash软件进行拼接,使用Uparse软件设置97%相似度对序列进行Operational Taxonomic Units(OTU)聚类并剔除嵌合体。利用RDP classifier算法对每条序列进行物种分类注释,设置比对阈值为70%,与16S rRNA数据库Silva、ITS数据库Unite进行比对。
利用PICRUSt和FUNGuild(Fungi Functional Guild)对测序结果进行功能预测。PICRUSt是针对16S扩增子测序结果进行功能预测的一款软件包。首先通过PICRUSt(PICRUSt流程存储greengene id对应的COG信息和KO信息)对OTU丰度表进行标准化,即去除16S marker gene在物种基因组中的copy数目的影响;然后通过每个OTU对应的greengene id,获得OTU对应的COG家族信息和KEGG Ortholog (KO)信息;并计算各COG的丰度和KO丰度。根据COG数据库的信息,可以从eggNOG数据库中解析到各个COG的描述信息,以及其功能信息,从而得到功能丰度谱;根据KEGG数据库的信息,可以获得KO、Pathway、EC信息,并能根据OTU丰度计算各功能类别的丰度。此外,针对Pathway,运用PICRUSt可获得代谢通路的3个水平信息,并分别得到各个水平的丰度表。FUNGuild是一款通过微生态guild对真菌群落进行分类分析的工具,guild是微生态学中的概念,其涉及到一类物种(不管亲缘关系相近与否),这些物种能通过相似的途径利用同类环境资源。FUNGuild基于目前已发表的文献或权威网站数据,首先根据营养方式将真菌分为3大类:病理营养型(Pathotroph)、共生营养型(Symbiotroph)、腐生营养型(Saprotroph)。基于3大营养方式,又进一步细分为若干个guilds,通过生物信息学方法将真菌物种分类与功能guild分类联系起来,就可以对真菌进行功能分类。
1.2.5 田间调查
在施药前对两个处理随机各6株树进行了调查,从8月19日起,之后每7 d施药一次,共3次。每次施药后,再次打药前1 d随机对每个处理的6株树进行调查,最后一次调查在8月31日施药后24 h,每株调查10片叶,共调查4次,并根据叶片病害分级标准,记录发病情况。0级:叶面无病斑;1级:病斑面积占整个叶面积的5%以下;3级:病斑面积占整个叶面积的6%~25%;5级:病斑面积占整个叶面积的26%~50%;7级:病斑面积占整个叶面积的51%~75%;9级:病斑面积占整个叶面积的75%以上。按照下列公式[14]计算病情指数和防治效果:
病情指数=∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)×100
防治效果(%)=(对照病情指数-施药后处理情指数)/对照病情指数×100
1.3 数据分析
采用SPSS进行数据分析,应用Duncan's新复极差法对田间试验进行显著性检验,T检验法对葡萄叶际微生物相对丰度进行显著性检验,利用上海美吉生物科技有限公司云平台(https://cloud.majorbio.com)制图。
2 结果与分析
2.1 混合菌剂处理对葡萄白粉病的防控作用
在整个病害调查期,施药前CK和SW的白粉病病情指数分别为74和75,施用混合菌剂处理的葡萄白粉病的病情指数显著降低,尤其在施用第3次药后下降明显,降低至30;对照的白粉病病情指数不断上升,在第3次药后接近100。在本研究中,混合菌剂对葡萄白粉病防效在第3次药后达到最高,且随施药次数增加呈上升趋势(图1)。

图1 施药处理后葡萄白粉病病情指数(A)和农药防治效果(B)Figure 1 Grapevine powdery mildew disease index (A) and pesticide control eあect (B) after application and control treatment
2.2 葡萄叶际微生物样品测序质量评估
使用农药混合菌剂和对照处理的葡萄叶际细菌群落总序列数分别为241 092、244 126条,真菌群落总序列数分别为400 657、392 167条,细菌、真菌平均片段长度分别为214、263 bp;按照相似度97%对非重复序列进行聚类后共获得细菌1016个OUT、真菌188个OUT。葡萄叶际细菌及真菌稀释曲线显示,在97%相似度分类水平下,细菌及真菌多样性稀释曲线逐渐趋于饱和稳定,表明测序数据量足够,可以反映葡萄叶际微生物绝大多数物种信息(图2)。

图2 葡萄叶际细菌(A)和真菌(B)的Shannon稀释曲线Figure 2 Shannon dilution curve of grapevine phyllosphere bacteria (A) and fungi (B)
2.3 混合菌剂对葡萄叶际微生物的影响
2.3.1 混合菌剂对葡萄叶际微生物Alpha多样性的影响
不同处理葡萄叶际微生物的Alpha多样性指数见表1,施药处理后葡萄叶际的细菌群落Chao1、Ace丰富度指数分别下降了50.78%、47.97%;Shannon多样性指数降低1.36,比对照降低48.57%,Simpson多样性指数增加。说明施用混合菌剂会显著降低葡萄叶际细菌的多样性和丰富度。
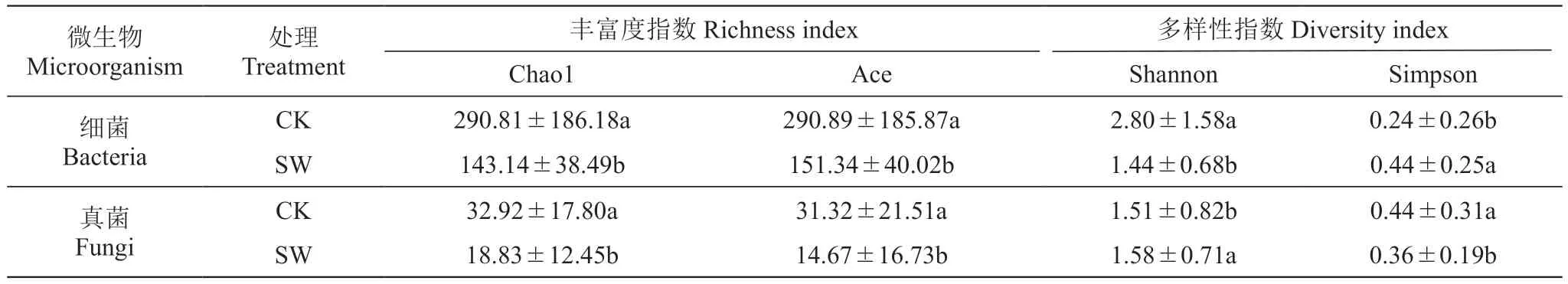
表1 施用混合菌剂对葡萄叶际微生物多样性指数的影响Table 1 Eあect of mixture application on grapevine phyllosphere microbial diversity index
施药后真菌群落Chao1、Ace丰富度指数分别下降了42.80%、53.16%;Shannon多样性指数增加0.07,Simpson多样性指数降低。说明施用混合菌剂会显著降低葡萄叶际真菌的丰富度,而显著增加了真菌的多样性(表1)。
2.3.2 混合菌剂对葡萄叶际微生物Beta多样性的影响
基于Bray-Curtis距离算法在OTU水平和属水平进行主坐标分析(Principal Coordinates Analysis,PCoA),如图3所示,在OTU水平及属水平上不同处理的葡萄叶际细菌群落均在坐标轴上有明显距离但又未完全分离,表明两处理之间细菌群落有部分相同的物种,PC1及PC2在各水平上共解释了47.36%、80.41%的微生物结构差异。进一步采用非参数检验法ANOSIM分析得出,在OTU水平上R=0.32,在属水平上R=0.25,两水平上均为P<0.05,即样品的组间差异大于组内差异,表明混合菌剂处理后在OTU水平及属水平上葡萄叶际细菌群落结构差异显著。

图3 不同处理葡萄叶际细菌(A&B)及真菌(C&D)在OTU水平及属水平的PCoA分析Figure 3 PCoA analysis of bacteria (A&B) and fungi (C&D) in grapevine phyllosphere under diあerent treatments at OTU level and genus level
在OTU水平及属水平上不同处理的葡萄叶际真菌群落均在坐标轴上完全分离,表明两处理之间真菌群落有明显差异,PC1及PC2在各水平上共解释了66.56%、69.41%的微生物结构差异。进一步采用非参数检验法ANOSIM分析得,在OTU水平上R=0.28,在属水平上R=0.29,两水平上均为P<0.05,即样品的组间差异大于组内差异,表明混合菌剂处理后在OTU水平及属水平上葡萄叶际真菌群落结构差异显著。
2.3.3 混合菌剂对葡萄叶际细菌群落结构的影响
在所有测定的对照样品中,Firmicutes为丰度最高的细菌门,平均相对丰度达60.18%,其次是Proteobacteria(20.13%)、Actinobacteriota(18.03%)、Bacteroidota(1.40%),以上细菌门累计相对丰度为99.74%,在不同处理中存在差异。施药处理葡萄叶际中的Firmicutes增加了37.48个百分点,Proteobacteria和Bacteroidota消失,Actinobacteriota降低了16.68个百分点(图4A)。

图4 不同处理的葡萄叶际细菌门水平(A)及属水平(B)物种组成Figure 4 Species composition at phylum level (A) and genus level (B) of grapevine phyllosphere bacteria under diあerent treatments
在属水平上,Bacillus、Pantoea、Stenotrophomonas、Paenibacillus、Curtobacterium、Sanguibacter为对照组葡萄叶际细菌群落中平均相对丰度较高的6个属,相对丰度分别为51.22%、7.70%、7.42%、6.68%、6.21%、5.62%。施药后,Bacillus增加46.19个百分点,Pantoea、Stenotrophomonas、Paenibacillus、Curtobacterium、Sanguibacter、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、unclassified_f__Micrococcaceae、Chryseobacterium、Psychrobacillus均消失,其余低丰度细菌类群合并为others,由4.35%降低至2.59%(图4B)。以上结果表明了施药影响葡萄叶际细菌类群。
2.3.4 混合菌剂对葡萄叶际真菌群落结构的影响
如图5所示,在所测定的对照样品中,Ascomycota为丰度最高的门,平均相对丰度达81.84%;其次是Basidiomycota(17.75%),以上2个真菌门累计相对丰度为99.59%。施药处理后葡萄叶际中的Ascomycota相对丰度降低了22.85个百分点,Basidiomycota则增加了21.9个百分点。

图5 不同处理的葡萄叶际真菌门水平(A)及属水平(B)物种组成Figure 5 Species composition at phylum level (A) and genus level (B) of grapevine phyllosphere fungi under diあerent treatments
在属水平上,Vishniacozyma、Cladosporium、Filobasidium、Coprinellus、Erysiphe为葡萄叶际真菌群落中相对丰度较高的5个属,平均相对丰度分别为38.07%、26.18%、8.94%,7.18%、4.55%;施药后,Vishniacozyma、Cladosporium、Filobasidium、Coprinellus分别降低了9.17、22.39、7.66、7.18个百分点,Erysiphe、Aspergillus、Mortierella分别增加了34.13、9.62、1.04个百分点,其余低丰度真菌类群合并为others,由11.90%降低至11.81%,Coprinellus、Cercospora、Sarocladium施药后消失。以上结果表明了施药影响葡萄叶际真菌类群。
2.4 混合菌剂对叶际微生物功能的影响
采用PICRUSt2模块对葡萄样品进行微生物群落功能预测,在16S扩增子及ITS测序结果中,主要评估了415条和74条MetaCyc途径,对两组样品进行比较,以P<0.05、倍数变化(FC)>3为条件进行筛选,共得到49条相关途径。其中有2条途径显著上调(图6A),分别为嘌呤核苷酸降解II(需氧,P166)、Beta-D-葡萄糖醛酸和D-葡萄糖醛酸降解超级通道(P231);47条相关途径显著下调,其中真菌参与的仅有1条下调,为5-氨基咪唑核糖核苷酸的生物合成途径I(P72,图6B)。选择FC值前15显著下调的途径进行分析(图6C),主要与葡萄的霉菌酸酯生物合成(P206)、嘧啶脱氧核糖核苷酸从头生物合成III(P212)、磷酸吡哆醛生物合成通道及修复(P233)、光呼吸(P237)、丙酮酸发酵(P247)、叶绿素a生物合成(P270)、苯乙酸降解I(好氧,P276)、嘌呤碱基降解I(厌氧,P283)、苯乙胺降解途径(P287)、ADP-L-甘油-&β-D-甘露基庚糖生物合成(P288)、噻唑生物合成I(P290)、脂质生物合成通路(P291)、维生素E生物合成(生育酚,P335)、甘油降解(P208)、2-硝基苯甲酸降解有关(P286)。

图6 微生物群落参与的MetaCyc途径变化Figure 6 Changes of metacyc pathway involved in microbial community
3 讨论与结论
目前国内外关于混合菌剂对葡萄白粉病防效的研究报道较少,多为单一菌剂对葡萄白粉病的防效研究[15]。在本研究中,混合菌剂对葡萄白粉病表现出了良好的防效,尤其在施用第3次药后防效明显,解淀粉芽孢杆菌在一定程度上可控制葡萄白粉病,腈菌唑具有较好的持效期,结合吡唑醚菌酯的杀菌广谱特性[17],能有效控制白粉病的发病程度。
植物叶际存在着大量微生物。微生物的多样性越高,对叶际微生物群落结构协调作用越强,叶际微生态系统越稳定[18]。使用混合菌剂防治葡萄白粉病的同时也会影响葡萄叶际微生物群落结构及多样性,降低有害菌的比例。在本研究中,经过混合菌剂处理后的葡萄叶际微生物多样性降低,叶际微生物的Chao1丰富度指数明显降低。但在细菌和真菌多样性上的影响不同,表现为细菌Shannon指数降低,而真菌Shannon指数增加,这可能是由于混合菌剂中含有的生防菌剂可作为一些有益菌的营养来源,导致一些微生物相对丰度增加,代表组间差异的PCoA图在OTU及属水平上也证明了两个处理间微生物多样性有明显差异。
在本研究中,与对照相比,在门水平上,药剂处理的优势细菌门为Firmicutes、Actinobacteriota,优势真菌门为Ascomycota和Basidiomycota;在属水平上,药剂处理后,相对丰度显著增加的细菌有Bacillus,真菌有Erysiphe和Aspergillus。在主要微生物菌群内,部分微生物可以通过植物及其他微生物之间的相互作用及自身丰度来影响群落结构,并在协调寄主与微生物互作中起到重要作用[19-20]。通过微生物功能预测模块分析发现,施用混合菌剂后显著降低了与葡萄磷酸吡哆醛生物合成、光呼吸、丙酮酸发酵、叶绿素a生物合成、苯乙酸降解I、维生素合成等途径相关的微生物数量,增加了与葡萄嘌呤核苷酸降解II(需氧)、Beta-D-葡萄糖醛酸和D-葡萄糖醛酸降解途径相关的微生物数量,说明药剂处理后会引起叶际微生物菌群变化,而进一步影响植物某些功能及生物合成[21-25]。
施用混合菌剂农药能有效防控葡萄白粉病的发生,但会对葡萄叶际微生物多样性及物种丰度造成一定影响,混合菌剂中的杀菌剂能直接杀死一些微生物,而混合菌剂中的微生物菌剂能增加某些微生物数量,更好地调节叶际微生物群落的平衡,建议云南相似葡萄基地采用混配方式施用农药,更有利于维护葡萄质量和微生物区系的稳定。具体农药最适浓度、频次以及显著变化的菌属是否与植物某些功能及生物合成有关还需要进一步深入研究。

