右美托咪定对颈动脉内膜剥脱术患者围麻醉期血流动力学状态、脑氧代谢指标及血清炎症因子水平的调控机制探讨
薛金磊,聂云龙,张乐,郑晨
(郑州大学附属郑州中心医院 麻醉与围术期医学科,河南 郑州 450000 )
颈动脉内膜剥离术为临床颈动脉严重狭窄患者主要治疗手段,也是预防和避免脑卒中发生的重要方法,动脉粥样硬化、长期缺血状态以及术中颈动脉短暂的开放、闭合都会引起脑功能降低,故选取合理的术中管理和麻醉方法,优化术中脑和神经功能保护和监测对于手术的顺利实施和预后改善具有重要意义[1]。有学者指出[2]:区域阻滞麻醉或局部麻醉可以在患者清醒状态下进行手术,利于对患者术中神经功能进行随时评价,患者可迅速恢复,但容易因神经损伤或不适感而不配合医师手术且易发生高血压等并发症,全身麻醉在切除术中更为适用,患者血流动力学相对较为稳定,但需对脑氧代谢和血流量相关影响因素进行控制。右美托咪定可在不影响脑电活动和呼吸的前提下,发挥止痛、镇静和抑制交感神经兴奋的作用,常作为手术麻醉的辅助用药[3],有研究指出[4]:右美托嘧啶在缺血模型大鼠实验中表现出一定的神经保护作用,将其应用于颈动脉内膜剥离术可能也会使患者受益,故本研究试将右美托嘧啶应用于颈动脉内膜剥脱术,观察对患者围麻醉期血流动力学、脑氧代谢及血清炎症因子的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2021 年10 月至2022 年10 月郑州大学附属郑州中心医院颈动脉内膜剥脱术患者104 例,以抽签法将其分为两组。常规组52 例,女22 例,男30 例;美国麻醉医师协会(ASA)分级:Ⅲ级8 例,Ⅱ级44 例;年龄53~66 岁,平均(61.94±7.67)岁。研究组52 例,女21 例,男31 例;ASA 分级:Ⅲ级11 例,Ⅱ级41 例;年龄55~68 岁,平均(62.28±7.81)岁。纳入标准:均由彩色多普勒超声检查确定颈动脉分叉70%以上狭窄;择期行颈动脉内膜剥脱术(单侧);术前心功能Ⅱ级或Ⅰ级,ASA 分级Ⅲ级或Ⅱ级;签署知情同意书,经本院伦理委员会批准。排除标准:长期服用抗抑郁镇静类药物患者;有神经外科手术既往史者;呼吸功能不全以及心瓣膜严重病变者;研究用药禁忌证者。
1.2 方法
所有患者均在进入手术室后给予面罩吸氧,外周静脉开放,并对脑电双频指数、血氧饱和度和心电图监测,行桡动脉穿刺进行有创动脉压监测,以B 超对患侧颈内静脉穿刺置管进行定位,将尖端定位在外耳道平行处,用于颅内静脉血的采集。麻醉诱导:采用罗库溴铵(国药准字H20100069,河北柏奇药业有限公司)1.0 mg/kg、芬太尼(国药准字H20123327,河南羚锐制药股份有限公司)2 μg/kg、依托咪酯(国药准字H32022379,江苏恒瑞医药股份有限公司)0.2 mg/kg、咪达唑仑(批准文号:国药准字H19990027,江苏恩华药业集团有限公司)0.1 mg/kg,气管插管,将呼吸机连接并依据患者具体体重进行参数设置等基础上,观察组在实施麻醉诱导前10 min 予以右美托嘧啶(国药准字H20110085,江苏恩华盐酸右美托咪定注射液)静脉注射,注射速度每分钟0.032 μg/kg,插管完成后到手术结束前30 min 以每分钟0.3 μg/kg 速度持续静脉给药。常规组同法输注生理盐水。
1.3 观察指标
1.3.1 脑血管动力学指标 以脑血管血液动力学分析仪对各患者舒张压与临界压差(DP)、外周阻力(R)、脉搏波波速(Wv)、平均血流量(Qmean)及平均流速(Vmean)进行检测评估其那血管动力学。
1.3.2 脑氧代谢指标 术中通过血气分析对其脑氧摄取率(COER)、桡动脉和颈内静脉球氧含量差(DajvO2)、颈内静脉球血氧含量(CjvO2)、颈内静脉球血氧饱和度(SjvO2)及颈内静脉球血氧分压(PjvO2)进行检测。
1.3.3 血清炎症因子 术后1 d,取各患者颈内静脉球血液5 mL,3 000 r/min 处理10 min,取血清对其中肿瘤坏死因子-α(TNF-α)、白细胞介素-13(IL-13)和白细胞介素-6(IL-6)以酶联免疫吸附法检测。
1.3.4 不良反应 记录各组术中心血管事件发生情况。
1.4 统计学方法
数据以SPSS 23.0 处理。计量资料以均数±标准差()表示,用t检验;计数资料以百分率(%)表示,用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者脑血管动力学指标比较
研究组患者术后早期DP、R、Wv 值低于常规组,Qmean 及Vmean 值高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者脑血管动力学指标比较(n=52,)
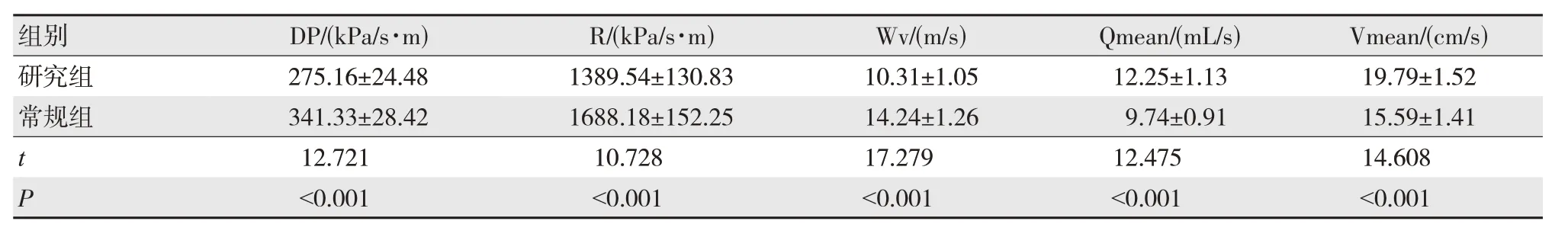
表1 两组患者脑血管动力学指标比较(n=52,)
2.2 两组患者脑氧代谢指标比较
研究组患者DajvO2低于常规组,COER、CjvO2、SjvO2高于常规组,差异有统计学意义(P<0.05),见表2。
表2 两组患者脑氧代谢指标比较(n=52,)
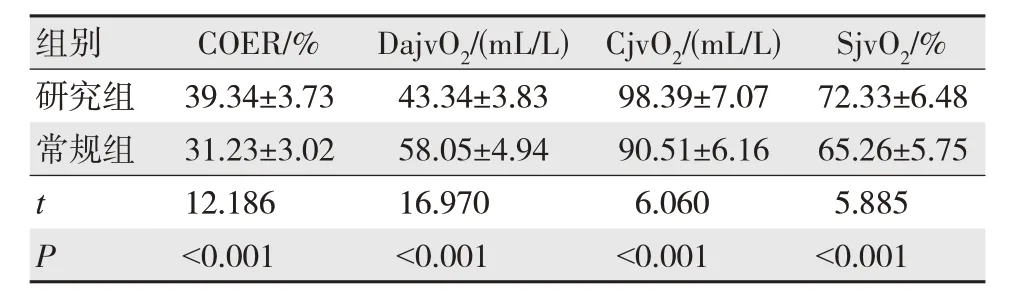
表2 两组患者脑氧代谢指标比较(n=52,)
2.3 两组患者炎症因子水平比较
研究组患者TNF-α、IL-13 和IL-6 均低于常规组,差异有统计学意义(P<0.05),见表3。
表3 两组患者炎症因子水平比较(n=52,)

表3 两组患者炎症因子水平比较(n=52,)
2.4 两组患者不良反应比较
研究组术中出现5 例高血压,5 例心动过速、5 例低血压和3 例心动过缓,常规组出现17 例高血压,16 例心动过速,12 例低血压及8 例心动过缓。研究组高血压、心动过速发生率低于常规组,差异有统计学意义(χ2=8.302、7.220,P=0.004、0.007),低血压和心动过缓两组发生情况比较差异无统计学意义(P>0.05)。
3 讨论
颈动脉内膜剥脱术行全身麻醉较颈丛神经麻醉更为舒适而更容易被接受,但全身麻醉后。患者无意识状态下需要对其脑神经和脑功能予以特殊保护,以减少中枢神经和脑神经的术后损伤,故临床常针对该术式麻醉管理和脑功能保护等环节进行严格把控,内容包含:使用保护脑功能的药物;对颈动脉进行阻断时对脑灌注量进行主动提高,并促进侧支的血液灌注;进行颈动脉开放时降低动脉压,预防出现高灌注综合征;增加手术熟练度和技巧,减少阻断和手术时间;对血流进行监测,出现灌注量减少时,及时使用颈动脉转流管等,以上环节对增加安全性减少并发症具有重要意义[5]。其中临床上对于有脑保护作用的药物争议较大,寻求更为安全、有效的脑保护辅助用药对临床有较大意义[6]。
颅底部位颈内静脉膨大最大处即为颈静脉球处,脑组织血液直接经过该处,且无其他静脉回流经过,故临床常通过对该处静脉血液进行监测来评估脑组织血流情况,其中,DajvO2可对脑代谢和脑血流情况进行综合性评估,SjvO2则是脑氧供需情况的直接反应指标[7],本研究中,研究组患者术后早期DP、R、Wv 值、DajvO2、TNF-α、IL-13和IL-6 低于常规组,Qmean、COER、CjvO2、SjvO2及Vmean 值高于对照组(P<0.05),表明颈动脉内膜剥离术采用右美托嘧啶麻醉可明显降低患者炎症反应,有效调节其脑血流动力学和脑氧代谢情况。原因可能为:右美托嘧啶为α2 受体高选择激动剂,具有镇痛、镇静和抗焦虑效果还可缓解手术过程对脑相关组织的损伤[8],其与α2 受体结合后对机体释放肾上腺素的过程进行调节,增加迷走神经张力的同时,抑制交感神经,激活胆碱能抗炎通路,从而抑制炎性因子的产生和释放,减轻炎症对脑组织和血管的损伤;还可对患者微血管痉挛状态进行局部解除,使脑灌注得以改善的同时,脑细胞通透性降低,从而避免了脑水肿和颅内压过高等并发症的发生[9]。另有研究指出[10]:右美托咪定能够对缺血再灌注部位的脑细胞钙、钾、钠通道进行阻断,减少细胞钙和钠的流入,进而减轻过氧化反应的发生,阻止钾-钠再脑细胞的交换,使脑代谢率和ATP 消耗降低,从而保护缺氧状态的脑细胞和神经细胞,还可促进抗凋亡相关蛋白合成与表达,下调神经细胞敏感性,从而减少谷氨酸等兴奋性氨基酸诱导的脑细胞和神经细胞凋亡的发生,发挥抗炎和脑保护作用。
研究组高血压、心动过速发生率低于常规组(P<0.05),低血压和心动过缓两组发生情况差异无统计学意义(P>0.05),表现出一定的安全性。原因分析:右美托嘧啶发挥镇静作用的主要部位在脑干蓝斑核,镇静机制和生理性睡眠类似,且对患者不产生呼吸抑制,在严格麻醉监测下,可保证其生命体征稳定的同时减少心动过速、高血压等并发症的发生,从而表现出一定的安全性[11]。右美托咪定镇静效果的发挥具有一定的剂量依赖性,且与其他麻醉药物同用时有一定协同作用,需要做出剂量调整,麻醉药物的用量与患者脑功能损伤亦有一定联系[12],本研究未对于使用右美托咪定辅助麻醉后对其他全身麻醉药物用量以及患者苏醒时间的影响是否有利于患者脑和神经功能的保护进行探讨,后期将对相关内容补充研究,为临床提升颈动脉内膜剥离术安全性提供参考。
综上所述,右美托咪定可选择性激动机体α2受体,通过激活机体抗炎通路,缓解缺血区域微血管痉挛状态,改善再灌注和脑代谢的同时,预防兴奋性氨基酸的神经细胞毒性损伤,利于缺血区域脑保护和炎症状态的改善,将其应用于颈动脉内膜剥脱术,可维持患者脑血流动力学和氧代谢稳定的同时,降低炎性因子水平且较安全。

