超声结合血清Tg、TSH水平对分化型甲状腺癌术前T分期和N分期的鉴别
张云鹤
(商丘市第四人民医院 超声科,河南 商丘 476000 )
甲状腺癌是影响居民身体健康的重要疾病之一,流行病学研究显示[1],甲状腺癌发病率约占全身肿瘤总人数的1%~5%。分化型甲状腺癌(DTC)为主要的病理分型,约占甲状腺癌的90%以上[2]。DTC 由于早期临床症状不明显,就诊时已处于中晚期,错过最佳治疗时间。术前正确的肿瘤分期判断对癌症患者治疗方案的选择和预后评估具有重要的指导作用,因此需及早发现和诊断DTC 并对其分期做出准确评估,以期指导临床制定合理的干预方案和实施个体化的治疗。超声对软组织的分辨率良好,不仅可显示肿瘤的形态和大小,而且能够评估异常淋巴结,是评估恶性肿瘤分期的重要手段,临床应用价值高[3],但由于超声检查更加依赖于检测者的操作技术水平及阅片者的经验,同时对于体积较小的病灶难以区分,因此单纯采用超声鉴别会存在误诊的情况[4],临床需联合其他检测方式进行鉴别。随着甲状腺分子生物学研究的不断深入,细胞因子作用也越来越凸显,血清肿瘤标志物作为一种简便的辅助鉴别手段已在临床广泛使用,其中血清甲状腺球蛋白(Tg)水平是DTC 的特异性肿瘤标志物,促甲状腺激素(TSH)是调节、控制甲状腺活动的一种糖蛋白类激素,上述血清标志物均参与甲状腺癌的发生与发展[5-6]。但目前关于超声联合血清Tg、TSH 水平是否可有效评估DTC 患者术前T 分期和N 分期尚需进一步明确。因此,本研究特将超声联合血清Tg、TSH 应用于DTC 患者术前的分期鉴别中,并对其鉴别价值进行探讨,以期为临床诊治提供参考依据。
1 资料与方法
1.1 一般资料
回顾性分析商丘市第四人民医院2020 年6 月至2022 年12 月收治的经病理学检查确诊的124例DTC 患者的临床资料,其中男37 例,女87 例;年龄22~63 岁,平均(49.85±3.54)岁;病理类型:乳头状甲状腺癌94 例,滤泡状甲状腺癌30例。本研究经医院伦理委员会审核批准。
纳入标准:①经术后病理学诊断为DTC[7],且留存癌组织;②年龄<70 岁;③患者术前均行超声检查以及血清Tg、TSH 检测;④影像学、实验室检查等临床资料完整。排除标准:①重大脏器功能不全;②其它恶性肿瘤;③血液系统疾病;④合并甲状腺弥散性病变、甲状腺功能亢进;⑤合并全身感染性疾病、免疫性疾病;⑥检查前近3个月服用过免疫类或激素类药物;⑦术前进行过放化疗等干预。
1.2 方法
1.2.1 超声检查方法 受试者均取仰卧位,充分暴露检查部位,采用西门子S2000 超声诊断仪进行检测,观察甲状腺两侧颈部淋巴结、左叶、右叶及甲状腺峡部。观察范围:前界为胸骨舌骨肌侧缘,后界为斜方肌,上至颅底水平,下至锁骨上,宽频线阵探头为7.5 MHz,详细记录影像学数据,包括数目、大小、形态、部位、边缘回声强度、内部回声强度、淋巴门变化等。同时多切面扫描颈部淋巴结,观察淋巴结内部血流情况,重点扫描提示转移性的淋巴结,确定其大小、形态及回声情况。由两位具有图像分析经验的医师进行分析,若意见不统一时,请主任医师复核后确定。参考国际抗癌联盟关于甲状腺癌的TNM 分期标准[8]:①T 分期定义:未发现甲状腺结节为T0;肿瘤最大直径≤2 cm,且局限于甲状腺内为T1(肿瘤最大直径≤1 cm,且局限于甲状腺内为T1a,而1 cm<肿瘤最大径≤2 cm,且局限于甲状腺内为T1b);原发肿瘤直径为>2 cm 且≤4 cm,局限于甲状腺内为T2;肿瘤最大径>4 cm,且局限于甲状腺内为T3a;肿瘤无论大小均与甲状腺包膜分界不清,包膜中断,且明显侵犯带状肌的腺外为T3b;肿瘤在甲状腺薄膜外可见,且侵犯喉、食管、气管,皮下软组织或喉返神经为T4a;肿瘤侵犯包裹颈动脉、椎前筋膜或纵膈血管为T4b。②N 分期的定义:无区域淋巴结转移为N0期;区域淋巴结转移为N1期,N1期包括N1a[肿瘤转移至Ⅵ区(气管旁、气管前或喉前淋巴结)]和N1b(肿瘤转移至单侧、双侧颈部或纵隔Ⅶ区)。
1.2.2 血清Tg、TSH 水平检测 采集患者空腹静脉血5 mL,3 750 r/min 离心10 min,分离血清,-80 ℃保存。采用全自动化学分析仪检测血清TSH水平,应用罗氏电化学发光仪检测血清Tg 水平。
1.2.3 术后病理学分期 术后标本行常规石蜡切片HE 染色,光学显微镜下观察,并与手术中所见相结合,参照国际抗癌联盟关于甲状腺癌的TNM分期标准进行病理T、N 分期鉴别。
1.3 观察指标
①患者术后病理学T、N 分期结果。②超声与病理学检查T、N 分期结果比较,并评估超声检查的准确性。③比较不同T 分期和N 分期患者血清Tg、TSH 水平。④分析超声及血清Tg、TSH 三者单独与联合鉴别DTC 患者术前T 分期和N 分期的价值,统计灵敏度、特异度、曲线下面积(AUC)和95%可信区间(95%CI)。
1.4 统计学方法
采用SPSS 26.0 统计学软件行数据分析。计量资料以均数±标准差()描述,两样本比较采用t检验,多样本比较采用单因素方差分析和SNK-q检验;计数资料以百分率(%)描述;采用受试者工作特征(ROC)曲线分析超声与血清Tg、TSH 单独及联合对DTC 术前T 分期和N 分期的鉴别价值。P<0.05 为差异有统计学意义。
2 结果
2.1 病理学检查结果
124 例DTC 患者术后病理学结果显示,T 分期:T1期47 例,T2期35 例,T3期25 例,T4期17例(T4a其12 例,T4b期5 例);N 分期:N0期67例,N1期57 例(N1a期34 例,N1b期23 例)。
2.2 超声检查与病理结果比较
124 例DTC 患者经超声检查鉴别T、N 分期的准确率:T1为85.11%,T2为77.14%,T3为60.00%,T4为 58.82%;N0为 86.57%,N1为68.42%。见表1。
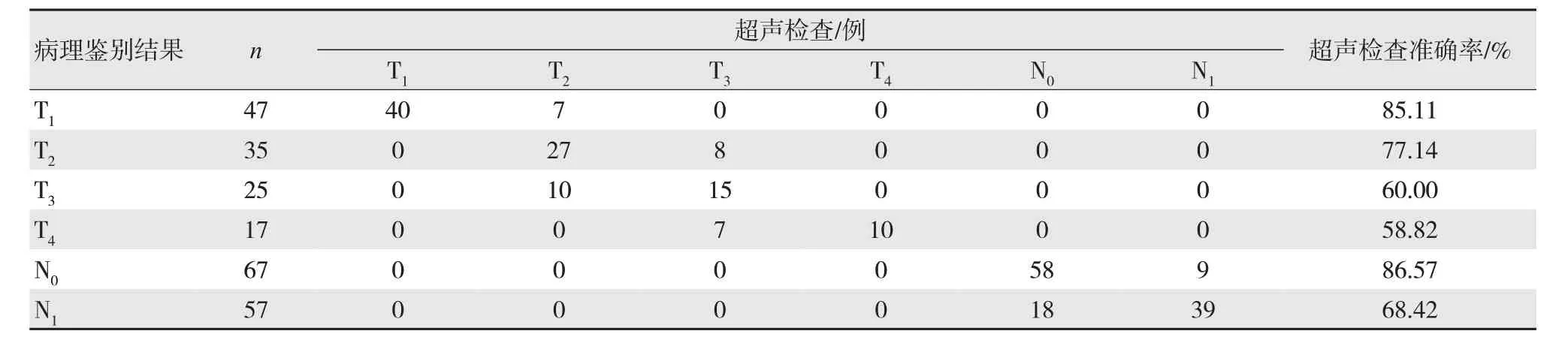
表1 超声检查与病理结果比较
2.3 不同T 分期血清Tg、TSH 水平比较
不同T 分期患者Tg、TSH 水平差异有统计学意义(P<0.05),T2、T3、T4期患者的血清Tg、TSH 水平均高于T1期,T3、T4期均高于T2期,T4期高于T3期,差异均有统计学意义(P<0.05),见表2。
表2 不同T 分期血清Tg、TSH 水平比较()
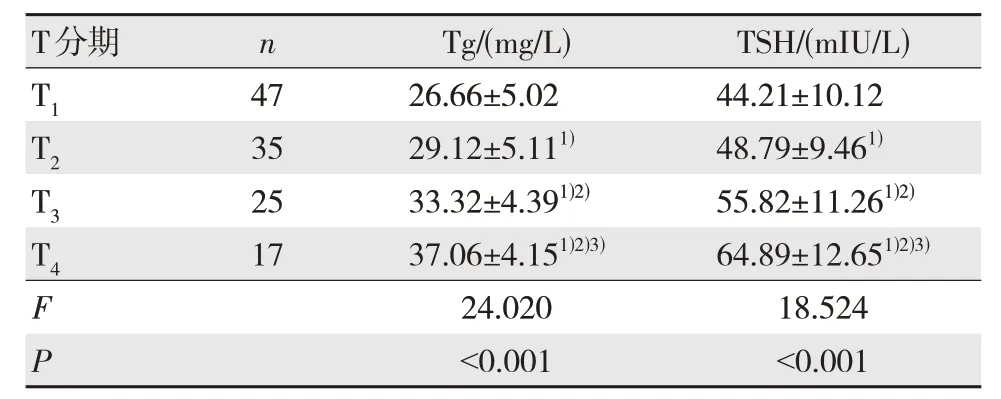
表2 不同T 分期血清Tg、TSH 水平比较()
注:1)与T1期比较,P<0.05;2)与T2期比较,P<0.05;3)与T3期比较,P<0.05。
2.4 不同N 分期血清Tg、TSH 水平比较
N1期患者血清Tg、TSH 水平高于N0期(P<0.05),见表3。
表3 不同N 分期血清Tg、TSH 水平比较()
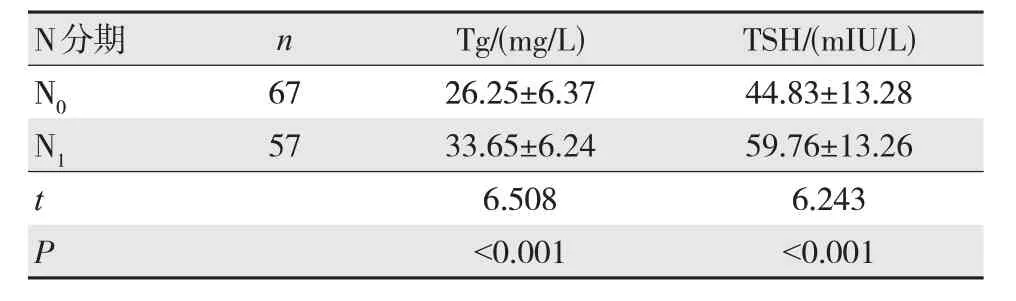
表3 不同N 分期血清Tg、TSH 水平比较()
2.5 超声联合血清Tg、TSH 水平对DTC 患者术前T 分期和N 分期的鉴别价值
超声、血清Tg、TSH 水平联合鉴别DTC 患者术前T1~2与T3~4分期的特异度高于单独鉴别(χ2=8.473,P=0.004;χ2=6.098,P=0.014;χ2=7.265,P=0.007),联合鉴别的AUC 均高于单独鉴别(Z=2.076,P=0.038;Z=2.384,P=0.017;Z=2.554,P=0.010),联合鉴别的灵敏度与单独鉴别差异无统计学意义(P>0.05),见表4、图1。
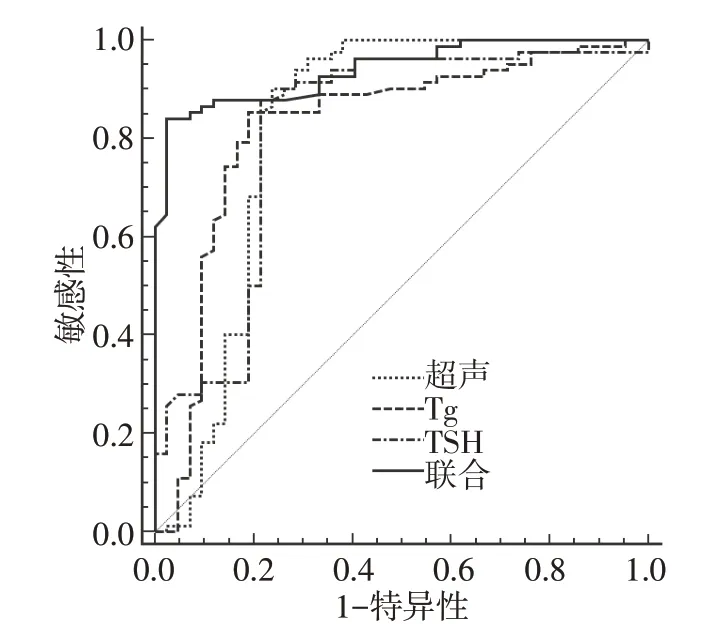
图1 超声联合血清Tg、TSH 水平鉴别DTC 患者术前T1~2与T3~4分期的ROC 曲线
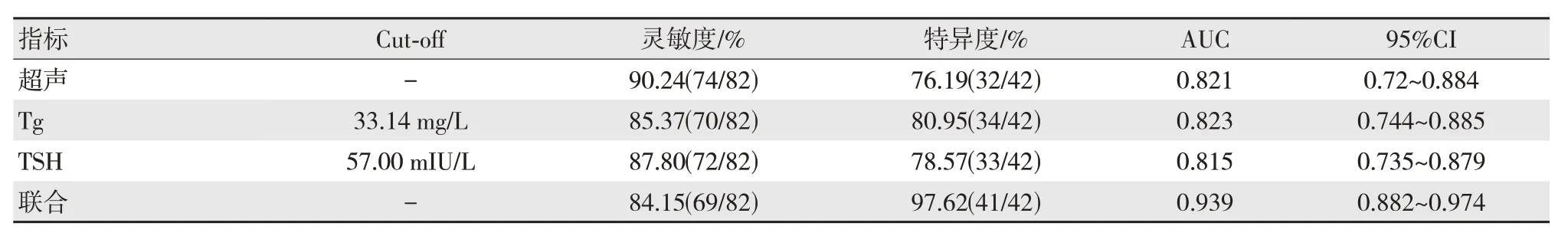
表4 超声联合血清Tg、TSH 水平对DTC 患者术前T1~2与T3~4分期的鉴别价值
超声、血清Tg、TSH 水平联合鉴别DTC患者术前N0与N1分期的特异度高于单独鉴别(χ2=15.523,P<0.001;χ2=10.469,P=0.001;χ2=12.931,P<0.001),联合鉴别的AUC 均高于单独鉴别(Z=3.358,P<0.001;Z=3.299,P=0.001;Z=3.658,P<0.001),联合鉴别的灵敏度与单独鉴别差异无统计学意义(P>0.05),见表5、图2。
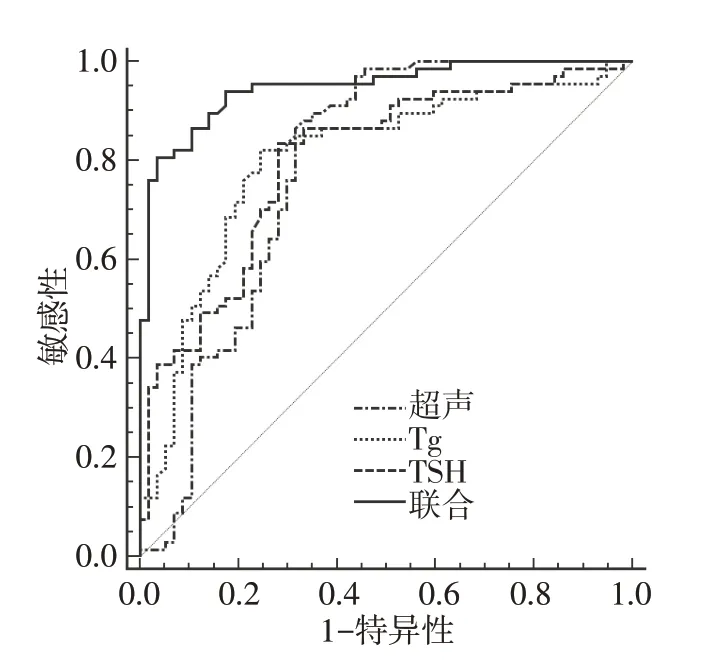
图2 超声联合血清Tg、TSH 水平鉴别DTC 患者术前N0与N1分期的ROC 曲线

表5 超声联合血清Tg、TSH 水平对DTC 患者术前N0与N1分期的鉴别价值
3 讨论
DTC 包括滤泡状甲状腺癌和乳头状甲状腺癌,后者约占全部甲状腺癌的75%[9]。临床上治疗DTC 以手术为主,但具体的手术方案仍需以临床分期为前提进行制定,故正确的术前分期评估对患者治疗方案的制定具有重要意义。目前临床对于DTC 术前分期的鉴别主要采用活检的手段,但其具有一定的创伤性[10]。因此临床需寻求有效且安全的鉴别手段,以期为临床治疗方式的制定提供参考依据。
本研究结果显示,超声检查鉴别T、N 分期的准确率:T1为85.11%,T2为77.14%,T3为60.00%,T4为 58.82%;N0为 86.57%,N1为68.42%,表明超声可对DTC 患者术前T、N 分期进行鉴别。超声具有较高的分辨率,可有效鉴别病灶的实质性或囊性,同时显示其大小、边界、位置以及是否存在钙化现象,从而进行T 分期的判断。但T1和T2期仅依靠肿瘤病灶大小进行鉴别,当病灶大小在2 cm 左右时,常由于测量误差造成T1和T2误诊,因此T1和T2期的准确性较低。T3期肿瘤组织体积较大,超声可通过冠矢状位、轴位等不同方位测量使结果更为准确,提高准确性。但当侵犯甲状腺周围肌肉组织的肿瘤体积不明显时不易被鉴别,所以导致结果存在一定偏差[11]。T4期存在误诊的原因可能在于超声进行探查时受肿瘤周围组织炎性反应干扰以及食管内潴留物等影响从而降低准确性。N0和N1期鉴别出现偏差的原因为中央区淋巴结位于舌骨和胸骨上窝之间、双侧颈动脉内侧,且易受中央区淋巴脂肪、食管、结缔组织等因素影响,难以进行全面扫描。此外,中央区转移性淋巴结体积较小,出现典型转移性淋巴结特征比例较小[12],以上均是造成超声对中央区转移性淋巴结的准确度低的原因。本研究结果显示,超声鉴别DTC 患者术前T1~2与T3~4分期、N0与N1分期的灵敏度和特异度分别为90.24% 和76.19%、86.57%和68.42%,表明超声可有效鉴别DTC 患者术前T、N 分期。超声可通过多平面成像技术对DTC 病变浸润深度以及淋巴结转移情况提供丰富的图像信息,从而发挥临床鉴别价值。但超声鉴别可受气体、骨骼等因素干扰,同时对锁骨上、气管旁等特殊部位的淋巴结易漏诊,因此需结合其他临床资料对DTC 分期进行鉴别。
本研究结果还显示,血清Tg、TSH 水平在DTC 患者T1、T2、T3、T4分期和N0、N1分期中均随着分期的增加而依次升高,且ROC 结果显示,血清Tg、TSH 水平鉴别DTC 患者术前T1~2与T3~4分期的灵敏度和特异度分别为85.37% 和80.95%、87.80%和78.57%,两者鉴别N0与N1分期的灵敏度和特异度分别为82.09% 和75.44%、83.58% 和71.93%,表明血清Tg、TSH 水平可在一定程度上反映DTC 患者分期状况。DTC 的浸润和组织生长皆会破坏甲状腺健康组织生理解剖结构,造成甲状腺细胞坏死,诱导炎性反应发生,从而促进甲状腺上皮细胞合成,释放大量Tg[13]。既往研究报道[14],Tg 与淋巴结是否转移密切相关,且N1期患者Tg 水平高于N0期患者,本研究与该文献共同表明Tg 可区分DTC 患者术前N 分期。TSH 是DTC细胞的刺激生长因子,可影响甲状腺滤泡细胞和上皮细胞的分化和增殖,并与TSH 受体结合刺激血管内皮生长因子、甲状腺细胞分泌生长因子和胰岛素样生长因子,促进癌组织细胞的生长发育,同时抑制癌细胞凋亡,参与DTC 的发生与发展过程[15]。既往研究表明[16],TSH 与甲状腺癌患者的病理分期呈正相关。因此血清Tg、TSH 水平均可作为临床辅助鉴别DTC 术前T 分期和N 分期的血清学标志物。
本研究进一步将超声与血清Tg、TSH 水平联合鉴别DTC 患者T、N 分期,ROC 结果发现三者联合鉴别T1~2与T3~4分期、N0与N1分期的特异度和AUC 均高于单独鉴别,且灵敏度并未明显降低,表明三者联合对鉴别DTC 患者术前分期的效能更佳,可获得更高的应用价值。彩色多勒普超声可清晰显示DTC 的细微病变征象,便于观察甲状腺血运状态、邻近组织,同时可清晰显示结节内部的砂粒样钙化斑,具有无创伤、简单、快捷、图像清晰以及多方位、多角度成像的优势。但是超声受甲状腺遮挡,难以显示全面肿瘤图像,且对微小转移淋巴结以及炎性淋巴结难以鉴别,造成鉴别存在误差或漏诊情况[17]。血清Tg、TSH 水平检测可有效反映DTC 患者疾病进展情况,通过检测此两项指标水平可从生物学角度对DTC 分期进行判断,但其水平可能会受患者自身其他疾病的影响,降低鉴别的准确性。而将超声与血清学标志物联合应用则可从影像学和生物学双重角度对DTC 患者术前分期进行有效鉴别,从而有助于提高鉴别的准确性。
综上所述,超声与血清Tg、TSH 均可有效鉴别DTC 患者术前T 分期和N 分期,但三者联合鉴别价值更佳,临床应用价值良好。

