miR17-92簇在痛风中的表达及临床意义
冯丹 姜蓉琼 杨桂钊 张惠 王丹 刘静 余成秀 袁国华
(1.川北医学院附属医院风湿免疫研究所,南充 637000; 2.川北医学院附属医院呼吸内科,南充 637000)
痛风是尿酸盐晶体沉积于皮下、关节、滑膜或肾脏等组织及器官引起的一组异质性代谢性慢性疾病[1]。与嘌呤代谢障碍和/或尿酸排泄减少引起的高尿酸血症直接相关,血清尿酸与痛风存在显著浓度依赖性[2]。临床上痛风有4个发展阶段:无症状高尿酸血症、急性痛风性关节炎(acute gouty arthritis,AG)、间歇期痛风(intermittent gout,IG)和慢性痛风石性痛风,这4个发展阶段并非依序而来。急性期患者常伴有高尿酸血症,且并非所有患者出现高尿酸血症就会进展为痛风性关节炎(gouty arthritis,GA),高尿酸血症向痛风进展的机制仍不完全清楚[1]。IG患者长期未控制的高尿酸血症可能造成不良预后,伴随多种并发症,包括心血管疾病、慢性肾病、肥胖等,甚至出现关节尿酸盐沉积导致残疾丧失生活能力,对个人及社会均造成极大负担[3]。因此本研究着眼于阐明IG患者合并高尿酸血症的原因及机制。
miRNA是由约22个核苷酸组成的短链非编码RNA分子,通过靶向mRNA的3'UTR位点介导基因沉默,抑制蛋白翻译或促进mRNA降解[4]。根据某些miRNA种子序列相似性,可将相似的成簇排列的miRNAs分为miRNA簇(miRNA cluster)[4]。其中miR17-92簇宿主基因(MIR17HG)跨越7 kb,包含800个核苷酸的miR-17-92簇转录物可编码6种miRNAs:miR17、miR18a、miR19a、miR20a、miR19b-1和miR92a-1,即miR17-92簇[5]。miRNA簇失调导致生物学功能改变是许多疾病的关键发病机制,可潜在调节细胞功能,包括生长、增殖、分化、发育、代谢、感染、免疫、细胞死亡、细胞器生物发生、信号转导、DNA修复和自我更新等[6-7]。近期多项研究提示miR-17-92簇各成员可能与痛风发病相关[7]。同时结合临床工作,Janus酶(JAK)/信号转导和转录激活因子(STAT)信号通路引起广泛关注,JAK-STAT通路是主要的细胞内信号转导通路之一,是各种细胞因子、激素和生长因子的重要下游介质[8]。研究发现IFN-γ是JAK-STAT通路免疫应答和信号的重要调节因子[9];IL-10主要由单核细胞、巨噬细胞、T和B淋巴细胞分泌,是一种调节细胞生长和分化的多功能细胞因子,参与炎症和免疫应答,被认为是炎症和免疫的抑制因子,参与急性痛风自发缓解[10-11]。本研究拟探索miR17-92簇及JAK-STAT通路成员在GA患者中的表达,测定IFN-γ及IL-10表达,寻找miR17-92簇可能的信号通路及作用机制,更好了解GA的发病机制,为寻找新的治疗靶点提供方向。
1 资料与方法
1.1 资料
1.1.1 研究对象 根据1977年美国风湿病协会(ACR)诊断标准或2015年美国风湿病学会/欧洲抗风湿病联盟痛风分类标准确定本实验研究对象[12]。收集2020年底至2021年底于川北医学院附属医院风湿免疫科确诊的痛风患者67例。其中AG患者22例,年龄16~72岁,平均年龄(45.6±14.6)岁,IG患者45例,年龄15~81岁,平均年龄(40.0±14.4)岁。研究对象均为男性,排除尿酸盐肾病、尿酸盐性尿路结石及肝肾功能损害患者,同时排除患有感染、乙肝、结核、肿瘤及药物等继发因素所致尿酸升高及合并其他疾病者。收集患者临床及实验室资料。对照组选择性别、年龄相符及血尿酸正常(UA<360 μmol/L)的健康男性体检者(HC)35例,年龄27~77岁,平均年龄(42.3±11.5)岁,均排除有痛风家族史、感染、肿瘤及可疑导致尿酸升高用药史等疾病史者。两组研究对象年龄差异无统计学意义(P>0.05)。本研究经川北医学院附属医院伦理委员会批准,受试者知情同意。
1.1.2 主要试剂及仪器 miR17-92簇检测采用茎环法,设计茎环引物,内参使用U6,miRNA引物由上海元莘生物工程有限公司设计合成,其余引物由上海生工生物工程有限公司合成。全血总RNA提取试剂盒(北京天根生化科技有限公司);HiScript 1st Strand cDNA Synthesis Kit、AceQ qPCR SYBR Green Master Mix(上海元莘生物工程有限公司);荧光定量PCR系统(美国Life Technologies公司);HiScript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)、Taq Pro Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司)。引物序列见附表1、附表2(www.immune99.com)。

表1 痛风相关基因及相互作用的miR17-92簇Tab.1 Gout-related genes and interacting with miR17-92 cluster

表2 miR17-92簇与JAK-STAT通路的靶向作用关系Tab.2 Relationship between miR17-92 cluster and JAKSTAT pathway
1.2 方法
1.2.1 生物信息学研究 通过miRWalk等数据库预测miR17-92簇可能的靶基因。搜索目前已研究的痛风相关致病基因及miRNA,搜索可能作用于JAK-STAT通路的miRNA,使用GSEA基因富集功能研究其交集并绘制相关图谱。
1.2.2 miRNA茎环法逆转录及RT-PCR 使用Trizol提取RNA,根据试剂盒说明将体系中的Oligo(dT)18和Random hexamers更换为miRNA特异性茎环引物和反向引物进行逆转录。产物cDNA根据试剂盒进行PCR反应,以U6为内参进行计算,基因表达倍数差异以RQ=2-ΔΔCt表示。
1.2.3 普通逆转录及RT-PCR 使用Trizol提取RNA,根据说明进行逆转录。所得产物cDNA根据试剂盒及反应条件进行PCR反应,基因表达倍数差异以RQ=2-ΔΔCt表示。
1.2.4 各项实验室指标收集 检测下列指标:碱性磷酸酶(ALP)、腺苷脱氨酶(ADA)、直接胆红素(DBIL)、间接胆红素(IBIL)、甘油三酯(TG)、总胆固醇(TC)、尿酸(UA)、肌酐(Crea)、葡萄糖(Glu)、血沉(ESR)、超敏C反应蛋白(hsCRP)、白细胞(WBC)、中性粒细胞(NE)、单核细胞(MO)、血红蛋白(HGB)、血小板(PLT)。
1.3 统计学处理 数据采用IBS SPSS26数据包及GraphPad prism 8软件处理,计量资料且符合正态分布的以表示,不符合正态分布的以M(Q1,Q3)表示。多组间两两比较采用Kruskal-WallisH检验,变量间相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析 通过以关键词GOUT搜索数据库miRwalk中已明确的靶基因及其相关作用的miRNAs,通过GSEA基因富集共得到8个靶基因HP、A1CF、SLC17A3、ADRB3、IL33、ABCG2、PRPS1、LPA作用于GA,1 553个miRNAs作用于痛风,包括miR17-92簇中的miR17-5p、miR18a-5p、miR20a-5p(表1)。进一步挖掘miR17、miR18a、miR19a相关靶基因,其中miR17通过基因富集作用得到2 326个靶基因;miR18a通过基因富集作用得到2 252个靶基因;miR19a通过基因富集作用得到268个靶基因。miR17-92簇所有成员与JAK-STAT通路中的相互靶向作用见表2,miRNA调控靶基因机制复杂,即使调控同一基因可能靶向不同疾病及不同效应,具体机制需进一步研究。将miR17、miR18a、miR19a及GA可能靶基因的相关靶基因绘制韦恩图(图1)。GA与JAK-STAT通路相关miRNA见图1,其交集中共同作用的miRNAs中包含miR17-92簇中的miR17、miR18a和miR20a,初步估计miR17-92簇可通过JAK-STAT通路参与痛风发病机制。搜索过程中发现其他信号通路也较大程度参与痛风病理过程,但痛风急性发作及缓解机制仍不明确,进一步研究痛风致病机制尤为重要。
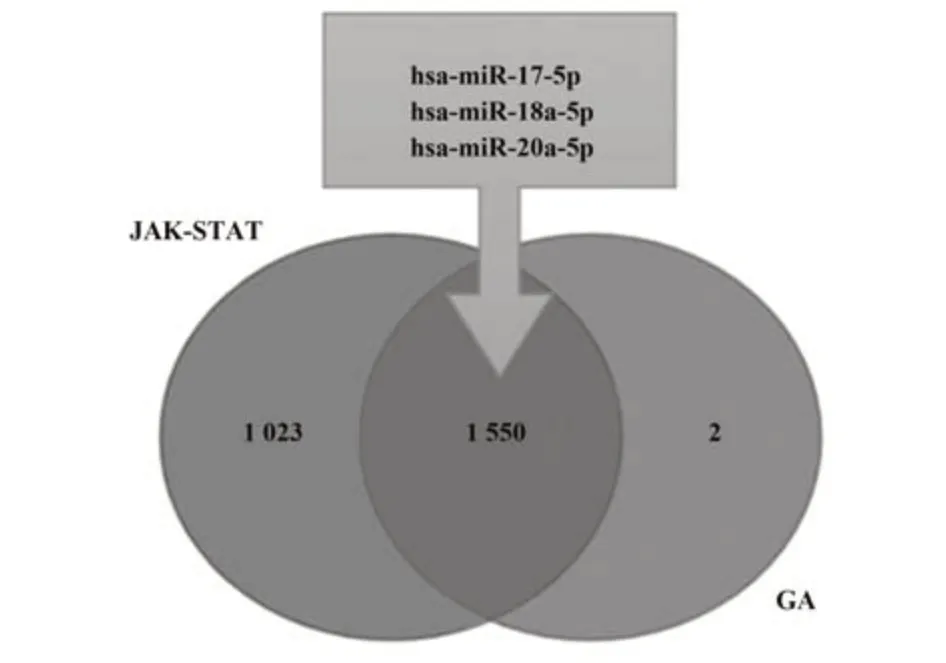
图1 靶向作用于GA与JAK-STAT通路的miRNAsFig.1 miRNAs associated with GA and JAK-STAT pathway
2.2 miR17-92簇中各成员表达分析 miR17、miR18a、miR19a、miR20a、miR19b在AG、IG、HC中表达差异均有统计学意义(H=8.753,P<0.05;H=6.338,P<0.05;H=6.523,P<0.05;H=9.061,P<0.05;H=9.729,P<0.01),miR92a在3组间表达差异无统计学意义。其中AG、IG组miR17a表达4.350 5(0.673 6,7.148 7)、2.482 3(0.743 6,5.104 1)明显高于HC对照组0.920 2(0.478 8,2.505 1),差异均有统计学意义(P<0.05,图2A)。IG组miR18a表达2.127 4(1.325 0,5.055 0)高于HC对照组1.304 7(0.580 7,2.860 7),差异有统计学意义(P<0.05,图2B)。AG组miR19a表达4.039 7(0.671 7,7.955 0)高于HC对照组0.941 6(0.489 0,1.998 1),差异均有统计学意义(P<0.05,图2C)。AG组miR20a表达7.048 8(0.862 3,17.294 4)明显高于HC组1.010 5(0.248 6,3.973 6),差异有统计学意义(P<0.01,图2D)。AG组miR19b表达4.371 4(0.449 0,9.752 1)明显高于HC组0.988 0(0.426 1,2.271 3),差异有统计学意义(P<0.01,图2E)。
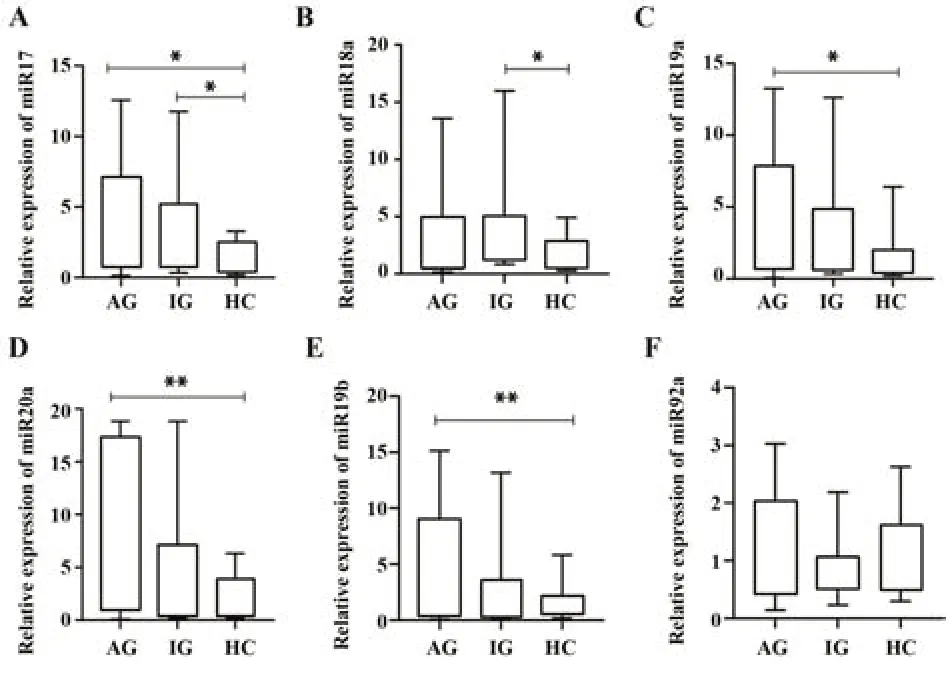
图2 AG、IG及HC组miR17-92簇各成员相对表达Fig.2 Relative expressions of miR17-92 cluster in AG,IG and HC groups
2.3 JAK-STAT信号通路中各成员mRNA表达JAK3、STAT2在AG、IG、HC三组中表达差异有统计学意义(H=10.349,P<0.01;H=14.801,P<0.01,图3)。其中IG、HC组JAK3表达1.119 1(0.753 9,1.602 7)、1.024 5(0.529 5,1.948 4)高于AG组0.526 0(0.326 7,1.206 3),差异有统计学意义(P<0.01,P<0.05)。AG、HC组STAT2表达1.377 5(0.674 2,2.486 9)、1.233 6(0.755 8,1.511 6)明显高于IG组0.701 5(0.296 8,1.238 1),差异有统计学意义(P<0.01,P<0.05)。各组间JAK1、JAK2、STAT1、STAT3未见明显差异。
2.4 IFN-γ及IL-10相对表达 IFN-γ三组间表达差异有统计学意义(H=8.734,P<0.05)。其中HC组IFN-γ mRNA表达0.754 1(0.677 1,1.752 7)高于AG、IG患者相对表达0.483 6(0.169 6,0.794 1)、0.472 7(0.249 2,0.938 2),差异有统计学意义(P均<0.05,图4A)。而3组间IL-10 mRNA表达差异无统计学意义(P>0.05,图4B)。
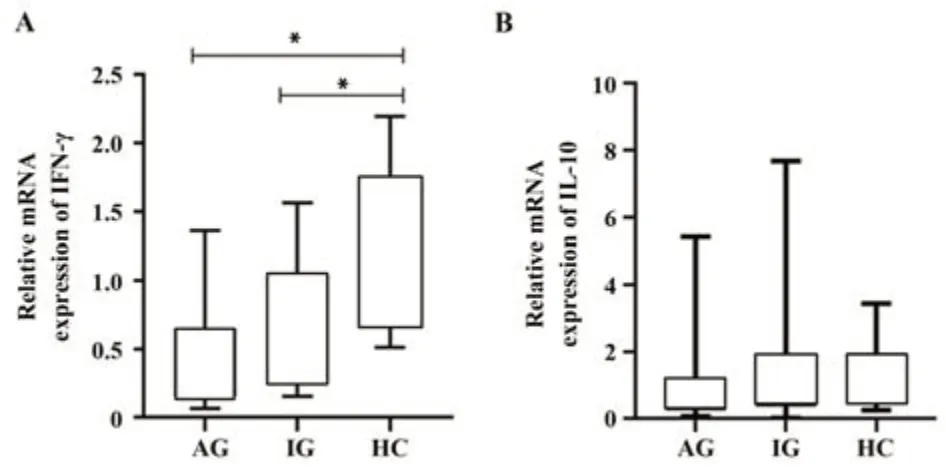
图4 AG、IG及HC组IFN-γ及IL-10相对表达Fig.4 Relative expressions of IFN-γ and IL-10 in AG, IG and HC groups
2.5 AG、IG组miR17-92表达与临床资料相关性分析
2.5.1 AG组miR17-92表达与临床资料相关性分析 AG患者miR18a表达与IBIL、Crea、MO、HGB呈负相关(rs=-0.79,P<0.01;rs=-0.55,P<0.05;rs=-0.63,P<0.05;rs=-0.68,P<0.01)。miR19a表达与TC、UA、HGB呈负相关(rs=-0.90,rs=-0.45,rs=-0.45,P均<0.05)。miR20a表达与Crea呈负相关(rs=-0.45,P<0.05)。miR19b表达与UA、HGB呈负相关(rs=-0.51,rs=-0.45,P均<0.05,表3)。
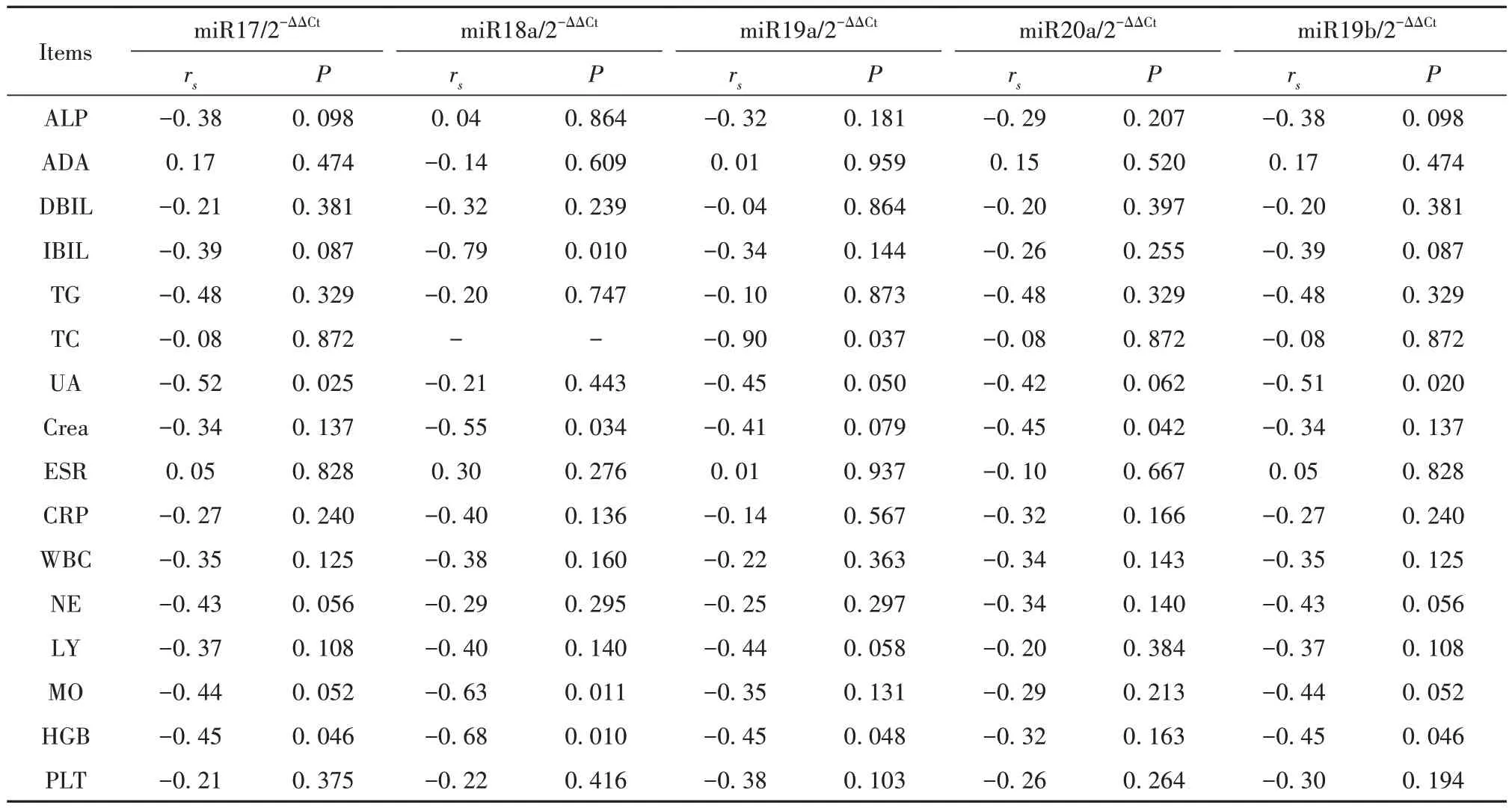
表3 AG患者miR17-92簇表达与临床资料相关性分析Tab.3 Correlation analysis between miR17-92 cluster expressions and clinical data in AG patients
2.5.2 IG组miR17-92表达与临床资料相关性分析 IG患者miR17表达与IBIL、WBC、LY、MO均呈负相关(rs=-0.55,rs=-0.49,P均<0.05;rs=-0.61,rs=-0.70,P均<0.01),miR18a表达与ALP呈正相关(rs=0.52,P<0.05)。miR19a表达与TC、UA呈负相关(rs=-0.55,rs=-0.40,P均<0.05)。miR20a表达与ADA、UA呈负相关(rs=-0.41,P<0.05;rs=-0.64,P<0.01,表4)。
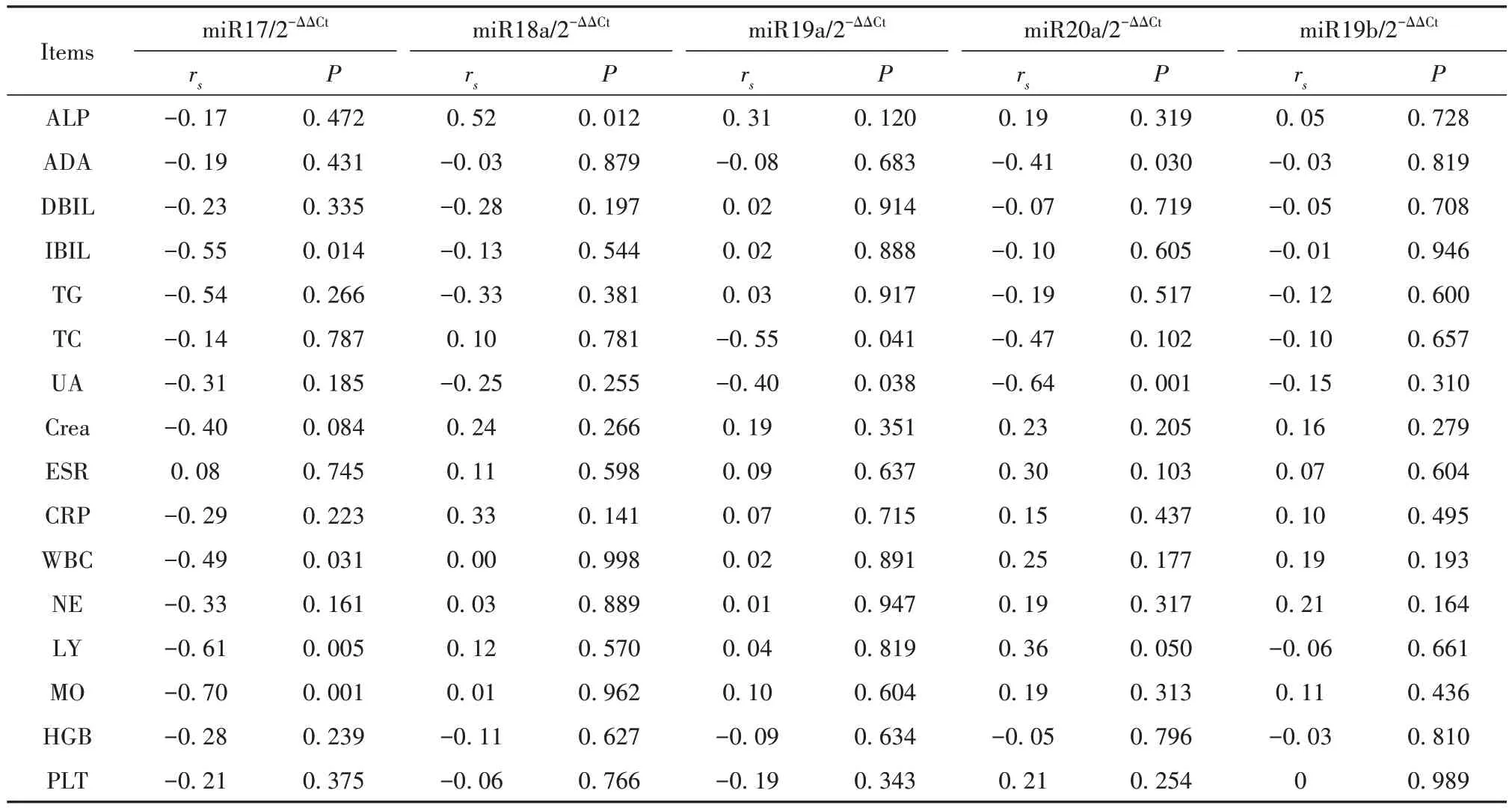
表4 IG患者miR17-92簇表达与临床资料相关性分析Tab.4 Correlation analysis between miR17-92 cluster expressions and clinical data in IG patients
3 讨论
现阶段痛风发作及缓解机制尚不明确,主要观点为单钠尿酸盐(monosodium urate,MSU)晶体与巨噬细胞相互作用触发炎症,诱导中性粒细胞和单核细胞浸润,扩大炎症反应。同时随着TGF-β1等多种机制参与,巨噬细胞吞噬作用等可诱导炎症自发缓解[13-14]。近年多项研究提示miRNAs积极参与痛风致病过程调控。
本研究通过明确miR17-92簇在GA患者中的表达,发现AG患者miR17、miR19a、miR20a、miR19b表达均较健康对照组升高,而IG患者仅有miR17、miR18a升高。提示miR17-92簇对痛风急性发作及自发缓解后间歇期均发挥调控作用,而miR18a等在AG与IG中差异表达,提示其时效特异性可能参与急性痛风自我缓解机制。BOHATÁ等[15]在间歇期痛风患者中测得miR17、miR18a表达升高,且发现AG中miR17水平仍显著升高,而miR18a表达差异无统计学意义。
miRNA通过抑制mRNA降解或蛋白表达介导靶基因沉默。本研究也通过生物信息学分析发现miR17-92簇成员不同程度通过JAK-STAT通路参与多种病理生理调节,因此进一步预测并检测miR17-92簇可能的作用靶基因JAK-STAT家族。其中JAK3相对表达在AG患者中较IG、HC明显降低,提示JAK3作用于急性痛风发作。STAT2在IG中降低,AG患者STAT2表达高于IG,但与HC无明显差异,提示JAK-STAT参与痛风发生发展过程。结合前述生物学信息学分析miR17、miR18a、miR20a、miR19b可共同靶向JAK3,miR17、miR18a、miR20a可共同靶向STAT2,推测miR17-92簇可能通过靶向调控JAK-STAT信号通路参与痛风病理过程。AG、IG患者IFN-γ相对表达均下调,而IFN-γ是JAKSTAT通路免疫应答和信号的重要调节因子,STAT1及STAT2可被IFN-γ直接激活诱导表达[9,16-17]。提示miR17-92簇可能通过下调IFN-γ表达负向调控JAK-STAT通路。
多项研究表明miR17-92簇成员如miR17、miR18a、miR20a、miR19a和miR92a等通过调控JAK1/STAT3、JAK2/STAT3轴等参与多种风湿免疫性疾病致病过程[18-20]。另一项研究提示miR19a和miR19b可靶向TLR2 mRNA,并降低类风湿关节炎中成纤维细胞样滑膜细胞TLR2蛋白表达[21]。而TLRs是先天免疫系统中重要的模式识别受体,广泛参与病原体相关分子模式识别和感知,MSU可通过识别TLR2释放一氧化氮,导致后续系列炎症[22]。本研究中miR19a/miR19b在AG患者中相对表达均有所升高,提示miR19a/miR19b可能参与阻碍MSU对TLR2的识别而抗炎,从而在AG患者中发挥作用,其作用机制仍需进一步明确。
临床资料相关性分析中,AG患者miR18a表达与IBIL、Crea、MO、HGB呈负相关;miR19a表达与TC、UA、HGB呈负相关;miR20a表达与Crea呈负相关;miR19b表达与UA、HGB呈负相关。IG患者miR17表达与IBIL、WBC、LY、MO均呈负相关,miR18a表达与ALP呈正相关。miR19a表达与TC、UA呈负相关。miR20a表达与ADA、UA呈负相关。提示miR17-92簇可能参与调控痛风多项生理病理机制。
综上,痛风是一种常见的晶体性关节炎,但其发病机制尚不明确。为进一步明确其致病机制,本研究检测miR17-92簇在痛风患者中的表达,其差异表达提示可能参与痛风发病机制。其次通过预测miR17-92簇可能的靶基因JAK-STAT家族验证得出其可能参与痛风发病。本课题组后续将扩大样本量以及进行体内外研究明确miR17-92簇在痛风中的调控机制,为阐明痛风发病机制提供新视角。

