骨髓微环境中CXC趋化因子配体8介导急性髓系白血病发生、发展的调控机制与临床意义
刘彦权 殷悦 唐焕文 (.广东医科大学附属东莞第一医院血液科,东莞 53808;.福建医科大学附属协和医院血液科,福州 35000)
急性髓系白血病(acute myelogenous leukemia,AML)是成人常见的一类以克隆性造血干祖细胞分化阻滞恶性增殖为特征的血液肿瘤,尽管化学治疗、造血干细胞移植、免疫治疗或靶向治疗能给AML患者生存带来希望,但仅有少数患者从中获得疾病的缓解,AML仍是一种严重威胁人类生命健康的恶性疾病[1]。骨髓微环境由细胞因子、骨髓基质细胞(bone marrow stromal cells,BMSC)以及细胞外基质(extracellular matrix,ECM)等共同组成,白血病细胞与骨髓微环境中各种介质相互作用,继而通过一系列信号通路或调控轴发挥相应的生物学效应,在白血病细胞恶性增殖、免疫逃逸、化疗耐药等方面扮演了不可或缺的角色,从骨髓微环境角度阐明AML致病分子机制显得尤为重要[2-4]。作为骨髓微环境中的一种多元效应性趋化因子——CXCL8及其所形成的趋化因子调控网络与白血病的发生、发展、临床表现、疗效以及预后转归等可能存在着密切的关联[5-6]。本研究旨在探讨和分析不同病情阶段的AML患者体内CXCL8的动态变化水平,研究其与AML患者临床病情发展的关系,同时分离临床初诊AML患者的BM-MSC,并以人AML细胞株U937为模型与AML患者BM-MSC共培养,浅析骨髓微环境中CXCL8对白血病发病与病情进展的作用,对AML基础研究和临床诊疗开拓具有重要的现实意义。
1 资料与方法
1.1 资料
1.1.1 一般资料 收集福建医科大学附属协和医院68例不同病情阶段的AML患者骨髓血标本[初治29例、完全缓解(complete remission,CR)23例、复发16例)]及20例健康体检者的血标本作为健康对照组。纳入本研究的AML患者符合国际血液学领域指南及相关文献标准。本研究经福建医科大学附属协和医院伦理委员会批准(伦理编号:2019KY092),入组患者均签署知情同意书,临床资料均从住院系统的临床病史记录及病例资料中获取。
1.1.2 仪器与试剂 超净台、酶标仪、CO2细胞培养箱均购于美国Thermo公司;离心机、移液枪及微量加样器均购于Eppendorf公司;超低温-80 ℃冰箱购于美国Thermo公司;FACS流式细胞仪购于美国BD公司;胎牛血清FBS、RPMI1640培养基均购于美国Gibco公司;Annexin V-FITC细胞凋亡检测试剂盒购于上海碧云天生物公司;TRIzol试剂购于上海Invitrogen公司;氯仿、异丙醇、无水乙醇均购于上海振兴化工公司;DEPC购于上海生工公司;逆转录试剂盒购于南京诺唯赞公司;SYBR GreenMaster(ROX)购于北京康为世纪生物公司;Human IL-8/CXCL8 ELISA试剂盒购于美国Novus生物公司;rCXCL8购于美国R&D公司;CXCL8拮抗剂(anti-CXCL8)购于美国Selleck公司;ERK1/2抗体、p-ERK1/2抗体购于美国Abcam公司,Bcl-2抗体、Bax抗体、GAPDH抗体购于美国CST公司。
AML细胞株HL60、U937、NB4、THP-1、K562等由福建省血液病研究所保藏提供。细胞系置于含10%胎牛血清(FBS)及100 U/ml青霉素、100 μg/ml链霉素RPMI1640培养基中,在37 ℃、5%CO2饱和湿度的培养箱中培养。细胞每2~3 d传代1次,取对数生长期细胞进行后续实验。
1.2 方法
1.2.1 骨髓血标本单个核细胞的提取 将与骨髓血标本等体积淋巴细胞分离液加入15 ml离心管(骨髓液∶分离液=1∶1),用等量PBS稀释骨髓标本,轻柔吹打混匀;将稀释的骨髓液缓慢叠加于人淋巴细胞分离液上,形成分明的界限,2 000 r/min室温离心20 min,用移液管吸取上层血浆冻存以备后续ELISA实验,吸取中间云雾状层单个核细胞层于1.5 ml EP管中,PBS洗涤2遍,2 000 r/min离心5 min,若存在较多红细胞,则加入红细胞裂解液2 ml,4 ℃裂解20 min,再用PBS洗涤2遍;吸弃上清,加入1 ml TRIzol后吹打混匀,储藏于-80 ℃,以备后续提取RNA。
1.2.2 BM-MSC梯度离心与培养 用等量PBS稀释骨髓标本,轻柔吹打混匀,将稀释的骨髓缓慢叠加于同等体积的人淋巴细胞分离液上,形成分明的界限;2 000 r/min室温离心20 min,离心后骨髓液分为4层(从上往下依次为血浆层、单个核细胞层、透明分离液层以及红细胞层),用无菌移液管小心吸取分离交界面的云雾状单个核细胞层转移至5 ml新鲜培养基中充分吹打混匀,离心洗涤2次后加入含有30%FBS的α-MEM重悬,6×109个/L细胞接种于25 ml培养瓶中继续培养,置于无菌培养箱中。
1.2.3 ELISA检测CXCL8水平 收集不同病情阶段AML患者及健康者骨髓血标本,离心后提取血清并冻存于-80 ℃冰箱中,检测CXCL8实验步骤严格按照ELISA试剂盒说明书进行操作。
1.2.4 白血病细胞株的复苏、换液与细胞计数从液氮罐中快速取出白血病细胞株,37 ℃水中快速解冻1 min,将细胞悬液移至含10%FBS的RPMI-1640培养基的离心管中吹打混匀,600 r/min离心5 min后弃上清,再加入8~10 ml至含10%FBS、100 U/ml 青霉素、100 μg/ml 链霉素的RPMI1640培养基中吹打混匀转移至无菌培养瓶,后置于37 ℃、饱和湿度5%CO2培养箱中继续培养,并于第2天离心换液后置于培养箱中继续培养。细胞计数则是在超净台中用巴氏管充分吹打混匀细胞,取少量细胞原液于1.5 ml EP管中,用移液枪取10 μl原液再加10 μl台盼蓝混匀后加入细胞计数板,并在细胞计数仪上计数。
1.2.5 qRT-PCR技术检测CXCR1/2表达情况 利用Trizol RNA提取试剂盒提取总RNA,检测浓度和纯度后,按照逆转录试剂盒说明书逆转录成cDNA,应用ABI 7500型荧光定量PCR仪和SYBR Green-Master(ROX)试剂盒进行PCR扩增,以GAPDH为内参照,引物序列如下:CXCR1正向引物5'-TTCTCCATAGCTGCCTCAACC-3'和反向引物5'-TGTAGGAGGTAACACGATGACG-3';CXCR2正向引物5'-TGGGCAACAATACAGCAAACT-3'和反向引物5'-GCACTTAGGCAGGAGGTCTTA-3';GAPDH正向引物5'-CACCCACTCCTCCACCTTTGA-3'和反向引物5'-TCTCTCTTCCTCTTGTGCTCTTGC-3'。总反应体系20 μl,包括:2 μl cDNA、10 μl SYBR Green(ROX)、正向、反向引物各0.5 μl、RNase-free ddH2O 7 μl;反应条件为:第一阶段(预变性):50 ℃ 2 min、95 ℃ 10 min,1个循环;第二阶段:95 ℃ 15 s(变性)、60 ℃ 1 min(退火/延伸),共40个循环;第三阶段(溶解曲线分析):95 ℃ 15 s、60 ℃ 1 min、95 ℃ 30 s、60 ℃ 15 s,1个循环;采用Ct值比较法对qRT-PCR结果分析,并对比各CXCR家族mRNA表达水平,即ΔCt=Ct值CXCR-Ct值GAPDH,采用2-ΔΔCt法计算各CXCR的相对表达量,其中ΔΔCt=(CtCXCR-CtGADPH)实验组-(CtCXCR-CtGADPH)对照组。
1.2.6 外源性rCXCL8刺激U937细胞增殖体系取对数生长期的细胞4×105个予以种板,将已接种的细胞随机分为2个大组:空白对照组(Blank组)及实验组(rCXCL8组),Blank组中加入适量RPMI1640培养基,置入细胞培养箱中培养直至实验结束,期间换液1~2次;实验组细胞在铺板后加入rCXCL8溶液,将其分为1 ng/ml组、5 ng/ml组、10 ng/ml组、20 ng/ml组共4个实验组,上述各组设3个复孔,于24 h后观察细胞状态并进行后续功能学实验。
1.2.7 CCK-8法检测U937细胞增殖 取对数生长期U937细胞,制备成单细胞悬液并调整细胞密度至4×104/ml接种于96孔板,每组设3个复孔,每孔体积100 μl,边缘孔用无菌PBS填充;置于37 ℃、5%CO2饱和湿度的细胞培养箱孵育,至细胞单层铺满孔底,分别加入不同浓度梯度的rCXCL8以及等体积RPMI1640培养基作为实验组与Blank组,培养24 h;在24 h结束培养后各组均在避光状态中加入10 μl CCK-8溶液(避免气泡)于酶标仪上振荡2 min后继续孵育4 h。自动酶标仪测定双波长450 nm、630 nm处吸光度(OD)值。以时间为横轴,OD值为纵轴绘制生长曲线。
1.2.8 Transwell法构建BM-MSC和U937细胞共培养体系 无菌条件下将Matrigel置于4 ℃冰箱或冰浴融化,采用PBS稀释成1 mg/ml,-20 ℃冻存备用;取出已稀释好的Matrigel进行冰浴融化,以50 ml的体积铺于Transwell小室(24孔板)聚碳酸酯膜上,37 ℃放置60 min,使Matrigel聚合成凝胶,在加基质胶时务必将24孔板放置在冰盒上,确保胶完全覆盖孔底,避免气泡;每孔加入200 ml RPMI1640培养基使胶重构;在Transwell下室加入5×105个/ml BMMSC细胞;在上室孔中加入U937细胞1×105个/孔,细胞悬液体积200 μl,置于5%CO2培养箱于37 ℃培养24 h;待培养时间结束后,收集上室液体并小心取出上室,用细胞培养基冲洗细胞,将刺激后的U937细胞收集,PBS洗涤,用于后续实验。
1.2.9 Annexin V/PI双染流式细胞术检测细胞凋亡 取对数生长期细胞予以实验,调整细胞浓度至1×105个/孔接种于6孔板,给予不同浓度rCXCL8(或anti-CXCL8)干预U937细胞,在37 ℃、5%CO2饱和湿度的培养箱中培养48 h后收集细胞并离心,PBS清洗2次,弃上清,往管中加入400 μl×Annexin V重悬细胞,再加入5 μl的Annexin V-FITC染色液,4 ℃避光孵育20 min,后加入10 μl PI染液,4 ℃避光孵育5 min,后用BD FACSVerse流式细胞仪检测细胞凋亡率,用FlowJo 10.0软件进行数据分析。凋亡细胞=早期凋亡细胞+晚期凋亡细胞。其中(Annexin V/PI)-(PI)-为活细胞,(Annexin V/PI)+(PI)-为早期凋亡细胞,(Annexin V/PI)+(PI)+为晚期凋亡细胞。
1.2.10 Western blot检测凋亡及通路蛋白表达情况 取对数生长期U937细胞予以不同浓度rCXCL8(或anti-CXCL8)干预,在37 ℃、5%CO2饱和湿度的培养箱中培养48 h,收集细胞并离心,PBS清洗细胞2次,弃上清,使用全细胞蛋白提取试剂盒提取细胞总蛋白,并利用BSA蛋白定量试剂盒检测蛋白浓度。使用等量蛋白质予以SDS-PAGE电泳,将其转移至PVDF膜,50 g/L脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜,洗涤后二抗孵育1 h,使用ECL化学发光试剂盒处理PVDF膜,在成像系统下曝光成像。
1.3 统计学分析 采用SPSS20.0软件对数据进行分析。本研究所有数据均以表示,组间比较采用单因素方差分析和t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 ELISA检测AML患者骨髓CXCL8水平 如表1所示,AML患者体内CXCL8水平整体高于健康对照组(P<0.05)。在不同病情阶段的AML患者中,处于初诊及复发的患者CXCL8水平显著高于正常对照组(P<0.01),且处于复发阶段的患者体内CXCL8水平显著高于其他分期组患者(P<0.01),而处于CR阶段且无感染症状的AML患者,其体内CXCL8水平与健康对照组人群相比无明显差异(P>0.05)。此外,CXCL8含量与AML患者临床指标中WBC呈正相关,而与Hb、PLT呈负相关,与年龄和性别无相关性。

表1 各病情阶段AML患者CXCL8水平与临床指标Tab.1 CXCL8 levels and clinical indicators in AML patients at different disease stages
2.2 qRT-PCR技术检测不同AML细胞系CXCR1/2表达情况 如图1所示,AML细胞系较健康体检者单个核细胞中CXCR1、CXCR2表达水平上调(P<0.05),其中U937细胞CXCR1、CXCR2中平均表达水平(Expressionmean)最高,故选择U937细胞作为本研究后续的AML疾病模型。
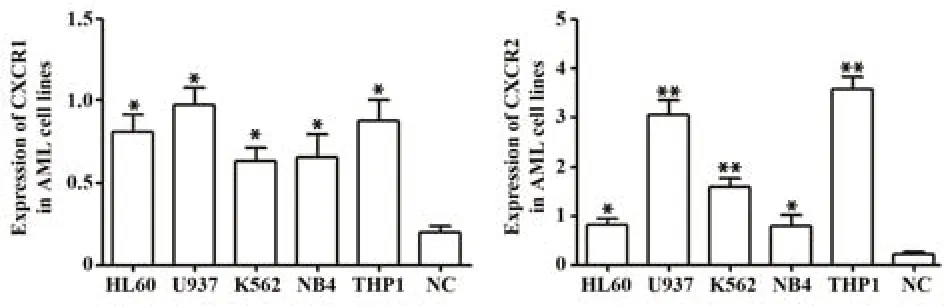
图1 不同AML细胞系CXCR1、CXCR2 mRNA表达情况Fig.1 Expressions of CXCR1 and CXCR2 mRNA in different AML cell lines
2.3 CCK-8法检测外源性rCXCL8对U937细胞增殖的影响 如表2所示,当rCXCL8浓度≤10 ng/ml时,U937细胞增殖率随rCXCL8浓度增加而升高(P<0.05)。而当rCXCL8浓度>10 ng/ml时,继续增加rCXCL8浓度,U937细胞增殖不明显,可能与rCXCL8刺激后增殖率达到平台期有关。
表2 外源性rCXCL8对U937细胞增殖的影响()Tab.2 Effects of exogenous rCXCL8 on proliferation of U937 cells ()

表2 外源性rCXCL8对U937细胞增殖的影响()Tab.2 Effects of exogenous rCXCL8 on proliferation of U937 cells ()
Note:Compared with blank group, 1)P<0.05, 2)P<0.01.
Added rate /%-16.74±8.091)43.46±7.432)64.23±5.282)66.95±6.312)Groups 0(Blank)1 ng/ml(A)5 ng/ml(B)10 ng/ml(C)20 ng/ml(D)Hole count 10 10 10 10 10 OD 10.26±0.67 11.98±0.91 14.72±0.73 16.85±0.82 17.13±1.38
2.4 外源性rCXCL8刺激U937细胞后CXCR1/2 mRNA表达差异 选择1 ng/ml、5 ng/ml、10 ng/ml及20 ng/ml rCXCL8干预U937细胞,并设置Blank组于48 h后应用Trizol法提取总RNA,并在6 h内逆转录为cDNA用于qRT-PCR检测。如图2所示,与Blank组相比,随着外源性rCXCL8浓度梯度的增加,其细胞表达CXCR1/2的水平逐渐升高,当rCXCL8逐渐升至10 ng/ml以上的作用浓度刺激下,CXCR1/2水平较不再上调,差异无统计学意义,且CXCR2更为明显,可能与rCXCL8刺激后达平台期有关,与2.3的结论相符。

图2 外源性rCXCL8刺激U937细胞后CXCR1/2 mRNA表达差异Fig.2 Differences of CXCR1/2 mRNA expression in U937 cells stimulated by exogenous rCXCL8
2.5 ELISA法检测BM-MSC+U937共培养体系CXCL8的水平变化 如图3所示,BM-MSC与U937细胞共培养体系上清液中CXCL8含量为(4.86±2.95)ng/ml,显著高于未加入BM-MSC的对照Mono组培养上清CXCL8含量(0.59±0.17)ng/ml(P<0.01)。此外,通过qRT-PCR技术检测单培养与共培养体系下U937细胞CXCL8的mRNA表达水平,在共培养体系下CXCL8水平显著高于Mono体系(P<0.01)。

图3 BM-MSC+U937共培养体系与Mono组CXCL8含量变化(A)与CXCL8 mRNA表达变化(B)Fig.3 Changes of CXCL8 content (A) and CXCL8 mRNA expression in BM-MSC+U937 co-culture system and Mono group (B)
2.6 流式细胞术检测rCXCL8与anti-CXCL8对U937细胞凋亡的影响 如图4所示,采用外源性rCXCL8刺激U937细胞,其凋亡率略低于空白对照组[(5.68±0.79)%vs(7.42±0.51)%,P<0.05],而通过拮抗CXCL8(anti-CXCL8)干预U937细胞时,其凋亡率升至(14.91±2.86)%,显著高于rCXCL8组[(5.68±0.79)%,P<0.01]及空白对照组[(7.42±0.51)%,P<0.01]。上述结果表明外源性rCXCL8刺激细胞增殖的同时可减少凋亡,而拮抗CXCL8表达可诱导U937细胞发生凋亡。

图4 rCXCL8与anti-CXCL8对U937细胞凋亡的影响Fig.4 Effects of rCXCL8 and anti-CXCL8 on apoptosis of U937 cells
2.7 CXCL8调控U937细胞增殖与凋亡的分子机制 如图5所示,外源性rCXCL8刺激U937细胞将明显上调抗凋亡分子Bcl-2的表达水平,并下调促凋亡分子Bax表达(P<0.05),在此基础上拮抗CXCL8后将使Bax表达上调、而下调Bcl-2表达,同时抑制ERK1/2信号通路活化水平以诱导U937细胞发生凋亡。
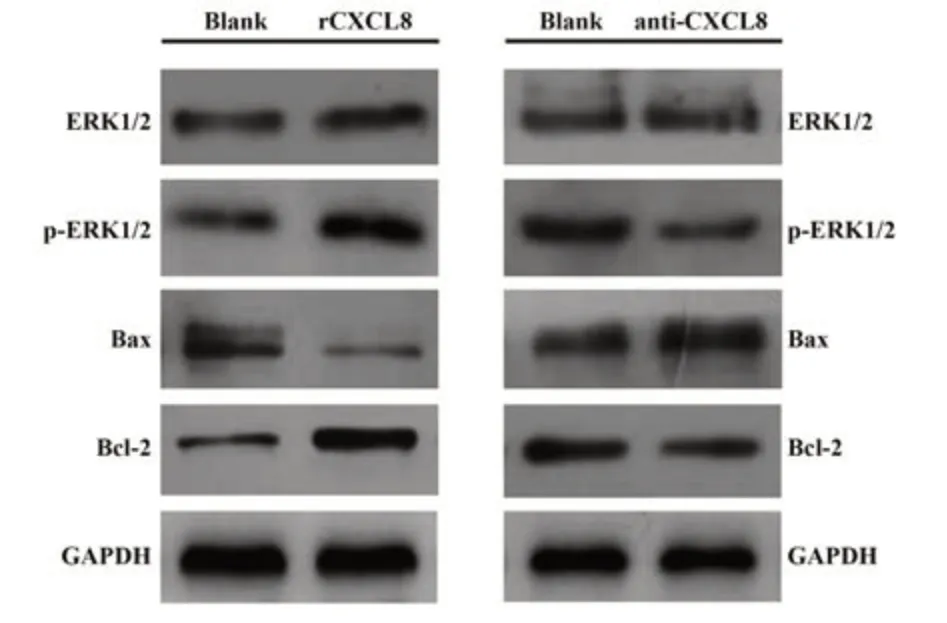
图5 CXCL8调控U937细胞增殖与凋亡的相关分子机制Fig.5 Molecular mechanism of CXCL8 regulating U937 cell proliferation and apoptosis
3 讨论
AML是一类源于造血干祖细胞遗传突变所致的恶性克隆性疾病,其特征为未成熟幼稚的髓母细胞无限增殖并在骨髓中累积,导致骨髓造血功能受损并浸润髓外组织器官。尽管近年来标准化学疗法的应用、造血干细胞移植甚至是免疫疗法等手段使AML患者的治疗及预后有所改善,但大多数患者仍需面对复发、难治、耐药或对临床治疗手段无效的惨痛现实,致使AML患者的总生存期短、预后差、病死率居高不下。其中,化疗抗性、耐药性与白血病细胞和骨髓微环境之间的相互作用密切相关[7]。值得关注的是,BM-MSC和白血病细胞常通过骨髓微环境中的趋化因子进行相互介导并发挥一系列的恶性生物学作用,继而导致骨髓微环境中的炎症介质反应加剧甚至使骨髓细胞向白血病细胞演变[8-9]。
作为“白细胞催化剂”的CXC型趋化因子CXCL8,是造血干细胞(hemapietic stem cell,HSC)和粒细胞-单核细胞祖细胞(Granulocyte-monocyte progenitor cells,GMPs)中显著上调的基因之一,提示CXCL8很有可能在AML的发生、发展中发挥至关重要的作用[10]。目前,CXCL8是一种已知的有效促炎因子,通过与肿瘤细胞上存在的特异性G蛋白偶联受体CXCR1以及CXCR2高亲和力结合,继而激活PI3K、PLC、PLD、JAK2、AC以及Ras等信号通路分子,在调控基因表达与细胞生物学行为等方面扮演着重要的角色[11]。此外,众多恶性肿瘤的研究证实,CXCL8在肿瘤细胞的存活、增殖、迁移以及侵袭等恶性生物学行为中发挥了至关重要的作用,并可能是肿瘤干细胞活性的重要调节剂[12-18]。而在AML患者骨髓微环境中,个别研究证实BM-MSC在炎症和缺氧的应激情况下可释放CXCL12、CXCL8,且BM-MSC所分泌的CXCL8可促进AML细胞恶性生物学行为的发生,从而导致AML发生耐药、病灶残留和复发[19]。
本研究首先通过ELISA检测不同病情阶段的AML患者体内CXCL8水平,结果显示AML患者体内CXCL8含量水平显著高于健康人群,此外,在不同病情阶段的AML患者中,处于初诊及复发的患者CXCL8水平显著高于正常对照组,尤其是处于复发阶段的患者体内CXCL8水平显著高于其他分期组患者,而处于CR阶段且无感染症状的AML患者,其体内CXCL8水平与健康对照组人群相比无明显差异。为此,本研究表明监测CXCL8水平变化将是判断AML患者临床疗效和病情阶段的重要监测指标。值得一提的是,尽管人类机体生理状态下存在一定基础水平的CXCL8,但机体若在病理状态存在免疫炎症反应或相关促炎因子的作用下,CXCL8水平将显著上调。AML患者由于体内大量幼稚未分化的髓系母细胞过度增殖且抑制正常造血及功能,多数患者在发病期间存在感染症状,这也可能是体内CXCL8水平上调的原因之一。所以,CXCL8很可能通过促进AML患者体内多种趋化因子或细胞因子之间相互作用,继而使骨髓微环境中炎症介质紊乱程度加重,进一步促进白血病病情的复发、进展与恶化。
CXCL8水平在AML患者的临床分期及预后中是一个极具潜力的标志物,然而,其在AML的病情发展及恶化的病理生理过程中如何发挥作用?本研究通过检测CXCL8特异性受体CXCR1/2在不同AML细胞系中的表达情况,发现其在AML细胞系中均表达上调,尤其是U937细胞系中CXCR1/2表达最高且稳定,故选择U937细胞系作为AML疾病模型。通过外源性rCXCL8干预U937细胞能促进U937细胞增殖,且增殖率呈浓度依赖性,并上调CXCR1/2的表达。而将分离的AML患者BM-MSC与U937细胞共培养时,BM-MSC与U937细胞共培养体系中CXCL8含量及其共培养体系下U937细胞CXCL8 mRNA水平均显著高于未加入BM-MSC的单培养Mono组CXCL8含量,表明AML患者BM-MSC细胞可分泌CXCL8,进而刺激U937细胞发生增殖。通过Western blot技术发现,外源性rCXCL8刺激U937细胞将显著上调抗凋亡蛋白Bcl-2蛋白的表达水平,并下调促凋亡蛋白Bax表达,进而诱发U973细胞恶性增殖,使凋亡受抑;在此基础上通过拮抗CXCL8(anti-CXCL8),可下调Bcl-2表达,并促进Bax表达上调,同时通过抑制ERK1/2信号通路活化水平进而诱导U937细胞发生凋亡,表明CXCL8介导AML细胞恶性生物学行为的调控机制可能与Bcl-2家族蛋白以及ERK1/2信号通路有关。
既往研究发现,AML的发生、发展与骨髓微环境中的可溶性因子、BM-MSC和ECM相互作用关系密切,而CXCL8可显著影响AML细胞的增殖和抗凋亡效应,这与本研究结论基本相符[20-23]。通过基因编辑技术敲低或药理学方法阻断CXCL8及其受体活性,可导致AML增殖减少、凋亡增加,同时减少对化疗的耐药性,表明CXCL8-CXCR1/2轴在AML病情发展中起到了重要作用[10]。值得关注的是,近年来有学者鉴定出CXCL8小分子抑制剂化合物NCI34255,应用其干预AML细胞株,不仅可减少AML细胞株增殖,还可增强AML细胞对化疗的敏感性,减轻化疗抗性[19]。与此同时,亦有研究发现,AML伴IDH1/2突变会产生合成代谢物R-2-羟基谷氨酸(R-2HG),从而激活NF-κB信号通路并显著上调CXCL8表达,促进AML细胞增殖和产生对化疗药的抵抗作用[24]。此外,伴有FLT3-ITD突变的AML患者具有最高的CXCL8 mRNA表达,并已证实CXCL8基因高表达是FLT3-ITD突变的AML患者不良预后的重要标志[25]。为此,靶向CXCL8治疗很有可能是FLT3-ITD及IDH1/2突变型AML患者的有效治疗策略。
综上,本研究的结果证实,CXCL8与AML病情、预后转归密切相关,是AML患者疾病进展、预后评估极为有效的监测指标。在骨髓微环境中,CXCL8可能是介导白血病细胞恶性增殖、免疫逃逸的重要趋化因子,通过拮抗CXCL8可诱导U937细胞发生凋亡,其机制可能与Bcl-2家族蛋白表达变化、抑制ERK1/2信号通路活化水平有关。此外,本研究中多项功能学实验结果表明,外源性rCXCL8或拮抗CXCL8干预U937细胞可影响其特异性受体CXCR1/2的表达,表明CXCL8-CXCR1/2轴在调控AML疾病发生、发展中亦尤其关键,但其中是否伴随其他分子机制的参与?以及靶向CXCL8是否对于逆转白血病细胞耐药、遏制白血病细胞免疫逃逸、削弱白血病细胞干性与化疗抗性等方面存在一定的意义?上述都需要更为深入的研究予以探讨。
诚然,本研究的创新之处是基础研究结合临床应用,采用多重技术检测临床上不同病情阶段的AML患者体内的CXCL8水平,分析和探讨其在病情监测、疗效评价及预后评估等方面所具备的重要临床价值,同时通过构建AML疾病的细胞模型,揭示了CXCL8介导AML发生、发展与恶性生物学行为的调控机制,证实CXCL8是极具潜力的分子标志物,为白血病的免疫与靶向治疗提供了科学且新颖的思路,但其间复杂的分子事件与效应机制仍需深入挖掘与探索,以便更好地付诸于基础研究并应用于临床实践。

