PD-1抑制剂对比化疗或伊匹单抗治疗晚期黑色素瘤安全性和有效性的Meta分析
林志冰 毛雅珍 周晓燕 林晓丹 徐桂秋 林伟 林雨虹
(福建医科大学附属福州市第一医院检验科,福州 350009)
目前晚期黑色素瘤的标准治疗包括PD-1抑制剂[纳武单抗(nivolumab,Niv)或派姆单抗(pembrolizumab,Pem)]单用或联合抗CTLA-4治疗[伊匹单抗(ipilimumab,Ipi)],而针对BRAFV600突变的晚期黑色素瘤患者,则有靶向BRAF联合MEK基因的抑制剂[达拉非尼+曲美替尼(dabrafenib+trametinib)、维莫拉非尼+科比替尼(vemurafenib+cobimetinib)、恩科拉非尼+比尼替尼(encorafenib+binimetinib)][1]。Niv和Pem作为PD-1抑制剂的代表药物,于2014年先后被FDA批准用于治疗不可切除或进展期黑色素瘤[2]。在既往未治疗的晚期BRAF野生型黑色素瘤患者中,相较于一线化疗(chemotherapy,chem)药物达卡巴嗪(dacarbazine),Niv可以延长总生存期(overall survival,OS),其客观反应率(objective response ratio,ORR)为40%,但大约60%的患者产生耐药性,30%的患者因不良事件停止治疗[3-5]。因此,有必要了解PD-1/PD-L1抑制剂相比于其他治疗方式在临床应用中的安全性和有效性。本研究检索国内外有关PD-1/PD-L1抑制剂治疗晚期黑色素瘤患者的随机对照试验(最终未检索到可用的有关PD-L1抑制剂对比其他治疗的临床试验),对其治疗相关不良反应(treatment-related adverse events,TRAEs)、无进展生存时间(progression-free survival,PFS)、OS和客观反应(objective response,OR)进行全面分析与探究,旨在对晚期黑色素瘤采用免疫抑制剂的临床治疗策略进行指导,并提供循证医学证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 随机对照试验(RCT)。
1.1.2 研究对象 接受抗PD-1/PD-L1单抗治疗的晚期黑色素瘤患者,其中患者的ECOG评分为0~1分,其种族、国籍、性别、病理结果、病程不限,且既往未行全身治疗。
1.1.3 干预措施 单用抗PD-1/PD-L1单抗治疗或联合其他治疗。
1.1.4 结局指标 有效性:①PFS;②OR;③OS。安全性:①TRAEs;②3~4级TRAEs。
1.1.5 排除标准 ①非英文和中文文献;②重复报道的研究;③资料不全,相关数据无法获取的研究。
1.2 文献检索 计算机检索PubMed、CNKI、维普(VIP)和万方(Wanfang)数据库,搜索时限均为自建库起至2022年5月1日,另外,以纳入文献的参考文献作为补充。检索采取主题词和自由词相结合的方式。英文检索词包括:nivolumab、pembrolizumab、avelumab、atezolizumab、durvalumab、PD-1、PD-L1、melanoma。
1.3 文献筛选和资料提取 由2位评价员独立筛选文献,提取数据并交叉核对,如遇分歧,则征求第三方的意见并讨论解决。文献筛选时首先阅读标题和摘要,在排除明显不相关的文献后,进一步阅读全文,以确定最终是否纳入。资料提取内容主要包括:①纳入研究的基本信息,包括研究题目、第一作者、发表杂志和时间等;②研究对象的基线特征,包括纳入患者例数、组织病理类型;③干预措施的具体细节等;④偏倚风险评价的关键要素;⑤所关注的结局指标和结果测量数据等。
1.4 纳入研究的质量评价和偏倚风险评估 采用改良版Jadad评价表对纳入RCT的质量进行评价;通过Egger法、Begg法和非参数剪补法对纳入研究的偏倚风险进行评估。两位作者独立进行数据提取和质量评估,都通过讨论和协商解决分歧。
1.5 统计学分析 采用RevMan 5.4软件进行TRAEs二分类数据的Meta分析,以比值比(odds ratio,OR)作为效应指标,各效应量均给出其点估计值和95%CI。采用STATA16版本软件分析PD-1抑制剂对晚期黑色素瘤的有效性,以OS、PFS和OR作为观测的结局指标,以风险比(Hazard ratio,HR)和OR作为效应指标,合并效应量并绘制森林图。纳入研究结果采用I2值评价各研究间的异质性大小,若各研究间无明显异质性,则采用固定效应模型进行数据分析,若各研究间存在异质性,则采用随机效应模型进行Meta分析。P<0.05为差异具有统计学意义。
2 结果
2.1 文献检索结果 初检筛出563篇文献,最终纳入7项符合要求的研究,文献筛选流程见图1。其中6项研究发表了多篇文章,为获得更详尽的数据,一并纳入参考:研究项目编号KEYNOTE-002纳入2篇文献,CheckMate 238纳入3篇文献,CheckMate 037纳入2篇文献,CheckMate 067纳入5篇,CheckMate 066纳入2篇,KEYNOTE-006纳入4篇[表1、附表1(www.immune99.com)];而项目编号KEYNOTE-002和KEYNOTE-006包含3组,对照组分别为化疗和Ipi,干预组均为Pem,KEYNOTE-002针对不同剂量设立两组,KEYNOTE-006针对给药的不同周期设立两组[附表1(www.immune99.com)],鉴于研究中的结论为干预组的不同分组并未影响最终观察指标,且未有明显证据表明其产生决定性影响,故皆纳入分析,后续计算纳入研究数量时计为2。
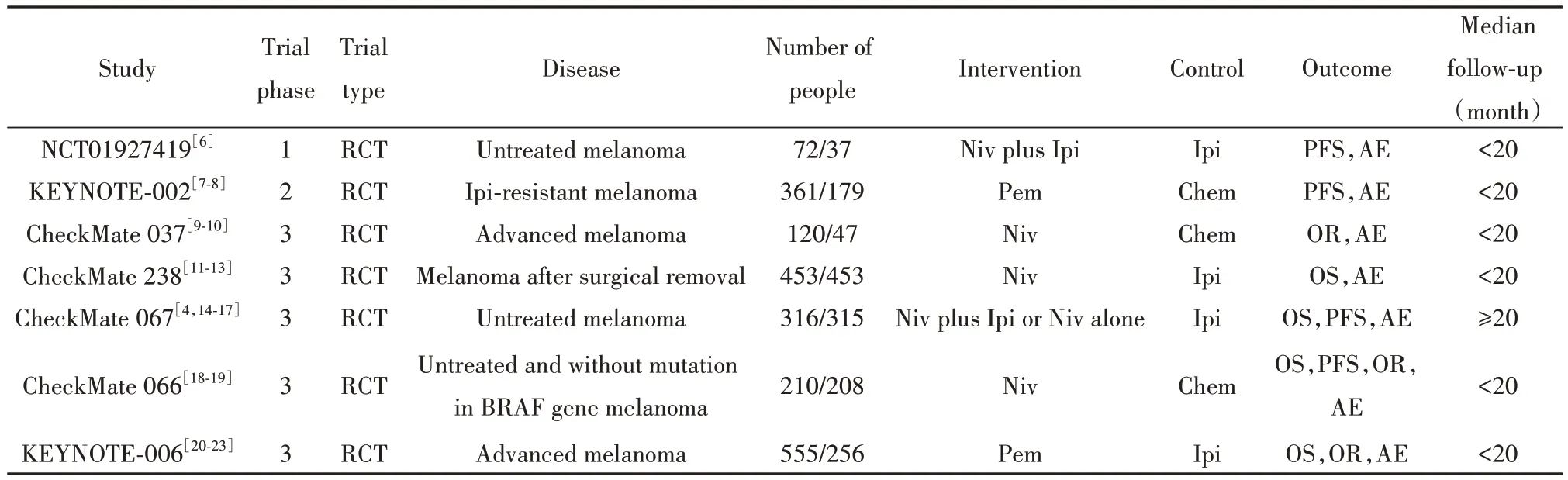
表1 纳入研究的一般特征Tab.1 Characteristics of included randomized controlled trials

图1 文献检索和筛选流程Fig.1 Literature search and screening process
2.2 纳入研究的基本特征 如表1所示,纳入的研究均为RCT;5项为3期试验;6项干预组为PD-1抑制剂单用,2项为PD-1抑制剂联合其他治疗;5项干预组为Niv参与,2项为Pem参与;3项对照组与Chem相关,4项为Ipi治疗。附表1为纳入研究的临床病理特征,包括研究对象的纳入标准和排除标准,试验前的治疗情况以及干预组和对照组的治疗策略(用药剂量及用药周期)。
2.3 纳入研究的质量评价 纳入的7项研究均为RCT,依据改良版Jadad评分量表进行研究质量评价,以总分0~3分为低质量,4~7分为高质量,评分结果显示均为高质量研究。见表2。
2.4 发表偏倚 Egger回归法和Begg秩相关法结果显示,纳入研究之间除PFS组的Egger法P值为0.031 5外,其余P值均>0.05,无明显偏倚(表3);继而通过剪补法分析,估计缺失研究的数量,再添补部分研究后,重新进行Meta分析,合并效应量估计值变化不明显,说明发表性偏倚影响不大,结果比较稳定。
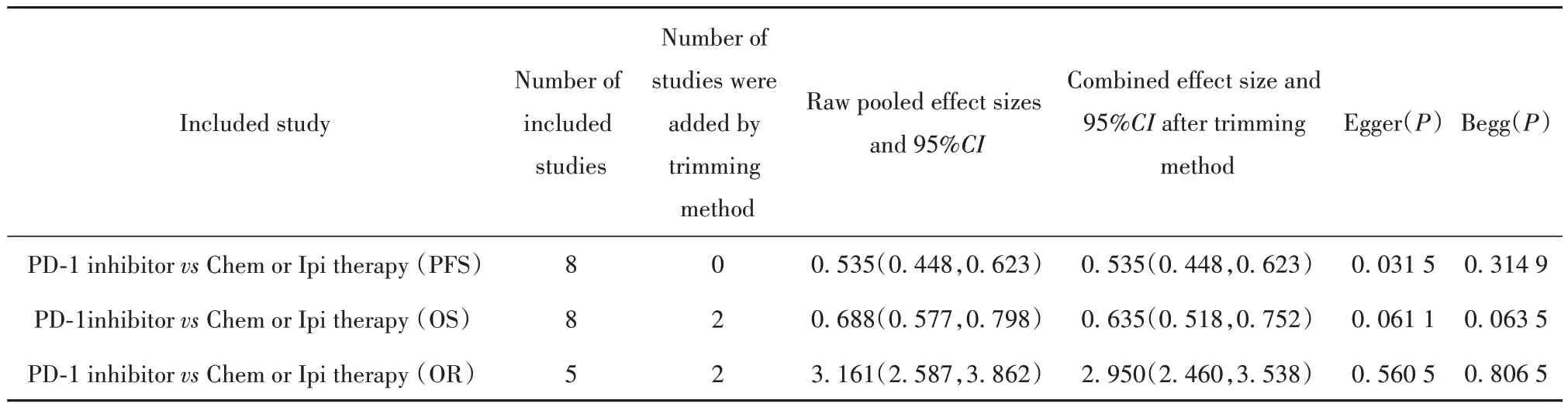
表3 剪补法、Egger和Begg法分析纳入研究的发表偏倚Tab.3 Trimming method, Egger and Begg analyze publication bias in included studies
2.5 PD-1抑制剂治疗相关不良反应 4项研究报告了PD-1抑制剂(Niv和Pem)对比化疗的TRAEs;2项研究报道PD-1抑制剂联合Ipi对比Ipi的TRAEs;3项研究报告PD-1抑制剂单用对比Ipi的TRAEs。根据异质性I2的结果选择分析模型,I2≥50%选择随机效应模型,否则选择固定效应模型。结果分析显示:①PD-1抑制剂治疗晚期黑色素瘤的3~4级TRAEs和任何TRAEs均低于一线化疗组,其差异具有统计学意义[OR=0.42,95%CI(0.23,0.76),P=0.005;OR=0.55,95%CI(0.41,0.72),P<0.000 1];②PD-1抑制剂联合Ipi的3~4级TRAEs高于Ipi组[OR=3.32,95%CI(2.44,4.52),P<0.000 1];而任何TRAEs与Ipi差异无统计学意义[OR=1.82,95%CI(0.42,7.91),P=0.42];③PD-1抑制剂单用的3~4级TRAEs和任何TRAEs均与Ipi组差异无统计学意义[OR=0.57,95%CI(0.25,1.26),P=0.17;OR=1.12,95%CI(0.67,1.86),P=0.66];④其他TRAEs细项见附表2(www.immune99.com)。
2.6 PD-1抑制剂对比化疗或Ipi治疗的PFS 8项研究报告了PFS,其中4项针对PD-1抑制剂对比chem(KEYNOTE-002的干预组分不同剂量的两组),4项针对PD-1抑制剂对比Ipi(KEYNOTE-006的干预组分不同用药周期的两组);结果显示:PD-1抑制剂对比chem或Ipi的PFS均明显延长,且差异有统计学意义[HR=0.54,95%CI(0.45,0.62),P<0.05](图2),且与亚组分析的结论一致[HR=0.59,95%CI(0.38,0.81),P<0.05和HR=0.52,95%CI(0.40,0.63),P<0.05]。

图2 晚期黑色素瘤中PD-1抑制剂对比伊匹单抗或化疗的PFSFig.2 PFS of PD-1 inhibitor versus ipilimumab or chemotherapy in advanced melanoma
2.7 PD-1抑制剂对比化疗或Ipi治疗的OS 共纳入8项研究,结果显示:合并总体效应量P<0.05,PD-1抑制剂相较对照组延长了患者OS[HR=0.69,95%CI(0.58,0.80),P=0.03](图3),亚组分析中chem组KEYNOTE-002的干预组分不同剂量的两组,Ipi组中KEYNOTE-006的干预组分不同用药周期的两组,结果均显示PD-1抑制剂治疗晚期黑色素瘤的OS更长[HR=0.71,95%CI(0.52,0.90),P<0.05和HR=0.67,95%CI(0.52,0.81),P<0.05]。

图3 晚期黑色素瘤中PD-1抑制剂对比伊匹单抗或化疗的OSFig.3 OS of PD-1 inhibitors versus ipilimumab or chemotherapy in advanced melanoma
2.8 PD-1抑制剂对比化疗或Ipi治疗的OR 共纳入5项研究,结果显示:合并总体效应量[OR=3.16,95%CI(2.59,3.86),P<0.05]、PD-1抑制剂的客观缓解率明显高于对照组(图4)。Ipi组中KEYNOTE-006的干预组分不同用药周期的两组,亚组分析结果均显示PD-1抑制剂治疗晚期黑色素瘤有更好的客观反应[OR=4.07,95%CI(2.63,6.28),P<0.05和OR=2.94,95%CI(2.35,3.69),P<0.05]。
3 讨论
黑色素瘤是一种侵袭性强、预后差的恶性肿瘤,中国每年新发病例约为20 000例[24-25]。目前,仍未找到治疗晚期黑色素瘤最为有效的方法。而近年,免疫疗法逐渐成为癌症治疗的热点。癌症免疫疗法是在对肿瘤逃逸机制研究的基础上发展起来的,其通过对免疫系统的调节克服肿瘤免疫逃逸,重新激活抗肿瘤免疫反应[26]。随着免疫治疗的不断发展,晚期黑色素瘤患者的OS、PFS和ORR得到明显改善,尤其是PD-1抑制剂中的Niv和Pem[27]。为了分析PD-1抑制剂对比化疗或Ipi在晚期黑色素瘤患者中的有效性和安全性,本文进行了相关的系统分析。
本文共纳入7项研究(KEYNOTE-002和KEYNOTE-006干预组分为两组,皆纳入分析则算为9项),涉及19篇文献,总计3 582(2 087/1 495)例患者,均为RCT,改良版Jadad量表评价均为高质量。干预组为PD-1抑制剂(Niv和Pem)参与的治疗,对照组主要分为化疗和Ipi两种治疗方式。Meta分析结果显示:①在晚期黑色素瘤患者中,PD-1抑制剂治疗相较于对照组,延长患者OS和PFS,并有更多患者对治疗产生客观缓解(完全+部分缓解);②PD-1抑制剂对比化疗,有效性更高,且安全性更好,发生更少的TRAEs(发生率:70.05%/79.08%),包括3~4级的TRAEs(8.06%/23.64%),而亚组分析则有所差异。在不限级的TRAEs中,恶心、便秘、食欲减退、脱发、贫血、中性白细胞减少和血小板减少较少发生,但与皮肤相关的TRAEs,如瘙痒、皮疹和白斑则较化疗更多发生。在3~4级的TRAEs中,严重的疲乏、恶心、贫血、中性白细胞减少和血小板减少均较少发生;③PD-1抑制剂联合Ipi对比Ipi,虽然有效性更高,但安全性稍差,更可能发生3~4级TRAEs(54.79%/33.21%),尤其是严重的疲乏、皮疹、肝功能相关指标(谷丙转氨酶升高和谷丙转氨酶降低);④PD-1抑制剂对比Ipi有效性更高,但安全性差异不大,TRAEs,包括3~4级的TRAEs差异均无统计学意义。在亚组分析中,仅有一般的瘙痒、腹泻发生率低于Ipi组,而甲状腺功能减退和关节痛的发生率高于Ipi组。纳入的研究中大多报道的是低级别事件,但也描述了高级别事件,特别是血液系统和肝功能相关不良反应(adverse events,AEs)。临床医生需要注意这些独特毒性的风险,制定治疗方案时根据抗PD-1/PD-L1试验指南进行适当调整。
此外,本研究亦存在一定的局限性:①本文最初的目的是探究PD-1/PD-L1抑制剂对比其他常规治疗方式,如化疗、CTLA-4抑制剂,在晚期黑色素瘤患者中的安全性和有效性,但在实际检索过程中未有符合纳入标准的关于PD-L1抑制剂的研究,因此,未能更全面地提供证据说明问题;②在纳入的8项研究中,关于TRAEs的7篇,根据干预组和对照组的不同情况进行亚组分析,尤其是PD-1抑制剂联合Ipi对照Ipi的Meta分析中,仅根据2项研究提取的数据研究数量较少,可能造成异质性较高,结果不稳定的状况发生;③研究的目标疾病是晚期黑色素瘤,纳入的研究中,有4项此前未经过治疗,2项经过Ipi治疗,1项经过完全切除术,1项至少经过全身治疗,目前未知这些患者进入临床试验前的不同治疗情况是否会对Meta分析结果产生影响。同样,对于黑色素瘤患者自身的不同特性,如BRAF基因突变与否,由于研究数量所限,也未能在本文中探讨,其影响亦未可知;④由于未有治疗的标准方案,研究者可能根据病人的承受程度设置不同的用药方案和用药剂量,最终合并数据时可能存在的偏倚,一定程度上影响整体评估,尤其是AEs的判断;⑤纳入研究的随访时间长短不一可能对患者生活质量的影响及远期转归的判断存在一定的影响。在将来的研究中,本课题组将不断更新数据,收集更多高质量的临床试验,对本文的数据进行更新和验证,尤其是在用药方案、随访时间和疾病类型上进行更详尽的分析,为晚期黑色素瘤患者选择治疗方案及监测治疗过程提供更可靠的指导意见。

