BRCA2基因在免疫杀伤肺癌细胞中的作用及机制研究
张群贵 赖剑平 李晓静 黄立 (赣州市肿瘤医院,赣州 341000)
肺癌是高发恶性肿瘤。在我国,每年新增肺癌患者约73万例,病死患者达到61万[1]。手术切除肿瘤,并给予放化疗的治疗策略是主要治疗手段,对早期患者疗效较好,但是对晚期转移及复发患者疗效甚微[1-2]。靶向药物及免疫疗法如免疫细胞治疗是新兴疗法,在部分肿瘤患者群中取得较好效果[2-3]。然而,肿瘤细胞通过降低表面抗原水平、突变基因位点、表观遗传修饰、干预DNA损伤修复等方式逃避免疫及药物杀伤,产生耐受[4-6]。其中,DNA损伤修复异常是临床上肿瘤耐药的重要机制。肿瘤细胞通过激活DNA损伤修复信号抵消药物治疗引起的DNA损伤[6-7]。联合给予DNA损伤修复抑制剂可显著改善肿瘤耐药情况。BRCA2是DNA修复相关基因,乳腺癌中BRCA2突变后,对靶向药物治疗更敏感[8]。研究报道BRCA2在肺癌组织中也发生突变,并且提高肺癌细胞对DNA修复靶向药物的敏感性[9]。然而,BRCA2对免疫细胞杀伤肺癌的影响是什么?分子机制是什么?本研究在细胞水平验证BRCA2敲减后,免疫细胞对肺癌细胞的杀伤作用及在分子水平探讨其作用机制。
1 材料与方法
1.1 材料 高糖培养基DMEM(KGM12800N-500)、胎牛血清(KGL3002)、青霉素/链霉素(KGY0023)购于江苏凯基生物;siRNA(G2210031)购于通用生物系统(安徽)有限公司;SYBR Green染料(D7260)、RNA提取试剂盒(R0026)、cDNA第一链合成试剂盒(D7168S)、CCK-8试剂(C0037)、MTT溶液(ST1537)、lipo8000(C0533)、SDS-PAGE制胶试剂盒(P0012A)均购于上海碧云天生物公司;pCDHGFP质粒(ry-lvp001)、GFP慢病毒(ry-lv001)、肺癌细胞系A549(ry-cl-1)、H1299(ry-cl-2)、H464(ry-cl-3)、H1975(ry-cl-4)、BEAS2B(ry-cl-5)购于上海冉研生物科技有限公司;ECL超敏试剂盒(P0018S)、蛋白提取试剂盒(P0013M)购于上海翊圣生物科技;外周血单个核淋巴细胞(B230470)购于明舟生物。
1.2 方法
1.2.1 细胞培养及siRNA处理 肺癌细胞以高糖DMEM培养基培养,显微镜下观察细胞并更新培养基,覆盖度达到95%以上时以0.05%胰酶消化,1 200 r/min离心5 min,收集细胞,然后以新鲜培养基重悬,在37 ℃、5%CO2条件下按照1∶3分瓶传代培养。
取状态较好的细胞,提前24 h铺于培养板或培养孔中,取50 pmol siRNA,以无血清培养基稀释,加入适量lipo8000,充分混匀,室温静置30 min,以移液器逐滴加入准备的细胞中,继续培养4~6 h后,更换新鲜培养基,继续培养48 h后,收集细胞开展后续实验。
1.2.2 荧光定量PCR扩增实验 以试剂盒提取细胞总RNA,定量并以0.5 μg总RNA反转录合成cDNA的第一链,取1 μl合成的cDNA第一链为模板,以SYBRGREEN染料法定量扩增,反应程序为:95 ℃5 min;95 ℃ 15 s;60 ℃ 15 s,40个周期。以β-actin为内参。
1.2.3 细胞增殖实验 按照4 000个/孔接种肺癌细胞100 μl于96孔培养板中,每24 h加入10%总体积的CCK-8试剂,继续孵育1~4 h后,酶标仪检测450 nm波长吸光度,参考对照组计算细胞增殖率。
1.2.4 细胞杀伤实验 以GFP慢病毒按照MOI=10感染A549与H1299细胞,培养72 h后,在荧光显微镜下观察GFP荧光表达分布与强度,判断慢病毒感染效率,获得稳定表达GFP的靶细胞。取指数生长状态的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)与表达GFP的靶细胞,按照1∶1、3∶1、6∶1共培养24 h,采用酶标仪检测GFP荧光强度,判断PBMC对肺癌细胞的杀伤效率。
1.2.5 Western blot实验 离心收集处理的肺癌细胞,以蛋白试剂盒提取总蛋白,以12%SDS-PAGE电泳分离总蛋白,然后转印至PVDF膜,以5%脱脂奶粉封闭PVDF膜室温1 h,加入目的蛋白抗体并于4 ℃孵育过夜,置换HRP标记的抗体室温孵育1 h,以ECL超敏试剂盒曝光检测目标蛋白条带。以GAPDH蛋白为内参,分析蛋白条带灰度值,计算蛋白相对表达量。抗体信息如下:抗ATM抗体(AF1399,稀释比例1∶4 000)、抗RAD51抗体(AF7860,稀释比例1∶1 000)、抗RAD50抗体(AF7857,稀释比例1∶2 000)、抗P53抗体(AF7671,稀释比例1∶5 000)、抗BRCA2抗体(AF6342,1∶1 000)、抗GAPDH抗体(AF1186,稀释比例1∶5 000)及HRP标记的羊抗鼠抗体(A0216,1∶1 000)、鼠抗兔抗体(A0208,1∶1 000)。
1.3 统计学分析 本研究中数据采用SPSS11.0软件分析,两组间比较采用Student'st检验,三组以上数据比较采用One-way ANOVO分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 BRCA2基因在肺癌细胞中被成功敲减 如图1A~C,BRCA2基因在常见的肺癌细胞系中呈现中丰度表达。在A549及H1299细胞中,BRCA2基因mRNA表达量和蛋白表达量较H1975及H464细胞中高(P<0.05)。如图1D,BRCA2基因mRNA表达量比对照组降低超过50%,表明BRCA2基因在A549及H1299细胞中被成功敲减。

图1 BRCA2基因被成功敲减Fig.1 BRCA2 gene is successfully knocked down
2.2 敲减BRCA2促进肺癌细胞生长 如图2A、B,CCK-8实验表明敲减BRCA2基因72 h后,肺癌细胞A549增殖率比对照组提高近30%,H1299细胞增殖率是对照组的1.8倍。MTT法检测进一步证实BRCA2敲减后,A549与H1299细胞增殖率均比对照组显著增强(图2C、D)。

图2 BRCA2基因调控肺癌细胞增殖Fig.2 BRCA2 gene regulates cell proliferation
2.3 敲减BRCA2的肺癌靶细胞株构建 如图3A,感染携带GFP的慢病毒72 h后,A549细胞表达GFP荧光效率在95%以上,H1299细胞中GFP表达效率也超过95%。表明成功构建表达GFP蛋白的肺癌细胞株。以BRCA2基因2#有效siRNA靶点转染该细胞株,Western blot结果表明BRCA2蛋白表达量被分别降低82%、59%(图3B、C)。
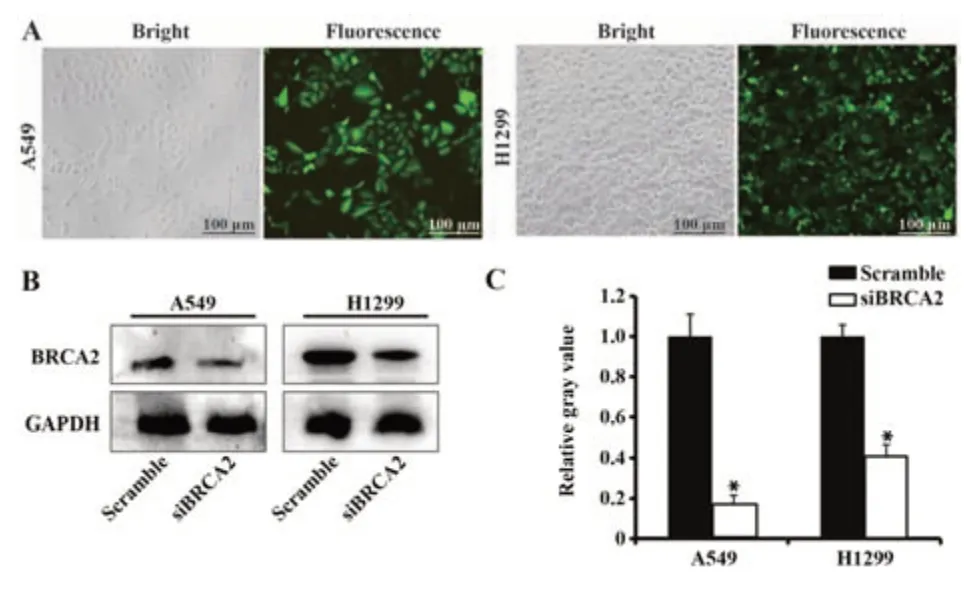
图3 表达GFP的肺癌靶细胞株构建Fig.3 Construction of lung cancer cells expressing GFP protein
2.4 敲减BRCA2提高单核细胞对肺癌细胞的杀伤效率 如图4A,PBMC与靶细胞A549共培养24 h后,敲减BRCA2基因组的荧光强度分别为3 986、674、722,而对照组荧光强度分别为9 247、6 070、3 104。PBMC与靶细胞H1299共培养24 h后,敲减组的荧光强度分别为3 771、1 026、679,而对照组荧光强度分别为8 326、5 196、3 596(图4B)。
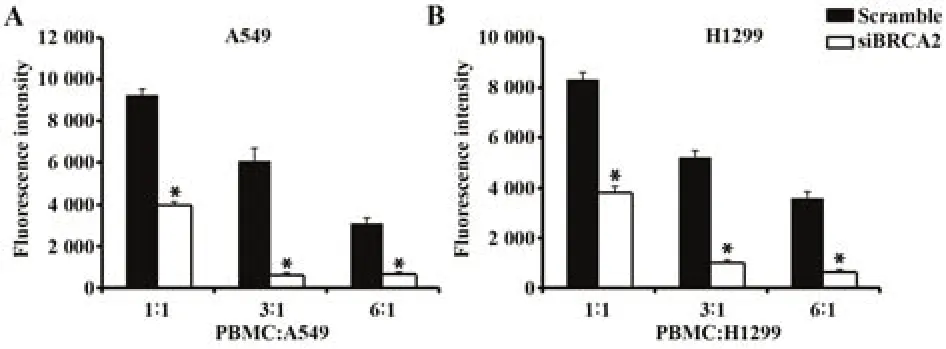
图4 敲减BRCA2提高PBMC杀伤效率Fig.4 BRCA2 knockdown increases killing efficacy of PBMC
2.5 BRCA2调控ATM信号 如图5,敲减肺癌A549细胞中BRCA2基因后,ATM基因表达量比对照组降低75.4%。DNA损伤修复相关基因RAD51、RAD50表达量分别比对照组降低26.9%、26.7%,而P53表达量却是对照组的7.2倍。该数据表明ATM信号可能是BRCA2干预的关键信号通路。

图5 BRCA2调控ATM信号通路分子表达Fig.5 BRCA2 regulates expression of members in ATM signaling pathway
3 讨论
肺癌是高发恶性肿瘤,每年导致数十万人死亡。手术切除结合放化疗是临床主要治疗策略,对早期患者疗效较好,但是对转移以及复发患者无显著效果[1-2]。主要原因为对肺癌发病诱因及信号机制缺乏了解。BRCA2是DNA损伤修复相关基因,最早发现在乳腺癌患者中发生BRCA2突变[8]。文献资料表明在肺癌患者中也检测到BRCA2基因突变并且与肺癌临床病理相关[9]。本研究发现降低BRCA2基因表达后,肺癌细胞生长能力增强。这与文献资料数据一致,即BRCA2在多个类型肿瘤中发挥癌症抑制因子的作用。如在乳腺癌中BRCA2突变后,癌细胞侵袭性及生长能力均显著提高[8]。在脑肿瘤中,干扰BRCA2基因表达后,癌细胞生长更旺盛[10]。然而,BRCA2表达降低后,癌细胞对化疗药物敏感性增强,有助于提高化疗疗效[8]。例如,BRCA2突变提高胰腺癌对顺铂的敏感性,PARP抑制剂对乳腺癌疗效更强[11-12]。深入研究发现BRCA2功能异常导致DNA损伤修复系统失调,无法修复化疗药物诱导的癌细胞DNA损伤,诱发癌细胞凋亡[13-14]。因此,两种不同机制的药物联合对肿瘤临床治疗可能起到事半功倍的效果。
研究发现增强免疫系统识别、杀伤肿瘤细胞对遏制肿瘤进展、提高临床疗效有重要意义。细胞免疫治疗是当前研究的热点话题,如过继性免疫细胞治疗、CART免疫细胞治疗等均为部分肿瘤患者带来了新的希望[15-16]。免疫细胞分泌细胞因子如IL-2、干扰素、颗粒酶等诱导肿瘤细胞凋亡或死亡。然而,肿瘤细胞通过降低自身表面抗原、基因突变等机制逃避免疫识别或杀伤,形成免疫耐受[17-18]。在本研究中,以PBMC处理肺癌细胞发现,干扰BRCA2基因表达后,PBMC对肺癌细胞的杀伤力比未干扰组更强。这与降低BRCA2基因表达提高化疗药物对癌细胞的杀伤力原理相同。随后发现DNA损伤修复关键基因如RAD51、ATM、RAD50及MRE11等表达也降低。ATM/RAD51介导的ATM信号是DNA损伤修复的重要信号通路,在细胞生存、凋亡等过程中发挥关键作用[19]。而本研究数据提示敲减BRCA2基因导致肺癌细胞中DNA损伤修复系统受损,无法有效修复受损DNA,进而诱导细胞凋亡。本研究发现在肺癌中干预BRCA2基因与免疫细胞的联合抑瘤作用,有望减轻临床上肿瘤细胞对免疫治疗的耐受性,从而提高免疫疗效。然而,本研究的不足之处在于缺乏动物体内数据。此外,BRCA2基因具体如何调控ATM/RAD信号,影响DNA损伤修复机制也需要更深层次的探究。

