补体C1s对食管鳞状细胞癌生物学行为的影响
任玲 陈昱伶 徐凤敏 蒙春梅 李倩倩 胡为民 (川北医学院基础医学与法医学院,南充 637100)
食管癌(esophageal carcinoma,EC)是最常见的恶性肿瘤之一,其发病率和病死率分别位居恶性肿瘤的第7位和第6位[1]。EC可分为两种常见的病理类型,即食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC)。我国EC的发病率在恶性肿瘤中居第3位,且绝大多数病例(>90%)为ESCC[2]。尽管多年来人们针对ESCC的防治做了大量工作,但其发病率和病死率仍居高不下[3]。因此,还需要更多的研究去探索ESCC进展的分子机制,以及确定新的关键生物标志物和潜在的治疗靶点。
早期研究表明补体的激活可能有助于裂解肿瘤细胞[4]。然而,近些年越来越多的证据表明补体不仅不能抑制肿瘤,反而会促进肿瘤的发展。肿瘤细胞产生的一些补体成分,如C1q、C3、C5a、补体因子B和因子Ⅰ等被报道具有促肿瘤作用[5-7]。本课题组前期研究发现,1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)/1型1-磷酸鞘氨醇受体(sphingosine 1-phosphate receptor 1,S1PR1)信号通路与ESCC的发生发展密切相关[8]。通过有参转录组高通量测序发现过表达S1PR1可上调ESCC细胞Eca-109C1S mRNA表达[9]。本研究将进一步探究C1s对ESCC细胞增殖、迁移、细胞-基质黏附以及裸鼠移植瘤生长的影响,为ESCC发生发展机制和治疗研究提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雌性BALB/c裸鼠(4~6周龄,体质量14~16 g)28只,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010,于川北医学院实验动物中心SPF级环境下饲养,自由进食、饮水。动物实验设施许可证号:SYXK(川)2018-076。动物处理方法符合中华人民共和国科技部《关于善待实验动物的指导性意见》。实验经川北医学院伦理委员会批准(伦理审批号:NSMC202181)。
1.1.2 主要试剂 ESCC细胞TE-1、Eca-109和KYSE-150均购自中国科学院细胞库;胰蛋白酶、RPMI-1640培养液购自Gibco公司;青霉素和链霉素购自HyClone公司;胎牛血清(fatal bovine serum,FBS)购自四季青公司;无脂肪酸牛血清白蛋白(fatty acid-free bovine serum albumin,FAF-BSA)购自Sigma公司;LipofectamineTM2000转染试剂购自Invitrogen公司;总RNA提取试剂盒购自Promega公司。逆转录试剂盒、定量PCR试剂盒购自TaKaRa Bio公司;ELISA试剂盒购自武汉菲恩公司;C1s抗体购自Abcam公司;MMP1和MMP13抗体购自Proteintech公司;β-actin抗体和CCK-8检测试剂盒购自碧云天公司;CD34抗体购自ServiceBio公司;引物由Sangon Biotech公司合成;特异性小干扰RNA(small interfering RNA,siRNA)由吉玛公司合成;短发夹RNA(short hairpin RNA,shRNA)质粒的构建、C1s过表达慢病毒及阴性对照慢病毒载体的构建和病毒包装由吉凯基因公司完成;筛选药物G418、嘌呤霉素和纤连蛋白均购自Solarbio公司。
1.2 方法
1.2.1 细胞培养 所有细胞均采用含10%FBS、100 U/ml青霉素和100 μg/ml链霉素的RPMI1640培养液,于37 ℃、5%CO2孵箱中进行常规培养。
1.2.2 siRNA/shRNA的转染和慢病毒感染 根据LipofectamineTM2000转染试剂说明书将C1s siRNA和NC siRNA转染ESCC细胞。C1s siRNA1正向序列:5'-GGUAGAGUUUGAUCAUAGAdTdT-3',反向序列:5'-UCUAUGAUCAAACUCUACCUC-3';C1s siRNA2正向序列:5'-GAUCCGAUGCAGAUAUUAAdTdT-3',反向序列:5'-UUAAUAUCUGCAUCGGAUCCU-3';NC siRNA正向序列:5'-UUCUCCGAACGUGUCACGUdTdT-3',反向序列:5'-ACGUGACACGUUCGGAGAAdTdT-3'。使用LipofectamineTM2000将C1s shRNA和NC shRNA分别转染TE-1细胞,用G418筛选稳定株细胞。C1s shRNA靶序列:5'-GCAAGTCCCAATTATCCCAAA-3';NC shRNA靶序列:5'-TTCTCCGAACGTGTCACGT-3'。根据慢病毒使用手册进行Eca-109细胞慢病毒感染,并用嘌呤霉素筛选稳定株细胞。本次所用的慢病毒包括C1s过表达慢病毒(C1s OE)以及对照慢病毒(Control)。RT-qPCR和Western blot验证C1s敲低和过表达的效率。
1.2.3 细胞生物信息学分析 利用NCBI-GEO数据库分析ESCC组织与癌旁正常组织(adjacent normal tissues,ANTs)中补体的表达,并比较ESCC组织与ANTs中C1S mRNA的表达差异。本次所用数据来自NCBI-GEO数据库的GSE20347[10]。
1.2.4 RT-qPCR检测C1S和HPRT mRNA水平按照说明书抽提细胞总RNA,并使用逆转录试剂合成cDNA。以合成的cDNA为模板进行qPCR反应,检测C1S和HPRT mRNA水平。使用2-ΔΔCt方法对数据进行分析。C1s正向引物:5'-CTCCTGAGCATGTGTTTA-3',反向引物:5'-CAGTGCAATGTCATTATCAA-3';HPRT正向引物:5'-TGAGGATTTGGAAAGGGTGT-3',反向引物:5'-GAGCACACAGAGGGCTACAA-3'。
1.2.5 Western blot分析 使用含有蛋白酶抑制剂的RIPA裂解液提取细胞总蛋白质并检测蛋白浓度。用蛋白上样缓冲液变性蛋白质后,使用8%SDS-PAGE分离蛋白质,然后将分离的蛋白质转移至PVDF膜。采用5%BSA-TBST室温封闭2 h,加入稀释后的一抗∶C1s(1∶1 500)、MMP1(1∶1 000)、MMP13(1∶500)和β-actin(1∶2 000),4 ℃孵育过夜。TBST漂洗后与辣根过氧化物酶标记的山羊抗兔IgG(H+L)抗体(1∶1 000)于室温孵育70 min。TBST漂洗后滴加适量ECL反应工作液,用化学发光凝胶成像仪进行显影成像。
1.2.6 ELISA检测细胞培养上清中C1s表达 将ESCC细胞接种于12孔板,12 h后,更换含有0.1%FAF-BSA的新鲜RPMI1640培养液。48 h后。收集细胞培养上清液并计数细胞。按照ELISA试剂盒说明书进行操作,检测OD450值。结合标准曲线和细胞数计算每1×105个细胞产生的细胞外C1s平均水平,并进行统计学分析。
1.2.7 CCK-8法检测细胞的增殖能力 将5×103个/孔ESCC细胞接种于96孔板。根据LipofectamineTM2000转染试剂说明书分别进行C1s siRNA和NC siRNA转染。在转染后第0、1、2、3天,每孔加入10 μl CCK-8试剂,37 ℃孵育2 h,检测OD450值。稳定细胞株的增殖实验除了没有转染步骤,其余步骤同上。
1.2.8 细胞划痕实验检测细胞的迁移能力 将ESCC细胞接种于12孔板,24 h后其汇合度达到90%左右时,使用200 μl枪头进行划痕。更换含0.1%FAF-BSA的RPMI1640培养液并使用倒置显微镜进行0 h拍照。根据LipofectamineTM2000转染试剂说明书分别进行C1s siRNA和NC siRNA转染。在转染后的48 h(TE-1)或72 h(Eca-109)拍照并计算细胞迁移率。稳定细胞株的细胞划痕实验除了没有转染步骤,其余步骤同上。
1.2.9 细胞-基质黏附的检测 向96孔板加入10 μg/ml纤连蛋白于4 ℃包被过夜。PBS洗涤后,用1%BSA在37 ℃下封闭1 h。用RPMI1640培养液将ESCC细胞重悬,并以2×104个/孔接种于96孔板中,37 ℃孵育2 h。PBS洗涤后,采用0.1%结晶紫染色贴壁细胞30 min。去除多余的染料,采用100 μl 10%乙酸溶解细胞内染料,检测OD595nm值。
1.2.10 裸鼠皮下成瘤实验 将28只雌性BALB/c裸鼠随机分为4组:TE-1-C1s shRNA组、TE-1-NC shRNA组、Eca-109-C1s OE组和Eca-109 Control组。将TE-1-C1s shRNA/TE-1-NC shRNA 细胞(3×106个/100 μl PBS),或 Eca-109-C1s OE/Eca-109-Control细胞(2×106个/100 μl PBS)进行裸鼠右腋下皮下注射。每3 d测量1次肿瘤的最长直径(a)和最短直径(b),并计算肿瘤体积:V=0.5×a×b2。实验结束后,剥离肿瘤组织,测量肿瘤体积和重量并进行拍照。肿瘤组织进行苏木精-伊红(hematoxylin-eosin,HE)染色和CD34的免疫组织化学(immunohistochemistry,IHC)染色,以肿瘤血管内皮细胞膜呈现棕黄色为阳性,在显微镜下计数CD34阳性微血管评估每个肿瘤组织的微血管密度。
1.3 统计学处理 采用SPSS23.0统计学软件进行数据分析。数据用表示。所有实验重复3次。采用两样本t检验进行两组数据间的比较,而多组数据间的比较则采用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 C1s在人ESCC组织中的表达 利用来自GEO-GSE20347的数据绘制热图以此描绘ESCC组织和ANTs组织中补体成分的表达情况(图1A)。结果显示相对高表达的补体分子主要集中参与早期补体途径的分子中,尤其是C3和经典途径成分(C1QA、C1QB、C1R、C1S、C4A和C2),而末端通路成分C8A、C8B和C9的表达量相对较低。此外,ESCC组织中C1S mRNA的表达明显高于ANTs(P<0.001,图1B)。
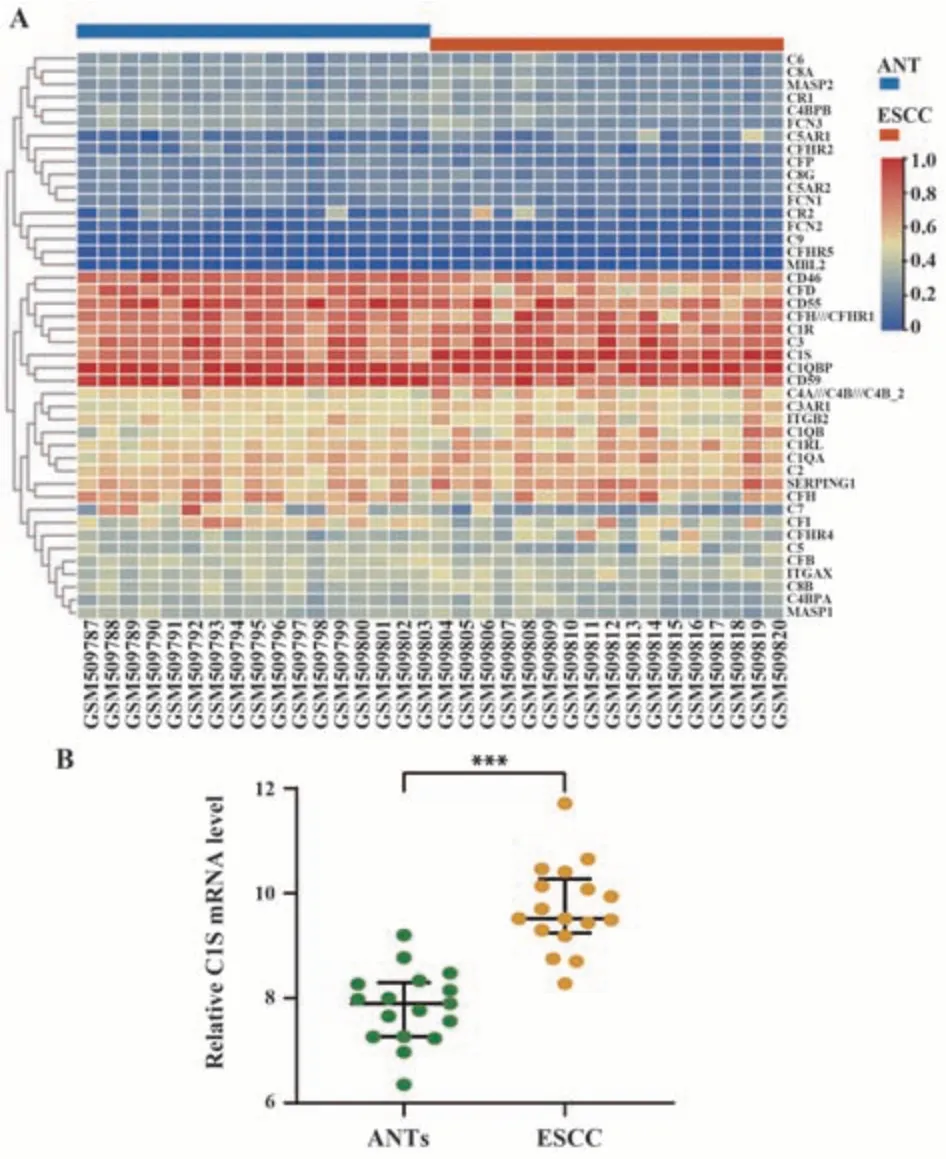
图1 C1s在人ESCC组织中的表达Fig.1 C1s expression in human ESCC tissues
2.2 C1s在人ESCC细胞系中的表达 RT-qPCR和Western blot结果显示C1s在3种ESCC细胞系中均有表达,且在TE-1细胞中表达最高(图2A~2C)。但包括C1s过表达细胞在内的所有细胞培养上清液中C1s的表达水平都很低(图2D~2F)。
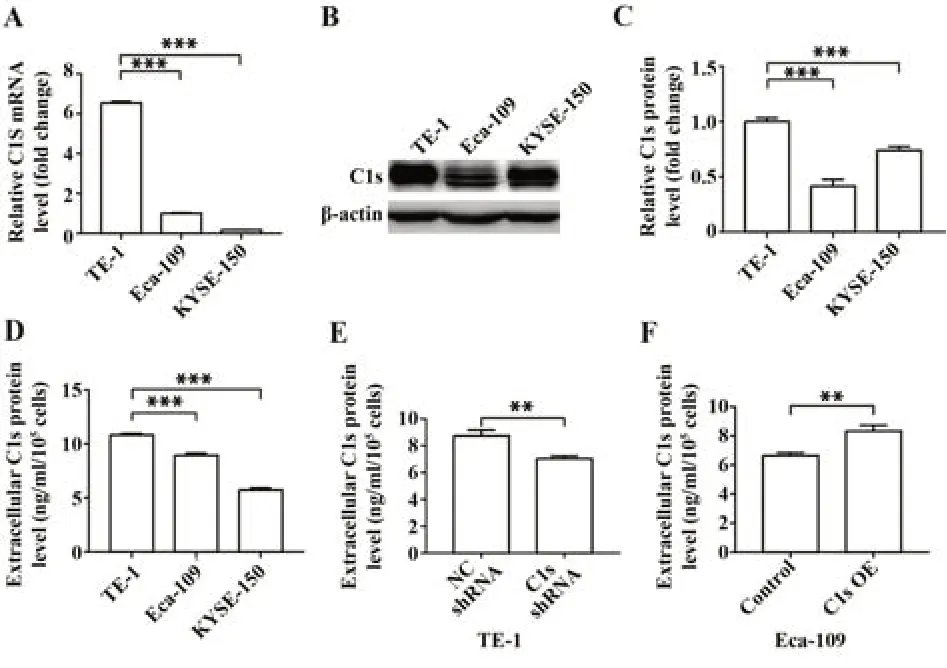
图2 C1s在人ESCC细胞系中的表达Fig.2 C1s expression in human ESCC cell lines
2.3 敲低或过表达C1s的效率验证 TE-1和Eca-109细胞转染C1s siRNA后,C1s表达均明显降低(图3A、3B)。在C1s敲低的TE-1稳定细胞株中,C1s表达明显降低(图3C)。在C1s过表达的Eca-109稳定细胞株中,C1s表达明显增加(图3D)。

图3 敲低或过表达C1s的效率验证Fig.3 Efficiency validation of knockdown or overexpression of C1s
2.4 C1s对ESCC细胞增殖的影响 CCK-8实验结果显示,与对照组相比,TE-1和Eca-109细胞转染C1s siRNA后细胞增殖均受到抑制(P<0.05,图4A、4B),C1s敲低的TE-1稳定细胞株增殖能力也明显下降(P<0.01,图4C),而C1s过表达的Eca-109细胞株增殖能力增强(P<0.05,图4D)。结果表明C1s促进ESCC细胞增殖。
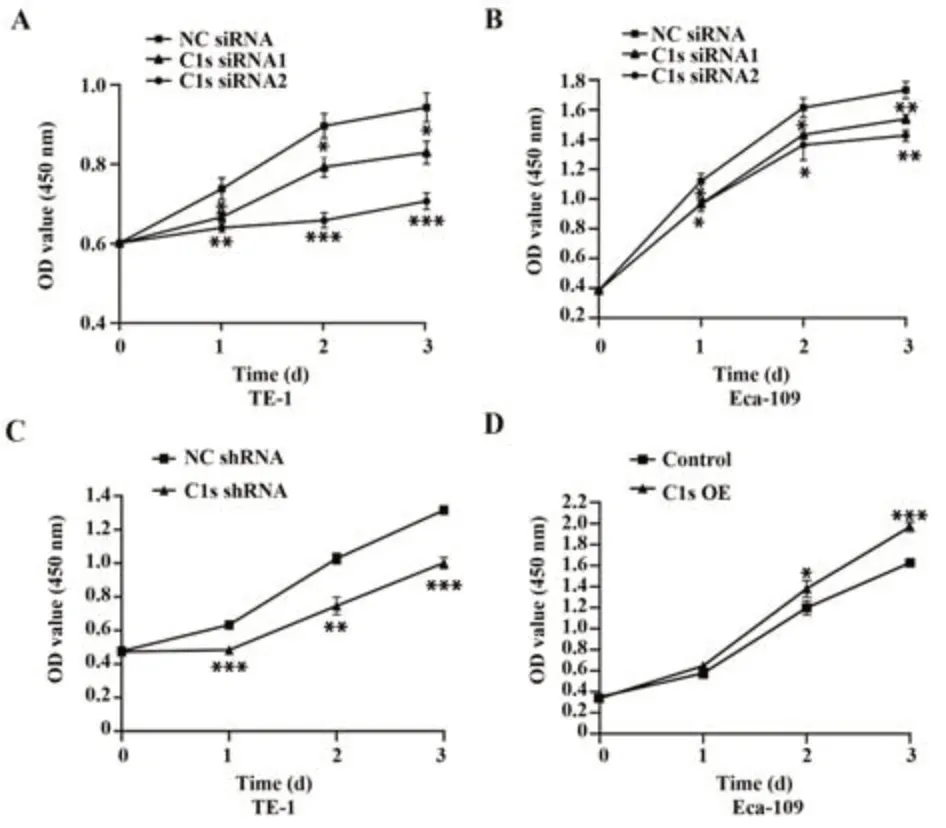
图4 C1s对ESCC细胞增殖的影响Fig.4 Effects of C1s on proliferation of ESCC cells
2.5 C1s对ESCC细胞迁移的影响 细胞划痕实验结果显示,与对照组相比,TE-1和Eca-109细胞转染C1s siRNA后细胞迁移率明显降低(P均<0.001,图5A、5B),C1s敲低的TE-1稳定细胞株迁移率也明显降低(P<0.001,图5C),而C1s过表达的Eca-109细胞株迁移率升高(P<0.001,图5D)。结果表明C1s促进ESCC细胞的迁移。

图5 C1s对ESCC细胞迁移的影响Fig.5 Effects of C1s on migration of ESCC cells
2.6 C1s对ESCC细胞-基质黏附的影响 细胞-基质黏附实验结果显示,与对照组相比,C1s敲低的TE-1稳定细胞株细胞-基质黏附受到明显抑制(P<0.001,图6A),而C1s过表达的Eca-109细胞株细胞-基质黏附明显增强(P<0.001,图6B)。结果表明C1s增强ESCC细胞-基质黏附。
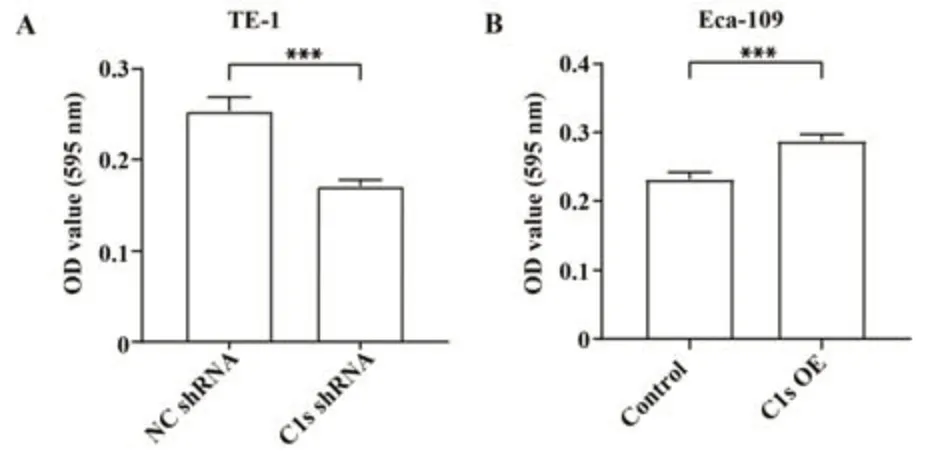
图6 C1s对ESCC细胞-基质黏附的影响Fig.6 Effects of C1s on cell-matrix adhesion of ESCC cells
2.7 C1s敲低或过表达后ESCC细胞中MMP1和MMP13的改变 在C1s敲低的TE-1细胞中检测到MMP1和MMP13的蛋白水平降低(图7A、7B)。在C1s过表达的Eca-109细胞中MMP1和MMP13的蛋白水平无明显变化(图7C、7D)。
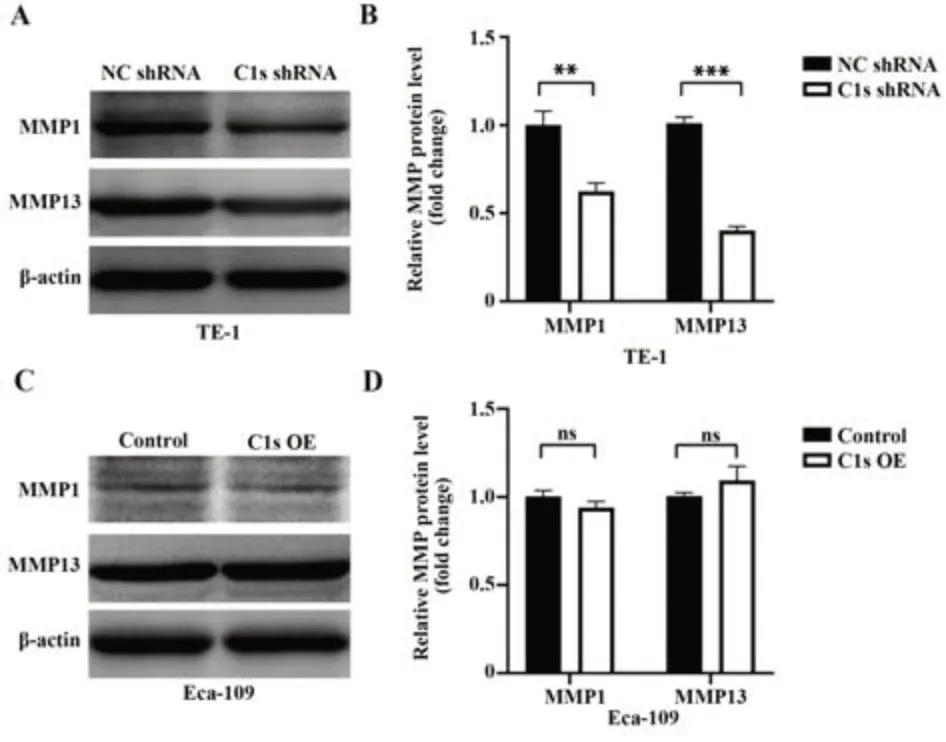
图7 C1s敲低或过表达后ESCC细胞中MMP1和MMP13的改变Fig.7 Alterations of MMP1 and MMP13 in ESCC cells after C1s knockdown or overexpression
2.8 敲低C1s对TE-1细胞在裸鼠皮下生长的影响 裸鼠皮下成瘤实验结果显示,C1s敲低组的肿瘤形成率为57%,明显小于对照组(100%,图8A、8B)。C1s敲低组的肿瘤体积小于对照组(P<0.05,图8C、8D),但两组肿瘤重量差异无统计学意义(P>0.05,图8E)。结果表明敲低C1s可抑制TE-1细胞在裸鼠皮下的肿瘤形成率。

图8 敲低C1s对TE-1细胞在裸鼠皮下生长的影响Fig.8 Effects of knockdown of C1s on growth of TE-1 cells subcutaneously in nude mice
2.9 过表达C1s对Eca-109细胞在裸鼠皮下生长的影响 C1s过表达组和对照组的肿瘤形成率均为100%。在对照组的7个肿瘤中有4个发生坏死,而在C1s过表达组中并未出现此现象(图9A、9B)。C1s过表达组的肿瘤体积明显大于对照组(P<0.001,图9C、9D)。C1s过表达组的肿瘤重量为(1.260 0±0.179 6) g,明显大于对照组的肿瘤重量(0.723 1±0.276 8) g(P<0.01,图9E)。此外,在C1s过表达组的肿瘤中CD34阳性血管的密度明显高于对照组(图9F、9G)。结果表明过表达C1s明显促进Eca-109细胞在裸鼠皮下的生长。
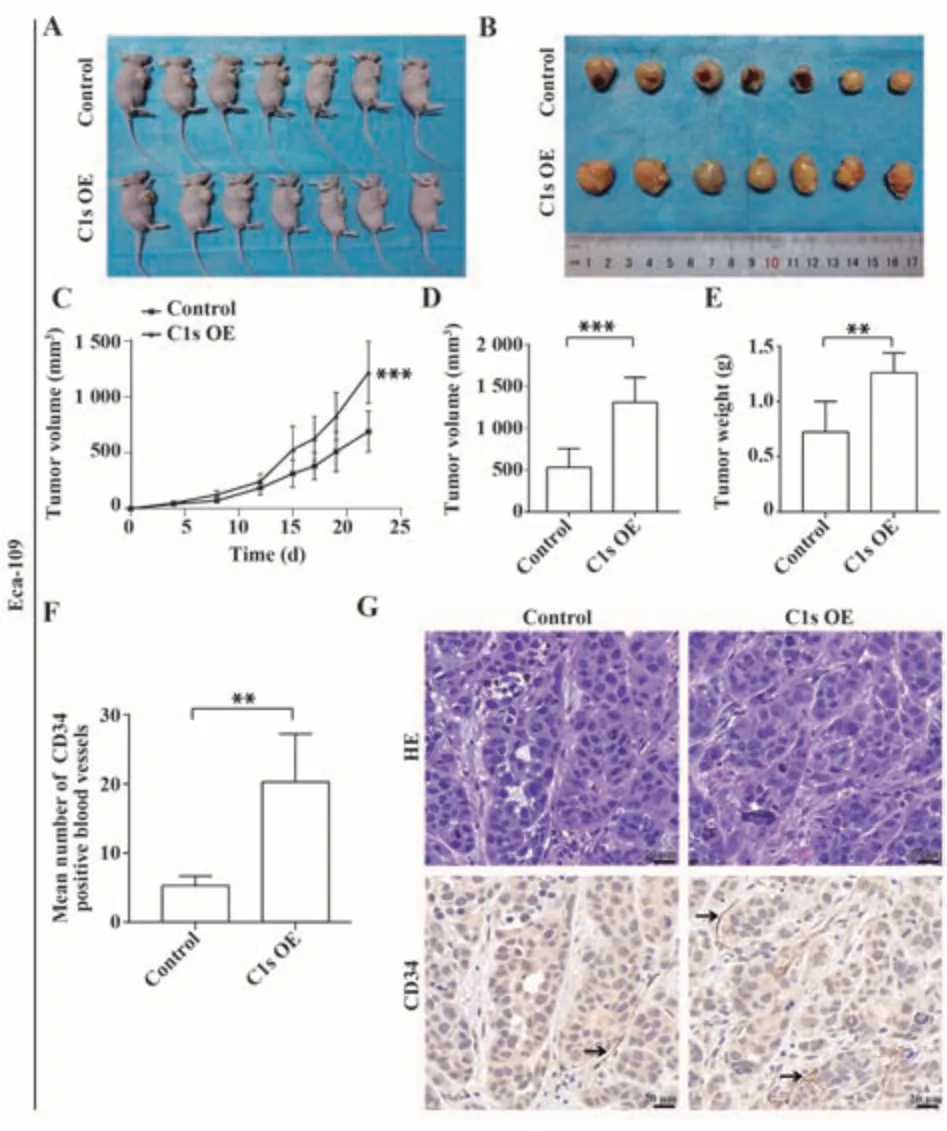
图9 过表达C1s对Eca-109细胞在裸鼠皮下生长的影响Fig.9 Effects of overexpression of C1s on growth of Eca-109 cells subcutaneously in nude mice
3 讨论
在肿瘤组织中有许多细胞可以产生补体,包括免疫细胞、内皮细胞以及恶性肿瘤细胞[4,11-13]。在大多数情况下,肿瘤细胞产生的补体主要为C1s、C1r、C2、C3和C4等,称为补体富集现象[14]。在ESCC中也存在补体富集现象。本研究发现在ESCC组织样本中,参与早期补体激活通路的补体分子(C1QA、C1QB、C1R、C1S、C4A和C2)表达水平较高,而参与终末通路的补体分子(C8A、C8B和C9)表达水平却相对较低。这说明终末通路的补体分子不太可能参与ESCC的生物学过程。
C1(C1qC1r2C1s2)复合物是补体经典激活途径的核心分子,C1s是C1复合物的重要组成。C1s酶原是由688个氨基酸组成的单链多肽。活化后的C1s则转变为由α链和β链组成、二硫键连接的双链结构,且这两个片段的分子量之和近似于C1s酶原的分子量,因此C1s的活化不存在大的肽丢失[15]。C1s是一种丝氨酸蛋白酶,与其他补体蛋白酶一样,C1s具有底物特异性并与补体系统的其他成分具有特定的相互作用。除了裂解C4和C2,C1s还可降解细胞外基质成分,如MHCⅠ类分子、1型明胶和2型胶原蛋白、核心蛋白聚糖和胰岛素样生长因子结合蛋白5[14,16]。因此,C1s还可参与多种其他生理病理反应,如炎症和肾纤维化[17]。本研究对GEO数据库中ESCC微阵列表达谱数据进行了分析,结果显示ESCC组织中检测到C1S mRNA表达,且表达量明显高于ANTs。C1s可能在ESCC的发生发展中发挥作用。
本课题组通过细胞功能实验和裸鼠皮下成瘤实验证实C1s可以有效促进ESCC细胞的增殖、迁移和细胞-基质黏附,且C1s在ESCC细胞外表达水平很低。C1s在ESCC中可能发挥着一种促肿瘤且独立于补体级联反应的非典型功能,该功能可能仅限于在细胞内发挥作用,而与细胞外的C1s无关。在其他一些癌症中也有报道过C1s的非典型功能,如皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)和透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)[14,18]。在ccRCC中沉默C1s可抑制细胞增殖,但在上清液中添加纯化的C1s酶原或酶时,却不能对其增殖活力产生影响[14]。这些报道与本次实验结果共同说明C1s在肿瘤细胞内的非典型功能可能与胞外C1s的水平无关。此外,与C1s过表达组相比,对照组出现多个移植瘤的坏死,且移植瘤中CD34阳性微血管的密度明显更低。C1s可能与ESCC肿瘤微血管形成有关。有研究表明,在cSCC细胞中敲除C1s后,肿瘤微血管形成就受到抑制[18]。由于细胞外检测到的C1s浓度很低,故C1s可能不直接参与肿瘤微血管形成,而是通过上调其他促血管生成因子的表达参与肿瘤微血管形成。
最近有研究报道,敲除C1r可抑制基质金属蛋白酶MMP1和MMP13表达,并抑制cSCC细胞的侵袭[19]。C1r可激活C1s,并且它们之间存在复杂且相互依存的关系。因此,C1s也可能与MMP1和MMP13具有相关性。MMP1和MMP13在ESCC中起促肿瘤进展作用[20-21]。本次结果表明,敲低C1s可抑制TE-1细胞中MMP1和MMP13表达,这表明C1s在TE-1细胞中的生物学功能可能涉及MMP1和MMP13。在C1s过表达的Eca-109细胞中MMP1和MMP13蛋白水平无明显改变,可能由于细胞系的不同,其下游途径有所差异。此外,有研究道,在cSCC细胞中敲低C1s后,PI3K和ERK1/2信号通路活性受到抑制[18]。在ESCC中PI3K和ERK1/2信号通路也与MMP密切相关,MMP1可通过激活PI3K途径促进ESCC细胞的增殖、侵袭和转移[20];MMP13受ERK1/2水平的调节,从而促进ESCC细胞的迁移和侵袭[22]。另外,在口腔鳞癌细胞中ERK1/2-MMP1轴也与细胞迁移和侵袭密切相关[23]。PI3K和ERK1/2通过调节其下游靶标影响细胞的存活、增殖、分化和转移,并与癌症的发生紧密相关[24-25]。C1s在ESCC中促肿瘤效应的下游机制可能涉及对PI3K和ERK1/2信号通路以及MMP表达的调节。
综上所述,补体C1s在ESCC组织中高表达,并可促进ESCC细胞的增殖、迁移和细胞-基质黏附,从而在ESCC进展中起促进作用。C1s参与肿瘤的生长和转移的具体机制有待进一步研究。

