HPV L1保守序列多肽抗血清降解HPV6感染能力的测试
邓金芳 李志英 薛冰 肖长义 (.三峡大学附属仁和医院妇产科,三峡大学妇科肿瘤研究所,宜昌 443000; .三峡大学基础医学院组织学与胚胎学教研室,宜昌 443000)
基于生物信息学技术在人乳头瘤病毒L1 C-末端筛选出一段高度保守稳定的30个氨基酸残基长度的序列,以此序列合成的多肽可诱导出针对不同型别HPV L1的抗体。经多种方法测试,证明该序列多肽诱导的抗体对组织标本内的HPV L1具有良好的检测性[1-3]。为明确该抗体对HPV L1是否具有降解作用,以及该段多肽作为免疫原是否具有开发为广谱HPV疫苗的潜在价值,而进行了本项研究。
1 资料与方法
1.1 资料
1.1.1 临床样本 收集来自三峡大学附属仁和医院妇产科门诊和皮肤性病科门诊的活检标本,所有标本均经病理诊断确诊。所取标本均先做病理诊断,剩余标本用于研究。用于研究的标本尽快进行分型鉴定,鉴定为HPV6型阳性的标本进一步做病毒提取。若不能立即处理,则置于-80 ℃冰箱保存。本研究经三峡大学附属仁和医院医学伦理委员会批准(2021k110)。
1.1.2 细胞来源 人永生化角质形成细胞购自中国典型培养物保藏中心(武汉大学),为HPV阴性的永生化角质形成细胞。
1.1.3 主要试剂 2×Taq Master Mix(Promega公司);DNA marker(上海捷瑞生物有限公司);引物由上海生工合成。
1.2 方法
1.2.1 病毒提取 参考文献[4-5],简述如下:采用无菌PBS溶液洗净1~1.5 g尖锐湿疣组织的血污,无菌眼用手术剪修剪标本,尽可能剔除皮下及真皮组织,并充分剪碎组织。将提取缓冲液(0.02 mol/L Tris,1 mol/L NaCl, pH=7.4)加入切碎的组织,并转入玻璃匀浆器内,匀浆器置于冰浴中充分匀浆。将上层液体转入1.5 ml EP管中,28 000 r/min、4 ℃离心12 min,收集上清置于冰上,将提取缓冲液中加入沉淀中,重复操作4次。收集4次操作上清并混合,0.22 μm微孔滤膜过滤除菌。留100 μl滤液行PCR分型,剩余悬液于0.5 ml EP管分装后置于-80 ℃冰箱封存以待下次使用。
1.2.2 病毒型别鉴定 引物及扩增参考文献[5-7],通过primer 5.0引物设计以及DNAMAN基因分析两款软件,参照已有的HPV6序列,筛选出评分高、片段小的引物。正向引物(4671-4690)TAGTGGGCCTATGGCTCGTC;反向引物(4950-4931)TCCATTAGCCTCCACGGGTG,目的条带:280 bp。PCR反应体系:2×Taq Master Mix 12.5 μl、HPV6和11型引物(10 μmol/L) 0.5 μl、提取的病毒悬液 1.5 μl,去离子水加至25 μl。PCR反应要求:94 ℃预变性5 min;40个循环:94 ℃变性 90 s,55 ℃退火1 min,72 ℃延伸90 s;最后72 ℃延伸5 min。1.5%琼脂糖凝胶电泳扩增产物,并于凝胶成像系统中拍照记录。
1.2.3 HPV6病毒对人永生化角质形成细胞感染效果的检测 从HPV6病毒感染的人永生化角质形成细胞中提取DNA,发现病毒感染后的细胞在280 bp处显示出明显条带,而在280 bp处没有显示出条带的则确定为未被病毒感染的细胞。
1.2.4 多抗血清降解病毒感染能力测试 参考文献[8-9],简述如下:人永生化角质形成细胞用含10%胎牛血清的DMEM培养基培养,当瓶底剩余空间为10%~20%,即细胞基本铺满瓶底时,将提取的HPV6病毒及经多抗血清中和后的病毒加入培养瓶中。病毒需与多抗血清做如下梯度稀释中和处理后加入,将病毒悬液与1∶10、1∶30、1∶90、1∶270、1∶810稀释的等量多抗血清混合,37 ℃下中和1 h。培养细胞在加入病毒后,继续37 ℃孵育,于1 h内,每隔15 min摇板1次,然后培养过夜。严格于感染培养后的24 h时,使用PBS充分洗涤3次,收集细胞。部分细胞提取DNA,做HPV6 DNA测定,测定方法同前;部分细胞提取蛋白,做HPV6 L1蛋白的ELISA检测。
1.2.5 细胞吸收病毒后L1蛋白的ELISA检测 待检样品用pH=9.6碳酸盐缓冲液稀释至蛋白含量为10 μg/ml,96孔板每孔添加100 μl,4 ℃培养12 h;将孔内溶液丢弃至废液缸,磷酸盐缓冲液洗板3次,每次3 min;加入封闭液,室温封闭1 h,缓冲液洗;加1∶500的L1多肽抗血清,37 ℃孵育1 h,缓冲液洗;加入1∶1 000稀释的过氧化物酶标记的山羊抗兔IgG,37 ℃培养1 h,缓冲液洗;DAB显色,调整酶标仪读取各孔490 nm处的光密度(OD)值。重复实验3次取平均值。以没有接触病毒的人永生化角质形成细胞做阴性对照。所得OD值用SPSS10.0软件处理。
1.3 统计学分析 采用SPSS10.0软件进行分析,多组间数据比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 标本收集及分型鉴定 共收集到符合要求的经临床及病理确诊的生殖器尖锐湿疣标本26例。分型鉴定结果表明,凡于280 bp处出现阳性条带的即鉴定为HPV6阳性,共鉴定出HPV6型20例,其他型别6例(图1)。
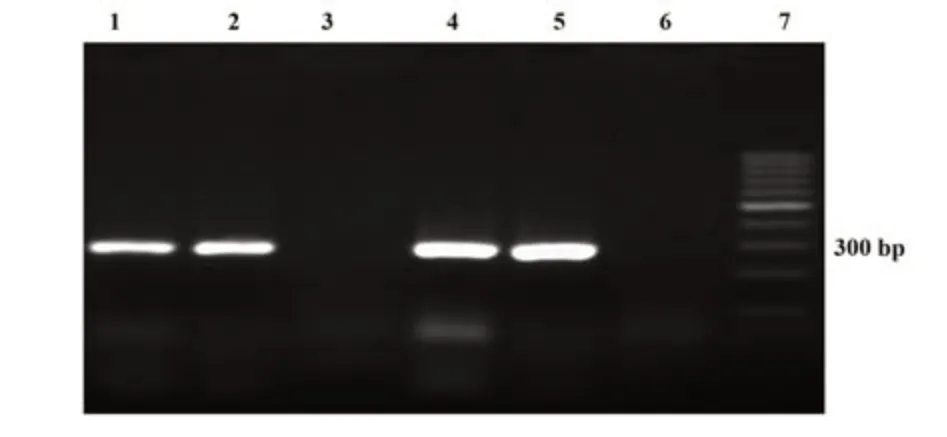
图1 临床标本HPV型别鉴定PCR电泳图Fig.1 PCR electrophoresis map for identification of HPV type in clinical specimens
2.2 HPV6病毒对人永生化角质形成细胞感染效果的检测 从HPV6病毒感染的人永生化角质形成细胞中提取DNA,结果发现病毒感染后的细胞在280 bp处显示出明显条带,而未被病毒感染的细胞在280 bp处未显示出条带,说明提取的HPV6病毒具有感染人永生化角质形成细胞的能力(图2)。
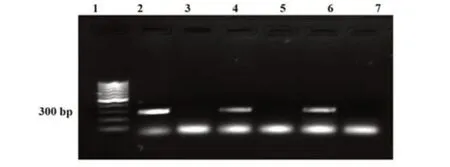
图2 HPV6感染人永生化角质形成细胞的病毒DNA检测PCR扩增图Fig.2 PCR amplification plot of viral DNA detection in HPV6-infected human immortalized keratinocytes
2.3 多抗血清降解病毒感染能力的测试 HPV病毒感染后,其PCR产物经电泳,在280 bp处有明显阳性条带(图3),随着抗体浓度增加阳性条带逐渐变暗。对PCR电泳图进行光密度值检测和统计学分析,与阴性对照组相比,结果均有统计学意义(P<0.05)。光密度值与抗体浓度之间呈显著负相关(r=-0.935 5,图4)。
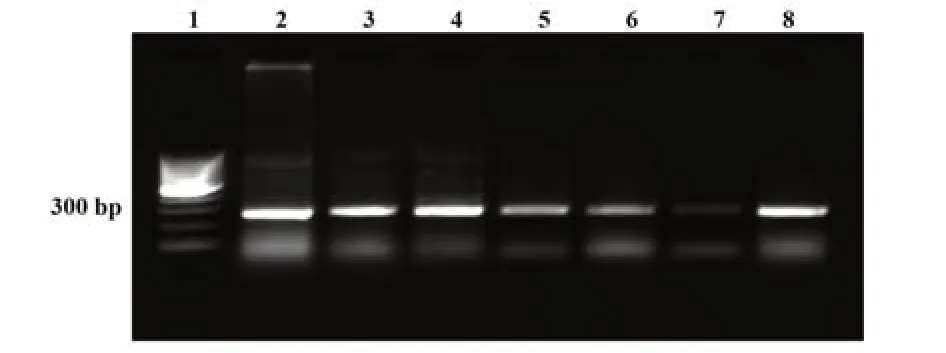
图3 中和后PCR电泳图Fig.3 Neutralized PCR electrophoresis
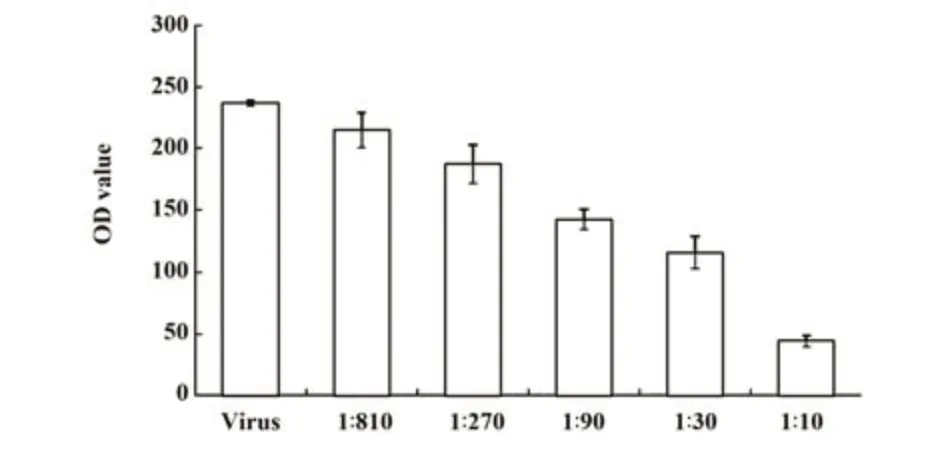
图4 倍比稀释抗血清分别与阳性对照光密度值比较Fig.4 Fold ratio diluted antiserum compared with positive control photodensity values
2.4 细胞吸收病毒后L1蛋白的ELISA检测 随着抗体稀释滴度增加,L1蛋白检出量呈上升趋势,病毒吸附于培养细胞的量显著增加。说明随着抗体稀释度增加,其对病毒的中和能力随之下降,抗血清浓度与L1蛋白含量之间呈负相关(r=-0.880 5)。见图5。
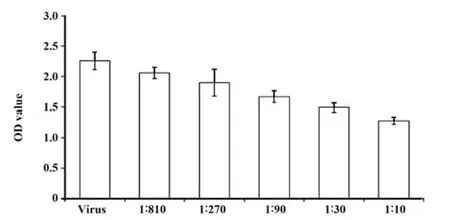
图5 被抗体中和后病毒感染的细胞内HPV6 L1蛋白的ELISA检测结果Fig.5 Results of ELISA detection of intracellular HPV6 L1 protein infected by postviruses neutralized by antibodies
3 讨论
已知HPV形成的体液免疫具有很强的型间限制,不同型别的HPV诱导形成的抗体很少具有型别间的交叉反应能力,这也是目前HPV感染预防采用多价疫苗的原因[10-12]。本项目组前期研究发现,以HPV主要外壳蛋白(L1)C-末端的一段保守序列合成的多肽,其诱发动物形成的抗体具有多价反应能力。但该多价抗体是否具有降解作用尚不知晓。因此,本实验测试多肽抗血清能否阻止HPV6病毒颗粒对人永生化角质形成细胞的吸附,明确此多价抗血清能否降解HPV6病毒。有研究表明人乳头瘤病毒能够体外感染单层培养的人永生化角质形成细胞[4,8],因此本研究选择此细胞辅助完成实验。
检验受染细胞中人乳头瘤病毒DNA的存在是判断人乳头瘤病毒感染成功最便捷的方法[4,7-8]。本研究以提取的HPV6病毒感染人永生化角质形成细胞,若PCR方法可以测试到细胞内含有HPV6 DNA,说明HPV6病毒能在体外培养情况下感染人永生化角质形成细胞,证明实验具有可行性。将抗血清按不同梯度浓度稀释,中和病毒,使用处理后的病毒再次接触人永生化角质形成细胞,再用PCR检测受染细胞内病毒DNA含量,可反映抗血清是否能够阻止HPV6吸附人永生化角质形成细胞。结果显示,随着免疫血清浓度的逐渐升高,HPV6 DNA条带的光密度值度逐渐降低,即受染细胞吸附病毒DNA的量逐渐减少。与阴性血清对照相比,差异有统计学意义。与此同时,采用ELISA法检测上述受中和病毒吸附于人永生化角质形成细胞的病毒L1蛋白量,亦证明抗血清浓度与L1蛋白含量间存在相反趋势,该相反趋势也有明显统计学意义。两种检测实验均显示此种序列抗血清能一定程度上阻止HPV6病毒颗粒结合在人永生化角质形成细胞上,从而在一定程度上降解HPV6病毒的感染能力。
虽然本研究利用体外培养细胞的吸附抑制模型[7],从两个层面证明多肽抗血清对HPV6的感染能力具有一定的降解作用,但该降解作用似乎并不完整,尚未达到完全降解的效果。此外,本实验因无法精准显示病毒感染细胞及向胞内移动的情况,这些不足仍需采取更准确有效的实验方法去研究处理。

