上消化道早期癌患者ESD术后迟发性出血发生的危险因素及预防性策略
郭智强
莆田涵江医院,福建省莆田市 351111
受不良饮食习惯、不良生活方式、周围环境理化因素影响,近些年来消化道恶性肿瘤高发,上消化道肿瘤组织病变多局限于黏膜及黏膜下层,患者多无明显症状,可存在嗳气、恶心、呕吐、上腹不适等症状,但特异性不显著,窄带成像放大内镜联合超声内镜探测病变浸润深度与病理检测一致性比单独使用超声内镜高,对提高疾病早期确诊率有很大帮助[1]。随着医学技术的发展及进步,内镜黏膜下剥离术(Endoscopic submucosal dissection,ESD)是治疗此类患者的主要方式,该手术可有效切除相关病灶,同时通过术中病理切片,可为后续诊疗提供依据,且该术式属于内镜微创手术,患者病灶切除率高,术后住院时间短,受到了消化内科医师及患者的青睐[2]。但此类手术若操作不当,加之围术期未采取针对干预措施,患者ESD术后可出现迟发性出血(Delayed postpolypectomy bleeding,DPPB),部分患者因出血速度快、出血量大,若不及时予以有效干预,可危及患者身心健康[3-4]。鉴于此,本研究选取我院消化内科行ESD术上消化道早期癌患者120例,探讨患者ESD术后DPPB发生的危险因素,进而提出预防性干预策略,报道如下。
1 资料与方法
1.1 病例资料 选取2020年4月—2023年1月我院消化内科行ESD术上的消化道早期癌患者120例,依据术后有无DPPB发生将患者分为发生DPPB组(29例)与未发生DPPB组(91例)。术后DPPB诊断标准:(1)伴呕血、黑便、头晕头痛等身体不适;(2)血红蛋白丢失超过20g/L;(3)血压下降超过2.66kPa或心率增加20次/min;(4)经内镜检查证实创面出血。若患者症状符合上述标准中的2项或以上,则可确诊为DPPB。本研究经医院理论委员会批准,且符合《赫尔辛基宣言》要求。
1.2 选择标准
1.2.1 纳入标准:(1)经影像学检查、腹部超声、肿瘤标记物、病理活检等检查结合患者病史,经科室会诊后确诊;(2)患者病灶无纤维化、无淋巴结转移;(3)经评估符合行ESD术标准,且均由内镜手术经验丰富、主治医师以上职称医生实施ESD术;(4)患者临床资料完整,对本研究知悉,且已签署同意书。
1.2.2 排除标准:(1)心、肝、脑、肾等重要脏器正常生理功能严重缺失;(2)癌细胞浸润至肌层或浆膜层者;(3)患有血液内科诊疗,凝血功能异常;(4)有精神科门诊就诊或入院史,认知或行为异常者;(5)全身重症感染者;(6)既往6个月内有腹部大手术史者;(7)对麻醉药物不耐受;(8)妊娠或哺乳期者。
1.3 资料收集及研究方法 120例上消化道早期癌患者均行ESD术治疗,术后随访30d,患者均无失访、脱落,依据随访结果及DPPB诊断标准,将发生DPPB的29例纳入迟发组,未发生DPPB的91例纳入非迟发组。经咨询我院预防医学、公共卫生学专家后,主要结合患者既往入院记录单、住院病案首页记录单信息内容,自行设计一般资料调查表,包括性别、年龄、病程、体质量指数在内的一般资料及内镜与病理检查指标,本着医学统计学“差异既相关”的原则,首先对两组患者ESD 术后DBPP发生的危险因素予以单因素分析,然后将差异具有统计学意义的自变量经变量赋值后,多因素Logistics回归分析EGC患者ESD术后发生DPPB的危险因素,基础上提出相应预防策略。

2 结果
2.1 上消化道早期癌患者ESD术后DBPP发生的单因素分析 患者ESD术后DBPP发生与年龄、性别、体质量指数、病程、糖尿病、内镜下病变形态无关联性(P>0.05),但与病灶位置、病变直径、术中明显出血情况、近30d使用氯吡格雷情况有关(P<0.05),见表1。
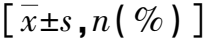
表1 上消化道早期癌患者ESD术后DBPP发生的单因素分析
2.2 多因素Logistics回归分析上消化道早期癌患者ESD术后发生DBPP的危险因素 以患者ESD术后是否发生DBPP为因变量(未发生=0,发生=1),将单因素差异具有统计学意义的因素作为自变量并进行赋值(赋值方法见表2),同时予以多因素Logistics回归分析,结果显示:病灶位置在胃窦、病变直径≥5cm、术中明显出血、近30d曾使用氯吡格雷是患者ESD术后DBPP发生的危险因素(P<0.05),见表3。

表2 自变量赋值方法

表3 上消化道早期癌患者ESD术后发生DBPP的多因素Logistics回归分析
3 讨论
随着内镜技术发展,内镜手术在胃肠道肿瘤治疗中的应用逐渐增多。ESD术适用于胃黏膜及下层肿瘤诊疗,对未转移的EGC、胃肠道间质瘤等均可有效切除,手术效果显著。 ESD术是经内镜黏膜切除术(EMR)基础上改进而来,该术式属于微创手术,因其具有创伤小、术后恢复快、预后局部复发率低等特点,现阶段已成为治疗上消化道早期癌患者的首选[5]。但受限于ESD术操作难大,对操作者专业技能有着非常苛刻的要求,患者术后易出现一系列并发症,其中以DBPP临床最为常见且危害性最大,不利于患者疾病转归[6],故患者ESD术后如何有效早期识别DBPP发生的危险因素,及时采取有效预防性措施进行干预显得十分必要。
本研究多因素Logistics回归分析显示:病灶位置在胃窦、病变直径≥5cm、术中明显出血、近30d曾使用氯吡格雷是上消化道早期癌患者ESD术后DBPP发生的危险因素,究其原因逐一分析如下:(1)胃窦处血管分布相对密集,若胃窦发生病变,为有效切除患者病变组织相关病灶,手术过程中剥离面积、剥离深度较大,若术中未行内镜钛夹有效止血,加之患者术后24h范围内因胃窦收缩、消化液反流,易诱发DBPP[7];(2)常理下,病变直径大小与患者血管裸露风险呈正相关,若术中止血措施操作不当,不小心损伤血管壁,患者术后极易发生DBPP[8];(3)术中明显出血与血管受损有关联,术中出血量明显会影响ESD术治疗效果,进而增加了患者术后DBPP风险的发生[9];(4)氯吡格雷作用于血小板中的环氧化酶、ADP受体,可抑制胃黏膜上皮细胞增殖、溃疡愈合过程中新生血管聚集生长,致使患者ESD术后存在出血倾向,患者易发DBPP[10]。 针对以上危险因素,特提出以下预防措施:(1)术前管床医师通过交谈方式向患者及家属讲解ESD术的相关知识,告知患者行ESD术的目的及必要性,同时向患者介绍科室既往此类患者通过ESD术成功治疗的典型案例,以纠正患者既往错误认知,增强健康信念,提高治疗依从性[11];(2)嘱患者术前12h禁食、6h禁饮,交待患者ESD术前行凝血四项指标检测,患者ESD术前,结合患者入院病历资料首页,于手术等候区再次与患者核实以上信息是否正确,同时格外注意近30d内服用氯吡格雷的患者,嘱手术室护士务必充分做好术前备血、质子泵抑制剂备齐、留置针穿刺建立有效静脉通路的术前准备工作;(3)对于病变位置在胃窦、病变直径≥5cm的术后DPPB发生风险高危患者,医师需知悉患者肿瘤位置、病变直径,同时术中操作须轻柔,避免因力度过大损伤患者血管壁,术后注意观察引流液颜色、性质,若发现出血,立即进行内镜检查,同时采取及时有效止血方式积极处理;(4)对于术中出血明显患者,必要时行内镜钛夹及时有效止血。
综上所述,病灶位置在胃窦、病变直径≥5cm、浸润深度至黏膜下层、术中明显出血、近30d曾使用氯吡格雷是上消化道早期癌患者ESD术后 DBPP发生的危险因素,医师可于患者ESD围术期采取针对性干预措施,以最大限度降低患者术后DBPP发生风险,利于患者预后。本研究亦存在以下不足:(1)本研究未设置哑变量,且纳入自变量偏少,且多因素分析结果可能存在混杂偏倚;(2)选取样本量相对偏少,样本可能存在个体差异及统计信息偏移。未来,需排除以上因素干扰,以期获得更具代表性的结论。

