ZWINT和CDK2在乳腺癌中的表达及与临床病理特征的关系和诊断价值
张芳芳 韩一菲 王靖楠 邹炎 应莉 李娜



【摘要】 目的 探討ZW10结合因子(ZWINT)和细胞周期蛋白依赖激酶2(CDK2)的相关性及其在乳腺癌病理诊断中的价值。方法 通过GEPIA数据库分析ZWINT 在乳腺癌和正常乳腺组织之间的表达差异,以及在乳腺癌中ZWINT和CDK2表达的相关性。通过Kaplan-Meier Plotter数据库预测ZWINT的表达与乳腺癌患者预后的关系。收集84例乳腺癌及其配对癌旁组织石蜡包埋病理标本和20例乳腺癌及其配对的癌旁组织新鲜标本,通过实时荧光定量PCR(RT-qPCR)和免疫组织化学检测乳腺癌和癌旁正常乳腺组织中ZWINT和CDK2 的mRNA及蛋白的表达,分析ZWINT和CDK2与乳腺癌临床病理特征的关系,并采用关联分析分析ZWINT和CDK2的相关性;采用受试者操作特征(ROC)曲线评估ZWINT和CDK2在乳腺癌病理诊断中的价值。结果 数据库分析结果显示, ZWINT在乳腺癌组织中高表达,在乳腺癌中ZWINT和CDK2的表达呈正相关(rs = 0.600,P < 0.001),ZWINT的表达与乳腺癌患者的预后相关(P均< 0.05)。84例病例检测结果显示,在乳腺癌组织中ZWINT和CDK2 的mRNA及蛋白的表达均高于癌旁组织(P均< 0.05),并且其高表达均与肿瘤大小、分期和淋巴结转移相关(P均< 0.05)。关联分析结果显示,对称测量下的Φ、Cramer V系数检验的关联程度相同,为0.322(P = 0.003),而列联系数为0.306(P = 0.003),ZWINT蛋白和CDK2蛋白表达密切相关。ZWINT和CDK2的ROC曲线的曲线下面积分别为0.886和0.818,对乳腺癌均具有较高的诊断价值。结论 ZWINT和CDK2与乳腺癌的发生发展及预后相关,检测ZWINT和CDK2有助于乳腺癌的病理诊断。
【关键词】 乳腺癌;ZW10结合因子;细胞周期蛋白依赖激酶2;临床病理特征;诊断价值
Relationship between ZWINT and CDK2 expression and clinicopathological features and their diagnostic values in breast cancer Zhang Fangfang△, Han Yifei, Wang Jingnan, Zou Yan, Ying Li, Li Na.△The Third Affiliated Hospital of Xinxiang Medical College, Xinxiang 453003, China
Corresponding author, Li Na, E-mail: lina@xxmu.edu.cn
【Abstract】 Objective To investigate the relationship between the expression of Zeste White 10 interactor (ZWINT) and Cyclin-dependent kinase 2 (CDK2) and clinicopathological features in breast cancer, and evaluate their pathological diagnostic values in breast cancer. Methods GEPIA database was utilized to analyze the difference in the expression of ZWINT between breast cancer and normal breast tissues and assess the correlation between ZWINT and CDK2 expression in breast cancer. Kaplan-Meier Plotter database was employed to predict the relationship between ZWINT expression and clinical prognosis of breast cancer patients. Paraffin-embedded pathological specimens of 84 cases of breast cancer and paired paracancerous tissues and fresh specimens of 20 cases of breast cancer and paired paracancerous tissues were collected. Quantitative real-time polymerase chain reaction (RT-qPCR) and immunohistochemical staining were used to detect the expression levels of ZWINT and CDK2 mRNA and protein in breast cancer and paracancerous normal breast tissues, to analyze the relationship between ZWINT and CDK2 expression levels and clinicopathological features of breast cancer. Association analysis was used to analyze the correlation between ZWINT and CDK2. Receiver operating characteristic (ROC) curve was delineated to evaluate the values of ZWINT and CDK2 in the pathological diagnosis of breast cancer. Results The results of database analysis showed that ZWINT was highly expressed in breast cancer tissues and there was a positive correlation between the expression of ZWINT and CDK2 in breast cancer (rs = 0.600,P < 0.001). The expression of ZWINT was closely correlated with clinical prognosis of breast cancer patients (all P < 0.05). The test results of 84 cases showed that the expression
levels of ZWINT and CDK2 mRNA and protein in breast cancer tissues were higher than those in para-carcinoma tissues (both P < 0.05), and high expression was closely correlated with tumor size, tumor stage and lymph node metastasis (all P < 0.05). Association analysis revealed that the degree of association of Φ and Cramer V coefficient test under symmetric measurements was the same as 0.322 (P = 0.003), while the column linkage number was 0.306 (P = 0.003). The expression levels of ZWINT and CDK2 proteins were closely correlated. The areas under the ROC curve of ZWINT and CDK2 were 0.886 and 0.818, which yielded high diagnostic values for breast cancer. Conclusions ZWINT and CDK2 expression levels are closely correlated the occurrence, development and prognosis of breast cancer. Detection of ZWINT and CDK2 contributes to pathological diagnosis of breast cancer.
【Key words】 Breast cancer; ZWINT; CDK2; Clinicopathological feature; Diagnostic value
乳腺癌是女性最常见的恶性肿瘤,2020年全球乳腺癌新发病例高达226万例,已成为女性排名第一的恶性肿瘤,严重威胁着女性的健康[1-2]。
因此,寻找乳腺癌诊断和预后评估的基因生物学标志物具有重要的临床价值。ZW10结合因子(ZWINT) 是有丝分裂纺锤体检查点的重要组成部分,在染色体有丝分裂精准分离中发挥着重要作用,参与细胞周期、细胞分裂和信号转导等信号通路的调控[3-4]。研究显示,ZWINT在多种人类肿瘤中高表达,并且与患者临床预后密切相关[5]。细胞周期蛋白依赖激酶2(CDK2)是一种细胞周期依赖性激酶(CDK),参与调控细胞周期进展、信号转导、DNA和RNA代谢等生物学过程[6]。研究表明,CDK2高表达会促进肿瘤的异常增殖[7]。ZWINT和CDK2在乳腺癌临床组织样本中的表达与临床病理特征的关系以及两者的相关性如何,ZWINT和CDK2在原发性乳腺癌的病理诊断与预后中是否有应用价值,笔者均未见文献报道,本研究就此进行了探讨,为将两者应用于乳腺癌的诊疗提供新的依据。
对象与方法
一、研究对象
1.标本来源
收集新乡医学院第三附属医院2020年1月至2022年12月接受手术切除且经病理学检查确诊的84例乳腺浸润性癌及与其配对的84例癌旁组织(距癌灶边缘5 cm)的石蜡包埋病理标本,所有患者术前均未接受化学治疗、放射治疗或免疫治疗。病理标本来源病例资料:均为女性,年龄33~88岁、中位数55岁;肿瘤直径≤2 cm 22例,>2 cm 62例;参照2019年版WHO乳腺癌组织病理分级分类法,Ⅰ级26例、Ⅱ级35例、Ⅲ级23例;参照2019年版TNM临床分期标准,TNM Ⅰ期20例、Ⅱ期14例、Ⅲ期50例;有腋窝淋巴结转移56例,无腋窝淋巴结转移28例。收集2022年1月至12月接受手术切除且经病理学检查确诊的20例乳腺浸润性癌及其配对癌旁组织(距癌灶边缘5 cm)新鲜标本,所有病例均由2名以上病理医师确诊。本研究方案经新乡医学院第三附属医院医学研究伦理委员会批准(批件号:K2023-041-01),所有参与者知情同意。
2.生物信息学数据
纳入GEPIA数据库中1 085例乳腺癌患者和291例正常乳腺者的乳腺组织,分析ZWINT的表达差异及其与CKD2的相关性。纳入Kaplan-Meier Plotter数据库中4 929例乳腺癌患者生存预后的数据,分析ZWINT与乳腺癌患者预后的相关性。
二、主要试剂
ZWINT兔抗人多克隆抗体(美国Santa公司),CDK2兔抗人多克隆抗体(美国Proteintech公司),二抗及二氨基联苯胺(DAB)(福州迈新生物技术开发有限公司),ZWINT和CDK2引物(上海生物工程有限公司)。
三、实验方法
1.生物信息学分析
在GEPIA数据库中分析ZWINT mRNA在乳腺癌和正常乳腺组织之间的表达差异,预测乳腺癌中ZWINT和CDK2 mRNA表达之间的相关性;通过Kaplan-Meier Plotter临床芯片数据库在线分析ZWINT的表达与乳腺癌患者预后的关系。
2.免疫组织化学(免疫组化)染色法检测
采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP法),ZWINT和CDK2一抗稀释比例分别为1∶200和1∶100,实验步骤按试剂盒说明书进行,用二氨基联苯胺显色、苏木精复染、梯度乙醇脱水、二甲苯透明、中性树胶封固。ZWINT和CDK2免疫组化评分标准:在双盲条件下由2名病理科醫师阅片,当免疫组化结果判断不一致时,共同讨论决定。ZWINT和CDK2阳性定位均位于细胞核,采用半定量法进行评分,根据染色强度和阳性细胞百分比对结果进行判读,染色强度评分如下:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比评分如下:<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。综合评分结果判定:细胞染色强度和阳性细胞百分比得分相乘,积分<4为ZWINT和CDK2低表达(低表达组),积分≥4为 ZWINT和CDK2高表达(高表达组)。
3.实时荧光定量PCR检测(RT-qPCR)
使用Trizol试剂盒按照说明书提取20例乳腺癌和配对癌旁组织中的总RNA,测定RNA浓度,按照逆转录试剂盒进行逆转录获得cDNA;使用10 μL体系按照SYBR Green I Master Mix说明书以β-actin为内参进行标准RT-qPCR。引物序列如下:
ZWINT-F:AACTCCGGGAAGCCTTTGAG,ZWINT-R:TTCTGGACTGCTCTGCGTTT;CDK2-F:ATGCCTGATTACAAGCCAAGTTTCC,CDK2-R:ACAAGCTCCGTCCATCTTCATCC;β-actin-F:CCTGGCACCCAGCACAAT,β-actin-R:GGGCCGGACTCGTCATAC。使用2-ΔΔCT法计算ZWINT和CDK2 mRNA的相对表达量。
四、统计学处理
采用SPSS 26.0处理数据,免疫组化表达计数资料以例(%)表示,组间比较采用χ ²检验,相关性采用分类变量的关联分析,非正态分布的变量数据使用Spearman相关性分析。应用GraphPad Prism 9.5进行图形绘制,RT-qPCR检测数据采用计量资料,以表示,2组间比较采用配对t检验。P < 0.05表示差异有统计学意义。
结 果
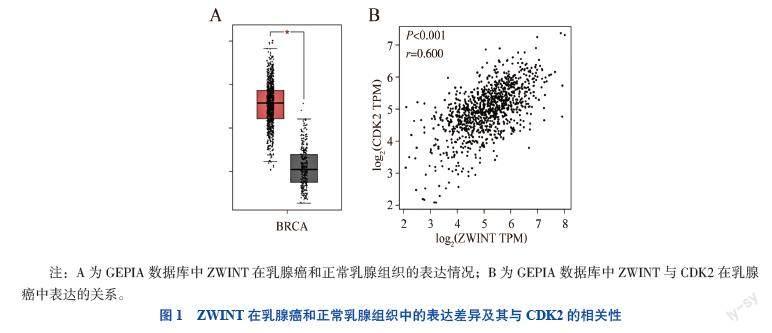
一、GEPIA数据库中ZWINT在乳腺癌和正常乳腺组织中的表达差异及其在乳腺癌中的表达与CDK2的相关性
在GEPIA数据库中进行检索及分析,共检索到1 085例乳腺癌组织和291例正常乳腺组织,结果显示,乳腺癌组织中ZWINT表达量高于正常乳腺组织(P < 0.05);ZWINT与CDK2之间存在相關性(rs=0.600,P < 0.001),见图1。
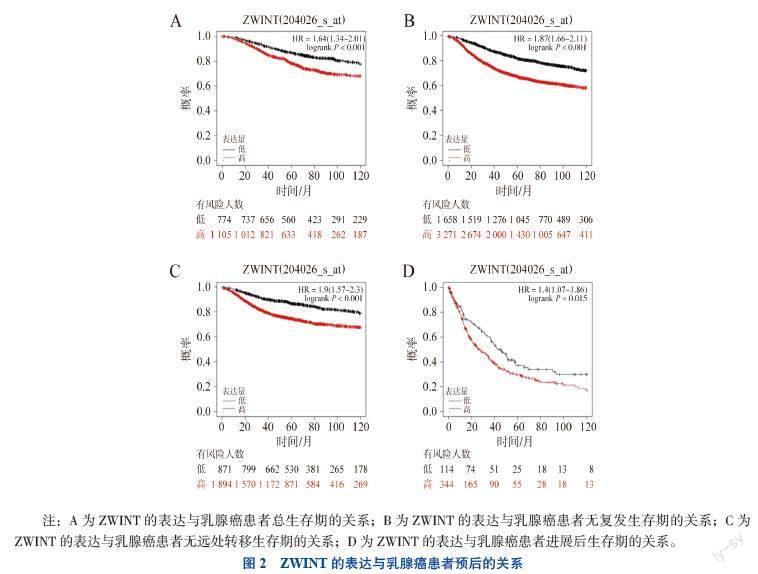
二、Kaplan-Meier Plotter数据库中ZWINT的表达与乳腺癌患者预后的关系
通过Kaplan-Meier Plotter数据库中的乳腺癌(mRNA)数据集进行生存分析,结果显示,在所有乳腺癌患者中ZWINT高表达组患者预后较差,其总生存期(OS,HR=1.64,P < 0.001)、无复发生存期(RFS,HR=1.87,P < 0.001)、无远处转移生存期(DMFS,HR=1.90,P < 0.001)和进展后生存期(PPS,HR=1.41,P = 0.015)均低于ZWINT低表达组患者,见图2。
三、ZWINT和CDK2的mRNA和蛋白在乳腺癌和癌旁组织中的表达水平
本院20例乳腺癌组织和癌旁组织的RT-qPCR检测结果显示,在乳腺癌组织中ZWINT mRNA和CDK2 mRNA的相对表达水平均高于癌旁组织(P均< 0.05),见图3A。84例乳腺癌组织和癌旁组织的免疫组化检测结果显示,在乳腺癌组织中ZWINT蛋白的高表达率为85.7%(72/84),高于癌旁组织中的高表达率29.8%(25/84),在乳腺癌组织中CDK2蛋白的高表达率为81.0%(68/84),亦高于癌旁组织中的高表达率33.3%(28/84),2组间比较差异均有统计学意义(P均< 0.05),见图3B。
四、ZWINT和CDK2蛋白表达与乳腺癌临床病理特征之间的关系
本院84例乳腺癌组织免疫组化检测结果和临床病理资料分析结果显示,ZWINT和CDK2蛋白高表达组均与肿瘤大小、分期和淋巴结转移密切相关,比较差异有统计学意义(P均< 0.05);两者蛋白的表达与乳腺癌的分级无关,比较差异无统计学意义(P > 0.05),见表1。
五、乳腺癌组织中ZWINT和CDK2蛋白表达的相关性分析
在72例ZWINT蛋白高表达的乳腺癌组织标本中,CDK2蛋白高表达的标本有62例(86.1 %);在12例ZWINT蛋白低表达的标本中,CDK2蛋白低表达的标本有6例(50.0 %)。由对称测量下的Φ、Cramer V系数检验结果显示,2种检测方法的关联程度相同,均为0.322(P = 0.003),而列联系数为0.306(P = 0.003),ZWINT蛋白和CDK2蛋白表达密切相关,见表2。
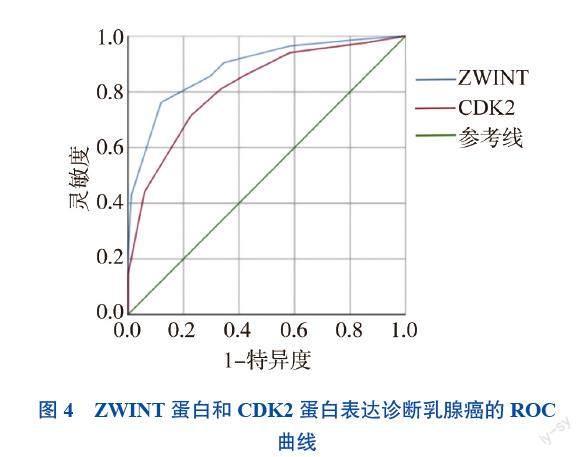
六、ZWINT蛋白和CDK2蛋白表达的受试者操作特征(ROC)曲线
通过统计分析本院84例乳腺癌组织的免疫组化检测结果,制作ZWINT蛋白和CDK2蛋白在乳腺癌组织中的ROC曲线,预测ZWINT和CDK2在乳腺癌中的诊断价值。结果显示,ZWINT蛋白的曲线下面积(AUC)为0.886(95%CI 0.837~0.936),敏感度为76.2%,特异度为88.1%;CDK2蛋白的AUC为0.818(95%CI 0.755~0.881),敏感度为71.4%,特异度为77.4%,见图4。ZWINT蛋白和CDK2蛋白表达在诊断乳腺癌能力方面均有较高价值。
讨 论
中国乳腺癌的发病率和病死率逐年上升,高浸润、高转移和高复发是乳腺癌患者死亡的主要原因,因此寻找乳腺癌的发病机制至关重要[1, 8]。
ZWINT是调控着丝粒分裂的重要蛋白,主要由278个氨基酸组成,主要功能是监管调控细胞周期和促进细胞增殖的作用,能够促进染色体运动和有丝分裂的进程[9]。当ZWINT缺失时会促进染色体异常分离和降低染色体稳定性,ZWINT高表达与多种肿瘤发生发展和患者预后密切相关[10]。有研究显示,ZWINT是一个促癌基因,在大多数肿瘤中高表达,可以调控肿瘤细胞的生长与增殖,并且ZWINT高表达的患者预后更差[11]。ZWINT在肺癌组织中的表达上调,敲低ZWINT可以降低肺癌细胞的增殖和侵袭能力,并且与肺癌患者的预后密切相关[12]。ZWINT在胰腺癌组织中高表达,可通过激活核因子κB信号通路或P53/P21信号通路促进胰腺癌细胞的增殖、侵袭和存活[13]。ZWINT mRNA和蛋白在肝细胞癌组织和细胞系中的表达也上调,ZWINT高表达与患者临床病理特征、生存期和较高的肿瘤复发率均密切相关,通过细胞分裂和免疫抑制调控肝细胞癌的进展,并且ZWINT的表达促进了多种细胞周期蛋白的表达[14]。有报道显示,ZWINT mRNA和蛋白质水平在胶质母细胞瘤中均过表达,敲除ZWINT能有效抑制肿瘤细胞的增殖和侵袭,诱导细胞凋亡,抑制肿瘤在体内的生长,因此ZWINT可成为胶质母细胞瘤新的潜在治疗性标志物[15]。本研究通过多个数据库分析并且通过RT-qPCR和免疫组化检测结果进行了验证,ZWINT的mRNA和蛋白在乳腺癌中的表达高于癌旁正常乳腺组织,并且其蛋白高表达与肿瘤大小、分期和淋巴结转移密切相关。预后分析发现,ZWINT的表达与乳腺癌患者的各种生存期密切相关,这与文献报道其他肿瘤的结果一致,提示ZWINT可作为乳腺癌发生、发展和预后评估的标志物之一。
CDK2是CDK家族重要一员,主要由298个氨基酸组成,是控制细胞由G0/G1期向S期过渡,维持S期正常进展的重要激酶,当CDK2与细胞周期蛋白结合时可调控细胞周期的进展[16]。研究显示,CDK2蛋白在多种肿瘤中过表达,如膀胱癌、乳腺癌、胃癌和卵巢癌[17]。CDK2是多种致癌信号通路的关键调节剂,其高表达促进了肿瘤的发生发展和异常增殖[6-7]。本研究显示,CDK2的mRNA和蛋白在乳腺癌组织中的表达高于癌旁正常乳腺组织,并且其高表达与肿瘤大小、分期和淋巴结转移均密切相关,与上述研究結果一致。表明CDK2可加速S期进程,使细胞过度增殖,在乳腺癌的发生发展中发挥一定作用。关联分析显示,ZWINT和CDK2表达密切相关,并且ZWINT和CDK2蛋白表达对乳腺癌诊断的敏感度和特异度均较高,在诊断乳腺癌方面均有较高价值。由此推测,ZWINT的高表达,可能通过调节CDK2等细胞周期相关因子的表达而调节细胞周期,进而促进乳腺癌的增殖。然而由于肿瘤发病机制复杂,乳腺癌中ZWINT异常高表达的分子机制及调控肿瘤发生发展的分子机制仍未明确。因此,后续还需要不断完善实验设计,扩大样本量等对ZWINT进行突破性的研究,旨在为肿瘤的治疗提供新的方向和思路,为临床提供更为可靠的参考。
综上所述,ZWINT和CDK2的异常表达与乳腺癌的发生和发展密切相关,两者可能存在相关调控机制,检测上述蛋白有助于乳腺癌的病理诊断。本研究不但表明检测乳腺癌中的ZWINT和CDK2有助于判断乳腺癌的发生和发展,还为乳腺癌发病机制的探讨提供了一定的参考依据。
参 考 文 献
[1] Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer J Clin, 2021, 71(3): 209-249.
[2] Arnold M, Morgan E, Rumgay H, et al. Current and future burden of breast cancer: global statistics for 2020 and 2040[J]. Breast, 2022, 66: 15-23.
[3] Starr D A, Saffery R, Li Z, et al. HZwint-1, a novel human kinetochore component that interacts with HZW10[J]. J Cell Sci, 2000, 113(11): 1939-1950.
[4] Yang L, Han N, Zhang X, et al. ZWINT: a potential therapeutic biomarker in patients with glioblastoma correlates with cell proliferation and invasion[J]. Oncol Rep, 2020,43(6):1831-1844.
[5] Wang H J, Wang L, Lv J, et al. Decreased expression of Zwint-1 is associated with poor prognosis in hepatocellular carcinoma[J]. Int J Clin Exp Pathol,2017,10(10):10406-10412.
[6] Tadesse S, Anshabo A T, Portman N, et al. Targeting CDK2 in cancer: challenges and opportunities for therapy[J]. Drug Discov Today, 2020, 25(2): 406-413.
[7] Fagundes R, Teixeira L K. Cyclin E/CDK2: DNA replication, replication stress and genomic instability[J]. Front Cell Dev Biol, 2021, 9: 774845.
[8] 许召君, 张成武, 马晓明. 全身免疫炎症指数在实体癌中的应用研究进展[J]. 新医学, 2023, 54(2): 110-114.
Xu Z J, Zhang C W, Ma X M. Research progress on application of systemic immune inflammatory index in solid cancers[J]. J New Med, 2023, 54(2): 110-114.
[9] Woo Seo D, Yeop You S, Chung W J, et al. Zwint-1 is required for spindle assembly checkpoint function and kinetochore-microtubule attachment during oocyte meiosis[J]. Sci Rep, 2015, 5: 15431.
[10] Yuan W, Xie S, Wang M, et al. Bioinformatic analysis of prognostic value of ZW10 interacting protein in lung cancer[J]. OncoTargets Ther, 2018, 11: 1683-1695.
[11] Ying H, Xu Z, Chen M, et al. Overexpression of Zwint predicts poor prognosis and promotes the proliferation of hepatocellular carcinoma by regulating cell-cycle-related proteins[J]. OncoTargets Ther, 2018, 11: 689-702.
[12] Cao S, Xiao S, Zhang J, et al. Identification of the cell cycle characteristics of non-small cell lung cancer and its relationship with tumor immune microenvironment, cell death pathways, and metabolic reprogramming[J]. Front Endocrinol, 2023, 14: 1147366.
[13] Chen P, He Z, Wang J, et al. Hypoxia-induced ZWINT mediates pancreatic cancer proliferation by interacting with p53/p21[J]. Front Cell Dev Biol, 2021, 9: 682131.
[14] Kim J H, Youn Y, Lee J C, et al. Involvement of the NF-κB signaling pathway in proliferation and invasion inhibited by Zwint-1 deficiency in pancreatic cancer cells[J]. J Cancer, 2020, 11(19): 5601-5611.
[15] Lin T, Zhang Y, Lin Z, et al. ZWINT is a promising therapeutic biomarker associated with the immune microenvironment of hepatocellular carcinoma[J]. Int J Gen Med, 2021, 14: 7487-7501.
[16] Palmer N, Talib S Z A, Ratnacaram C K, et al. CDK2 regulates the NRF1/Ehmt1 axis during meiotic prophase I [J]. J Cell Biol, 2019, 218(9): 2896-2918.
[17] Liu X, Liu S, Piao C, et al. Non-metabolic function of MTHFD2 activates CDK2 in bladder cancer[J]. Cancer Sci, 2021, 112(12): 4909-4919.
(收稿日期:2023-09-25)
(本文編辑:洪悦民)

