金属硼化物的制备、性质与应用研究进展
赵小军,高胜利,刘志宏,*
1 西安建筑科技大学冶金工程学院,西安 710055
2 陕西师范大学化学化工学院,西安 710062
硼(B)元素是第一个拥有p电子的元素,处于金属与非金属元素之间的特殊位置,是典型的缺电子原子。硼与电负性小的金属元素结合形成的化合物,叫金属硼化物。金属硼化物的金属(M)与硼的比例通常从3 : 1 (M3B)至1 : 12 (MB12),还有少数特例(如MB50和MB66,M = 碱金属(Li、Na、K)、碱土金属、III-VIII族过渡金属、镧系元素和锕系元素(Th、U、Pu)除外)[1,2]。如果B原子与M原子的比例为4 : 1或更高,则属于富硼硼化物(如MB4、MB6和MBl2)[3-5]。在金属硼化物中,由于硼的电子缺失性、较短的共价半径以及sp2杂化轨道与三中心键的兼容性,使得金属硼化物经常呈现出奇特的物理和化学性质,是纳米材料领域的研究热点。长期以来,国内外多数基础无机化学教材中对硼化物的介绍非常有限,而且知识陈旧,只是简单地提到硼化物按照组成结构可分为离子型、共价型和间充型三大类,并笼统地介绍了若干性质和应用,缺乏结构和制备方法的介绍。尤其是新金属硼化物及最新研究进展未能在教材里及时体现。针对目前教材中相关内容的局限性和滞后性,有必要将此部分内容在教材中进行更新和补充,以凸显最新的理论观点、科研成果,达到通过基础课的学习培养学生科研素养的目的。为此,本文重点介绍了碱金属/碱土金属硼化物和过渡金属硼化物的结构、性质、制备和应用研究进展。
1 金属硼化物概述
1.1 金属硼化物的结构
金属硼化物成键时应该是电子从电负性小的金属原子向“缺电子”的硼原子(或原子组合)转移。但这对富硼的金属硼化物来说是不适用的。在富硼的金属硼化物中,电子的转移正好相反,是由金属原子向硼原子组合(即硼网)转移电子而成键。其中MB2是富金属硼化物和富硼金属硼化物之间的过渡。因此,对于二硼化物的成键,两个方向的电子转移都应考虑。在过渡金属硼化物中,最高硼含量是随着金属的原子序数增大(d能带中的空位减少)而降低。金属硼化物的组成多样,可归因于硼原子的缺电子性引起成键的复杂性。随着晶格中硼原子的比例增大最终导致金属硼化物结构的多样性。金属硼化物晶格中硼原子可表现出多种结构类型:单硼原子、成对硼原子、链式、双链式、硼分子网络和硼原子骨架(图1)[6,7]。这些金属硼化物中只有极少数是按组分元素的正常氧化态互相化合,如Ti3B4可认为是+4的Ti与-3的硼形成的化合物;FeB可认为是+3的Fe与-3的硼形成的化合物。其余大多数金属硼化物的组成如LiB4、CaB12、V2B、Cr4B和Mn4B等都无法用正常氧化态来表示。从组成来看,二元金属硼化物约有24种型式,其中有6种型式(M2B、MB、MB2、MB4、MB6和MB12)较为常见,如表1所示。
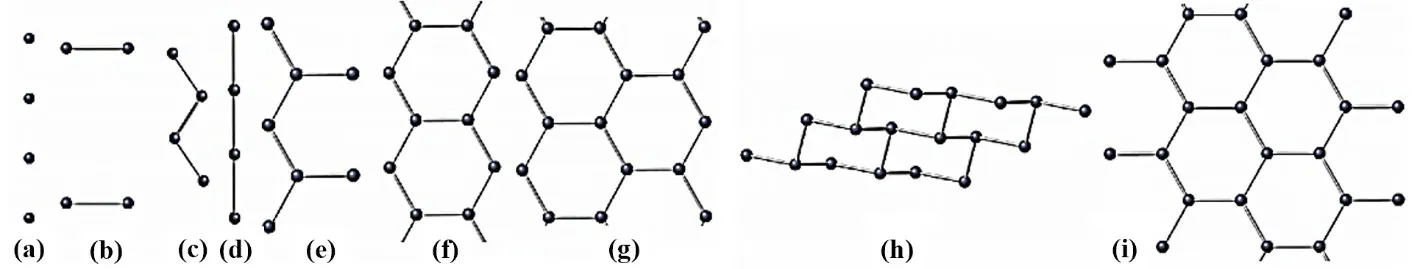
图1 硼原子结构图
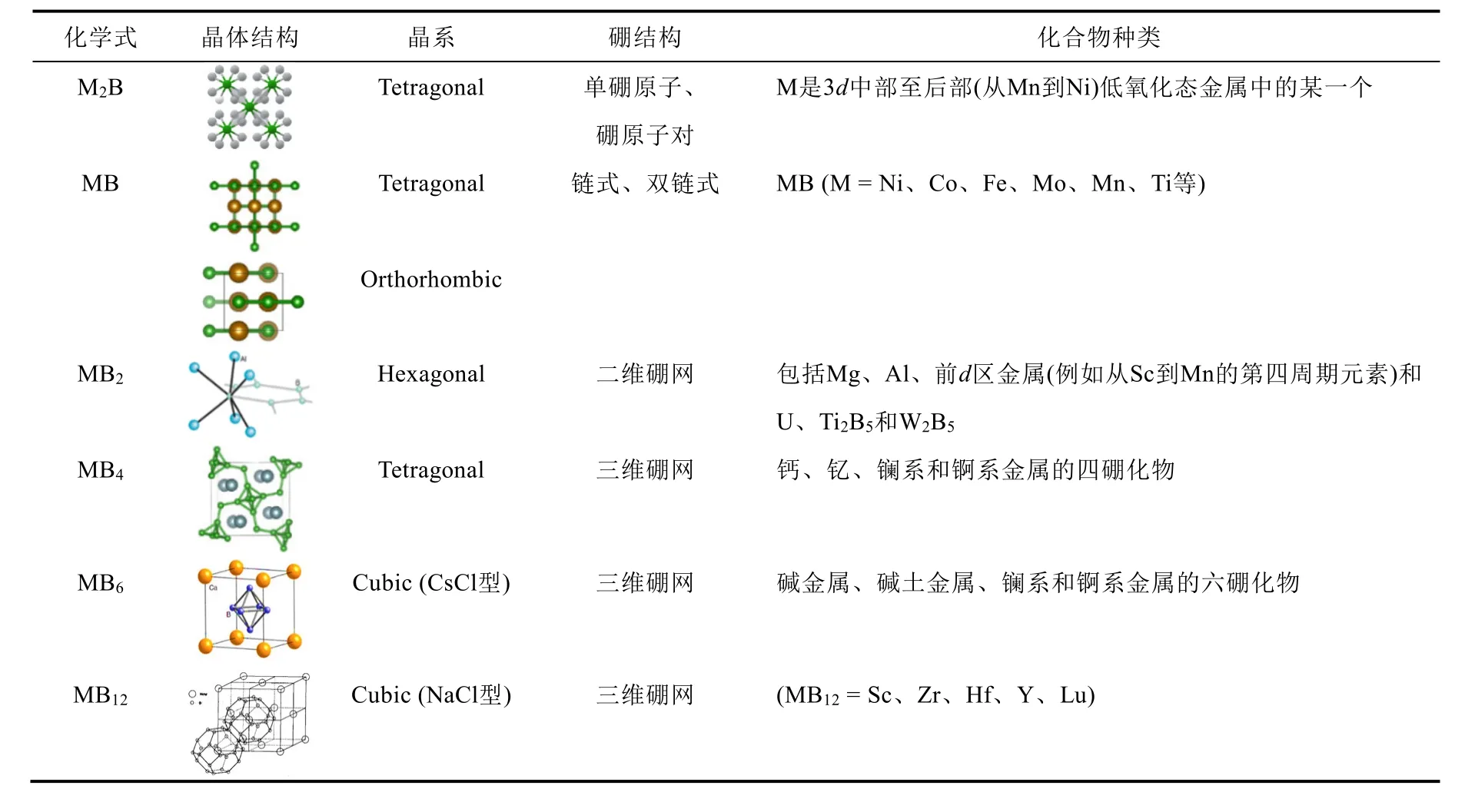
表1 M2B、MB、MB2、MB4、MB6和MB12的晶体结构图
M2B是富金属硼化物,当硼原子和金属原子的半径比rB/rM超过0.414时,有利于金属对硼取八面体配位。三角棱柱体配位的“理想”比率是0.528,但实际比率在0.64-0.71范围内。当硼原子相对于金属原子的比例增大时就开始形成硼原子对(Cr5B3和M3B2结构中可以观察到此倾向)。随着比例接近于1 : 1,会形成斜方晶或四方晶结构。金属原子堆积成三角棱柱体,硼原子的“Z”字形链穿过各个棱柱体的一部分四边形面,而各个硼原子则被金属原子三角棱柱体所配位。MB2具有二维硼网结构,由交替的金属原子和硼原子的平面或皱褶六角形网层构成;环绕硼原子仍有三角棱柱体配位,硼原子构成规则的正方形和七边形混合网孔。每个正方形是一个硼八面体的部分,每个七边形中的三个硼原子并不是两个相邻八面体的部分,而是在金属原子三角棱柱体的中心,B八面体本身都处在金属原子的立方体内。MB2是M2B和MB6的过渡。
在三元硼化物中,含有碱金属和3d过渡金属的硼化物值得特别关注[8]。在30种可能的A-T-B三元体系(A = 碱金属,Li、Na、K、Rb、Cs;T = 3d过渡金属,V-Ni)中,只报道了3种三元硼化物,它们都在Li-Ni-B体系中。如果还考虑4d和5d过渡金属,则有90种潜在的三元A-T-B体系(A = Li-Cs;T = Ti-Ni、Zr-Pd、Hf-Pt),但仅报道了11种含有较重的镍或钴同系物的三元化合物。RE (稀土金属)-T-B三元硼化物体系(RE = Y、Nd、Eu、Tb、Dy)与A-T-B三元硼化物体系形成鲜明对比。目前已经报道了超过300个三元硼化物相的RE-T-B。三元硼化物的结构类型可以根据金属/硼比率的硼聚体的大小进行分类。硼-硼聚集体通过硼-硼距离来决定。大量的三元金属硼化物表现出的晶体结构是由二元金属硼化物的有序化衍生的。
1.2 金属硼化物的制备
20世纪中叶,研究人员采用电弧熔炼法制备出Re-B、Ru-B、Rh-B、Pd-B、Os-B、Ir-B等系列金属硼化物。随着人们对硼化物研究的深入,开发出许多新的金属硼化物的制备方法。
(1) 直接合成法(电弧或熔融法)。
一般采用过渡金属粉末(M)与B粉,在电弧熔炉、高频感应炉或高温炉中熔化成分或在真空或惰性气氛下烧结进行。样品的纯度很大程度上取决于原料的纯度。硼可能在加热过程中升华导致制备样品未按照化学计量进行化学反应,因此硼添加量过量10% (质量分数)。电弧熔炼法不足在于要求制备的材料要具备金属性。然而,硼只具有半导体或绝缘体特性,也易挥发,高硼含量的金属硼化物难以采用电极熔炼法制备。通过电弧熔融成功合成金属硼化物,包括以下几类硼化物:
a) 富金属硼化物:TiB、W1-xTaxB、ReB2、NbB2、TaB2、Sc1-xWxB2、Sc1-xRexB2、Ru2B3、WB2;
b) MB4:(W、Ti、Zr、Hf、V、Nb、Ta、Cr、Mn、Re、Mo)的合金;
c) MB12:Y1-xHfxB12、Th1-xZrxB12、Zr0.6Y0.4B12、ErB12、UB12、Zr1-xYxB12、Zr1-xScxB12、Y1-xScxB12、YB12、ScB12、ZrB12;
d)β菱形硼及其过渡金属掺杂相:HfB50、ScB50、YPtB50。
(2) 还原反应法。
还原反应法包括碳热还原法、金属热还原法、硼热还原法、卤化硼/氢气还原等。
① 碳热还原法:C为还原剂,金属氧化物为金属源,B4C或B2O3为硼源,温度大于1600 °C。
② 金属热还原法:相对于碳热还原法的不同之处是将还原剂替换为Al或Mg[9],如:
该反应是一个放热反应,反应速率难以控制,后续杂质处理工序较为复杂。
③ 硼热还原法:B作为还原剂,与金属氢化物、氧化物、氮化物或硫化物的反应制备金属硼化物。相对于碳热还原法和金属热还原法减少了杂质元素的引入。
④ 用氢气还原卤化硼和金属卤化物的混合物。
本质上,这种方法首先在还原气氛下将反应物分解成它们的单质,然后单质在气相中的反应形成金属硼化物。但是该方法不能制备铌、钽、钼和钨的硼化物(会沉积出金属单质)。
(3) 固态置换法。
固态置换法是一种利用化学反应原位合成复合材料的一种方法。一般采取过渡金属元素的卤化物和碱土金属主族化合物作为反应物,在无需加热的条件下即可快速反应完成。
(4) 电解熔盐。
该方法是通过电解合成硼化物,其中涉及电流通过强电解质盐的熔融混合物,以及阴极或阳极上的电化学沉积反应形成硼化物,常用于表面处理涂层。
(5) 水溶液中用硼氢化物还原金属离子。
2003年,B. Albert首次在冰浴条件下将NaBH4溶解在NiCl2水溶液中制得无定形的Ni3B[10]。随后其他金属硼氢化物(NaBH4、KBH4或LiBH4)溶液与金属氯化物反应可制备多种金属硼化物[9],包括Fe-B、Co-B、Ni-B、Cu-B和Pd-B。
1.3 性质
硼化物的物理性质明显取决于它们的纯度,因此各种文献上报道的熔点、硬度、磁性、电/光学性质方面的数据差异很大。一般富金属硼化物的熔点都接近于其金属部分,但是富硼硼化物的熔点主要反映硼框架的性质。某些高熔点过渡金属二硼化物MB2的熔点均高于其金属部分,也比单质硼高。硬度方面,从硼单原子到硼链倾向于形成共价相连的3D网络结构的金属硼化物,这导致金属硼化物具有高剪切模量(因为位错不能横穿过共价键),大多数硼化物都是硬的。金属硼化物类型差异导致其电/光学性质差异性较大,详细的内容后面根据金属硼化物种类分别讨论。
金属硼化物的化学性质与相应金属的碳化物、氮化物、硅化物和磷化物相似。周期系IA、IIA和IIIB族(包括镧系和锕系)金属硼化物往往可被水分解而生成硼的氢化物。在氧化剂存在下,硼化物的情性是随着硼含量的增加而增强。许多金属硼化物像它们的母体元素,在室温下可以不受空气的氧化。在加热时,所有硼化物都能被空气氧化,但氧化速度差别很大,这取决于它们的纯度、粉细程度、有关金属的性质以及是否形成氧化物或硼酸盐保护层。金属硼化物在酸溶液中的溶解(反应)与金属有关系[5]。对盐酸和硫酸来说,大致有如下规律:
(1) 主族元素硼化物的耐蚀能力,随着硼含量的增加而增强;
(2) 过渡金属硼化物的耐蚀能力,随着金属原子的原子序数增加而增强。
除Cr的硼化物外(钝化作用),大多金属硼化物都能被硝酸溶解。氢氟酸可以侵蚀低级硼化物(如VB、FeB、CrB、Cr3B4和UB4),但对大多数较高级的硼化物(如TiB、VB2、Pt2B3,LnB6,ThB6和UB12)没有作用。所有硼化物都能溶解在诸如王水、硝酸和硫酸、硝酸和过氧化氢等这样一些氧化性混合酸中。金属硼化物往往可与无水酸反应。如在200 °C下CrB和NiB与盐酸吡啶反应生成(C5H5N)NiCl2、(C5H5N)3CrCl3和(C5H5NH)2NiCl4的混合物。氯磺酸在140 °C时可与VB2、NbB2、CrB2和CaB6完全起反应,产生SO2和HCl同时伴有SO2Cl2和Cl2。无水HF在225 °C时可与CaB6、TiB、MnB和MoB反应。ThB4、CrB、MnB和MnB2可与无水HCl反应。
大多数硼化物能耐抗水溶性碱,但有报道称MnB和MnB2会与水或氨水反应。多数硼化物与熔融的第IA氢氧化物和碳酸盐反应。各类硼化物有耐氮化的性质[5]。
此外,碱金属硼化物、碱土金属硼化物、IIIB-VIII族过渡金属硼化物、镧系元素和锕系元素硼化物(Th、U、Pu除外)的结构、性质各有其特异性,最终导致其应用具有差异性,如图2所示。
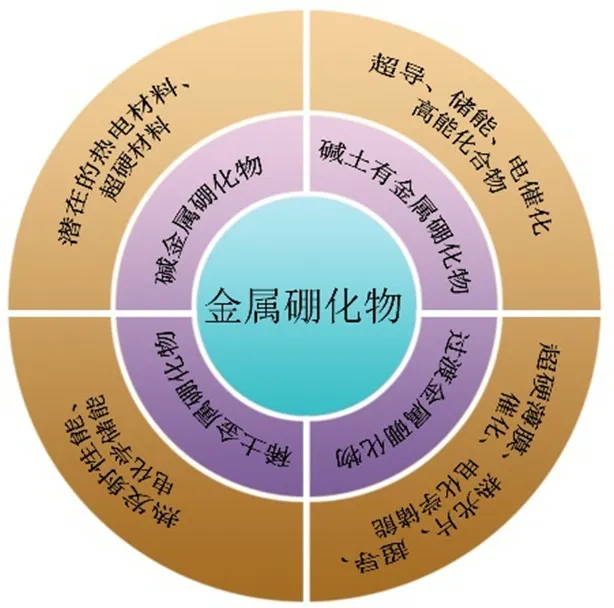
图2 金属硼化物及其应用
2 碱金属硼化物(Alkali metal boride)
Li/Na/K可以与硼原子形成多种构型的离子型碱金属硼化物。目前,只有少数碱金属硼化物的组成和结构得到了精确测定。这主要受到这些材料的合成和表征的限制,如常压下低熔点碱金属和硼的反应难以控制,且产品通常是微晶粉末而非单晶[11]。该类化合物主要有LiB0.8-1.0、LiB2、LiB3、Li3B14、LiB10、Li6B5、Na2B29、Na3B20、KB6等[1,12]。很多碱金属硼化物的组成、结构、物理性质都是通过计算化学进行预测,但只有少数化合物得到很好的表征。Wang等[13]报告了x:y≈ 1 : 1的P63/mmc六方LiB的制备过程。Wörle和Nesper[14]得出LiBx(0.82 <x≤ 1.0)具有线性碳炔状硼链结构。高于20 GPa时可以驱动非化学计量LiBy(向下至y= 0.75)到2D分层状LiB的转变。Sun等[15]利用第一原理计算和进化结构搜索的方法对LixBy单层体系的结构及其能带和载流子有效质量进行预测(图3),发现了Li2B2、Li4B8、Li2B6和Li2B12单层结构。
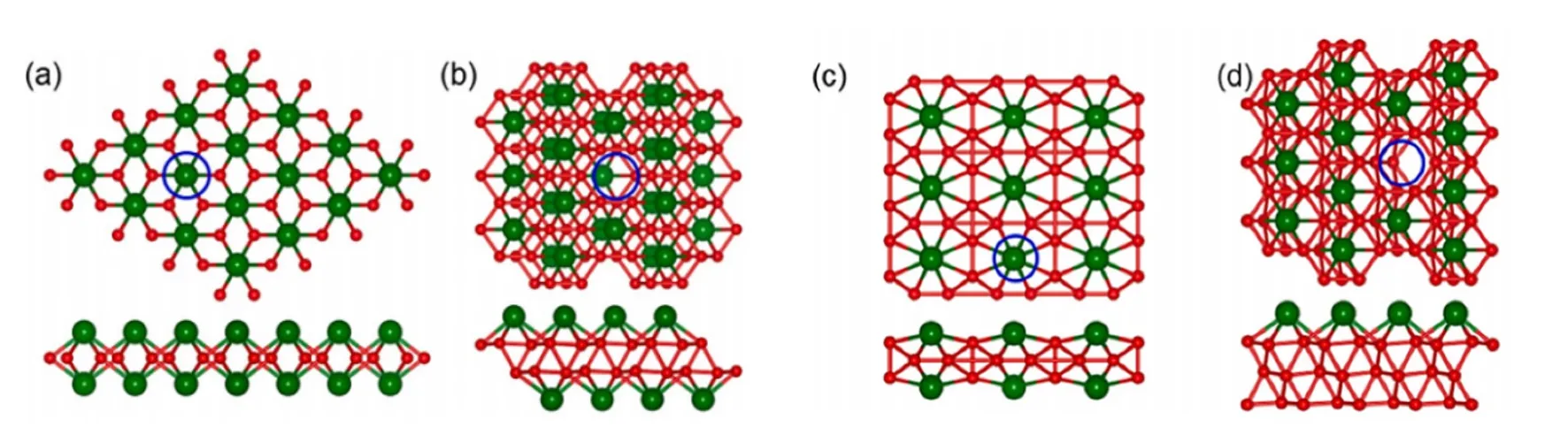
图3 (a) Li2B2、(b) Li4B8、(c) Li2B6和(d) Li2B12的顶视图(上)及侧视图(下)
Dudenkov等[16]预测了新型非团簇LiB9结构存在的可能性,结构为P63cm空间群的六方晶系,a= 0.565 nm,c= 0.504 nm,Z= 2,密度ρ= 2.49 g·cm-3。基面包含硼原子穿孔的三角面层,其离域电子通过3c-2e键结合成框架。
在Na-B二元体系中,Naslain等[17]首次报道了NaB6和NaB15。Albert等[18]发现NaB6化合物实质上是Na3B20。Na2B30的结构是单斜Na2B29(2(NaB3B12+ NaB2B12)),每个单胞有两个间隙B原子未被占用(Cm-Na2B29)。2018年,He等[11]使用DFT计算提出一种新型I212121对称性的正交晶系Na2B30材料,主要由B12二十面体组成,具有间隙硼三角形单元和Na原子容纳二十面体的笼中。在压力达到16 Gpa条件下,I212121-Na2B30比Imma-Na2B30更稳定[19]。2020年,Morito课题组[20]在1173-1373 K温度范围内成功合成Na2B30,包括块体Na2B30和单体Na2B30。当温度升高到1453 K,产物中同时观察到Na2B29和Na3B20的衍射峰。将制备的Na2B30暴露于空气48 h后可观察到H3BO3生成,6个月后Na2B30完全转化为H3BO3。2003年,通过无定形B和K金属直接反应制得CsCl型(CaB6的结构)KB6[21]。KB6具有局域自旋的特征,在低于70 K的磁化率中表现出极高的磁滞现象。电阻率测量表明KB6具有金属性。
3 碱土金属硼化物(Alkaline earth metal borides)
3.1 结构与制备
碱土金属(Be,Mg,Ca,Sr和Ba)与硼原子构成碱土金属硼化物,主要有Be4B、Be2B、BeB2、BeB6、BeB12、MgB2、MgB4、MgB7、MgB20、Mg5B44、CaB6、SrB6、BaB6等,其结构如表1所示。2021年,Zhou等[3]利用粒子群优化算法在0 GPa的压力下对富硼碱土金属化合物MB12(M = Be、Mg、Ca、Sr)的晶体结构、形成能、电子和机械性能进行了预测。BeB12和CaB12稳定晶体结构分别是四方I-4和I-42m的空间群,而MgB12为Amm2正交晶系,SrB12为Pm-3立方晶系(图4),且BeB12、MgB12、CaB12和SrB12的稳定相都是间接半导体,带隙分别为0.82、1.20、0.03和0.92 eV;预测了MB12弹性系数、体积、剪切和杨氏模量以及德拜温度、硬度和各向异性因素等。总体上,MB12表现脆性行为,硬度是超硬材料。目前多数碱土金属硼化物的制备主要集中处于理论研究阶段,相关的实验报道不多。2001年,Nagamatsu等[22]以Mg和B作为原材料按物质的量比为1 : 2在973 K制备出MgB2超导材料。Liu等[23]采用磁控溅射方法在SiO2基底上生长了CaB6薄膜;Dorneles等[24]采用脉冲激光沉积方法,在MgO (100)或A12O3(001)基底上生长出了厚度为12 nm的CaB6和SrB6膜。Yin等[25]利用CaSi2||B配对电解槽,可以在阳极生产多孔Si,在阴极生产CaB6,有望实现材料合成的零排放。Mori研究小组[26]利用传统的化学气相沉积(CVD)方法在蓝宝石基底上以B和Sr为原料成功获得SrB6纳米片。
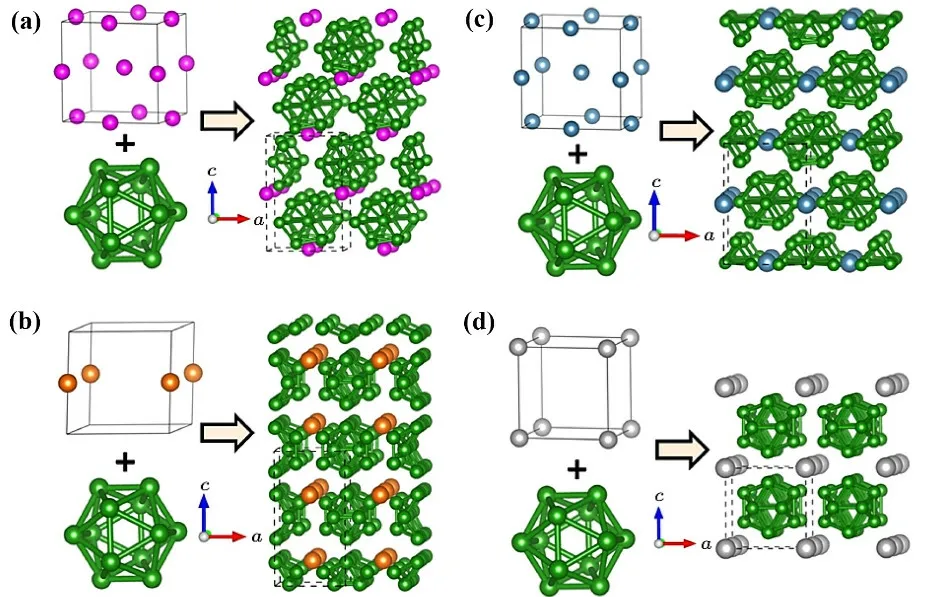
图4 (a) BeB12、(b) MgB12、(c) CaB12和(d) SrB12的晶体结构
3.2 性质和应用
碱土金属硼化物在超导、储能、光/电催化等领域都具有潜在的应用前景。以下综述两种典型的碱土金属硼化物的应用。
(1) MgB2:由六方晶格的c轴上的B和Mg两层组成,空间群为P6/mmm,a= 3.086 Å (1 Å = 0.1 nm),b= 3.086 Å,c= 3.524 Å;α=β= 90°,γ= 120°。B原子像石墨片层一样排列,Mg原子在层间交替(图5)。Mg原子为B原子网提供了它的两个价电子。MgB2在低温下失去电阻,具有超导性,起始和终点超导转变温度(Tc)分别为39 K和38 K,属于常规超导体[22]。它的转变温度几乎高达其他同类型超导体的两倍,实际工作温度为20-30 K。与大多数含有过渡金属的常规超导体显著不同,主要是因为传统I型超导体依赖于s轨道重叠,而MgB2还具有显著的p轨道重叠,导致其具有更高的热容和更高的Tc。目前,工业界用液氦来冷却铌钛合金超导磁铁,其工作温度为4.5 K。相比之下,MgB2可以用液氖、液态氢或封闭循环式冷冻机来冷却,降低了使用和维护成本。
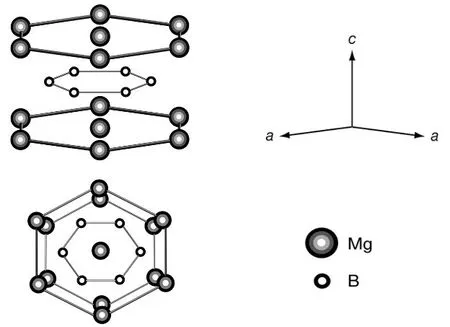
图5 MgB2的晶体结构[22]
MgB2插层式的晶体结构表现出各向异性的特征,其超导性很大程度上取决于成分和制造工艺。不纯的MgB2样品(例如晶粒边界存在氧化层)与纯净MgB2样品表现也不同。因此,通过掺杂可以实现MgB2性能改性[27]:如碳掺杂MgB2可以提高临界磁场(Hc2)和最大电流密度,实验发现5%的碳掺杂可以将Hc2从16 T提高到36 T,而Tc仅从39 K降低到34 K;部分Mg原子被Al所取代,转变温度会降低;若掺杂一些铜,转变温度则会升高。MgB2作为催化剂用CVD法制备可制备氮化硼纳米管(BNNTs),制备的BNNTs可以广泛用于热界面材料[28]。此外,MgB2可用做高能化合物,作为冲压式喷气机的燃料或火箭推进剂[29]。MgB2极低的能耗和较长的超导相干长度等使其在大地探矿、医疗仪器、环境和军事方面具有广泛应用前景。
(2) CaB6:因其La和Ba掺杂引起铁磁特性而受到广泛关注[30]。Li等基于sX-LDA的计算表明CaB6是带隙为0.89 eV的半导体[31],其导带主要由B 2p和Ca 3d组成,价带由B 2p轨道和B 2s轨道组成。当材料具有Ca空位时,CaB6的半导电性被认为是n型。CaB6的晶格是中心具有隧道状结构的框架,为离子的嵌入提供潜在途径。Kanakala等[32]将Li嵌入CaB6中形成Ca1-xLiyB6CaB6,以此作为锂离子电容器电极材料。在电流密度为0.42和2.5 A·g-1时,CaB6电极的最大比电容分别是35.7和18.2 F·g-1。Warburg系数计算证明:Li+离子在CaB6中的扩散系数远高于钛酸盐和混合氧化物。Yin等将CaB6作为水性一次电池的阳极材料,在30% KOH溶液中的比容量为2400 mAh·g-1[33]。
4 过渡金属硼化物(transition-metal borides,TMBs)
4.1 结构
硼与过渡金属组成的化合物叫过渡金属硼化物。过渡金属元素的种类数量远大于碱金属和碱土金属元素,组成范围从M3B到MB66。它们的晶体结构会随着硼与金属的摩尔比的增加而改变,例如硼化镍(Ni3B,Ni2B,Ni4B3,NiB)由孤立硼原子逐渐演化为一维、二维、三维硼框架(图6)。对于给定过渡金属硼化物,当金属元素改变时其晶体结构也会改变,如二维层状TiB2中的Ti改变为Re时,晶体结构由二维层状变为褶皱的二维片状[34]。
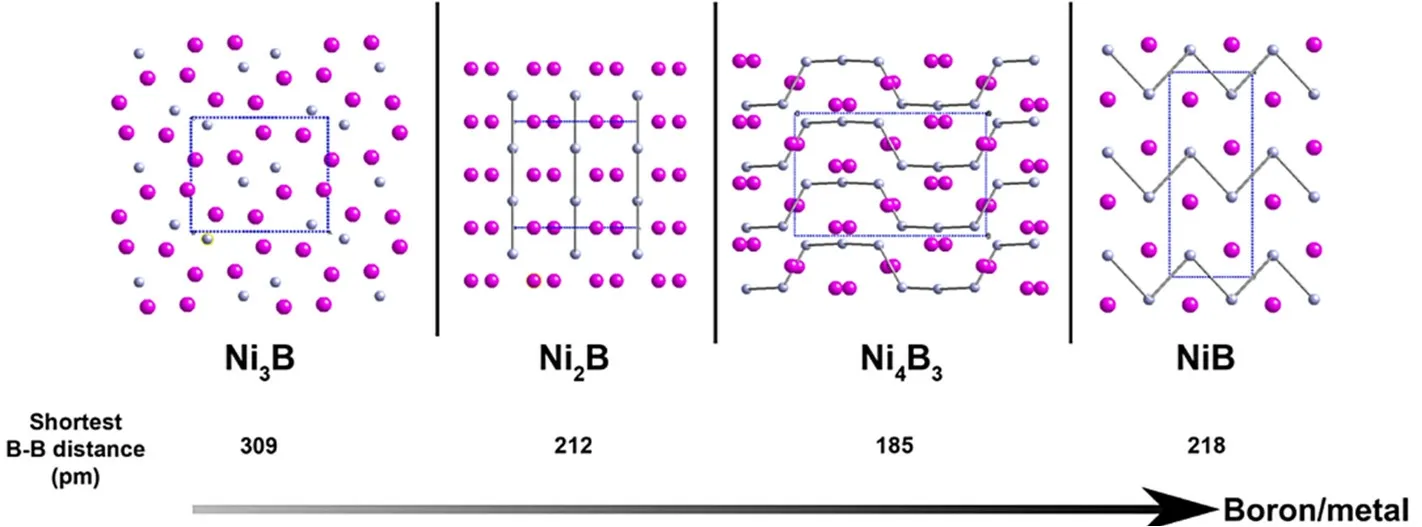
图6 硼化镍的晶体结构
4.2 性质和应用
TMBs丰富的结构是由硼原子的多价态结合方式以及过渡金属的高价电子密度可以使过渡金属和硼原子之间存在不同的电荷转移引起的。
(1) 力学性能:制备TMBs最有效的方法就是引入高温高压等极端条件。高压可以缩短原子间距,增加电子云交叠,有利于形成强化学键和空间3D结构。高温高压合成有利于制备出高致密性的体材料。2007年,Chung等[35]制备出了ReB2超硬材料,ReB2沿着(001)晶面具有较强的抗压头剪切能力以及存在褶皱的硼层,体现了准3D的效应。
高硼相和低硼相是否对过渡金属硼化物的硬度有影响呢?研究表明TMBs中低硼相的硬度并不低于高硼相,硼含量的高低并不能决定其硬度[36]。低硼相的硬度和过渡金属与硼原子之间的化学键结合的强弱有关。高硼相、具备3D硼结构的过渡金属硼化物并不一定具备高硬度,因为3D硼空间中部分B—B化学键具有方向性;部分B—B键为扭曲的共价键,此类方向性不好的共价键较弱,在压头剪切的作用下更容易发生断裂。TMBs作为多功能硬质材料具有重要的实际应用价值,如利用磁控溅射方法在304钢为基底上制备2.8 μm的WB2薄膜[37]、硼原子缺失的MoB2-x薄膜[38]、直径5 nm左右的TiB2纳米柱超硬薄膜[39]。
(2) 超导性质:许多TMBs的超导性能没有一种超过MgB2的Tc,如Mo2B (Tc= 5.07 K)和W2B(Tc= 3.22 K)、TaB (Tc= 4 K)和NbB (Tc= 8.25 K)。几乎所有富硼金属硼化物不具有反铁磁超导体,如ScB12(Tc= 0.39 K)、YB6(Tc= 7.1 K)、YB12(Tc= 4.7 K)、ZrB12(Tc= 5.82 K)、LaB6(Tc= 5.7 K)、LuB12(Tc= 0.48 K)和ThB6(Tc= 0.74 K)。
(3) 电学/光学性质:有相当一部分TMBs的电阻系数比较小,如TiB2、ZrB2和HfB2具有高电子传导性行为;M3B4(M = Ti、V、Cr、Zr、Nb、Mo、Hf、Ta和W)、Mo2B2和Fe2B2也显示出金属导电性。TMBs在可见光谱范围中不具有任何光学性质,这些特性导致了硼化物的一些特殊应用。如硼化物薄膜被用作紫外光的滤光片用于深空望远镜[40]。
(4) 催化:自20世纪60年代以来,金属硼化物粉末被用作各种有机反应的催化剂,其中效果最显著的是氢化和还原。早期通过NaBH4制备出无定形TMBs沉淀的催化性质未得到充分解释[9],原因是这种无定形现象掩盖了硼对催化活性的作用,表面认为高金属含量是催化活性的原因。计算表明,强M—B键的存在降低了晶粒生长的机会,保持了硼化物高的表面积,其中硼具有维持结构稳定的作用。Vrubel等[41]提出了Mo—B作为非贵金属在酸性和碱性条件下的析氢催化剂,表现出良好的稳定性。虽然与Pt/C的性能仍然存在差距,但是为后续的金属硼化物作为水电解催化剂的研究提供了思路。近年来,非/贵金属金属硼化物(M = Mo、W、Fe、Ni、Co、V、Ru、Pd、Os、Re等)都展示出优秀的催化活性[42]。2022年纳米晶态CoB催化剂实现了催化氨硼烷高效制氢[43]。1981年首次研究TMBs作为电催化产氧(OER)催化剂[44]。最近,TMBs才作为潜在的OER电催化剂重新获得关注,如基于Fe、Co和Ni的单金属(CoB、Co2B、Co3B、Ni2B、Ni3B、TiB2、Fe2B等)、双金属(NixFe2-xB、Gd-CoB、Fe3Co7-B等)和三金属硼化物(Fe-Co-2.3Ni-B、NiCoFeB、V掺杂NiCoB等)材料被开发为高活性、低成本和稳定的OER电催化剂[9]。Bai等[45]用化学还原法和KOH水解合成氢氧化镍铁硼(NiFeB hydroxide)纳米片表现出良好的电催化析氧性能。此外,利用化学气相沉积法,采用TiB2、TaB2、MoB、Mo2B5、Ni2B等金属硼化物为催化剂和硼源,在氮气环境下可成功制备出克量级的BNNTs。由于其不需要尖端的合成设备,适合推广及其产业化[46,47]。然而,TMBs在水分解、燃料电池和金属-N2/O2/CO2电池中的放大实验研究很少。
(5) 电化学储能:1999年,美国专利报告[48]首先构想出利用金属硼化物的多电子反应特性,以KOH水溶液为电解质,将金属硼化物作为负极材料制成高容量的一次性电池。随后,杨汉西等[49]利用三电极体系研究了VB2和TiB2电极在30% KOH溶液中的电化学行为,两个化合物的循环伏安曲线都显示了很强的阳极氧化峰,说明这两个化合物均具有优异的电化学氧化活性,反应机理如下:
Tu等[50]利用化学还原法制备Co-Ni-B纳米颗粒,作为水系电池的正极材料,具有出色的倍率和循环性能;VB2、TiB2、Fe-B、Co-B等作为水系电池的负极材料具有优异的电化学性能[51,52];NixB[53]和CoB[54]作为超级电容器的电极材料,在碱性电解液中展现出良好的电容行为。非水体系中,CoB[55]、Co2B[56,57]、Ni3B[58]、ZrB2[59]、Mo/MoB[60]能够作为吸附-催化长链多硫化锂中间体催化转化为短链硫化锂产物的催化剂。
5 稀土金属硼化物(rare earth boride,REBs)
REBs家族主要有REB2、REB4、RE2B5、REB6、REB12、REB66等,其中RE为稀土金属元素。其中稀土六硼化合物REB6是被广泛研究的金属间化合物之一。REB2(RE = Ce、Pr、Nd、Pm)所有化合物具有AlB2(P6/mmm)和ReB2结构的机械稳定性[61]。REB6具有特殊的CaB6型晶体结构。REB4(RE = La、Ce、Gd、Tb、Dy)属于P4/mbm空间群的四方晶系[62];在17种稀土元素中,除了放射性元素未研究外,目前只发现13种稀土元素RE (La、Ce、Sm、Eu、Pr、Nd、Gd、Yb、YB、Tb、Dy、Ho、Er)能和B形成REB6、REB12[63]。REBs的应用主要表现在以下两方面:
(1) 热发射性能:电子发射是一种表面现象。作为理想的热阴极材料,重要特性是具有低功函数和高表面稳定性。多晶稀土硼化物块体制备较为容易,但由于多晶体存在大量的孔隙、晶界与位错等缺陷,其电子发射性能有限。Tang等[64]利用LaB6制成纳米针作为球差透射电子显微镜中的电子源,获得了0.96 Å的分辨率。与现在使用的W(310)电子源相比,具有更小的能量扩散。Nagao等[65]利用优异光学响应和低损耗的高结晶LaB6薄膜的生长,结合其固有的耐火性能,建立了实现单轴和相干LaB6薄膜的最佳生长参数,在近红外到中红外器件应用中表现出优异的等离子体响应和温度稳定性,可以承受恶劣的光热设备操作。
(2) 电化学储能:稀土金属六硼化物具有超低的功函数,意味着当用作电化学能源材料甚至电池材料时,其工作温度更低,使用寿命更长。Wang等[66]通过低温溶液燃烧法和高压固态反应分别制备了CeB6纳米颗粒和纳米线作为锂离子电池负极。在1000 mA·g-1下6000次循环测试后,循环稳定性良好且比容量仍接近100 mA·g-1。该课题组进一步报道了EuB6和YB6的储锂性能[67]。与商业化的石墨负极材料相比,稀土六硼化物纳米结构的循环稳定性能更好,但整体电化学性能比其他金属硼化物没有竞争力,各方面性能还有很大的提升空间,尤其是充放电比容量。苏丽娜[68]采用第一性原理对稳定的单层LaB4作为锂离子电池负极材料的性能进行了分析,发现单层LaB4两侧最多可以吸附24个Li原子,最大理论比容量为294 mAh·g-1。
6 结语
基于要“把最新研究成果引入教学内容”的教材改革要求,体现教学“知识-能力-素质有机融合”的理念,我们将金属硼化物的研究进展及其在先进功能材料中的应用,做了较为系统的综述。在计算化学的理论和算法发展背景下,对金属硼化物的结构、性质、应用方面进行的预测,加上随着科学技术的发展,让极端条件下进行化学合成反应成为可能。它们具有的特殊性质不管在理论研究还是新型功能材料潜在应用的开发方向都有重要作用。希望本文能起到有助于教师备课和学生自主拓展学习的作用,特别是相关文献的系统学习,对提高学生对科学问题的理解力、思考力和判断力以及释放出创造能力都具有重要意义。

