智能型药物控释可视化系统的构建与表征
——高分子实验的新设计与教学实践
张来英,苟洪瑀,庄海妮,秦宇航,邱惠娟,吴伟泰
厦门大学化学化工学院,福建 厦门 361005
实验教学是化学类和近化学类专业本科教学中不可或缺的部分。为了能更好地培养学生分析问题、解决问题、理论和实践相结合和创新的能力,以帮助学生在毕业后更快更好地适应科研或实际工作需求,设计与科研前沿及与生产、生活实际联系更为紧密的实验教学内容和实验方法势在必行。创新设计的综合性强化实验作为实验课程体系中的重要一环,以实际需求为导向,以科研带动教学内容的更新,交叉融合多学科知识,更注重实际应用,有望改变传统灌输式的教学方法和动手能力不强的培养现状,有效提高学生的实验主动性,提升学生综合运用知识的能力,并培养创新思维的习惯,以期为推动高等教育实验教学改革、提高本科实验教学质量提供参考。
高分子化学是化学和材料学科最重要的专业基础课程之一。近年来,随着高分子科学和材料科学的迅猛发展,合成性能优异的高分子新材料已成为研究热点,可为生物医药等领域发展提供基础。众所周知,血液中药物浓度(即血药浓度)存在安全范围,而传统片剂、注射剂等药物制剂在进入人体后的释药速率具有不可控特征,使得血药浓度在短时间内到达峰值后快速降低,因此往往需要适量多次给药,以维持相对稳定的血药浓度,使之处于既不高于安全上限阈值、也不低于可产生药效下限阈值的较窄范围内。如果将载体材料与药物分子相结合,设计构建出智能型药物控释系统,使之可以通过某种方式调控释放药物,将有望在减少不良反应的同时提高药物利用率,从而缓解上述问题[1–3]。在众多载体材料之中,刺激响应性高分子微凝胶具有合成方法简单、响应快、生物相容性良好等优点,受到广泛关注[4,5]。基于以上背景,本实验围绕着高分子微凝胶的合成及其用作药物载体材料,设计了一个集高分子化学、物理化学、仪器分析等学科交叉融合为一体的综合性强化实验。通过温敏性微凝胶的合成,促进学生加深对自由基沉淀聚合的理解;同时,通过温度响应特性的紫外-可见分光光度计和动态激光光散射仪等表征,结合高分子微凝胶用作药物载体材料以设计构建智能型药物控释系统的需求,促进学生深入体会高分子材料设计理念。
值得一提的是,实现化学实验的绿色化是非常紧迫而重要的任务。药物释放涉及分子扩散等物理化学基本知识,但传统药物分析中常用的化学检验方法存在着试剂消耗量大等诸多缺点,对教学成本和环境都非常不友好,并不符合绿色化学的概念。为此,本实验从绿色化学理念出发,提出结合色彩理论与化学知识来理解药物释放过程,以在可见光区存在明显吸收的药物作为模型药物,将“没有明显实验现象”的药物释放过程“可视化”,增强实验教学效果,以达到节省实验教学试剂、提高学生对实验的兴趣等目的。该方法结合了分子扩散、物质吸光定律等知识,通过色度分析等即可获得药物分子浓度随时间变化的曲线,甚至可拓展到利用智能手机和取色软件,就可开展药物释放动力学实验。
1 实验目的
(1)巩固高分子材料设计与合成方法,掌握自由基沉淀聚合的基本理论及实验操作;
(2)了解药物释放动力学,加深理解分子扩散的物理化学基本知识;
(3)提升学生对紫外-可见分光光度计、动态激光光散射仪等仪器的使用及分析能力。
2 实验原理
水凝胶是一类具有三维交联高分子网络、网络内含有水等溶剂的高分子材料,展现出类似于生物组织的柔韧性等特性,因而可用作载体材料以设计构建药物控释系统[6]。尤其受到重视的是可感知外界环境(温度、pH、葡萄糖等)而自身产生物理化学性质变化的刺激响应性高分子凝胶。对于由具有最低临界溶解温度(lower critical solution temperature,LCST)的高分子链构成的温敏性微凝胶,在高分子链LCST的相应温度附近,会发生温度响应体积相转变,该温度称为体积相转变温度(volume phase transition temperature,VPTT)。相比于宏观块状凝胶,颗粒尺寸为微纳米级的刺激响应性高分子微凝胶[7]具有“响应快”等优势[8]。本实验将聚焦高分子微凝胶合成,使用2-甲基-2-丙烯酸-2-(2-甲氧基乙氧基)乙酯(diethylene glycol monomethyl ether methacrylate,EO2)、聚乙二醇二甲基丙烯酸酯(poly(ethylene glycol)dimethacrylate,PEGDMA)作为原料,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)作为表面活性剂,过硫酸铵(ammonium persulfate,APS)作为引发剂,通过水相自由基沉淀聚合法合成温敏性微凝胶(为讨论方便,写为PEO2;如图1所示),并将其用作载体材料以设计构建智能型药物控释系统,利用微凝胶低温溶胀、高温收缩的特性,实现药的装载、释放。为使药物释放过程“可视化”,本实验选用在可见光区存在明显吸收的抗癌药物盐酸阿霉素(doxorubicin,DOX·HCl)作为模型药物。
2.1 温敏性微凝胶的自由基沉淀聚合法合成原理
从高分子化学知识角度来说,微凝胶可由单体在均相或微纳米多相环境中通过自由基聚合机理制备获得,如沉淀聚合、乳液聚合、微乳液聚合、无皂乳液聚合等,其合成关键在于如何抑制高分子链的过度聚合交联,以控制凝胶颗粒尺寸处于微纳米级[9]。从胶体化学知识角度来说,微凝胶的聚合制备一般主要经历成核、生长过程。在本实验中,我们将采用自由基沉淀聚合法(radical precipitation polymerization)来合成高分子微凝胶。自由基沉淀聚合法是非均相聚合法,是指生成的聚合物不溶于其单体,或者单体和引发剂能溶于反应介质但生成的聚合物不能溶于反应介质,使得聚合物生成后从反应体系中沉淀出来的一种聚合方法。对于本实验的温敏性高分子微凝胶合成,我们将选用具有LCST的高分子的相应单体作为原料,在反应过程早期,该单体可聚合形成高分子链;当这些高分子链增长到达一定长度时,由于反应温度高于高分子的LCST,高分子链将蜷曲形成前驱体颗粒;由于范德华引力等作用,这些前驱体颗粒在积累到一定浓度后发生聚集。前驱体颗粒及其聚集体的形成,叠加聚合反应,使得凝胶颗粒不断长大,直到达到平衡状态,形成稳定的、具有一定颗粒尺寸分布的微凝胶[10]。如果有需要,通过适当调节单体、表面活性剂的种类和投料量等,可以调节微凝胶的尺寸[11]。
2.2 药物分子装载及其释放的原理
本实验将以上合成的温敏性微凝胶用作载体材料以设计构建智能型药物控释系统,利用微凝胶低温溶胀、高温收缩的特性,实现药的装载、释放。在温度低于VPTT时,微凝胶溶胀;当将溶胀的微凝胶置于一定浓度的药物分子溶液中,由于药物分子在微凝胶内、外存在浓度差,药物分子可扩散进入微凝胶内部直至达到浓度平衡,实现药物分子的装载。在温度高于VPTT时,微凝胶收缩,收缩过程伴随高分子网络产生的“收缩力”,药物分子将随同水一起被“挤出”,从微凝胶内部扩散到外部溶液中,实现药物分子的释放。由于选取的模型药物分子DOX在可见光区存在吸收,因此在释放过程中可观察到溶液颜色的变化。
在“可视化”感性认识药物分子释放过程的基础上,本实验将进一步结合物理化学知识,理性分析药物分子释放过程的分子扩散机理。对于微凝胶等多孔聚合物中药物分子等生物活性物质的释放,在多数情况下,该释放符合Fick定律,其动力学过程可用Higuchi及其改进模型来描述[12]。但当初始含药量大于药物的溶解度时,实验结果经常与Higuchi模型不一致,此时药物恒速释放,具有溶出控制的特征。Paul等提出了一个简单的半经验指数方程[13]:
Mt/M∞=ktn
式中,Mt和M∞分别为时间t时和无穷时间时的药物累积释放量;k为结构常数;n定义为扩散指数,其数值与释放机理有密切关系。一般情况下,0 1只1 mL针筒,2只2 mL针筒,电子天平,带有加热控温功能的磁力搅拌器,磁子,橡胶塞,封口膜,250 mL三颈烧瓶,球形冷凝管,100 mL量筒,油浴锅,烧瓶夹,冷凝管夹,2只气球,1个长针,2个针头,称量纸,1个4 mL离心管,50 mL离心管若干,滴管若干,10 mL量筒,锡纸,透析袋(M.W.=14000),细绳,100 mL烧杯,移液枪,1.5 mL离心管若干。 2-甲基-2-丙烯酸-2-(2-甲氧基乙氧基)乙酯(EO2,Aldrich),聚乙二醇二甲基丙烯酸酯(PEGDMA,Aladdin),过硫酸铵(APS,Aldrich),盐酸阿霉素(DOX·HCl,迪柏生物),5 mmol∙L-1pH=7.4、pH=8.0的磷酸缓冲盐溶液(PBS,所用的十二水合磷酸氢二钠、二水合磷酸二氢钠、氯化钠均为国药试剂),均为分析纯。 紫外-可见分光光度计(Thermo Scientific公司,Multiskan GO全波长酶标仪),动态激光光散射仪器(BI-200SM,Brookhaven公司)。 (1)将EO2、PEGDMA分别放置于电子天平上,用针筒分别从中抽取1.882 g EO2、0.11 g PEGDMA,加入至已装有磁子、两端口用橡胶塞塞紧的250 mL三颈烧瓶中,再加入100 mL去离子水; (2)将三颈烧瓶浸入置于磁力搅拌器上的油浴锅中,装上球形冷凝管,固定反应装置,确保烧瓶内液面高度低于油浴液面,并对反应体系进行通Ar气、排空气处理,反应装置图如图2所示; 图2 温敏性微凝胶PEO2的合成装置图 (3)将搅拌器温度设定为70 °C,保持加热10 min,称取0.046 g APS于4 mL离心管中,加入1 mL去离子水溶解,摇匀。取一只2 mL针管吸取离心管中配好的溶液,向反应体系缓慢、逐滴滴加; (4)反应持续进行约3 h。反应完毕后将溶液转移至离心管,离心、洗涤2–3次后撇去上清液,得乳白色PEO2微凝胶。 (1)避光条件下称取5 mg DOX·HCl于50 mL离心管中,加入10 mL pH=8.0 PBS缓冲液,振荡,使药物完全溶解;将离心浓缩的微凝胶加入到装有药物溶液的离心管中,将离心管盖好并包上一层锡纸,放入冰箱冷藏保存10 h; (2)冷藏10 h后,将装有药物凝胶的离心管取出后进行离心,并用pH=8.0 PBS缓冲液洗涤2–3次,以去除凝胶表面的药物。撇去上清液后得橘红色装载药物的DOX@PEO2。 (1)将50–60 mL pH 7.4 PBS缓冲液加至100 mL烧杯,放置于磁力搅拌器上进行搅拌,设置温度为39 °C、转速为600–650 r∙min-1; (2)将DOX@PEO2装入透析袋后,置于上述烧杯中,每隔30 min或者1 h用移液枪量取1 mL样品溶液于1.5 mL离心管中,同时向释放体系中补充1 mL pH 7.4 PBS缓冲液; (3)采用紫外-可见分光光度法,获得样品溶液在300–700 nm处的吸收光谱。 (1)取200 μL微凝胶溶液后用去离子水稀释至10 mL左右,利用涡旋振荡器对稀释液进行混匀,配制微凝胶稀释液,用动态激光光散射仪测量不同温度下微凝胶稀释液中微凝胶的流体力学直径 (2)用紫外-可见分光光度计测量药物释放不同时间下溶液的吸光度并绘制释放曲线。 紫外-可见分光光度法测试不同温度(36–44 °C)下PEO2微凝胶溶液在350 nm波长处的吸光度,结果如图3所示。从图3中可得,微凝胶溶液在350 nm处的吸光度随着温度的升高,呈现先上升后趋于平稳的趋势。这代表微凝胶在温度改变前后产生了刺激响应,温度响应区域为37–40 °C。通过对350 nm吸光度–温度曲线进行一阶导并利用Lorentz函数进行拟合,可获得该微凝胶的VPTT为38.0 °C。 图3 微凝胶溶液在不同温度下对350 nm波长吸光度-温度图(左)及其一阶导数图(右) 通过动态光散射测试不同温度(30–44 °C)下PEO2微凝胶的水合粒径并作图。如图4所示,在30–44 °C温度范围内,随着温度的升高,PEO2微凝胶的流体力学直径先保持不变,后在36–40 °C范围内发生突降,最后趋于平稳。这代表微凝胶在温度改变前后产生了体积相转变,转变区域为37–40 °C。对流体力学直径 图4 不同温度下微凝胶的水合粒径变化图(左)及其一阶导数图(右) 上述分析结果可以解释为:低温时,聚合物链可与水形成氢键作用,处于舒展状态,微凝胶溶胀,微凝胶溶液呈现透明状态,溶液具有良好的透光率;高温时,聚合物链与水之间的氢键被破坏,聚合物链间形成氢键作用,微凝胶收缩,粒径减小,微凝胶呈现浑浊状态,溶液透光率降低。 如图5所示,通过观察药物释放中溶液的颜色变化,发现可以将“没有明显实验现象”的药物释放过程“可视化”。随释放时间的延长,溶液颜色逐渐加深,这是由于药物控释系统中的药物分子被不断释放,在溶液中逐渐累积所导致的。 图5 DOX@PEO2药物释放过程可视化的图片展示 为对药物释放过程进行定时、定量监测,我们对药物释放过程的溶液进行定时取样并测试相应的紫外-可见吸收曲线。我们通过紫外-可见分光光度仪测试了透析液在300–700 nm波段处的吸收曲线,结果表明药物分子DOX在480 nm处存在吸收,且随药物释放时间的延长,透析液在480 nm处的吸收峰逐渐升高后趋于平稳,如图6所示。由此也可看出,当释放时间超过12 h时,药物基本释放完全。 图6 不同释放时间透析液在300–700 nm波段处的吸收曲线 通过截取不同释放时间的样品溶液在480 nm处的吸光度可绘制药物释放过程的动力学曲线,如图7所示。根据物质吸光定律,可直接使用吸光度等代替Mt和M∞来进行拟合获得扩散指数n,以从微观上了解药物分子的释放机理。采用Peppas模型(Mt/M∞=ktn)进行拟合,实际方程为Mt/M∞=0.48t0.31(R2=0.988),获得拟合扩散指数n值为0.31。可见,本实验中智能型药物控释系统DOX@PEO2的药物分子释放是Fick扩散控制为主的过程。 图7 DOX@PEO2在39 °C下的药物释放曲线:480 nm处吸光度变化图(左)及对应的Peppas模型拟合图(右) (1)化学合成实验中,温度设为70 °C的主要目的有哪些? (2)在使用紫外-可见分光光度法表征VPTT时,如果存在特征吸收峰并采用该吸收值进行表征实验,是否会影响实验结果? (3)结合高分子凝胶等知识,简述分子扩散与药物释放的联系。 (4)这种基于高分子微凝胶的药物控释系统有哪些潜在的应用? (5)结合之前学习的化学知识,本实验可以拓展到其他哪些可控系统的构建? 本实验是厦门大学化学化工学院综合化学实验“温度响应高分子微凝胶的水相制备与表征”[14]的并行实验之一,广受学生欢迎。该实验极大地激发了学生学习的兴趣和好奇心;在锻炼实验能力的同时,启迪了学生的创新意识和创新思维;有助于培养学生的学科融合思维和环保意识,培养学生将理论、实验和实践有机融合起来发现并解决问题的能力,提升了学生的创新科研素养,为将来科研或工作奠定了基础。 本实验可分为两大部分,一部分实验内容为微凝胶的合成、表征及其药物装载,另一部分实验内容为药物释放过程,分别在同一周内的两天(或者连续两周,每周各一天)进行;每次实验时间建议为6–12小时,学生可以单人单套操作也可以2–3人一组,可以作为综合性强化实验引入。除本文所列实验内容外,还可根据实际教学需要,拓展至其他响应性高分子及药物,开设为探索性实验。 本文介绍高分子实验的一个新设计与教学实践。通过水相自由基沉淀聚合法合成了温敏性微凝胶,并使用紫外-可见分光光度计和动态激光光散射仪对其温度响应特性进行表征,进而将其用作载体材料以设计构建智能型药物控释系统,利用微凝胶低温溶胀、高温收缩的特性,实现药物的装载、释放。提出结合色彩理论与化学知识来进行药物释放的测定,以在可见光区存在明显吸收的药物作为模型药物,将“没有明显实验现象”的药物释放过程“可视化”,以更加直观的方式观测药物释放的过程;在此“可视化”感性认识的基础上,进一步结合物理化学知识,通过紫外-可见分光光度法对药物释放过程进行定时、定量监测,以理性分析药物分子释放过程的分子扩散机理。 本实验在水相中进行小量合成,简便易行、绿色环保、安全可靠且成本较低,集高分子化学、物理化学、仪器分析等学科交叉融合为一体,可面向化学、材料、药学等专业开设,有较好的普适性和较强的可设计性,适合作为本科生实验课程开展。本实验可拓展利用智能手机和取色软件,代替紫外-可见分光光度计来开展相关实验内容,因此在智能手机普及的当下,甚至有望在实验条件欠缺的学校中推广这个实验。3 实验材料、试剂和仪器
3.1 实验材料和试剂
3.2 仪器
4 实验步骤
4.1 温敏性微凝胶PEO2的合成

4.2 智能型药物控释系统DOX@PEO2的构建
4.3 智能型药物控释系统DOX@PEO2的药物释放过程
4.4 表征和测试
5 结果与讨论
5.1 温敏性微凝胶PEO2的紫外-可见分光光度法表征

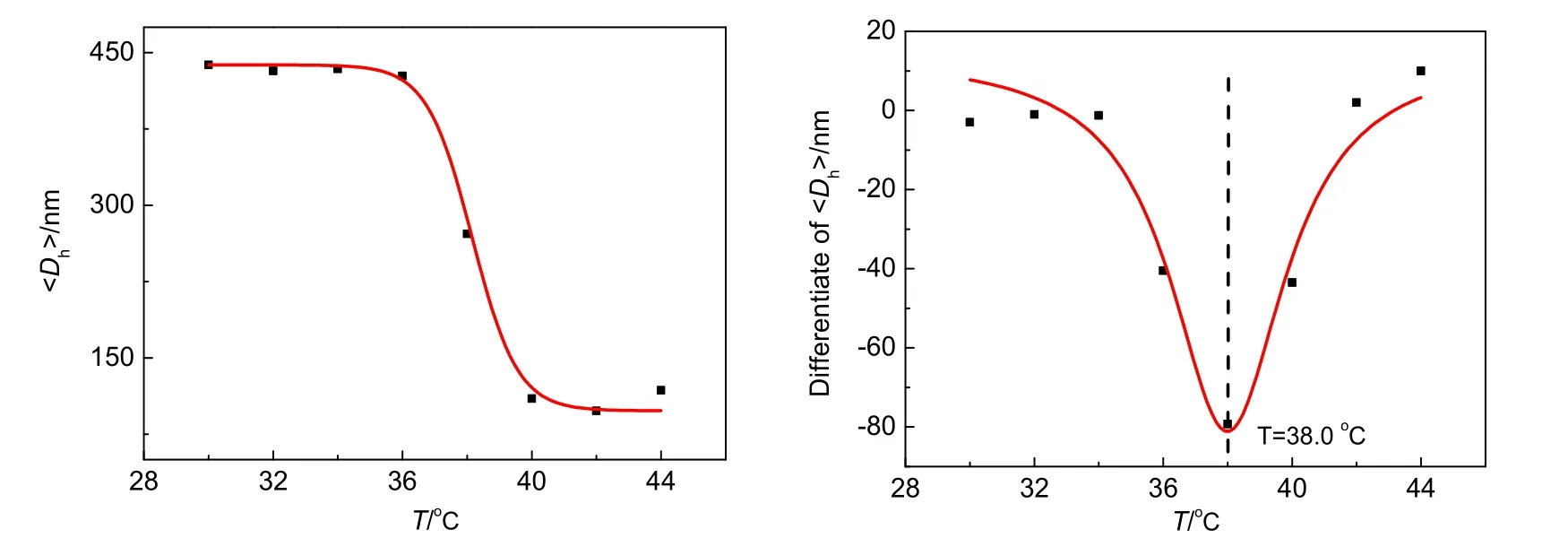
5.2 温敏性微凝胶PEO2的动态激光光散射仪表征
5.3 智能型药物控释系统DOX@PEO2的药物释放过程可视化

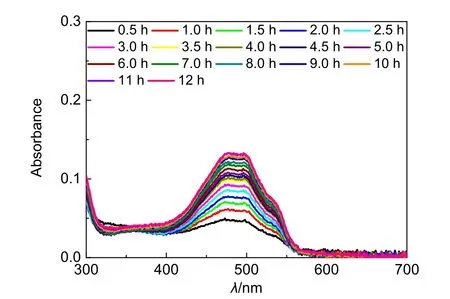
5.4 智能型药物控释系统DOX@PEO2的药物释放动力学

6 思考题
7 教学反馈与教学建议
8 结语

