木薯MePPD3 基因的克隆及功能分析
贾素行,朱寿松,符仁稳,李春霞,陈银华
(海南大学 热带作物学院,海口 570228)
木薯(Manihot esculenta)是热带地区主要的粮食作物和经济作物,有着“地下粮仓”、“淀粉之王”的称号[1-2],木薯在我国主要用于各种工业原料的生产[3-5],其市场前景十分巨大。菜豆黄单胞菌木薯萎蔫致病变种(Xanthomonas phaseolipv.manihotis,Xpm)早已列入我国有害生物名录,它是木薯细菌性枯萎病的病原菌,其能够使木薯叶片褪绿萎蔫甚至全株死亡,可导致木薯减产20%~90%[6-7]。1991 年于类囊体腔中首次发现PsbP 蛋白,后经过不断研究发现PsbP 蛋白广泛存在于藻类、蓝细菌和高等植物中[8-9]。目前,已发现的PsbP 蛋白分为3 大类,分别是PsbP 蛋白、类PsbP 蛋白PPL(PsbP-like protein)和PsbP 结构域蛋白PPD(PsbPdomain protein)[10-12]。PsbP 蛋白是叶绿体光系统Ⅱ(photosystem Ⅱ complex, PSⅡ)的重要组成部分,它在维持钙离子、氯离子浓度方面发挥重要作用;此外,敲除PsbP基因后, PSⅡ的功能将受到一定的影响[13-15]。科学家在拟南芥(Arabidopsis thaliana)中发现,PPL1 能参与 PSⅡ复合体的组装,其和植物适合光照强度变化有关[16-17];拟南芥的PPL2 缺失突变体中,叶绿体NADH 脱氢酶的积累量和活性降低[17]。Roose 等[8]于2007 年从拟南芥基因组中鉴定出7 个PPD 蛋白,它们分别是PPD1、PPD2、PPD3、PPD4、PPD5、PPD6、PPD7。已有研究发现,PPD1 是PSI 复合体的组装因子,在拟南芥中,PPD1 缺失突变体能导致PSI 复合体无法正常组装,从而影响植物的光合作用[18-19];在拟南芥中,PPD5 蛋白和OST1 相互作用并被其磷酸化,使细胞中H2O2积累增加并使气孔关闭增强[20]。但目前尚未有过任何关于PPD3 蛋白功能的研究报道。
本研究以‘华南8 号’木薯为材料,通过qRTPCR 扩增得到MePPD3(Manihot esculenta psbP domain-containing protein 3)基因,并对该基因进行生物信息学分析;同时,对该基因在木薯不同部位和病原菌XpmCHN11 侵染后不同时间的表达模式进行分析;最后利用TRV 介导的基因沉默技术沉默MePPD3基因后测定抗病表型,旨在为进一步研究MePPD3基因的分子机理和木薯抗细菌枯萎病的抗病机理提供基础。
1 材料与方法
1.1 菌株大肠杆菌DH5α 感受态细胞和农杆菌GV3101 感受态细胞购自上海唯地生物;菜豆黄单胞菌木薯萎蔫致病变种Xanthomonas phaseolipv.manihotisCHN11 由笔者所在实验室提供。
1.2 植物材料供试的木薯品种为‘华南8 号’(‘SC8’),由笔者所在实验室提供。
1.3 试剂多糖多酚植物总RNA 提取试剂盒(RNA prep Pure Plant Kit)和RNA 反转录试剂盒(FastKing gDNA Dispelling RT SuperMix)购自天根生化科技有限公司;琼脂糖凝胶回收试剂盒和质粒小提试剂盒购自艾德莱。
1.4 所用引物从phytozome 数据库中下载木薯MePPD3基因的CDS 序列,使用Primer Primer 5.0 分别设计该基因的全长扩增引物、定量分析引物和亚细胞定位引物。本研究所用引物如表1所示。

表1 本研究所用引物
1.5 MePPD3基因cDNA 全长序列克隆取少许木薯叶片于液氮中速冻,用液氮预冷后的研钵进行研磨。使用试剂盒提取木薯RNA 并将其反转录为cDNA。以木薯cDNA 为PCR 模板,以MePPD3-F 和MePPD3-R 为引物,扩增木薯Me-PPD3基因序列。待琼脂糖凝胶电泳检测结果无误后,转入植物亚细胞载体pCAMBIA1300-35SGFP 中,挑选阳性单克隆送至楠山生物进行测序。
1.6 MePPD3基因的生物信息学分析借助SignalP 5.0 Server 对MePPD3 蛋白的信号肽进行预测;通过TMHMM Serverv 2.0 分析MePPD3 蛋白的跨膜结构;利用NetPhos 3.1 Server 在线工具(http://www.cbs.dtu.dk/services/NetPhos/)预测Me-PPD3 蛋白的磷酸化位点和糖基化位点;分别使用在线网站PSIPRED.(http://bioinf.cs.ucl.ac.uk/psipred/)和PHYRE2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)预测MePPD3 蛋白的二级结构和三级结构。
通过NCBI 序列比对,找到MePPD3 蛋白在不同植物中的同源蛋白。通过DNAMAN 8.0 软件对这9 个同源蛋白进行多序列比对;使用MEGA 11.0 软件对这些同源蛋白构建NJ 进化树;使用MEME 在线网站对MePPD3 及其同源蛋白进行保守Motif 分析。
1.7 MePPD3基因的亚细胞定位将构建好的植物亚细胞定位载体pCAMBIA1300-35S-GFPMePPD3与空载pCAMBIA1300-35S-GFP 分别转入GV3101 菌株。挑取阳性克隆于28 ℃ 200 r·min-1培养过夜,取适量菌液转移至新的LB(含Kan 和Rif)液体培养基中扩大培养。调节OD600≈1.0,黑暗静置2.5 h,注射于生长30 d 左右的烟草(Nicotiana tabacum)叶片背面,做好标记,培养40 h 后于共聚焦显微镜下观察其荧光。
1.8 qRT-PCR 检测MePPD3基因在木薯不同部位中的表达水平使用Primer Primer 5.0 设计定量引物qpcr-MePPD3-F/R。分别取长势相同的木薯的顶芽、幼嫩叶片、成熟叶片、叶柄、须根、块根等部位,每个部位至少3 个生物学重复,液氮速冻后,使用RNA prep Pure Plant Kit 试剂盒提取木薯总RNA,然后再按照FastKing gDNA Dispelling RT SuperMix 试剂盒的流程反转录cDNA。
1.9 qRT-PCR 检测XpmCHN11 侵染后不同时间MePPD3基因表达水平变化用OD600≈0.05的菜豆黄单胞菌木薯萎蔫致病变种XpmCHN11侵染多株长势相同的木薯,分别于侵染后0 h、6 h、1 d、3 d、5 d 随机剪取叶片,液氮速冻后将其研磨提取RNA,并反转录为cDNA。
1.10 VIGS 沉默MePPD3基因后检测木薯抗病性有无变化构建沉默载体pCsCMV-MePPD3。将其与正对照pCsCMV-B 和负对照pCsCMVA 分别转化入GV3101 菌株,在LB 液体培养基(含Kan 和Rif)中培养阳性克隆至OD600=1.0。然后注射于木薯‘SC8’叶片背面,24 ℃培养30 d。
在LPGA 固体培养基(含Chl)上活化XpmCHN11 菌株,活化2 次后,用无菌水清洗菌体并稀释至OD600=0.05,用该菌液注射木薯叶片。侵染6 d 后,观察叶片表面病斑的扩散情况。
2 结果与分析
2.1 MePPD3基因的克隆及其理化性质分析以木薯RNA 为模板,MePPD3-F/R 为上下游引物,通过RT-PCR 技术,得到目的基因MePPD3(Manihot esculenta psbP domain-containing protein 3)(图1-a)。基因序列分析发现,MePPD3基因全长807 bp,编码268 个氨基酸。ExPasy 在线网站分析结果显示,MePPD3 相对分子质量为67 522.75,理论等电点为5.11,分子式为C2 467H4 129N807O1 033S184,不稳定系数为49.9,脂肪系数为27.14,亲水系数为0.775。使用NCBI 的CDD 数据库分析其保守结构域,结果发现,其氨基酸序列第106~266 位存在PsbP 结构域(图1-b),推测其为PPD3蛋白。

图1 MePPD3 基因全长扩增及蛋白结构分析
2.2 MePPD3 蛋白的生物信息学分析使用NetPhos 在线网站,预测MePPD3 蛋白有32 个磷酸化位点,其中,有19 个丝氨酸、6 个苏氨酸和7 个酪氨酸(图2-a);有5 个糖基化位点(图2-b);使用TMHMM 在线网站预测发现,其存在跨膜结构域(图2-c);使用SignalIP 在线网站发现,其无信号肽(图2-d);使用PSIPRED 在线网站预测MePPD3 蛋白二级结构,发现其有6 处螺旋结构,其中,螺旋占21.3%,折叠占26.5%,无规卷曲占52.2%(图2-e);通过PHYRE2 在线网站预测其三级结构,发现其有6 个螺旋结构,这符合二级结构预测结果和PsbP 蛋白的结构特征(图2-f)。
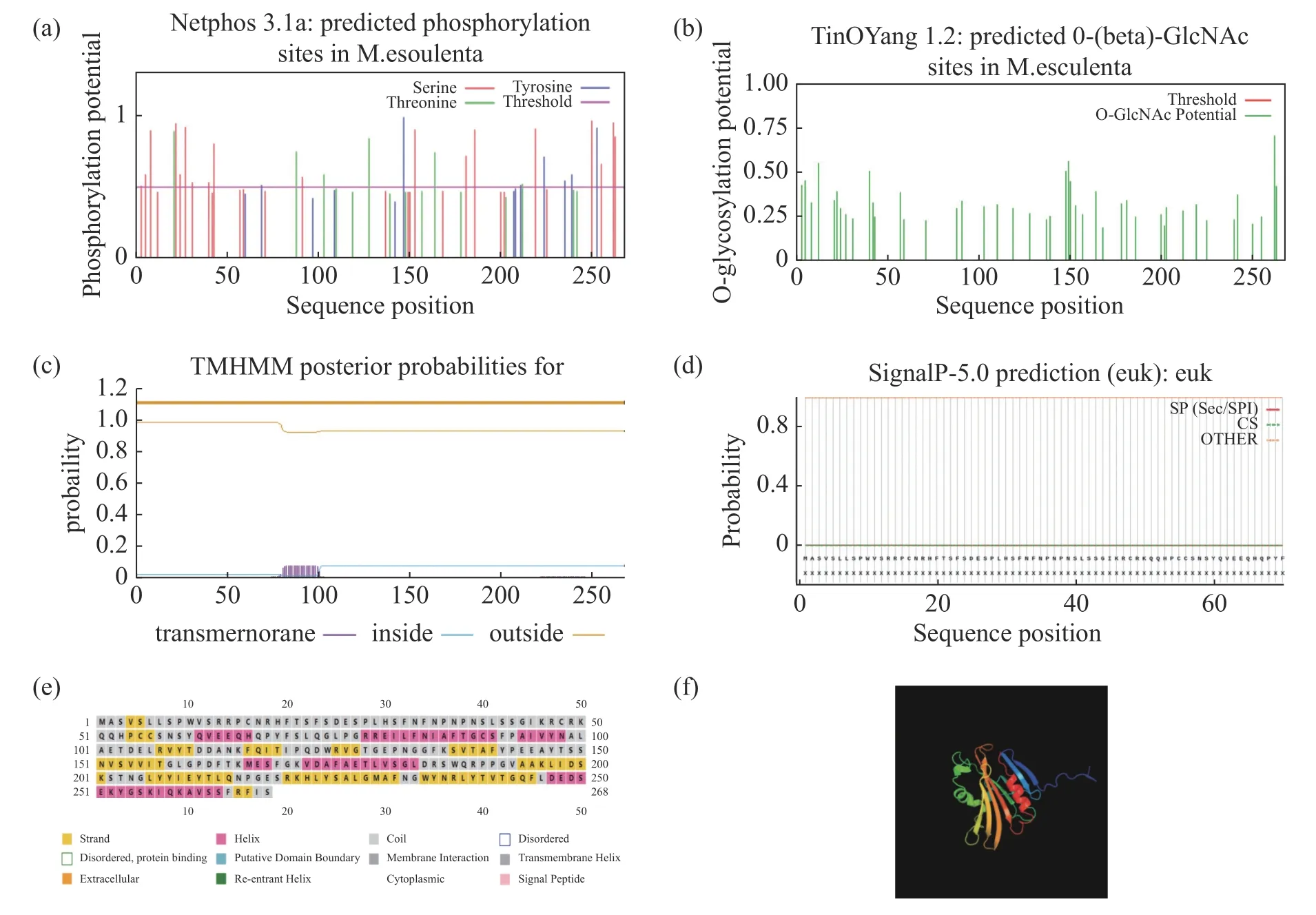
图2 MePPD3 蛋白的生物信息学分析
2.3 MePPD3 蛋白同源序列、进化树和保守结构域分析为研究PPD3 蛋白在不同植物中是否具有较高的同源性,首先在NCBI 通过BLAST 比对,在橡胶(Hevea brasiliensis)、蓖麻(Ricinus communis)、雷公藤(Tripterygium wilfordii)、茶树(Camellia sinensis)、胡杨(Populus euphratica)、芒果(Mangifera indica)、麻风树(Jatropha curcas)、开心果(Pistacia vera)等8 种植物中找到了与木薯MePPD3 蛋白同源的氨基酸序列(表2)。使用DANMAN 8.0 对这些序列进行比对(图3),结果发现,MePPD3 蛋白在不同的植物中具有较高的同源性,其中与橡胶中PPD3 蛋白的同源性最高。PsbP 保守结构域在不同植物中的差别不大(图中红线框),且N 端氨基酸序列含有叶绿体/线粒体定位信号(图中蓝线),表明MePPD3 蛋白可能定位于叶绿体或线粒体。

图3 MePPD3 在不同植物中的同源序列比对

表2 MePPD3 在不同植物中的同源蛋白
为了进一步验证这些蛋白的亲缘关系,使用MEGA11.0 对这9 个同源蛋白构建NJ 进化树(图4)。结果发现,木薯中的MePPD3 蛋白与其他几种植物中的MePPD3 蛋白具有较高的亲缘关系,值得一提的是它与橡胶中PPD3 蛋白的亲缘关系最接近,可达99%,蓖麻中的PPD3 蛋白次之。
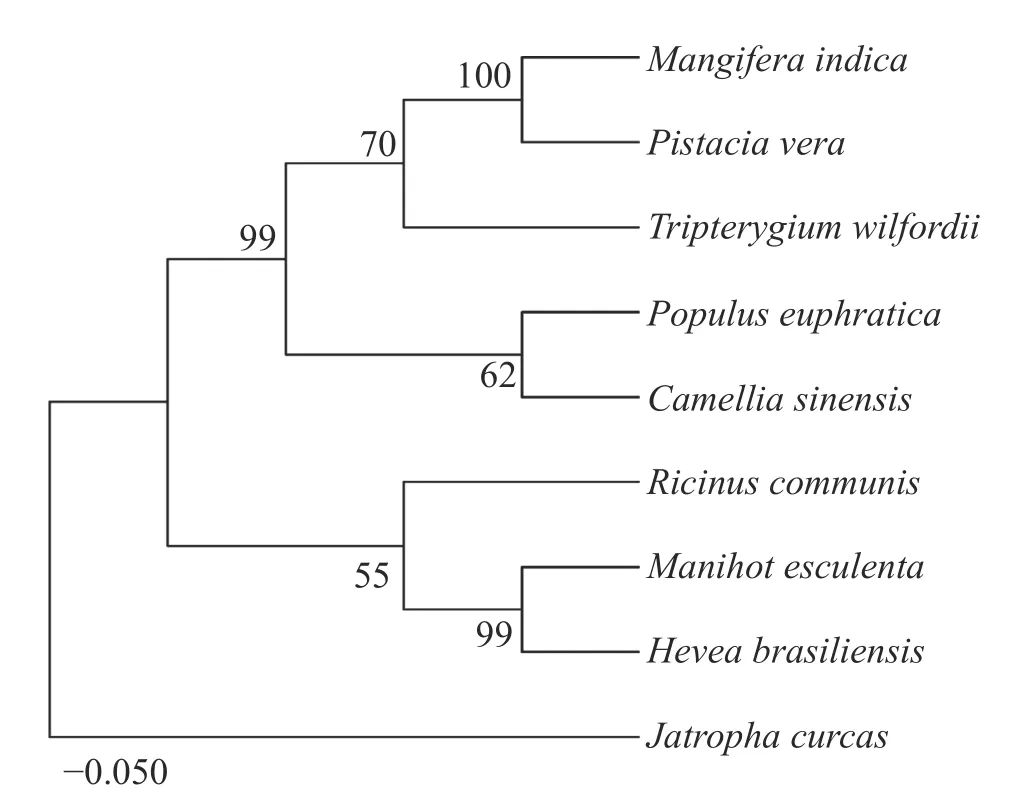
图4 不同物种间MePPD3 同源蛋白的系统进化树分析
应用MEME 在线网站对MePPD3 蛋白及其同源蛋白进行保守Motif 分析(图5),发现这9 个同源蛋白至少含有6 个保守Motif,其中,Motif 1、Motif 2、Motif 3、Motif 4 和Motif 6 具有高度保守性。此外,MePPD3 蛋白和橡胶、蓖麻中PPD3 蛋白具有Motif 的种类和数量一致,均具有这8 个Motif。这与同源蛋白多序列比对和进化树分析的结果一致,初步说明,PPD3 蛋白在不同植物体内具有较高的保守性,MePPD3 蛋白的功能极有可能与其他PPD3 蛋白的功能一致。
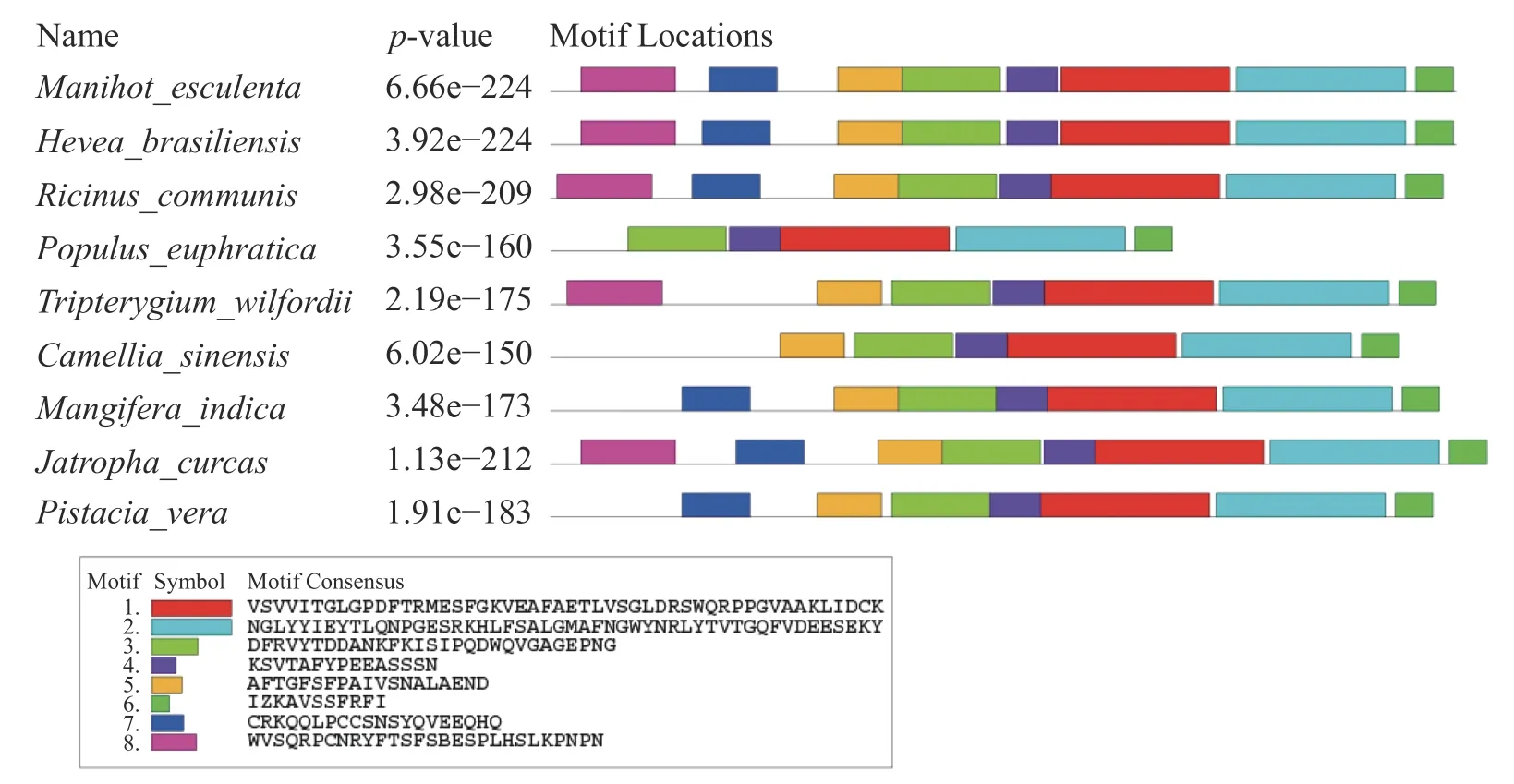
图5 MePPD3 结构域分析
2.4 MePPD3 蛋白的亚细胞定位为探究木薯MePPD3 蛋白在植物细胞内的亚细胞定位,构建了植物亚细胞定位载体pCAMBIA1300-35S-GFPMePPD3(图6-a)。使用已提前转进GV3101 菌株的亚细胞定位载体pCAMBIA1300-35S-GFPMePPD3和空载pCAMBIA1300-35S-GFP 注射生长约30 d 的烟草叶片。40 h 后,剪取叶片观察荧光信号(图6-b),结果发现,与对照(GFP 空载)相比,试验组在叶绿体中能观测到绿色荧光,且能与叶绿体的红色自发荧光基本重合,表现出黄色的光。说明MePPD3 蛋白定位在叶绿体中,符合Psbp 蛋白(叶绿体光系统II 亚基蛋白)的特点。
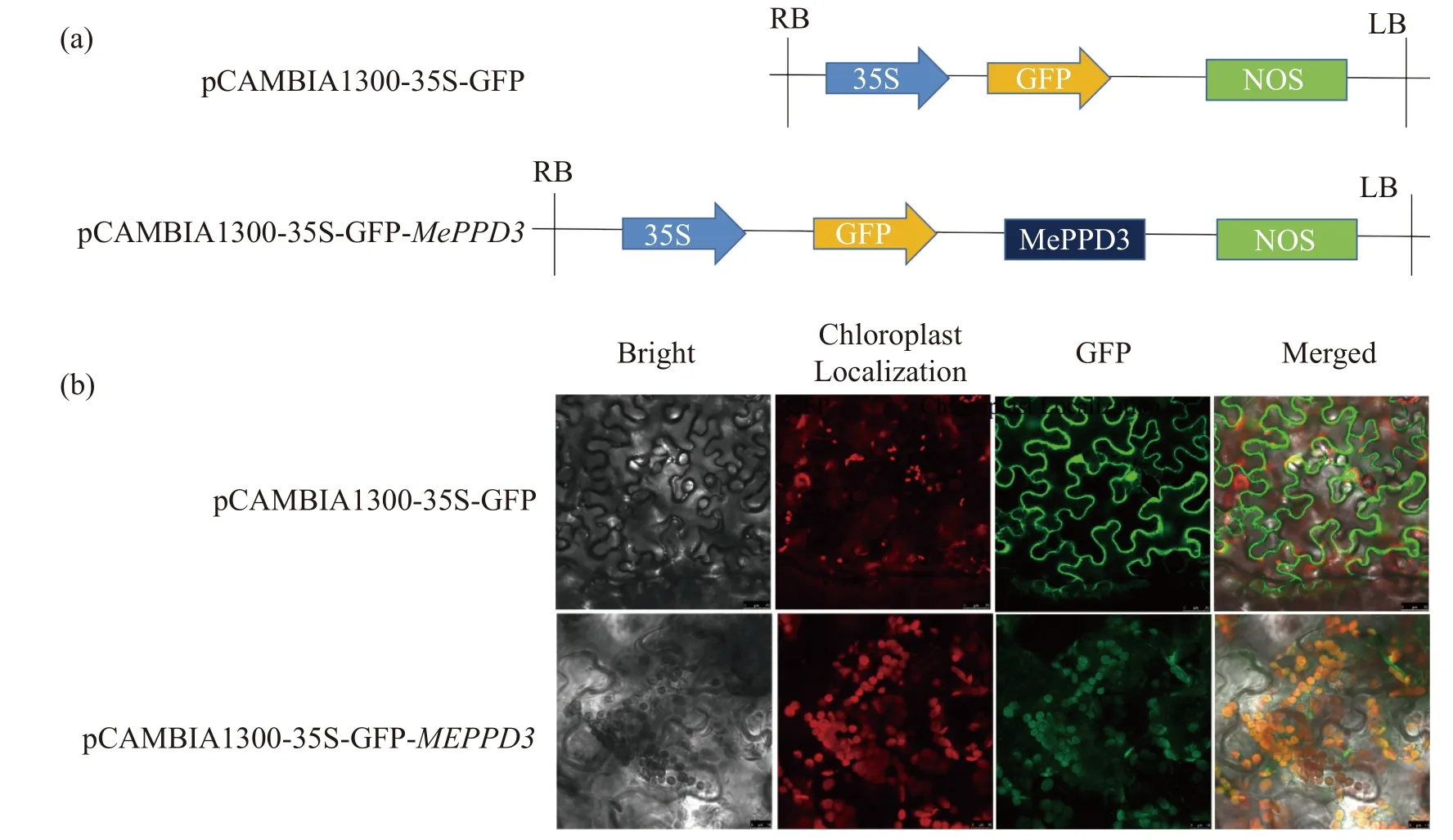
图6 MePPD3 蛋白的亚细胞定位
2.5 木薯不同部位MePPD3基因的表达模式分析为研究木薯MePPD3基因在木薯不同部位中的表达情况,分别选择同一株‘SC8’木薯的成熟叶片、幼嫩叶片、叶柄、顶芽、块根、须根等部位,对其进行real-time PCR 检测MePPD3基因的表达量是否发生变化。观察发现(图7),MePPD3基因在木薯不同组织中均有表达,其在木薯叶片中的表达量最高,在幼嫩叶片中的表达量为顶芽的5 倍,在成熟叶片中的表达量为顶芽的18 倍;在木薯的叶柄、须根、块根的表达量和顶芽接近。这说明MePPD3基因主要在木薯的叶片中表达,这与其具有的Psbp 结构域的功能相符。
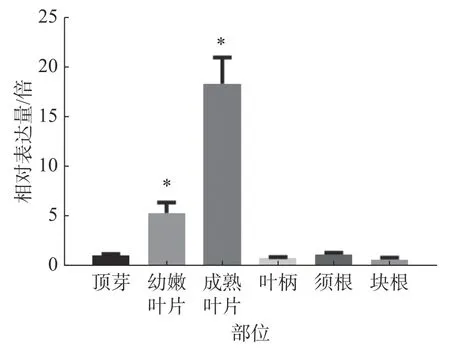
图7 MePPD3 基因在木薯不同部位的表达模式图
2.6 病原菌侵染不同时间后MePPD3基因的表达模式分析为探究病原菌XpmCHN11 侵染后MePPD3基因在木薯叶片中的表达量是否发生变化,分别取接种0、6 h,1 、3 、5 d 的木薯叶片,通过实时荧光定量PCR 检测MePPD3基因的表达量变化(图8)。从中可以明显地看出,在XpmCHN11 侵染木薯后的不同时间,MePPD3基因的表达量呈先上升再下降趋势。在6 h 时,其表达量上升了2.5 倍;在1 、3 和5 d 时,其表达量逐渐下降为本底表达量。这说明,MePPD3基因可能在木薯抗病过程中发挥着作用。
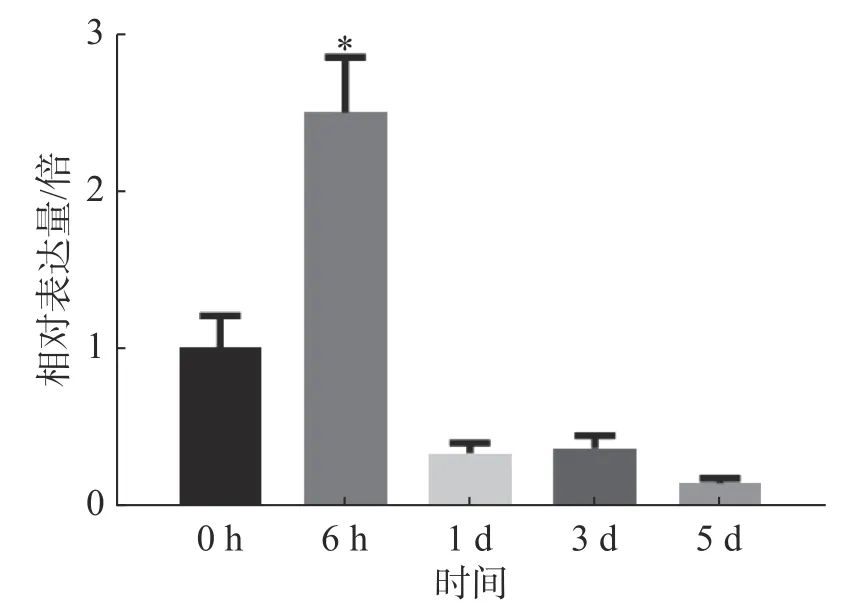
图8 病原菌侵染后不同时间MePPD3 基因的表达量
2.7 MePPD3基因沉默后木薯SC8 抗病性为明确MePPD3基因在木薯抗病过程中的作用,采用VIGS 技术沉默MePPD3基因,沉默40 d后,接种正对照植株的叶片出现了白化表型(图9-a)。qRT-PCR 结果显示,经过VIGS 沉默之后,MePPD3基因的相对表达量显著降低,其表达量下降了2 倍(图9-b),说明该基因受到了有效沉默。
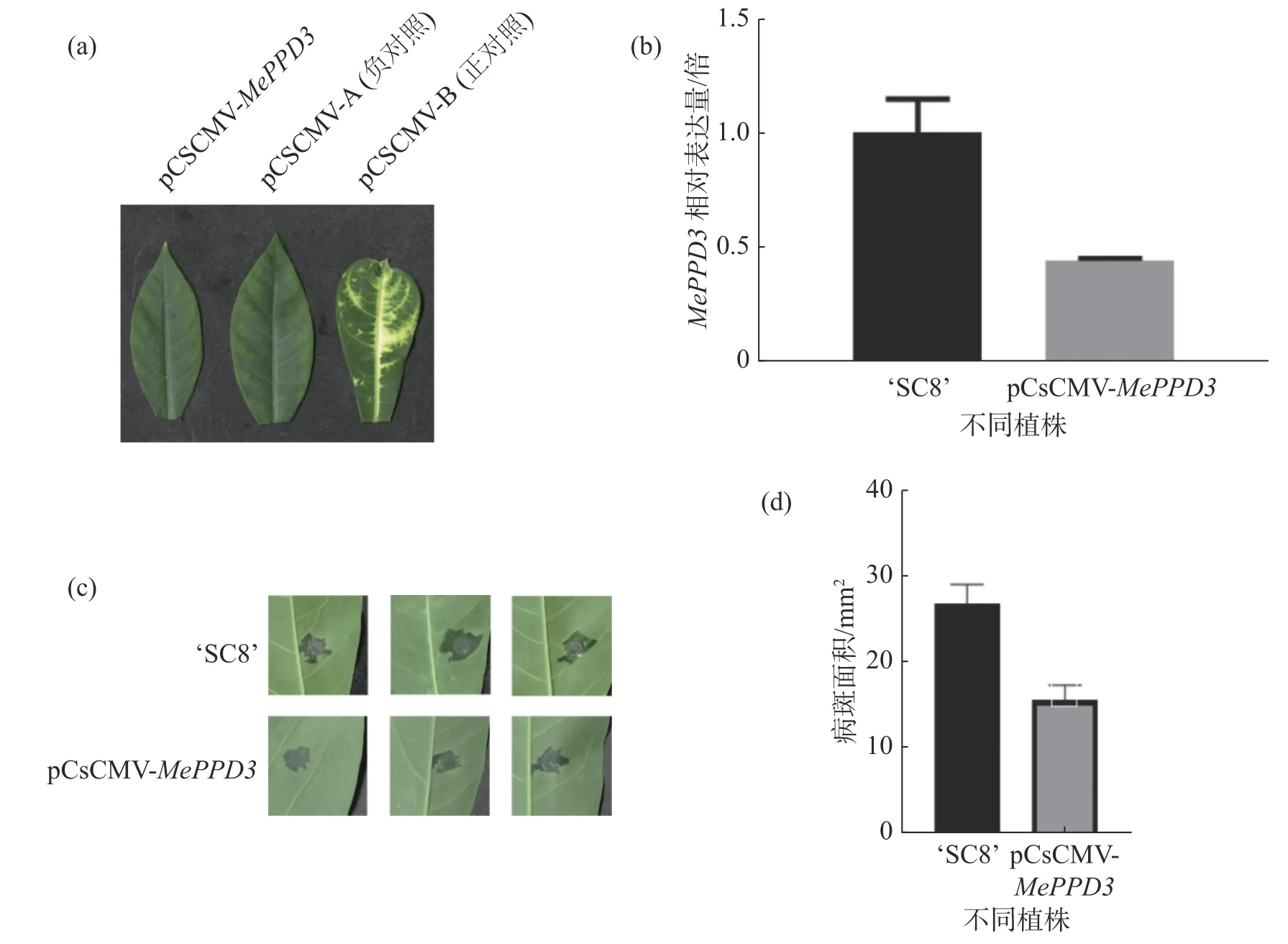
图9 VIGS 沉默植株表型及抗病性检测
分别在沉默植株和野生型植株上接种XpmCHN11,结果发现,接种后6 d,沉默植株和野生型植株叶片均已产生水渍状病斑,且沉默植株的水渍状病斑明显小于野生型植株(图9-c),统计后发现沉默植株的病斑面积约为对照植株的一半(图9-d),该结果显示MePPD3负调控了木薯的抗病性。
3 讨 论
叶绿体是植物体所特有的细胞器,它能为植物体的各项生命活动提供能量。PsbP 蛋白是叶绿体光系统Ⅱ的重要组成部分,它能参与 PSⅡ的组装[13-15]。此外,葡萄球菌萄球菌RXLR 效应因子RXLR31154 通过影响Psbp 来降低H2O2积累,从而促进葡萄致病[21]。PPD 蛋白是PsbP 蛋白家族的一员,目前已发现的PPD 蛋白有7 种。蛋白在PSI 组装过程中发挥重要作用[18-19];PPD5 蛋白和ROS 爆发、气孔关闭有关[19]。以上研究充分说明了Psbp 蛋白在植物光合作用和免疫反应中发挥着一定的作用。但目前关于PPD3 蛋白的研究却不是很多。
为了增进对PPD3 蛋白的了解,本研究首次从木薯数据库中得到MePPD3基因。MePPD3基因CDS 序列全长807 bp,编码268 个氨基酸序列。对MePPD3基因进行了一系列的生物信息学分析,结果发现:该蛋白第50~100 位存在跨膜结构,第106 到266 位为PsbP 保守结构域。其三级结构由6 个螺旋组成,符合PsbP 蛋白家族的结构特征。选取8 种植物中的同源蛋白序列进行多序列比对、进化树和保守结构域分析,结果发现,PPD3 蛋白在不同植物中具有较高的保守性,木薯MePPD3 蛋白和橡胶中PPD3 蛋白具有相同的保守结构域,且两者的相似性可达99%。因此,推测PPD3 蛋白在不同植物中起到的作用一致或相近。此外,通过烟草瞬时表达,证实MePPD3 定位于叶绿体,这与PPD3 蛋白的叶绿体/线粒体定位信号相符,说明MePPD3 可能在叶绿体中发挥功能。另外,本研究通过qRT-PCR 检测,发现MePPD3基因在木薯成熟叶片中表达量最高;黄单胞菌XpmCHN11 侵染木薯叶片后,MePPD3表达量呈现上调趋势,初步推断,MePPD3可能参与了木薯的抗病途径;VIGS 沉默MePPD3基因后接种结果显示,MePPD3负调控木薯的抗病途径。结合前人研究推测,MePPD3 可能通过影响气孔开闭和ROS 爆发来参与木薯抗病,是否正确仍需要后续研究来证实。
——紫 苏

