基于肠道菌群探讨醒脑开窍针刺法对脑卒中大鼠突触可塑性的影响*
谭春凤,徐 琼,王 波,黄建福,郑全成
(三亚市中医院 三亚 572019)
脑卒中是导致人类死亡或残疾的重大疾病之一,老龄化和高体质量指数等风险因素的累积导致全球范围内终生脑卒中风险增加[1]。缺血性脑卒中后脑实质受损,伴随复杂的神经炎症和全身性免疫反应[2]。幸存者多存在感觉运动和认知功能损害,神经可塑性对于神经功能的恢复和患者的康复至关重要[3]。研究显示,头穴丛刺法可促进脑缺血大鼠突触形态的重塑,改善神经功能[4]。大脑和肠道通过神经元网络连接,形成复杂的肠-脑轴,现有证据表明,缺血性卒中可导致肠道菌群严重受损,而肠道菌群失衡可反过来引起病人神经炎症,造成神经行为缺损和疾病结果恶化[5-7]。通过重塑肠道菌群结构,恢复肠道微环境,可能减轻大脑中炎症,恢复突触可塑性[8-9],从而改善脑卒中的结局。庞青民等[10]证实,醒脑开窍针刺(Xingnao Kaiqiao acupuncture,AC)法可以改善兴奋性神经递质的代谢,减轻脑卒中造成的神经行为问题。然而其减轻脑卒中大鼠神经行为问题的作用是否与肠道菌群相关,同时,对突触可塑性的影响均不清楚。因此,本研究采用醒脑开窍针刺法干预脑卒中大鼠,观察其对大鼠肠道菌群及突触可塑性的影响,以探讨其改善脑卒中后神经行为问题的机制。
1 材料和方法
1.1 动物
SPF 级45 只SD 大鼠,体质量200-230 g,雄性,购自北京维通利华公司,许可证号:SCXK(京)2016-0011。大鼠在温湿度恒定、12 h/12 h光/暗周期的动物房中饲养,摄水摄食均自由,实验操作遵守三亚市中医院动物伦理委员会规定。
1.2 主要试剂和仪器
环球牌0.18 mm×7 mm 针灸针(苏州针灸用品公司);华佗牌电针治疗仪(苏州医疗用品厂);生长相关蛋白43(Growth-associated protein 43,GAP-43)、突触素(Synaptophysin,SYN)、脑源性神经营养因子(Brainderived neurotrophic factor,BDNF)、白介素(IL)-1β、GAPDH、羊抗兔IgG二抗(Abcam公司);高尔基染色试剂盒(FD Neuro Technologies 公司);粪便DNA 试剂盒(天根生化科技公司);Quant-iT™ dsDNA 分析试剂盒(Invitrogen 公司);光学显微镜(Leica 公司);电泳转膜仪器(BioRad 公司);超薄切片机(LKB Produkter AB 公司)、透射电镜(Transmission electron microscopy,TEM)(日本HITACHI公司),等。
2 方法
2.1 缺血性脑卒中模型建立
SD 大鼠用1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,固定(仰卧位)在手术板上。在颈部正中切口,分离肌肉和结缔组织,暴露左颈总动脉(Common carotid artery,CCA)和内、外动脉(Internal、External CA,ICA、ECA),用手术线将CCA 的近心端系紧,远心端仅轻轻系上(需保证栓线可正常插入)。在离ICA和CCA 分叉4 mm 处切“V”形口,经ICA 将圆头尼龙线(直径:0.28 mm)徐徐推入约18 mm,遇阻停止,造成脑中动脉闭塞,实现脑缺血。120 min 后缓缓抽出尼龙线,认真缝合伤口。造模成功标准:大鼠清醒后,Zea Longa 评分[11]为1-3 分。假手术(sham,S)组仅分离暴露动脉,不进行脑动脉闭塞。
2.2 分组和治疗
造模成功的脑缺血大鼠随机分为模型(model,M)组和AC 组,各15 只。取15 只大鼠(S 组)进行假手术操作。造模后,AC 组参照文献[10]进行AC 干预,每天1次,连续7天。具体为:首先在双侧“内关”穴(大鼠前肢内测距腕横纹上侧3-4 mm 尺桡骨缝之间)直刺进针,捻转提泄手法施针1 min,并留针30 min,连接电针仪刺激(波形:疏密波,强度:3 mA,频率:2 Hz);随后在“水沟”穴(鼻中隔下方)向上进针3 mm,雀啄手法施针10 次,并留针30 min,连接电针仪刺激(波形:疏密波,强度:3 mA,频率:2 Hz)。
2.3 神经功能评估方法
末次治疗后,采用Zea Longa 评分评估S 组、M 组和AC 组(n=12)大鼠神经功能。分数越高意味着损伤越重。
2.4 TEM观察突触结构
末次治疗后,每组各3只大鼠通过颈静脉灌注4%多聚甲醛,10 min 后分离缺血半影带(Ischemic penumbra,IP)皮层组织,切为1 mm×1 mm×1 mm 小块,在2.5%戊二醛中固定24 h。随后,经1%四氧化锇固定、PBS 冲洗、乙醇和丙酮分级脱水等处理后,用超薄切片机制备IP 皮层组织超薄切片(约60 nm),并用乙酸双氧铀和柠檬酸铅分别染色10 min。在TEM 下观察切片并拍照。
2.5 样本采集
评分后,对各组大鼠麻醉,在超净台中用腹部压迫法收集新鲜粪便(n=12),置于-80℃保存,用于提取肠道微生物群的DNA。随后,6只大鼠迅速取脑,分离IP 皮层组织,置于A+B 混合液(高尔基染色试剂盒)中,用于高尔基染色观察;余下6只大鼠的IP皮层组织保存在-80℃,用于Western blot。
2.6 高尔基染色
取A+B 混合液中的IP 皮层组织,6 h 后,更换新鲜A+B 混合液,持续浸泡14 天,随后将IP 皮层组织移至试剂盒的C液中,4℃下避光保存3天(每24 h更换1次C液)。将上述组织浸没在15%甘油+20%蔗糖混合液中,4℃下放置24 h。用冰冻切片机制备常规切片(约100 μm),经乙醇分级脱水、二甲苯透明后封片。在普通显微镜下观察切片并拍照。用Image J 软件分析二级树突上的树突棘密度。
2.7 Western blot检测
在RIPA 裂解液中裂解IP 皮层组织,提取总蛋白,并使用BCA 测定法测定浓度。将等量(20 μg)蛋白上样到SDS-PAGE 凝胶上并通过电泳分离,随后将蛋白转移(半干法)到PVDF 膜上。将膜在5%脱脂奶粉中封闭,并在4℃下与一抗(GAPDH、BDNF、SYN、GAP-43、IL-1β、TNF-α)孵育,次日加入二抗来检测抗体标记,使用ECL 发光液使蛋白可视化,在蛋白凝胶成像仪上拍照并分析。
2.8 ELISA检测
取-80℃的IP 皮层组织在磷酸缓冲液中匀浆,取离心后的上清,按照ELISA 试剂盒步骤检测IP 皮层组织中IL-1β、TNF-α及IL-17含量。
2.9 微生物群DNA测序及分析
用粪便DNA 试剂盒提取大鼠肠道微生物群的总DNA。使用对应于V3-V4 区域的引物(正向:5’-GTG CCAGCMGCCGCGGTAA-3’;反向:5’-GGACTACHV GGGTWTCTAAT-3’)扩增16S rDNA,使用Invitrogen的Quant-iT™ dsDNA 分析试剂盒对扩增产物定量。随后对扩增产物使用NEB next®Ultra™ II DNA Library Prep Kit for Illumina 试剂盒(New England BioLab 公司)制备文库并进行质检,然后使用Illumina MiSeq测序平台进行2 × 150 bp 双向全基因组测序(由北京奥维森科技公司完成)。对测序所得优质序列数据进行OTUs 聚类分析,并基于OUTs 结果对菌群结构(包括多样性和差异性等)进行分析。
2.10 统计学处理
运用GraphPad Prism 8.0 软件分析数据。实验数据用平均数±标准差(±s)描述,用单因素方差分析行多组间比较,用SNK-q检验行两两比较。P<0.05 为差异有统计学意义。
3 结果
3.1 AC对大鼠神经损伤程度的影响
M 组神经功能评分较S 组高(P<0.05);AC 组神经功能评分较M组低(P<0.05),见图1。
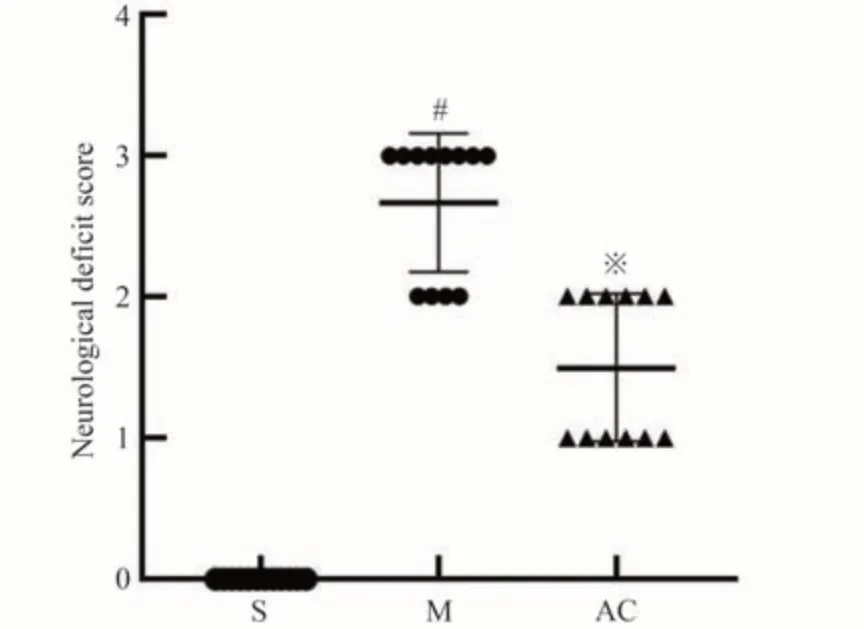
图1 三组神经损伤评分的比较
3.2 AC对大鼠IP皮层组织突触形态结构的影响
S 组树突棘密度为(16.53±2.91)个·10 μm-1,突触形态规则。相比于S 组,M 组树突棘密度[(7.15±1.43)个·10 μm-1]降低(P<0.05);突触囊泡数量较少、形态不规则,前膜、后膜及间隙边界模糊,间隙宽度变宽,突触后致密带(Postsynaptic densities,PSD)变薄。相比于M 组,AC 组树突棘密度[(12.86±2.75)个·10 μm-1]增加(P<0.05);突触囊泡数量和后致密带厚度均有所增加,前膜、后膜及间隙边界趋于规则,见图2。
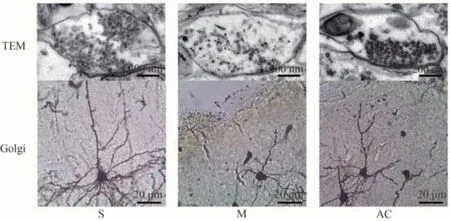
图2 三组大鼠突触形态结构观察
3.3 AC对大鼠IP皮层组织BDNF、SYN、GAP-43蛋白表达的影响
相比于S 组,M 组BDNF、SYN、GAP-43 蛋白水平增高(P<0.05);相比于M 组,AC 组BDNF、SYN、GAP-43蛋白水平进一步增高(P<0.05),见图3、表1。
表1 三组BDNF、SYN、GAP-43蛋白水平比较(±s,n=6)
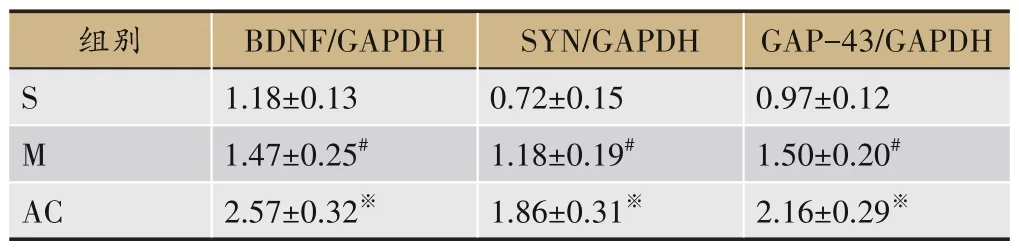
表1 三组BDNF、SYN、GAP-43蛋白水平比较(±s,n=6)
注:与S组比较,#P<0.05;与M组比较,※P<0.05。(下表同)
GAP-43/GAPDH 0.97±0.12 1.50±0.20#2.16±0.29※组别S M AC BDNF/GAPDH 1.18±0.13 1.47±0.25#2.57±0.32※SYN/GAPDH 0.72±0.15 1.18±0.19#1.86±0.31※
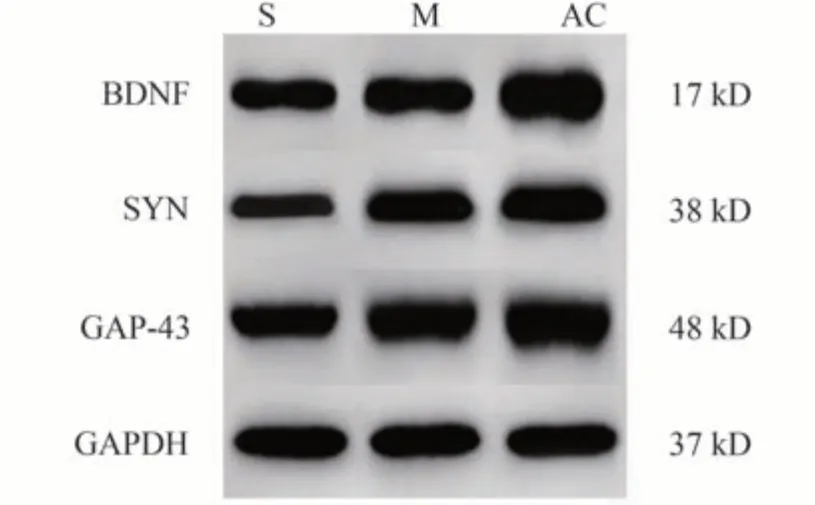
图3 Western blot检测BDNF、SYN、GAP-43蛋白水平
3.4 AC对大鼠大脑炎症的影响
相比于S 组,M 组IP 皮层组织IL-1β、TNF-α 及IL-17 含量增高(P<0.05);相比于M 组,AC 组IP 皮层组 织IL-1β、TNF-α 及IL-17 含 量 降 低(P<0.05),见表2。
表2 三组IL-1β、TNF-α及IL-17含量比较(±s,n=6)
组别S M AC IL-1β(μg·mL-1)15.90±2.14 46.28±4.49#26.45±3.26※TNF-α(μg·mL-1)12.63±2.25 35.46±3.85#20.75±3.61※IL-17(μg·mL-1)10.86±1.97 29.41±4.28#18.07±3.39※
3.5 AC对大鼠肠道菌群的影响
3.5.1 菌群多样性分析
经 分 析,相 比 于S 组,M 组Shannon、Chao1 和Observed species 指数降低(P<0.05),即菌群多样性和数 量 减 少;相 比 于M 组,AC 组Shannon、Chao1 和Observed species 指数升高(P<0.05),即菌群多样性和数量增加。3组Goods coverage指数均>99%,表明本研究的测序覆盖率增高。见表3。
表3 三组Shannon、Chao1、Observed species及Goods coverage指数比较(±s,n=6)
组别S M AC Shannon 5.37±0.42 4.21±0.53#5.29±0.36※Chao1 335.80±20.51 246.70±25.43#315.40±18.67※Observed species 291.58±24.18 205.76±31.62#278.44±27.35※Goods coverage 0.99±0.00 0.99±0.00 0.99±0.00
3.5.2 菌门相对丰度的差异性分析
经分析,S 组、M 组、AC 组大鼠的肠道菌群归属于10个菌门、24个菌目和118 个菌属。在门水平上,3组大鼠肠道优势菌群为厚壁菌门、拟杆菌门和变形菌门,三者相对丰度总和在S 组、M 组、AC 组中分别占比为96.45%、93.49%、95.51%。除此之外,丰度排名前5的还包括疣微菌门和放线菌门。相比于S 组,M 组拟杆菌门相对丰度较低,而F/B 比率增高(P<0.05);相比于M 组,AC 组拟杆菌门相对丰度升高,而F/B 比率降低(P<0.05),见图4、表4。
表4 三组菌门相对丰度的比较(±s,n=6)
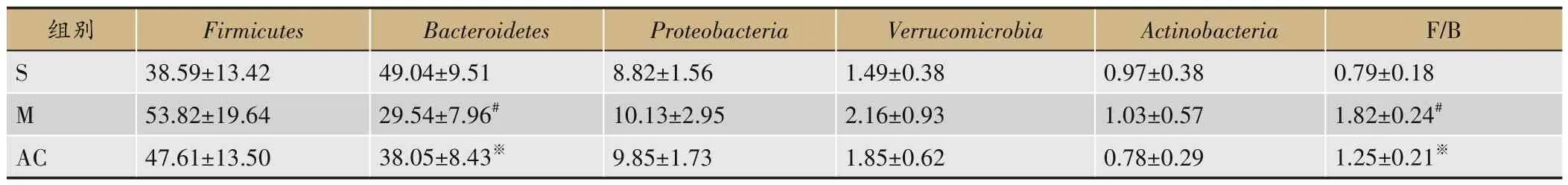
表4 三组菌门相对丰度的比较(±s,n=6)
组别S M AC Firmicutes 38.59±13.42 53.82±19.64 47.61±13.50 Bacteroidetes 49.04±9.51 29.54±7.96#38.05±8.43※Proteobacteria 8.82±1.56 10.13±2.95 9.85±1.73 Verrucomicrobia 1.49±0.38 2.16±0.93 1.85±0.62 Actinobacteria 0.97±0.38 1.03±0.57 0.78±0.29 F/B 0.79±0.18 1.82±0.24#1.25±0.21※
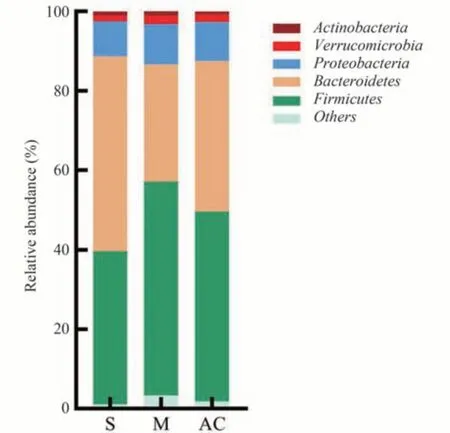
图4 三组大鼠优势门菌群的相对丰度
3.5.3 菌属相对丰度的差异性分析
在属水平上,3 组大鼠肠道优势菌群主要归属于27 个属。相比于S 组,M 组拟杆菌属(bacteroides)、理研菌属(Rikenella)、埃希氏菌-志贺氏菌属(Escherichia Shigella)、罕见小球菌属(Subdoligranulum)、瘤胃球菌_NK4A214 属(Ruminococcaceae_NK4A214)、瘤胃球菌_UCG-005 属、瘤胃球菌_1 属(Ruminococcus_1)、布劳特氏菌属(Blautia)、艾克曼菌属(Akkermansia)、Marvinbryantia、粪球菌 属(Coprococcus)、链球菌属(streptococcus)相 对 丰 度 增 高(P<0.05),乳杆菌属(Lactobacillus)、Lachnospiraceae_UCG-006、瘤胃球菌_UCG-014 属、Candidatus Saccharimonas、Lachnospiraceae_NK4A136、普氏沃氏菌_1属(Prevotella_1)、罗斯菌属属(Roseburia)、普 氏 沃 氏 菌_9 属(Prevotella_9)、Prevotellaceae_UCG-001、罗姆布茨菌属(Romboutsia)、双歧杆菌属(bifidobacteria)、Eubacterium_xylanophilum相对丰度较低(P<0.05)。相比于M 组,AC 组理研菌属、埃希氏菌-志贺氏菌属、艾克曼菌属相对丰度较低(P<0.05),粪球菌属、乳杆菌属、瘤胃球菌_NK4A214属、瘤胃球菌_1 属、普氏沃氏菌_9 属、Candidatus Saccharimonas、双歧杆菌属相对丰度增高(P<0.05),链球菌属、拟杆菌属等相对丰度亦呈向S 组回调的趋势(P>0.05),见图5、表5。
表5 三组大鼠优势属菌群相对丰度的比较(±s,n=6)
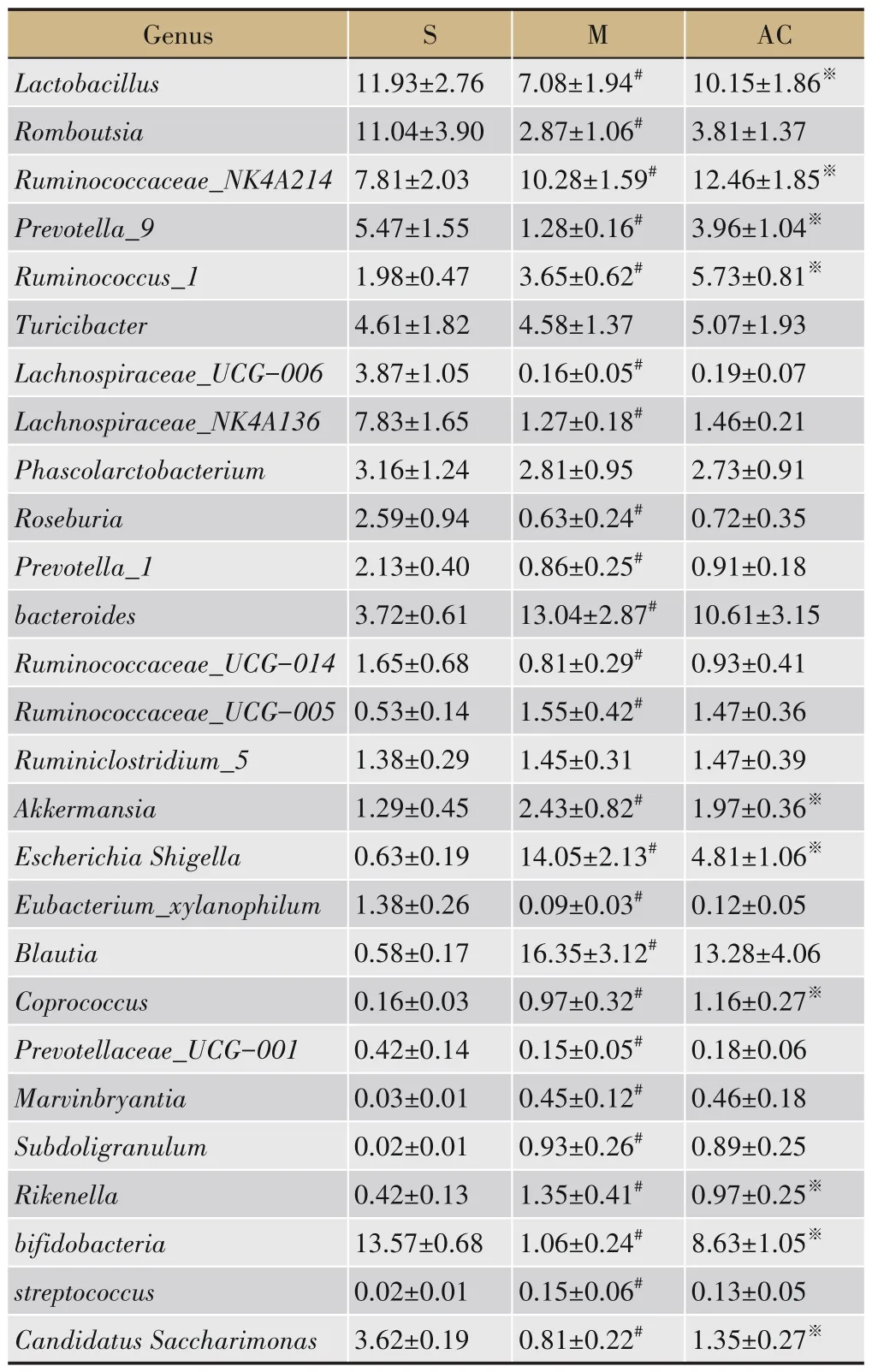
表5 三组大鼠优势属菌群相对丰度的比较(±s,n=6)
Genus Lactobacillus Romboutsia Ruminococcaceae_NK4A214 Prevotella_9 Ruminococcus_1 Turicibacter Lachnospiraceae_UCG-006 Lachnospiraceae_NK4A136 Phascolarctobacterium Roseburia Prevotella_1 bacteroides Ruminococcaceae_UCG-014 Ruminococcaceae_UCG-005 Ruminiclostridium_5 Akkermansia Escherichia Shigella Eubacterium_xylanophilum Blautia Coprococcus Prevotellaceae_UCG-001 Marvinbryantia Subdoligranulum Rikenella bifidobacteria streptococcus Candidatus Saccharimonas S M 11.93±2.76 11.04±3.90 7.81±2.03 5.47±1.55 1.98±0.47 4.61±1.82 3.87±1.05 7.83±1.65 3.16±1.24 2.59±0.94 2.13±0.40 3.72±0.61 1.65±0.68 0.53±0.14 1.38±0.29 1.29±0.45 0.63±0.19 1.38±0.26 0.58±0.17 0.16±0.03 0.42±0.14 0.03±0.01 0.02±0.01 0.42±0.13 13.57±0.68 0.02±0.01 3.62±0.19 7.08±1.94#2.87±1.06#10.28±1.59#1.28±0.16#3.65±0.62#4.58±1.37 0.16±0.05#1.27±0.18#2.81±0.95 0.63±0.24#0.86±0.25#13.04±2.87#0.81±0.29#1.55±0.42#1.45±0.31 2.43±0.82#14.05±2.13#0.09±0.03#16.35±3.12#0.97±0.32#0.15±0.05#0.45±0.12#0.93±0.26#1.35±0.41#1.06±0.24#0.15±0.06#0.81±0.22#AC 10.15±1.86※3.81±1.37 12.46±1.85※3.96±1.04※5.73±0.81※5.07±1.93 0.19±0.07 1.46±0.21 2.73±0.91 0.72±0.35 0.91±0.18 10.61±3.15 0.93±0.41 1.47±0.36 1.47±0.39 1.97±0.36※4.81±1.06※0.12±0.05 13.28±4.06 1.16±0.27※0.18±0.06 0.46±0.18 0.89±0.25 0.97±0.25※8.63±1.05※0.13±0.05 1.35±0.27※
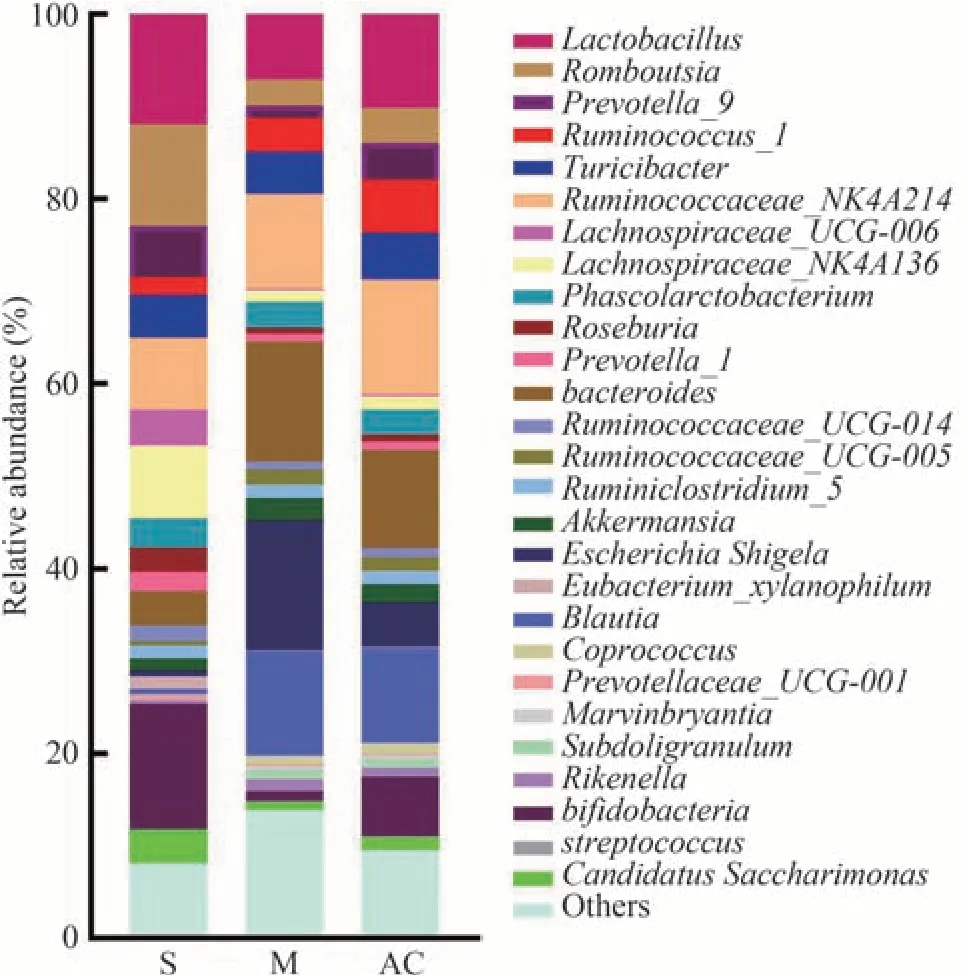
图5 三组大鼠优势属菌群的相对丰度
4 讨论
缺血性脑卒中是脑血管疾病中最常见的类型,血流的中断会导致脑内部分神经元快速死亡,形成缺血梗塞区,并引起周围区域(IP)发生血流减少、神经元萎缩、突触功能减弱等改变[12]。神经可塑性可重建未受损神经元之间的连接,是IP 中的重要修复过程,因此其可能是缺血性脑卒中的治疗靶点[13]。突触可塑性包括形态结构和功能两方面,其中形态结构是突触功能和可塑性的基础[14-15]。本研究中,M 组大鼠的PSD 变薄,突触间隙宽度变宽,而这些变化会减弱传递效率并抑制突触功能可塑性,从而导致功能缺陷[14]。醒脑开窍针刺法干预后,大鼠突触囊泡数量和PSD 厚度均有所增加,边界趋于规则,提示醒脑开窍针刺法可以恢复PSD 厚度,改善突触形态结构。疾病发生后,大脑会启动一系列自发修复,包括重要生长因子(BDNF)的表达、突触和树突的生长、轴突重塑等,且可以通过治疗来促进[16]。SYN 为突触发生的经典标志物,其表达水平可反映脑内突触的密度,缺血性损伤时,SYN 水平显著降低,随着大脑自我修复的启动,其水平逐渐增高[17]。GAP-43 在轴突生长期和突触形成早期特异表达,可作为轴突生长和再生的分子标记[18]。正常大鼠脑中仅存在少量GAP-43 表达,但在缺血发生后IPGAP-43 表达显著升高[19]。本研究中,M 组IPBDNF、SYN、GAP-43 蛋白水平明显高于S 组,反映了大脑的自我修复。而醒脑开窍针刺法干预进一步提高了IPBDNF、SYN、GAP-43 蛋白水平,提示干预后大鼠的突触可塑性更高,结合突触形态结构的改善,有利于突触传递效率的提高,这可能是醒脑开窍针刺法促进脑卒中大鼠神经功能改善的机制。
肠道菌群通过调节糖脂代谢、炎症和免疫反应,在脑卒中的神经病理生理学中起重要作用[20]。本研究发现,脑卒中大鼠肠道菌群多样性下降、数量减少,且菌群构成明显不同。而给予醒脑开窍针刺后,肠道菌群的多样性显著升高,数量显著增多,且菌群构成向S组回调。表明醒脑开窍针刺法可促进脑卒中大鼠肠道菌群构成向正常回调。研究显示,F/B 比率增加是机体衰老和生态失调的标志,且F/B 比率增高会加重脑卒中小鼠的全身炎症和神经损伤程度[21]。本研究中,M 组IP 皮层组织IL-1β、TNF-α、IL-17 含量增高,拟杆菌门相对丰度显著降低,F/B 比率增高,而醒脑开窍针刺后,IL-1β、TNF-α、IL-17 含量降低,拟杆菌门相对丰度显著增高,F/B 比率降低,提示醒脑开窍针刺可以通过调节拟杆菌门相对丰度,降低F/B 比率,进而减轻脑卒中大鼠炎症反应。
在胃肠道中存在多种条件致病菌,能够引起肠道炎症,其一旦突破肠道屏障,甚至可能引起全身性炎症[22]。在炎症性肠病小鼠的粪便中[23],埃希氏菌-志贺氏菌属和艾克曼菌属相对丰度增高,IL-6、IL-18 等促炎因子含量同步增加,而外源性给予双歧杆菌可减轻肠道炎症。Candidatus Saccharimonas在急性胰腺炎大鼠粪便中相对丰度降低,可能通过释放抗菌肽抑制肠道炎症反应[24]。Butara等[25]观察到,理研菌属的富集与较轻的结肠炎有关,可能具有启动和扩大肠道炎症的作用。同时研究发现,脑缺血猴的粪便中后拟杆菌属相对丰度增加,乳杆菌属减少,伴随血浆脂多糖和IFNγ、IL-6炎症因子水平升高[26]。在本研究中,脑卒中大鼠肠道中乳杆菌属、Candidatus Saccharimonas相对丰度降低,埃希氏菌-志贺氏菌属、理研菌属、艾克曼菌属、拟杆菌属相对丰度升高,促炎菌群与抗炎菌群失调,导致肠道处于炎症微环境。醒脑开窍针刺后,理研菌属等促炎菌属相对丰度下降,Candidatus Saccharimonas等抗炎菌属相对丰度回升,有利于肠道微环境恢复健康状态,而肠道微环境可通过肠-脑轴影响大脑微环境,推测醒脑开窍针刺法可能通过作用于肠道菌群,调节肠道微环境,降低脑卒中大鼠大脑中的炎症反应。
粪球菌属、艾克曼菌属、瘤胃球菌属等还可产生丁酸、乙酸、丙酸等短链脂肪酸(SCFA)代谢物,而SCFA 可穿透血脑屏障,促进神经营养因子合成、减轻神经炎症、调控脑内神经元的存活、增加突触的可塑性,最终改善脑卒中引起的神经功能缺陷[27]。本研究中,M 组大鼠瘤胃球菌_NK4A214 属、粪球菌属、艾克曼菌属等产生SCFA 的菌群增多,可能是机体应对脑卒中的自我保护机制。不同的是醒脑开窍针刺后瘤胃球菌_NK4A214 属和粪球菌属相对丰度继续增高,艾克曼菌属相对丰度则下降,可能与艾克曼菌属不仅产生丁酸盐还产生炎症因子有关。另外,双歧杆菌属、乳杆菌属为重要的益生菌,双歧杆菌、乳杆菌补充剂已被证明可以改善认知功能和神经炎症[28]。本研究在脑卒中大鼠粪便中检测到,乳酸菌属相对丰度降低,醒脑开窍针刺后其相对丰度显著升高。以上结果提示醒脑开窍针刺法可能通过改变肠道菌群构成,调节机体脑内炎症反应等,改善脑卒中大鼠神经功能。
综上所述,醒脑开窍针刺法可恢复有益菌属相对丰度,降低有害菌属相对丰度,减轻大脑炎症并可改善突触可塑性,减轻脑卒中大鼠神经功能损伤。但是肠道菌群还可产生多种代谢物,其改善突触可塑性的具体机制仍待研究。

