基于OPG/RANKL/RANK信号通路探究“引血下行法”调控激素性股骨头坏死骨代谢表达的影响
区志坚 李希文 邱华耀 黄思聪 林烁 李逸群
1佛山市第二人民医院骨科(广东佛山 528000);2佛山市南海区第七人民医院中医科(广东佛山 528231)
激素性股骨头坏死(steroid-induced osteonecro⁃sis of the femoral head,SONFH)是指应用糖皮质激素(glucocorticoid,GC,以下简称激素)导致股骨头组织破环、骨结构塌陷和髋关节功能障碍的骨科疾病,其中最主要的病理改变是骨髓造血功能衰竭、组织脂肪化和成骨细胞凋亡[1-3]。随着临床过度使用激素类药物,SONFH 成为一种高发疾病[4],其疼痛程度和高致残率对患者的生活质量影响极大。
目前对于SONFH 的发病原理尚未达成统一认识,涉及骨细胞凋亡、血管内凝血、脂代谢紊乱、髓内压增高、骨质疏松现象、基因调控等假设和学说[5]。在多种发病原理中,共同的病理环节是骨细胞活性异常。破骨细胞(osteoclast,OC)起骨吸收作用,成骨细胞(osteoblast,OB)则起骨积累作用,生理条件下OC 与OB 的活性维持动态平衡,从而维持正常的骨代谢和骨量。研究[6-7]发现,大剂量或长时间的激素对OB/OC 平衡产生影响,OC活性增强导致骨量损失,OB 活性减退导致骨分化受阻,并在长期应力作用下,骨小梁坏死断裂,股骨头血供不良,形成骨坏死和骨塌陷的结果。研究[8-9]显示,OPG/RANKL/RANK 信号通路对体内OB/OC 的平衡具有重要的调节作用。骨保护蛋白(osteoprotegerin,OPG)是一种由OB 和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM⁃SCs)分泌的糖蛋白,参与骨代谢。NF-κB 配体激活因子(receptor activator of NF-κB ligand,RANKL)由OB 分泌,可特异性结合位于OC 表面的NF-κB 受体激活因子(receptor activator of NF-κB,RANK),激活OC 的活性,促进细胞成熟、分化,正向调控OC活动;OPG 可被诱导与RANKL 竞争结合RANK,降低OC 活性,抑制OC 的分化,负向调控OC 的功能[10]。OPG 和RANKL 竞争与RANK 结合可起到双向调控OC 的作用,影响OC 的功能,进而调控骨吸收/骨重建过程[11]。
本课题选用的“引血下行法”代表方是广东省名老中医李逸群教授的经验方——引血下行方,对SONFH 患者“肾之阴阳俱虚、气滞血瘀困阻”的病机尤为合适。中药药理研究发现[12],牛膝等具有补肾、引血、活血功效之物能增强人体免疫,减轻GC 的毒副作用,上调机体内分泌水平,抑制OC 骨吸收活性,促进OB 骨重建;还可抑制血小板过度凝集,平调脂代谢紊乱,降低股骨头内脂肪栓塞的几率,促进成骨分化的进程,从而防治SONFH。
本研究团队首创选用广东省名老中医李逸群教授的经验方“引血下行方”作为“引血下行法”代表方,基于“引血下行、活血行气、温肾滋阴”的主要治法,从传统医学角度出发,选择梯度浓度分组对比,结合现代SONFH 的发病机制和可能信息通路进行初步探索,以期研究出可能作用机制。
综上所述,本研究拟通过观察引血下行方对SONFH 大鼠的OPG/RANKL/RANK 信号通路的影响,验证引血下行方治疗SONFH 的有效性,探析引血下行方的作用机制及生物靶点,阐释中医“引血下行法”防治SONFH 的疗效及可能机制。
1 材料与方法
1.1 实验动物 购自广东省医学实验动物中心的雄性SD 大鼠50 只,体质量为(180 ± 10)g(许可证编号:SCXK(粤):2018-0002)。本研究在广东药科大学中心动物实验室完成(合格证号:44007200101434)。本课题研究已通过广东药科大学实验动物伦理委员会认证(编号:gdpwlac⁃spf2017620)。
1.2 药品、试剂与仪器 引血下行方组成:牛膝25 g,补骨脂20 g,山萸20 g,代赭石15 g,黄芪15 g,生龙骨10 g,生牡蛎10 g,赤芍15 g,桃仁15 g,当归15 g,丹参 15 g,熟地15 g,龟板10 g。中药材购自佛山市第二人民医院中药房。原药材经两次水提后浓缩,制成含生药浓度1.0 g/mL 的标准制剂,于4 ℃冰箱密封备用。
主要试剂和仪器:脂多糖(Sigma,批号L2880);甲基泼尼松龙(麦克林公司,批号30013,以下简称甲强龙);无水乙醇(天津市大茂试剂厂,批号SJ-C1-13-01DM-01);二甲苯(天津市大茂试剂厂,批号SJ-B1-04-01DM);大鼠OPG Elisa 试剂盒(江苏酶免实业有限公司,批号MM-0115R1);大鼠RANKL Elisa 试剂盒(江苏酶免实业有限公司,批号MM-0504R1);Anti-Osteoprotegerin 抗体(Abcam,批号Ab73400);Anti-RANKL 抗体(Abcam,批号Ab239607);重组Anti-TRAF6 抗体(Abcam,批号Ab40675-100);DAB 显色试剂盒(康为世纪,批号CW2069S);抗体稀释液(Asbio,批号20211118);石蜡切片机(德国Leica,型号RM2255);石蜡包埋机(德国Leica,型号EG1160);病理组织漂烘仪(Histo-line laboratory,型号TEC-2500);BQ 显微镜(Olympus,型号BX51);实验室专用超纯水机(广州宇飞仪器有限公司,型号20121720)等。
1.3 实验前准备 随机分组:采用随机数字表法对SD 大鼠分组,从表中抽选任意数字起始,沿某一方向依循获得每只大鼠的随机数字,该数字除以2 求余数,整除为对照组(C 组),余数1 为造模组,得C 组10 只,造模组40 只(O 组、H 组、M 组、L 组各10 只)。
1.4 造模 SD 大鼠适应性饲养1 周后进行造模。造模组于大鼠腹腔内注射脂多糖(LPS,20 μg/kg),共注射两次,每次间隔24 h。LPS 注射执行24 h后,臀肌注射甲强龙(SM,40 mg/kg),共注射3 次,每次间隔24 h。第2 ~ 6 周,SM 用量减为20 mg/kg,每周一次,共注射5 周;C 组予等剂量、同频次的生理盐水注射。每次注射后臀肌肌注8 万IU 青霉素,过程悬吊饮水。6 周后,两组各随机抽取2 只SD 大鼠,腹腔注射10%水合氯醛麻醉,心脏取血处死,并取股骨头,光镜下观测组织形态学,判断造模是否成功,证实造模成功后,光镜下取照。
1.5 SD 大鼠SONFH 模型的鉴定
1.5.1 大体形态鉴定 造模过程中观察大鼠一般情况;取股骨头观察其关节面形态、软骨色泽及质地、骨面硬度及韧度。
1.5.2 股骨头标本固定与脱钙 股骨头标本置于4%多聚甲醛中,固定2 d,微波辅助快速脱钙(辐照15 s/h,共辐照8 次/d,温度维持在41 ~ 43 ℃),当大头针刺入股骨头无明显阻力时说明脱钙完全,将标本按需分切。
1.5.3 股骨头标本包埋与制片 快速脱钙后的标本,予乙醇梯度脱水化、二甲苯透明化处理。常规石蜡包埋,切片厚度为4 μm,烘片、脱蜡、脱水并染色。参照试剂盒说明书进行HE 染色,中性树脂封片,光镜下观测切片组织形态。
1.6 药物干预 参考大鼠和人体表面积的用药量换算率,计算出用于大鼠灌胃的引血下行方的低剂量治疗组(L 组)、中剂量治疗组(M 组)、高剂量治疗组(H 组)的含生药浓度分别为2.5、5、10 g/kg。引血下行方标准液含生药浓度为1.0 g/mL,则L组、M 组、H 组的灌胃剂量分别为2.5、5、10 mL/kg。灌胃:早晚各1 次/天,共4 周;C 组和O 组则予5 g/kg的生理盐水灌胃,1 次/d。
1.7 组织样本取材及形态学观察
1.7.1 血液样本 灌胃4 周后,腹腔注射10%水合氯醛麻醉,腹腔动脉采血5 ~ 6 mL,置入肝素抗凝管,离心15 min(3 500 r/min),取上清液,置入-20 ℃冰箱中保存。
1.7.2 股骨头样本 取SD 大鼠仰卧位,脱毛处理后常规消毒铺巾,沿股骨头大结节处作一1.5 cm切口,自外下向内上斜切,逐层暴露,小心剥离股骨头周围的韧带软组织,股骨颈处用咬骨钳离断处理,把两侧股骨头完整取出,自冠状面劈成两半,放入4%多聚甲醛中固定。按1.5.2 所示快速脱钙,2 d 后使用大头针刺入股骨头中心无明显阻力时,将其切成1.5 cm × 1.5 cm × 0.5 cm 的组织小块,包埋,切片及制片,光镜下进行组织形态学观察。
1.8 股骨头组织OPG、TRAF⁃6、RANKL 相关因子检测
1.8.1 血清学指标检测 按各检测试剂盒说明书,分别检测血清指标如TRAP5b、RANKL、CTX 等相关指标。
1.8.2 骨组织形态学检测 股骨头组织包埋、切片、制片步骤同前,HE 染色后将切片置于光镜下镜检,采用BQ 图象分析系统采集图像,对组织形态进一步分析。
1.8.3 免疫组化染色及图像分析 行其中的股骨头组织分别进行包埋、切片、梯度脱水后,置入沸腾的新鲜配制柠檬酸抗原修护液[pH 为(6.0 ± 0.1)],原位放置,待其逐渐冷却后,对其使用双蒸馏法,漂洗组织3 次,加入按比例稀释的免疫组化抗体(OPG、RANKL 和TRAF-6)后,将其置于4 ℃冰箱中过夜,用PBS 缓冲液洗涤组织3 次,滤纸吸干残留的PBS。室温下将各组织切片产物置于DAB 显色试剂盒中显色10 min 后,使用蒸馏水洗涤,使用苏木素复染3 min,再使用蒸馏水洗涤。将上述股骨头组织标本放置于密室阴干后,用中性树脂进行封片处理。PBS 缓冲液替代一抗,以此作阴性对照,若股骨头组织标本中出现棕色染色则代表为阳性表达。显微镜下对各组切片的染色结果分别进行观察,每张切片随机选取5 个不重叠的等大视野范围进行观察,使用BQ 图象系统采集图像,使用半定量分析对其染色强度进行分析,同时记录数据。
1.9 统计学方法 采用GraphPad prism 7 软件进行统计学分析,数据以均值±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,并作多重比较。P< 0.05 为差异有统计学意义。
2 结果
2.1 股骨头组织的病理形态学改变 C 组:软骨厚度较均匀,软骨细胞同源,数量正常,骨小梁结构连续性好,未见明显断裂,罕见的空骨陷窝,骨松质内造血组织丰富(图1A1);脂肪组织含量正常(图1A2)。O 组:同源的软骨细胞及细胞基质大量减少,甚至消失,可见大量云片状的坏死细胞,不连续甚至撕裂的潮线,骨小梁结构破坏、缺失,骨质分解为云片状的黑色坏死组织(图1B1);脂肪组织增生明显(图1B2)。L 组:同源的软骨细胞及细胞基质大量减少,破骨性吸收陷窝较多,骨髓组织较少,已分解的碎裂的黑色坏死组织,骨小梁结构稀疏断裂,部分分解为片状组织(图1C1);松质骨内众多脂肪细胞填充(图1C2)。M 组:同源软骨细胞及细胞基质部分减少,软骨内骨髓腔形成,破骨性吸收,骨小梁结构稀疏或断裂,造血组织减少,少量分解的骨性黑色坏死物(图1D1);松质骨内较多脂肪细胞堆积(图1D2)。H 组:软骨细胞排列混乱,软骨基质不均匀,致密结缔组织增生满布,软骨层内静脉窦或血管充血扩张,部分已机化或栓塞,腔内炎性细胞集中,部分机化血管周围可见新生类骨质,骨小梁结构基本连续(图1E1);骨髓腔内存在少量脂肪细胞(图1E2)。
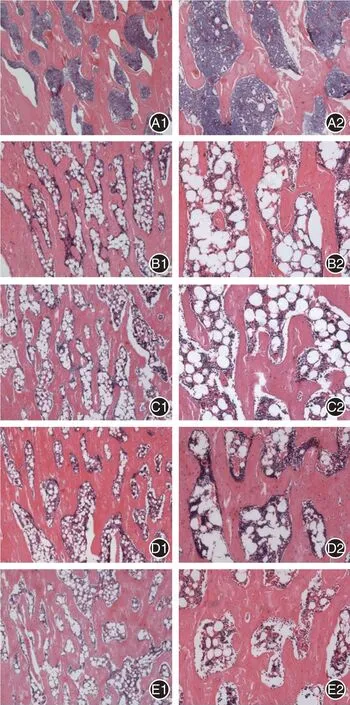
图1 骨形态图(4×10 倍)和脂肪细胞形态(10×10 倍)Fig.1 Bone morphology (4×10) and morphology of adipocytes (10×10)
通过本研究对比发现,引血下行方具有促进成骨组织新生的作用,改善骨小梁连续性,而高剂量疗效最为显著。
2.2 光镜下股骨头的组织形态 脂肪细胞数量方面,C 组、M 组、H 组显著低于O 组(P< 0.05),L 组与O 组对比差异无统计学意义(P> 0.05);脂肪细胞密度方面,C 组及各剂量治疗组均显著低于O 组(P< 0.05);骨髓腔面积方面,C 组骨髓腔面积小于O 组(P< 0.05),各剂量治疗组与O 组差异均无统计学意义(P> 0.05)。见表1。
表1 各组光镜下股骨头的组织形态Tab.1 Histomorphology of femoral head under light microscopy in each group ±s

表1 各组光镜下股骨头的组织形态Tab.1 Histomorphology of femoral head under light microscopy in each group ±s
注:C组、L组、M组、H组分别与O组进行t检验。a:t = 31.04,P = 0.000 1;b:t = 1.31,P = 0.21;c:t = 4.18,P = 0.001;d:t = 7.34,P = 0.000 1;e:t = 66.95,P = 0.000 1;f:t = 5.26,P = 0.000 1;g:t = 9.80,P = 0.000 1;h:t = 15.16,P = 0.000 1;i:t = 2.39,P = 0.03;j:t = 0.85,P = 0.41;k:t = 0.20,P = 0.84;l:t = 0.45,P = 0.66
H组(n = 10)217.44 ± 7.75d 148.02 ± 4.56h 1.47 ± 0.01l脂肪细胞数量脂肪细胞密度(mm2)骨髓腔面积(mm2)C组(n = 10)33.11 ± 6.01a 25.22 ± 3.04e 1.31 ± 0.10i O组(n = 8)272.75 ± 22.35 187.71 ± 6.55 1.45 ± 0.14 L组(n = 10)260.10 ± 18.78b 173.14 ± 5.22f 1.50 ± 0.11j M组(n = 10)235.56 ± 15.42c 160.96 ± 5.05g 1.46 ± 0.06k
2.3 股骨头组织的OPG、RANKL表达水平 C组、L 组、M 组、H 组的OPG、RANKL 的表达水平及OPG/RANKL 比值均低于O 组,差异有统计学意义(P< 0.05),见表2。
表2 各组股骨头组织的OPG、RANKL 表达水平Tab.2 OPG and RANKL expression levels in femoral head tissues of each group±s

表2 各组股骨头组织的OPG、RANKL 表达水平Tab.2 OPG and RANKL expression levels in femoral head tissues of each group±s
注:C组、L组、M组、H组分别与O组进行t检验。a:t = 8.66,P = 0.000 1;b:t = 7.91,P = 0.000 1;c:t = 8.46,P = 0.000 1;d:t = 11.05,P = 0.000 1;e:t = 7.31,P = 0.000 1;f:t = 3.30,P = 0.005;g:t = 7.74,P = 0.000 1;h:t = 8.59,P = 0.000 1;i:t = 12.10,P = 0.000 1;j:t = 8.00,P = 0.000 1;k:t =12.50,P = 0.000 1;l:t = 16.74,P = 0.000 1
H组(n = 10)836.67 ± 24.58d 291.97 ± 11.05h 2.87 ± 0.11l OPG(ng/L)RANKL(pmol/L)OPG/RANKL C组(n = 10)847.44 ± 44.09a 288.47 ± 16.98e 2.94 ± 0.20i O组(n = 8)683.06 ± 30.68 343.67 ± 12.94 1.99 ± 0.10 L组(n = 10)802.00 ± 29.43b 320.97 ± 14.53f 2.50 ± 0.15j M组(n = 10)852.82 ± 47.72c 294.49 ± 12.48g 2.90 ± 0.18k
2.4 股骨头组织的TRAF⁃6 表达水平 TRAF-6 在C 组、L 组、M 组、H 组的表达水平均显著低于O 组(P< 0.01),见表3。
表3 各组股骨头组织的TRAF-6 表达水平Tab.3 TRAF-6 expression levels in femoral head tissues of each group±s

表3 各组股骨头组织的TRAF-6 表达水平Tab.3 TRAF-6 expression levels in femoral head tissues of each group±s
注:C组、L组、M组、H组分别与O组进行t检验比较,a:t = 19.72,P = 0.000 1;b:t = 3.19,P = 0.007;c:t = 13.25,P = 0.000 1;d:t = 8.53,P = 0.000 1
TRAF-6(U/L)H组7.86 ± 0.38d C组6.56 ± 0.31a O组9.17 ± 0.21 L组8.67 ± 0.39b M组7.53 ± 0.28c
3 讨论
3.1 “引血下行法”组方要义和分析 长期使用GC 的SONFH 患者不仅存在髋部持续痛,静息痛,甚者无力,活动受限,难以站立,髋部周围皮肤出现局部瘀斑或红斑等股骨头坏死等股骨头坏死标志性症状及体征,还可出现脸颊部丘疹、红斑、干燥、萎缩、脱屑、酒渣鼻、痤疮、色素沉着、紫癜、舌淡白苔腻、脉浮大兼数,甚至散而无根等“虚阳浮越”之象。中医认为,GC 颇具“温燥浮越”之药性,而临床上使用GC 的病种数不胜数,长期使用后的患者往往会出现髋部持续疼痛,腹股沟区域静息痛,站立无力,行走不能,往往发现SONFH 时已病程较长,病情较重。中医认为,过用GC 伤阴在所难免,致使肾阴亏空,甚有阴虚火旺,浮越上犯,出现精神萎靡、怕冷畏寒、倦怠疲劳、腰膝酸软、双颧潮热红斑、颈部虚热、受凉不能抗、受热不能忍等肾阴阳两虚、虚阳浮越之虚实夹杂证。肾阳虚者,五脏六腑失于温煦,上中下三焦气血困凝不通,瘀滞经脉血络,困阻失疏;肾气虚者,膀胱气化无源,全身之血液运行困阻,无不停留成瘀;肾阴虚者,藏内之阴血亏空,经脉血络荣养无源,阴血难行而聚为生瘀,肾气阴阳亏损均能致使血瘀困阻,隔绝浮越之阳与下沉之阴交互,加重肾阴阳两虚,使得虚阳更难沉降,阴阳失于转化。故SONFH 发病,乃以正虚为本,先天不足为其发病之内因,邪实则为标,又外遇寒、热、湿邪侵袭,经脉血络疏通困难,血瘀乃成,阻碍疏行,濡养失责,阴不敛阳,虚阳浮越,阳虚无以温旭,气化失司,阴液耗伤,阴阳失调,日渐病损,故成此病。因此SONFH 的主要病机为肾虚血瘀。故治疗SONFH 需注重补肾以濡养根本,配合化瘀行血之品疏行滞瘀,使得标实得祛,本虚得补,方可大病得除。
本课题选用的“引血下行法”代表方是广东省名老中医李逸群教授的经验方——引血下行方:牛膝25 g,补骨脂20 g,山萸肉20 g,代赭石15 g,黄芪15 g,生龙骨10 g,生牡蛎10 g,赤芍15 g,桃仁15 g,当归15 g,丹参15 g,熟地15 g,龟板10 g。该方作为”引血下行法”的代表方之一,尤其重视“活血、引血、养肾”之治法,方中牛膝联用代赭石可引血下行、益肾养骨,持浮越之虚阳下行于肾,阴阳顺调,治本之功著,乃君药;桃仁、赤芍、丹参等活血化瘀、驱邪通骨,化解血脉经络之瘀留,梳行困阻之气滞,治标之功显,属臣药;当归配伍熟地可滋肾阴养血,海深则养龙,阴足则潜阳,滋阴且固阳,龟板、龙骨、牡蛎联用滋肾阴潜肾阳而强骨,加强引血下行之力,为佐药;山萸肉、补骨脂、黄芪等益气助阳、温肾壮骨,阳足则阴留,温煦得当,阴生不断,亦为佐药。上述诸药合用,扶正与驱邪并用,相得益彰,共奏“引血下行、活血化瘀、温肾滋阴”之功,对SONFH 患者“肾之阴阳俱虚、气滞血瘀困阻”之病机,尤为合适。
3.2 引血下行方修复股骨头坏死组织及调节OPG/RANKL/RANK 信号通路的机制探讨 HE 染色后,通过光镜下观测其股骨头组织,H 组股骨头的软骨层可见新生较大量的类骨质组织,骨小梁连续性结构存在;M 组存在于软骨层的类骨质结缔组织新生部分相对较少,可见少量坏死骨质溶解成的黑褐色坏死物质。L 组软骨层则可见较大量的破骨性陷窝,骨小梁连续性差,甚至呈片状坏死。通过研究发现,引血下行方具有促进成骨组织新生的作用,改善骨小梁连续性,而高剂量疗效最为显著。研究[13]发现,引血下行类药物能新生侧支循环,提高周围血管通透性,从而改善局部血液微循环,同时降低脂肪细胞的表达,减缓组织脂肪化的进程,从而促进成骨进程。研究[14]提示,牛膝甾酮作为牛膝的主要有效成分,可有效地激发大鼠SONFH 骨髓间充质干细胞(bone manrrow mesenchymal stemcells,BMSCs)的自噬、成骨分化的进程,这可能与miR-98-5p、CKIP-1 的表达下调有关。类似于牛膝、补骨脂、山萸肉等引血、补肾之药品,可有效下调OC 的活性,加强OB 的表达,并改善局部血管微循环,促进软骨组织增生形成成骨,这可能与OPG/RANKL/RANK 信号通路的双相调节有关[15-16]。
OPG 和RANKL 来源于BMSCs 和OB,RANK 来源于OC 胞膜上。研究[17]发现,RANK 竞争性地被OPG/RANKL 结合,因此OPG/RANKL/RANK 信号通路对OB、OC 活性调节以及成熟分化过程具有调控作用。研究[18-19]表明,BMSCs 可促进OC 的生成,而OC 诱导因子聚集到一定浓度时可使反向抑制OC 的表达活性,通过OPG/RANKL/RANK 信号通路对BMSCs 进行双向调节,协调OC 和OB 活性从而达到促骨形成的作用。而本研究数据表明,引血下行方能上调OPG 活性,与RANKL 竞争性结合,具有明显的促成骨作用,其中高剂量的引血下行方疗效更优。
3.3 本研究的局限性及解决方法 本研究亦存在一定局限性,受限于研究资金,所纳入研究的本方的中药种类较少,纳入研究的动物数量尚待增加,研究的信息通路尚可增加,“引血下行方”的梯度浓度可进一步细分研究。今后可加大研究资金投入,进一步加大纳入研究的动物数量,同时增加研究的中药种类,尤其是引血活血补肾类中药,引进中药有效成分萃取和效应浓度测定技术,细化效应浓度,推陈出新,明细化有效成分和浓度,后期可进一步研发出引血下行方的效应试剂,如经过四期实验,有望在未来为SONFH 患者提供完善的保髋保守治疗的方案,亦可进一步细化研究”引血下行法”治疗SONFH 的作用机制,有望阐明”引血下行法”对SONFH 作用的主要信息通路,可大量节约此类研究的实验资源,同时提供实验研究的可信且稳定的基础数据。
3.4 引血下行方治疗机制分析 引血下行方中牛膝具有引血下行、益肾养骨之作用,常用于治疗SONFH。现代药理学分析牛膝中多种有效成分参与了骨的代谢过程,其中牛膝甾酮可有效抑制OB的增殖活性,上调碱性磷酸酶活性,促进矿化结节形成,上调OPG 等标志产物的表达,竞争性结合RANKL来上调成骨分化相关基因表达,诱导自噬体形成,诱导OB 往促骨组织的分化[20-22]。研究[23]发现,补骨脂具有健骨强肾温阳之功,其主要成分补骨脂素有出色的抗氧化作用,能下调OC活性,抵抗OC 分离后陷窝数目的扩张和增加[24]。RANKL 对OB 促骨形成表达有抑制作用,同时会激活OC,而OPG 通过竞争性结合RANKL 来下调其活性,进而抑制OC 表达。作为补骨脂的主要有效成分,补骨脂异黄酮可有效抵抗RANKL-NF-KB 通路的介导激活进程,从而控制OC 分化进程,影响OC/OG 分化趋势,从而减缓骨质疏松症状[25]。研究[26-28]表明,作为当归的主要有效成分,当归多糖可有效抑制OC/OG 凋亡,介导成骨分化能力恢复,激活OCN、Osterix、BMP 等成骨因子,下调PPARγ 等成脂因子表达,从而诱导OC/OG往成骨进程分化,促进成骨。
本研究中,引血下行方各剂量治疗组的OPG含量明显高于O 组,RANK/RANKL 表达显著低于O 组,各剂量治疗组TRAF-6 表达显著低于O 组,表明引血下行方可能通过影响OPG/RANKL/RANK信号通路下调OC 生成与表达,激活OB 成骨分化进程,改善股骨头成骨环境,从而改善SONFH 症状,降低SONFH的发生率。
综上所述,引血下行方可调控OC 的活性和OB 的成骨分化进程,改善股骨头周围血管凝血环境,诱导骨小梁促成,从而防治SONFH;其防治SONFH 的可能作用机制存在多靶点效应或多样化效应,可能通过OPG/RANKL/RANK 信号通路介导作用,将研究引血活血补肾类中药对SONFH 修复作用机制及OC/OB 调控机制提供方向和参考。
【Author contributions】OU Zhijian is responsible for constructing the research ideas,designing experimental plans,and writing the pa⁃per.LI Xiwen is responsible for constructing the research ideas,imple⁃menting the experimental plan,and writing the paper.QIU Huayao,HUANG Sicong and LIN Shuo were responsible for the execution of the experimental plan and writing of the paper for this study.LI Yiqun is responsible for the construction of the research ideas and the design of the experimental plan.All authors read and approved the final manuscript as submitted.

