河南省某兔场兔肝球虫和大肠杆菌混合感染情况及耐药性研究
张 昕,张自强,朱欣妍,张晨杰,刘玉梅
(河南科技大学 动物科技学院,河南 洛阳 471000)
兔球虫病是家兔中最常见的也是危害最严重的寄生虫病,被列为国家二类动物疫病。根据国内外学者的报道,各兔场均发现不同程度的球虫感染[1-4]。按球虫的种类和寄生部位不同可将兔球虫病分为肝型、肠型和混合型。临床上混合型和肠型常见,分别占31.75%和56.48%,肝型较为少见,约占3.34%[5]。兔球虫病多发于幼兔,感染率、病死率高,可出现高达70%的死亡率;成年兔一般均可耐过,但可排出卵囊成为长期带虫者和传染源,且耐过兔长期消瘦、发育迟缓、体质变差、抗病能力降低,极易继发其他病原菌的感染[6]。兔大肠杆菌病是一种条件性致病菌,当兔生活环境发生变化、饲养管理不当、断奶以及患上其他致使家兔抵抗力降低的疾病时,通常会引起该病的发生,该病呈现暴发性、潜伏期短、死亡率高的特点[7]。
目前国内外对于兔混合型或肠型球虫病继发大肠杆菌报道较多,但关于兔肝球虫与大肠杆菌混合感染报道较少[8]。本研究结合实际生产中疑似兔肝球虫与大肠杆菌混合感染病例,通过临床症状观察、病理剖检、球虫检测以及从病兔组织分离病原菌,并进行PCR鉴定、基因测序及药敏试验,确定球虫感染类型以及病原菌的耐药谱,对科学用药、预防控制肝球虫和大肠杆菌混合感染提供参考依据。
1 材料与方法
1.1 病料来源
2021年1月,河南省某兔场商品兔群出现食欲不振、消瘦、腹围增大并伴有明显腹泻症状为主要特征的疾病,病兔出现大量死亡,死亡率约70%。通过临床观察发病兔、病理剖检、球虫检测及无菌采集病死兔肝脏、肺脏、气管、肾脏、盲肠等组织,进行病原菌的分离培养及检测。
1.2 主要试剂与仪器
普通琼脂培养基、麦康凯琼脂培养基购自北京索莱宝科技有限公司;药敏纸片、细菌微量生化鉴定管购自杭州微生物试剂有限公司;Premix TaqTM(E× TaqTM Version 2.0 plus dye)购自大连TaKaRa公司;细菌基因组DNA小量提取试剂盒、Proteinase K、DL2000 DNA Maker购自北京庄盟国际生物基因科技有限公司;溴化乙锭溶液购自苏州天可贸易有限公司。试验用主要仪器包括显微镜、台式冷冻高速离心机(Beckman Coulter)、普通PCR仪(Applied Biosystems 2720)、凝胶成像系统(BIORAD)、电泳仪(北京市六一仪器厂)。
1.3 球虫检测
取3~5 g新鲜粪便,加入7 mL饱和食盐水,捣碎混匀,再加入50 mL饱和食盐水,混匀后60目筛网过滤,取滤液,注满麦克马斯特板计数室,置于显微镜下放3~5 min,而后在显微镜下计数1 cm2的虫卵总数,求2个计数室中虫卵数的平均数,根据公式OPG=(n1/0.15)×60÷m计算出每克粪便中的虫卵数(OPG)。其中n1为卵数,0.15为每个计数室有效体积,60为粪液总体积,m为粪便克数。
肝球虫检测:抽取胆汁涂片于玻片上,置于显微镜下检测。
1.4 病原菌的分离纯化
无菌采集病死兔肝脏、肺脏、气管、肾脏、盲肠等组织,分别接种于普通营养琼脂培养基,37 ℃培养24 h后,观察菌落的生长情况。挑取疑似单个菌落接种于麦康凯琼脂平板上纯化,并对纯培养细菌进行革兰染色,镜检。
1.5 生化试验
将分离的菌纯培养物分别接种到微量生化管,37 ℃培养24~48 h,观察并记录结果。
1.6 引物设计与合成
选取GenBank中发布的大肠杆菌eae基因序列,经DNA Star软件对比分析后,利用Primer Primier 5.0软件设计1对引物。引物由通用生物(安徽)股份有限公司合成,引物序列及目的片段的大小见表1。

表1 引物序列Table 1 Primer sequences
1.7 分子生物学鉴定
取分离纯化后的菌液,按照细菌基因组DNA小量提取试剂盒说明书上的步骤进行细菌DNA的提取后,以菌液的核酸为模板,分别进行大肠杆菌eae基因的PCR扩增。反应体系25 μL:DNA模板 1 μL,Premix TaqTM 12.5 μL,上、下游引物各1 μL,ddH2O 9.5 μL。反应条件:94 ℃ 4 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min;4 ℃保存。扩增后的PCR产物用2%的琼脂糖凝胶电泳进行检测后,送至通用生物(安徽)股份有限公司进行测序,将测序结果与GenBank中已登录的菌株进行同源性比对分析,并利用MEGA 7.0构建系统进化树。
1.8 动物回归试验
将1株分离菌分别接种于普通营养培养基,37 ℃培养24 h后用平板法进行细菌计数,稀释菌液浓度至109CFU/mL。将8只20 g左右SPF级KM小鼠随机分为2组,每组4只,第1组每只小鼠分别腹腔注射稀释好的菌液0.2 mL,对照组小鼠注射相同剂量的PBS。相同环境下饲养,接种后观察,对病死鼠进行剖检。
1.9 药敏试验
按照美国临床检验标准委员会(NCCLS)推荐的K-B纸片法[9]进行药敏试验操作和结果判断。将分离的菌接种到普通琼脂培养基上,放入药敏纸片,测量抑菌圈的直径。抗生素纸片包括:红霉素、庆大霉素、新霉素、四环素 、多西环素、复方新诺明、多黏菌素B、麦迪霉素、卡那霉素、诺氟沙星、环丙沙星、氨苄西林、丁胺卡那、头孢哌酮、氯霉素。
2 结果与分析
2.1 临床剖检
病兔腹泻严重,排出棕褐色水样粪便,污染肛门周围和后肢被毛(图1A)。肠系膜出血,盲肠出血严重(图1B)。胆囊充盈(图1C)。肝脏肿大,表面和实质有白色和淡黄色结节,呈圆形,如粟粒至豌豆大,沿胆小管分布(图1D)。
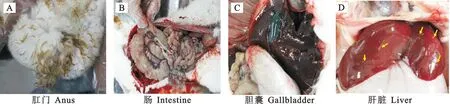
图1 病死兔剖检Fig. 1 Dissection of sick and dead rabbits
2.2 球虫检测结果
随机抽取5只兔子取粪样检测,OPG值分别是0.0156×104、0.0623×104、0.0321×104、0.0252×104、0.0276×104(图2A),未达到肠球虫感染标准(OPG≥0.5×104)[10]。胆汁涂片镜检可看到视野里出现大量球虫卵囊(图2B)。

图2 球虫检测Fig. 2 Cryptococcus assay
2.3 细菌形态及培养特性观察
经细菌分离培养,从5只病死兔肝脏中分离到5株细菌,5株菌体形态特征、培养特性、生化特性和药物敏感性一致。细菌在普通琼脂上生长后,能看到不产生色素、圆形、中等大小、表面有微微凸起、边缘整齐、半透明灰白色的菌落(图3A),在麦康凯琼脂平板上能形成红色菌落(图3B)。革兰染色镜检可见染色阴性、无芽孢的中等大小直杆菌,大小为(0.4~0.7)μm×(2~3)μm,其菌体两端钝圆,多单个散在或者成对排列(图3C)。

图3 细菌培养形态及革兰氏染色A.普通琼脂培养;B. 麦康凯琼脂培养;C.革兰染色镜检Fig. 3 Bacterial culture morphology and Gram stainingA. Ordinary AGAR culture;B. McConkey AGAR culture;C. Gram staining microscopy
2.4 生化试验
细菌理化性质见表2,其理化性质符合大肠杆菌的生化特性。因此,据分离菌形态、培养特性及表2生化特性分析结果,初步判定此次分离培养菌为大肠杆菌。
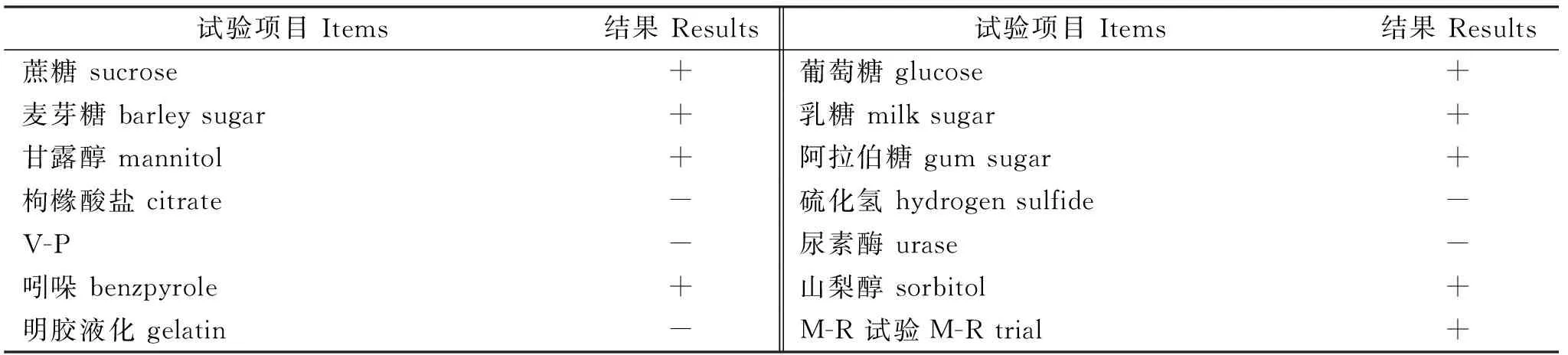
表2 生化试验结果Table 2 Biochemical test results
2.5 分子生物学鉴定
经2%琼脂糖凝胶电泳后,5只兔子的肝脏处分离得到的细菌约在833 bp处出现特异性条带(图4 )。分别将2种扩增产物的测序结果经NCBI blast分析,采用DNAStar软件中MegAlign进行多序列比对,采用MEGA 7.0软件分别构建其遗传进化树,结果见图5。
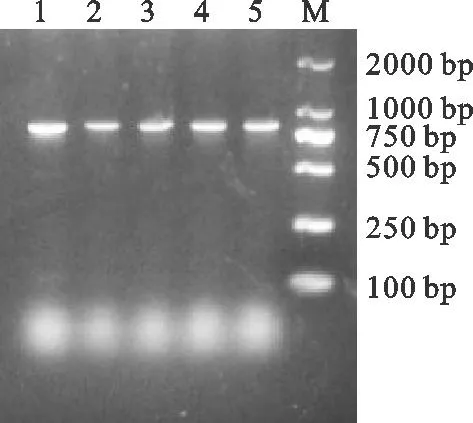
图4 分离菌eae基因 PCR扩增电泳图M. DL2000 Marker;1~5.分离菌株Fig. 4 eae gene PCR amplification electrophoresis of isolation bacteriaM. DL2000 Marker; 1~5. Isolated strains
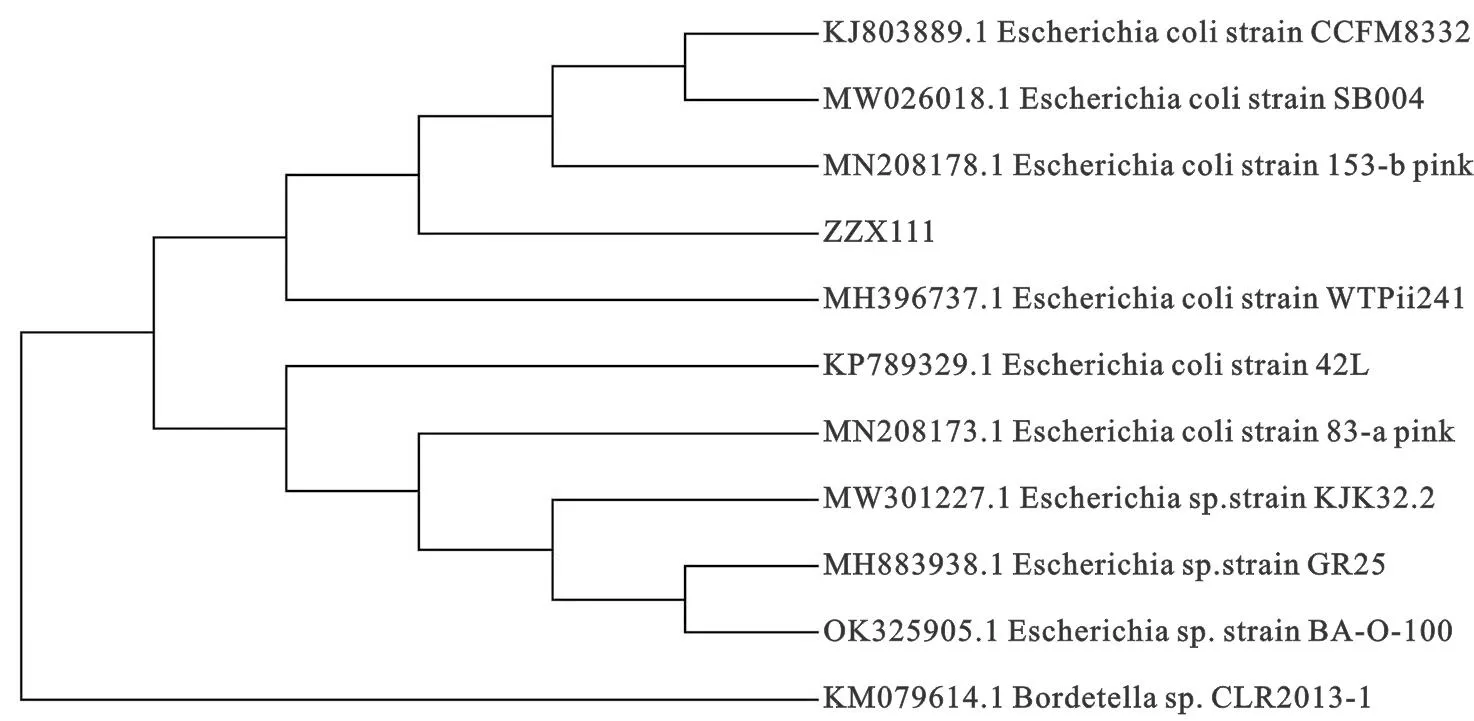
图5 分离菌16S rRNA基因系统发育树(邻接法构建)Fig. 5 Phylogenetic tree of isolation bacteria 16S rRNA gene(Neighbor-joining,NJ)
2.6 动物回归试验
通过动物回归试验发现,对照组小鼠在观察期内无临床症状。试验组小鼠在注射24 h后出现精神沉郁、进食减少、嗜睡等症状,48 h后开始出现死亡现象,至72 h 小鼠死亡3只,余1只存活,存活小鼠精神沉郁,被毛无光泽,厌食消瘦。死亡小鼠剖检观察发现皮下有出血点,腹水充盈,肝脏淤血肿大,肾脏肿大有出血点,肠道内容物有血块。肝脏、肾脏等组织接种于普通营养琼脂平板培养,分离菌的菌落特征和染色镜检结果均与原分离菌株一致,16S rRNA的PCR鉴定证实序列与原分离株相同。
2.7 药敏试验
根据美国临床实验室标准化委员会(NCCLS,2004年第14版)[9]推荐的K-B纸片扩散法进行药敏试验及结果判定。将该大肠杆菌接种到普通琼脂培养基上,放入药敏纸片,测量抑菌圈的直径。大肠杆菌对不同药物的敏感性见表3。由表3可知,大肠杆菌对多黏菌素B、丁胺卡那、氨苄西林、头孢哌酮敏感,对环丙沙星表示中介,对红霉素、庆大霉素、新霉素、麦迪霉素、四环素、卡那霉素、多西环素、复方新诺明、诺氟沙星、氯霉素不敏感。
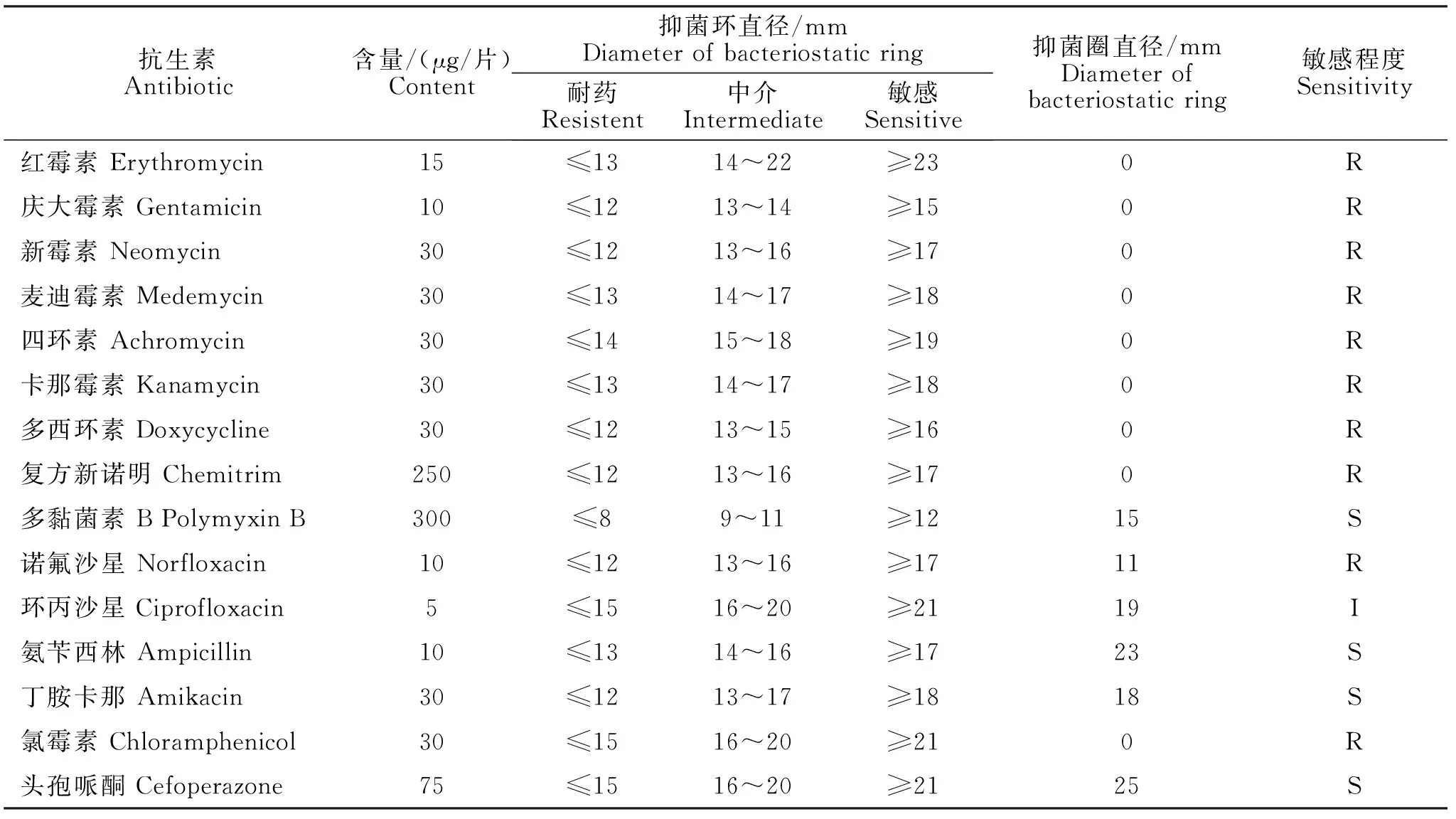
表3 不同药物对大肠杆菌菌株的抑菌效果Table 3 Bacteriostatic effects of different drugs on Brodetella bronchiseptica strains
3 讨 论
兔球虫病是养兔业危害最大的疾病之一,因球虫造成的经济损失高居首位[11]。球虫按感染部位可分为肝型、肠型和混合型,临床上以混合型和肠型较为常见。Okumu等[12]通过抽检肯尼亚农场2 680只兔发现兔球虫感染率85.1%,其中肠球虫29.5%,肝球虫11.5%,其余为混合感染。张嘉等[13]对福建某肉兔场球虫感染进行调查发现球虫总感染率为89.79%,以肠球虫为主,混合型为次。叶勇刚等[14]对四川规模兔场球虫病感染情况调查显示总感染率为71.11%,其中1~3月龄幼兔感染率达96%,全部为混合型感染。彭家炜[15]对河南南阳地区兔球虫病流行病学进行调查,发现总感染率为52.5%,幼兔的感染率显著高于其他年龄段,均属于混合型和肠型。ElShahawi等[16]调查了埃及家兔球虫的感染情况,发现感染率达到70%,大多数是肠球虫,混合型和肝型少见。
兔大肠杆菌病是兔养殖中的主要传染病之一,症状以腹泻为主,具有潜伏期短、死亡率高的特点。大肠杆菌极易产生耐药性,近年来抗生素频繁使用导致大肠杆菌耐药性愈发严重,病情复杂化,治疗难度增加,且各个地区临床用药的不同造成大肠杆菌对抗菌药物的耐药性呈现出不同程度的差异。韩超逸等[17]报道贵州省某兔场爆发大肠杆菌病,发病率17%,死亡率14%,药敏结果显示仅对庆大霉素和头孢曲松敏感。王孝友[18]报道重庆市某兔场大肠杆菌对环丙沙星、庆大霉素、氟派酸、新霉素敏感,发病初期未能及时采取敏感药物治疗导致60日龄病兔腹泻严重,发病后很快死亡。王佳佳等[19]报道河南省某兔场大肠杆菌与克雷伯氏菌混合感染导致病兔腹泻迅速死亡,药敏结果显示大肠杆菌对庆大霉素、环丙沙星、头孢氨苄、头孢唑啉、头孢哌酮、头孢拉定、氨苄西林7种药物敏感。高海慧等[20]报道分离得到的75株牛源大肠杆菌对阿莫西林、哌拉西林、氨苄西林、头孢唑啉、氟苯尼考、恩诺沙星、四环素的耐药率均大于90%,且多重耐药菌株占85.33%,耐药严重。王昌建[21]报道79株临床分离的猪源大肠杆菌对β-内酰胺酶类的药物氨苄西林耐药率为92.4%。
本次发病兔场病兔精神沉郁、食欲减退、俯卧不动、消瘦、腹胀、肝区触诊有痛感,腹泻严重,排出棕褐色水样粪便,死亡前歪倒,惨叫而亡。通过采取饱和食盐水漂浮法对兔场病兔进行粪检,检测出球虫的OPG值未达到肠球虫感染标准(OPG≥0.5×104)。剖检多只病兔后观察发现个别肝脏表面和实质有白色和淡黄色条形结节,沿胆小管分布。抽取胆汁涂片显微镜下可见大量球虫卵囊,其余病兔胆汁均可观察到球虫卵囊,是典型的由斯氏艾美耳球虫寄生在肝脏和胆管上皮细胞造成的肝球虫症状[10]。后经细菌的分离培养、PCR鉴定和进一步的测序,确定分离菌为大肠杆菌,药敏试验结果显示,该菌仅对多黏菌素B、丁胺卡那、氨苄西林、头孢哌酮敏感,对其他药物有较强抗性,耐药严重。该兔场发病后,兔场技术人员检测了粪便中的球虫卵囊,未见球虫感染,与实验室检测结果一致。由于肝球虫感染在临床球虫感染中较为少见,且前期临床和病理变化不明显,导致该场技术人员未能及时发现肝球虫及对症治疗,仅当做细菌感染治疗。在使用大量针对细菌感染治疗的药物后,仍然不能有效控制兔群发病,兔群在肝球虫与大肠杆菌相互协同作用下,病死率高达70%,造成兔场损失惨重。该兔场最终根据药敏试验结果,采用磺胺氯丙嗪钠与丁胺卡那联合用药,控制住了兔场大规模的发病,疗效显著,避免了更大的经济损失。
在兔的养殖过程中,单独的肝球虫感染较为少见,球虫感染常常会继发细菌性感染,生产中应以预防为主、治疗为辅,预防上采取加强饲养管理、消毒保持兔舍卫生、定期使用药物预防球虫。在该病流行季节采取轮换或穿梭用药进行预防。一旦发病,使用抗球虫药并通过药敏试验筛选出细菌敏感药物进行科学合理的治疗。

