响应面法优化风柜斗草发酵工艺及抗氧化活性分析
王琼珺,林泽燕*,林燕燕,杨彩媚,刘舜慧,王淑贞
(1.漳州卫生职业学院 药学院,福建 漳州 363000;2.漳州卫生职业学院 海洋天然产物与活性研究实验室,福建 漳州 363000)
中药发酵是中药常用炮制方法之一[1-3],近年来随着大健康理念的提出,酵素作为功能食品越来越为人们接受,市面上的酵素主要为果蔬发酵液[4];随着植物酵素的普及,“药食同源”植物酵素也逐渐受到人们的关注,通过接种发酵,可以促进药用植物的细胞壁溶解、有效成分释放,从而提高药效、减少毒副作用等,并获得各种功能产品,降低生产成本,提高产品质量[5]。
风柜斗草(Sarcopyramis nepalensisWall)学名楮头红,性凉,味酸,无毒,具清肺热、去肝火之功,治风湿痹痛、耳鸣、耳聋及目雾羞明[6],分布于全国多地,福建闽南地区常用于治疗急性肝炎、蛇头疔、肺热咳嗽、无名肿毒等[7]。研究表明,风柜斗草全草含有多种成分[8-10],具有一定的生物活性和药理作用[11-13],王燕燕等[14-16]研究发现,黄酮类化合物是风柜斗草的重要成分。植物黄酮是一类特殊的多酚化合物,在亚洲特别是我国古代,医生常应用富含黄酮的药用植物或香料来预防和治疗某些疾病;现代药理学研究也发现植物黄酮具有较好的药理活性,其中包括抑菌[17]、抗炎[18-19]、抗癌[20-21]等。
民间应用风柜斗草一般采用传统的煎煮方法,实验室有效成分获得也依赖传统的提取方法[8-11,22]。郑晓艳等[9]通过分析风柜斗草的水提取液、乙醇提取液以及石油醚提取液,发现风柜斗草醇提物含有多种天然活性物质;谢勇平等[22]将楮头红醇提取物用正丁醇萃取,首次从楮头红中提取得到呋甾烷型甾体皂苷,命名为楮头红皂苷A;林艺华[23]对风柜斗草中黄酮类成分进行定量分析,发现风柜斗草黄酮提取物具有较强的抗氧化活性。目前,国内外风柜斗草发酵工艺及其活性的研究鲜见报道,杨彩媚等[24]应用酿酒酵母(Saccharomyces cerevisiae)发酵风柜斗草干草粉末得到其发酵液,发现该发酵液总黄酮含量高于水提取液,且清除自由基的能力较强,但尚未考察接菌量、发酵时间、发酵温度等因素,发酵工艺存在不确定性,为更好的利用风柜斗草,有必要进一步明确风柜斗草发酵工艺及研究发酵液的生物活性。
本研究以总黄酮含量为评价指标,采用单因素试验和响应面法考察植物乳杆菌(Lactobacillus plantarum)接种量、发酵时间、发酵温度对风柜斗草发酵的影响,确定风柜斗草最佳发酵工艺条件,并对发酵液的有效成分含量及生物活性进行分析,以期为合理利用风柜斗草资源及产业化开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
风柜斗草(Sarcopyramis nepalensisWall):福建漳州市售;植物乳杆菌(Lactobacillus plantarum):北京川秀国际贸易有限公司。
1.1.2 试剂
亚硝酸钠、硝酸铝、氢氧化钠、碳酸钠(均为分析纯):汕头市西陇化工股份有限公司;浓硫酸、盐酸(均为分析纯):国药集团化学试剂有限公司;没食子酸、福林酚试剂、L-酪氨酸、L-酪氨酸酶:北京索莱宝科技有限公司;十二水合磷酸二氢钠、二水合磷酸氢二钠(分析纯):美国Sigma公司;芦丁标准品(纯度≥95%):中国食品药品检定研究院;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH):东京化成工业株式会社;维生素C(vitamin C,VC):上海福昕生物科技有限公司;0.22 μm滤膜:无锡耐思生命科技股份有限公司。
1.2 仪器与设备
T6 新世纪紫外分光光度计:北京普析通用仪器有限责任公司;FA2003电子天平:上海精密科学仪器有限公司;HH系列数显恒温水浴锅:金坛市科析仪器有限公司;L535R台式大容量离心机:长沙湘仪离心机仪器有限公司;ZHLY-180振荡培养箱:上海知楚仪器有限公司;SW-CJ-2D型单人单面超净工作台:苏净安泰空气技术有限公司;Multiskan SkyHigh 型全波长酶标仪、3949型恒温培养箱:美国赛默飞世尔科技公司。
1.3 方法
1.3.1 风柜斗草发酵液的制备
用水快速冲洗风柜斗草表面泥沙、杂质,烘干至质量恒定,取出打磨成粉,过80目筛。取风柜斗草粉末2 g,加入植物乳杆菌,在超净工作台中接入100 mL无菌水中,在一定温度下,80 r/min转速振荡培养、离心,取上清液,用0.22 μm滤膜过滤,滤液备用,全程为无菌操作[24]。
1.3.2 风柜斗草发酵液发酵工艺优化单因素试验
以植物乳杆菌接种量0.5%,发酵温度30 ℃,发酵时间15 h为基础培养条件;分别单独考察发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、植物乳杆菌接种量(0.1%、0.5%、1.0%、1.5%、2.0%)、发酵时间(6 h、9 h、12 h、15 h、18 h、21 h、24 h)对风柜斗草发酵液中总黄酮含量的影响。每组设置3个平行试验。
1.3.3 风柜斗草发酵液发酵工艺优化响应面法试验设计
为确定风柜斗草发酵液最佳发酵工艺参数,在单因素试验的基础上,选择菌种接种量(A)、发酵时间(B)、发酵温度(C)为影响因素,以总黄酮含量为响应值,进行响应面试验设计,考察各因素间交互作用对风柜斗草发酵液总黄酮含量的影响,响应面试验因素与水平见表1。
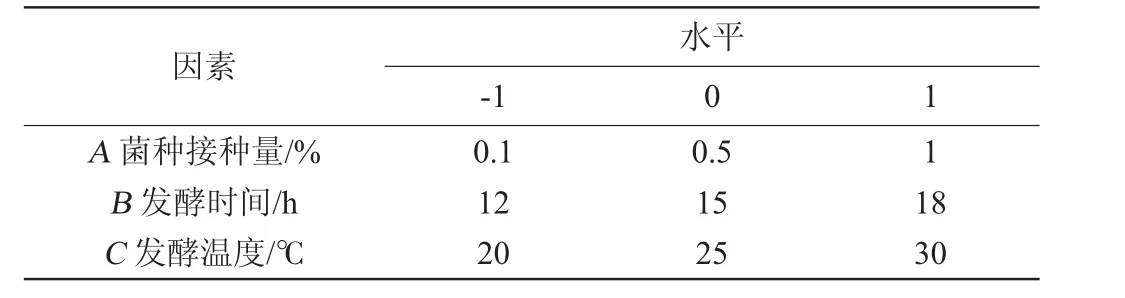
表1 发酵工艺优化响应面试验设计因素与水平Table 1 Factors and levels of Box-Behnken experiments for fermentation technology optimization
1.3.4 风柜斗草发酵液有效成分测定(1)总黄酮含量的测定
发酵液总黄酮含量的测定采用紫外分光光度法。芦丁标准曲线的制作参照《中华人民共和国药典(一部)》(2020版)[25],以芦丁标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制芦丁标准曲线,得到标准曲线回归方程y=3.01x-0.023 4,R2=0.999 6。根据标准曲线计算总黄酮含量。
(2)总酚含量的检测
发酵液总酚含量测定参考关奎奎等[26]的方法,以没食子酸标准品为对照品,在波长750 nm处测定吸光度值。以没食子酸标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制没食子酸标准曲线。得到标准曲线回归方程y=24.5x+0.000 4,R2=0.999 8。根据标准曲线计算发酵液总酚含量。
(3)粗多糖含量检测
参照参考文献[25]测定多糖含量,以葡萄糖标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线回归方程y=28.48x-0.256 2,R2=0.999 6。根据标准曲线计算发酵液粗多糖含量。
1.3.5 风柜斗草发酵液体外抗氧化活性测定[27-28]
(1)总抗氧化能力测定
根据试剂盒操作要求进行测定,以总抗氧化能力μmol/mL表示。
(2)超氧阴离子自由基(O2-·)清除率的测定
按试剂盒要求要求设置空白孔、测定孔及对照孔,测定其吸光度值,以下式计算超氧阴离子清除率。
式中:530 nm波长处测定样品溶液吸光度值为A样品,试剂盒中对照品溶液的吸光度值为A对照。
(3)羟自由基(OH-·)清除率的测定
按试剂盒要求设置空白孔、测定孔及对照孔,各吸取50 μL进行显色反应,按下式计算风柜斗草发酵液羟自由基清除率。
式中:A样品为波长536 nm处测定样品溶液吸光度值,以试剂盒中对照品溶液吸光度值记为A对照,加蒸馏水不加试剂盒中试剂的孔为空白,吸光度值记为A空白。
(4)DPPH自由基清除率的测定
样品溶液与DPPH试剂等体积混合,避光反应30 min,测定波长517 nm处吸光度值,对照溶剂用无水乙醇代替,按下式计算DPPH自由基清除率。0.01 mg/mL和0.05 mg/mL VC溶液为阳性对照。
式中:517 nm波长处测定样品溶液与DPPH液的吸光度值记为A样品,样品溶液与无水乙醇混合液吸光度值记为A对照,DPPH液与无水乙醇混合液的吸光度值,记为A空白。
1.3.6 酪氨酸酶抑制活性的测定
参考李娜等[29]的方法测定。配制pH 6.8磷酸盐缓冲液(phosphate buffer saline,PBS);取酪氨酸酶用PBS定容至浓度为1 kU/mL;取L-酪氨酸,加PBS溶解并定容至质量浓度为0.5mg/mL;风柜斗草发酵液为样品溶液;熊果苷(10mmol/L)为阳性对照。先将各试剂置于25℃恒温孵育箱中孵育10min,取出加样,再于37 ℃恒温箱反应20 min,取出转入提前预热的酶标仪中,波长475 nm处测定吸光度值。
总反应体系设定100 μL,以L-酪氨酸10 μL为底物,做5组试验,风柜斗草发酵液分别添加20 μL、30 μL、40 μL、50 μL、60 μL,加PBS溶液至足量后测吸光度值。以不同添加量的熊果苷为对照,比较不同添加比例风柜斗草发酵液对酪氨酸酶的抑制情况,每组重复3次。
式中:Aa为酪氨酸+PBS缓冲液的吸光度值;Ab为酪氨酸+PBS缓冲液+酪氨酸酶的吸光度值;Ac为酪氨酸+PBS缓冲液+样品的吸光度值;Ad为酪氨酸+PBS缓冲液+样品+酪氨酸酶的吸光度值。
1.3.7 数据处理
采用SPSS19.0进行均值比较,采用Origin8.0进行图表绘制,用Design-Expert8.06设计响应面及数据分析、方程拟合和图表绘制,每个试验重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 风柜斗草发酵工艺优化单因素试验
2.1.1 不同发酵温度对总黄酮含量的影响
不同发酵温度对总黄酮含量的影响结果见图1。由图1可知,当发酵温度从20 ℃升高到25 ℃时,总黄酮含量随之升高;当发酵温度为25 ℃时,总黄酮的含量最高,为(7.54±0.87)mg/mL;而当发酵温度高于25 ℃后,总黄酮含量出现降低趋势,可能是由于黄酮结构中含大量的羟基,温度升高极易被氧化;发酵温度为35~40 ℃时,提取液中总黄酮已经达到饱和。因此,选择最佳发酵温度为25 ℃。
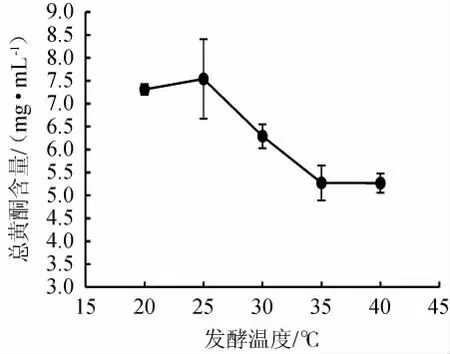
图1 不同发酵温度对风柜斗草发酵液总黄酮含量的影响Fig.1 Effect of different fermentation temperature on total flavonoids contents in fermentation liquid of Sarcopyramis nepalensis
2.1.2 不同接种量对总黄酮含量的影响
不同接种量对总黄酮含量的影响见图2。由图2可知,植物乳杆菌接种量从0.1%增大到0.5%时,总黄酮的含量呈上升趋势,在接种量0.5%时,总黄酮含量达最高为(5.87±0.40)mg/mL,接种量超过0.5%后,总黄酮含量呈下降趋势。因此,选择最佳接种量为0.5%。

图2 不同接种量对风柜斗草发酵液总黄酮含量的影响Fig.2 Effect of different inoculum on total flavonoids contents in fermentation liquid of Sarcopyramis nepalensis
2.1.3 不同发酵时间对总黄酮含量的影响
不同发酵时间对总黄酮含量的影响见图3。由图3可知,随着发酵时间的增长,风柜斗草发酵液总黄酮的含量先增高再降低,当发酵时间<15 h时,发酵液中的总黄酮含量较低,随着发酵时间的延长,发酵液中黄酮的含量随着时间的增长而升高;发酵时间为15 h时,总黄酮含量最高,为(7.87±0.85)mg/mL,发酵时间>15 h后总黄酮含量逐渐下降。这是由于发酵时间>15 h后,发酵液中的黄酮浓度基本已经达到饱和,且风柜斗草中的其他物质溶入提取液中,导致黄酮含量降低。因此,选择最佳发酵时间是15 h。
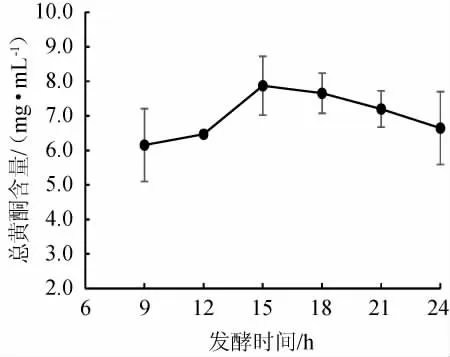
图3 不同发酵时间对风柜斗草发酵液总黄酮含量的影响Fig.3 Effect of different fermentation time on total flavonoids content in fermentation liquid of Sarcopyramis nepalensis
2.2 发酵工艺响应面法优化试验结果与分析
2.2.1 响应面优化设计方案与结果
在单因素试验结果基础上,将接种量(A)、发酵时间(B)、发酵温度(C)3个因素作为自变量,以总黄酮含量为响应值(Y)进行响应面试验,响应面试验结果见表2,方差分析结果见表3。
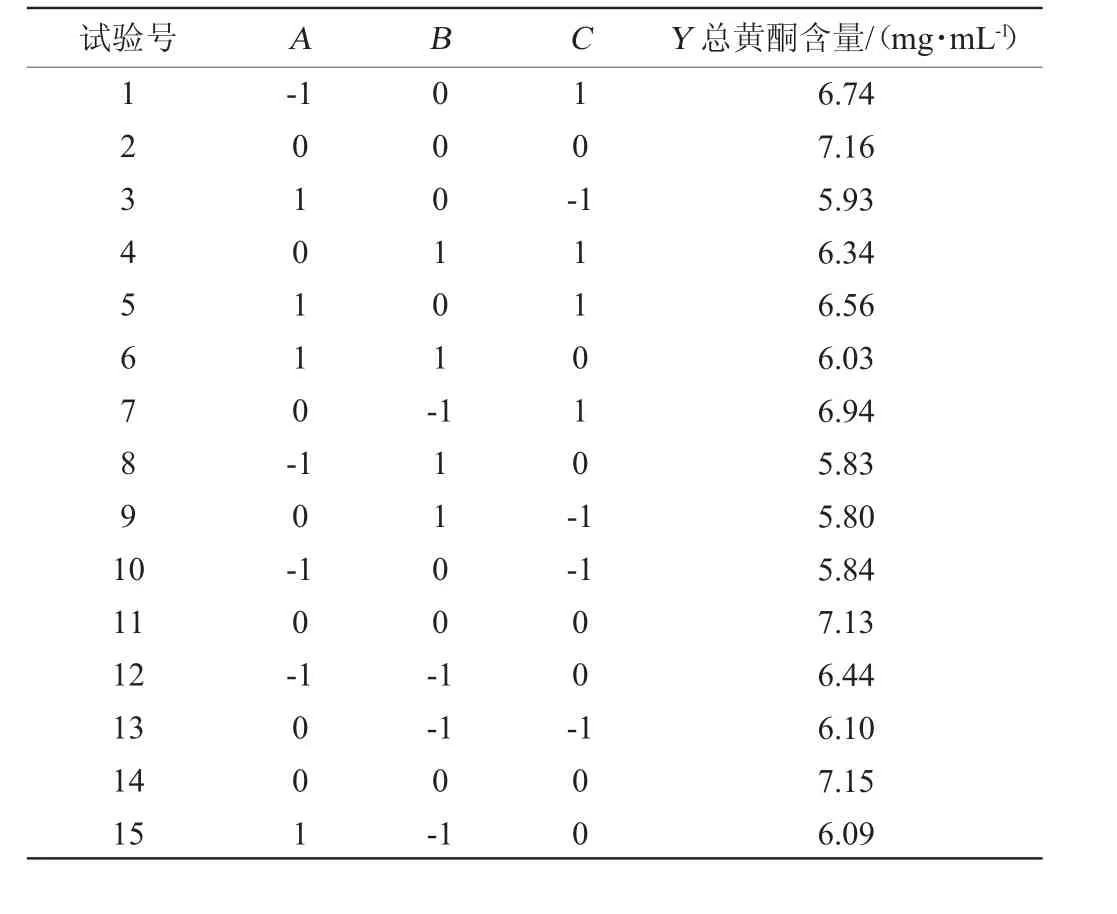
表2 发酵工艺优化响应面试验结果与分析Table 2 Results and analysis of response surface experiment for fermentation conditions optimization
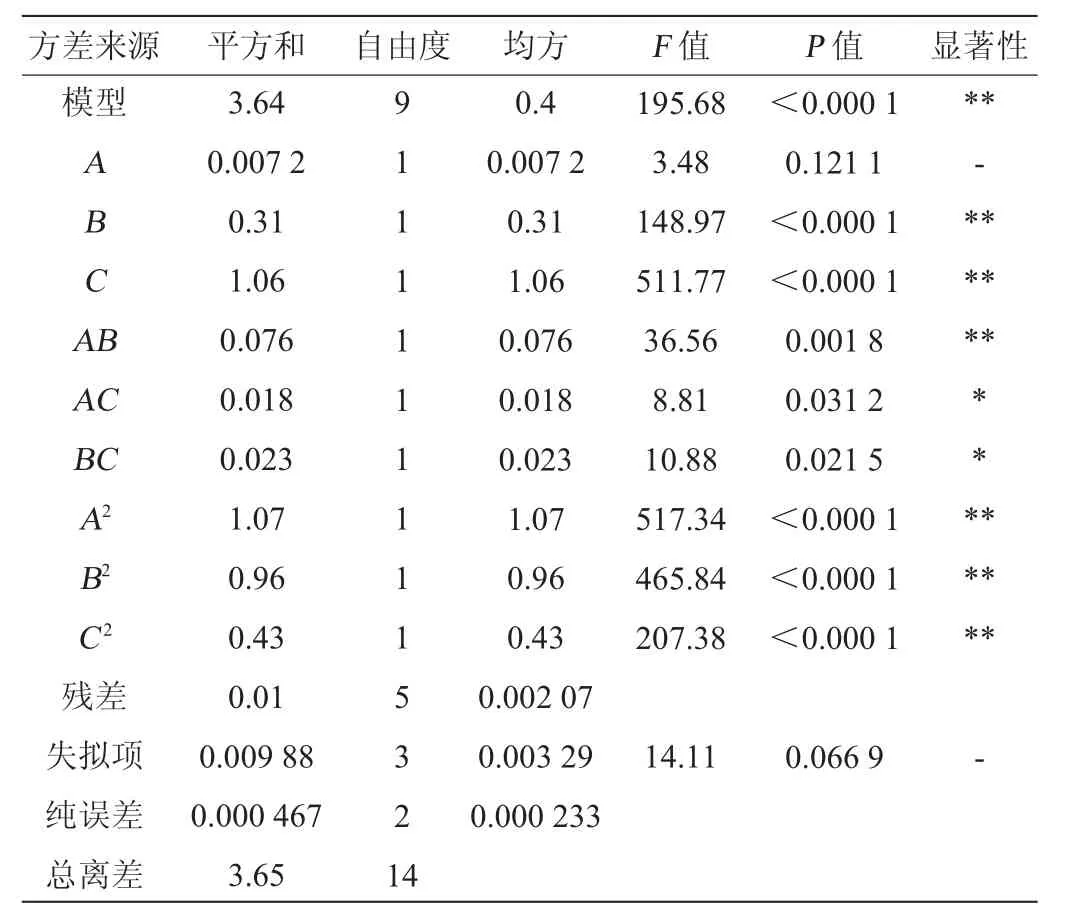
表3 回归模型方差分析Table 3 Variance analysis of regression model
2.2.2 建立回归模型和方差分析
利用响应面软件Design-Expert8.06对表2中的数据进行多元回归拟合,获得响应值总黄酮含量(Y)的回归模型方程式为:
由表3可知,建立的模型极显著(P<0.000 1),失拟项不显著(P>0.05),说明模型拟合度良好。模型的适配度高达99.72%,说明试验误差小,可以利用该模型预测发酵工艺对风柜斗草总黄酮含量的影响。由F值可知,各因素对风柜斗草发酵液总黄酮含量的影响程度由强到弱依次为发酵温度将发酵温度(C)>发酵时间(B)>接种量(A),且结合表中P值可知,回归模型中一次项B、C,交互项AB,二次项A2、B2、C2对结果影响极显著(P<0.01);交互项AC、BC对结果影响显著(P<0.05),其他因素对结果影响不显著(P>0.05)。
2.2.3 响应面因素交互作用分析
接种量、发酵时间、发酵温度交互作用对风柜斗草发酵液总黄酮含量影响的响应面和等高线见图4。由图4可知,响应曲面开口均朝下,各交互作用的试验点范围内都出现了最高点,说明三个工艺参数所选水平范围合理,其中交互项AB的交互作用的响应曲面陡峭,等高线呈椭圆形,说明接种量(A)和发酵时间(B)的交互效应对风柜斗草发酵液总黄酮含量影响极显著;另外接种量(A)和发酵温度(C)交互作用以及发酵时间(B)和发酵温度(C)交互作用的响应曲面较陡峭,说明对风柜斗草发酵液总黄酮含量有显著影响,这与方差分析结果一致。
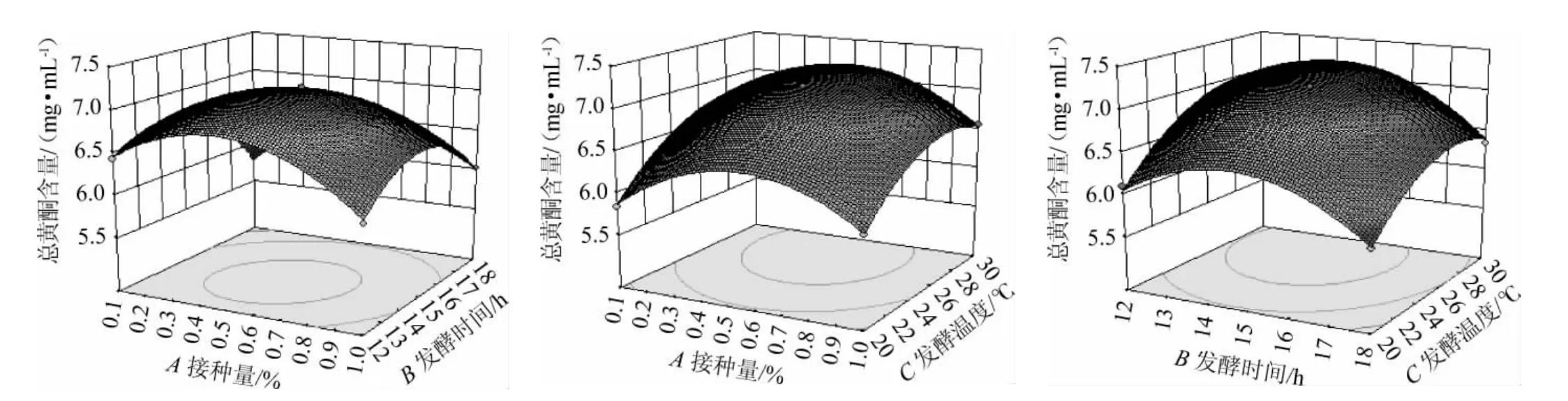
图4 各因素间交互作用对风柜斗草发酵液总黄酮含量影响的响应面和等高线Fig.4 Response surface plots and contour lines of effects of interaction between each factors on total flavonoids content in fermentation liquid of Sarcopyramis nepalensis
2.3 最佳工艺条件试验验证
利用Design-Expert8.06软件,通过优化得到最优发酵工艺条件为:接种量0.51%,发酵时间14.26 h,发酵温度27.85 ℃,通过回归方程可得风柜斗草发酵液总黄酮含量7.28 mg/mL。结合实际操作可行性,将最佳发酵工艺修正为:接种量0.5%,发酵时间14 h,发酵温度28 ℃。按此发酵工艺条件进行3次平行验证试验,测得风柜斗草发酵液总黄酮含量实际值为(7.24±0.03)mg/mL,与预测值7.28 mg/mL差异不显著(P>0.05),与模型预测基本一致,表明该模型有效可行,可以预测风柜斗草的发酵工艺。将上述风柜斗草发酵液进行总酚含量和多糖含量检测,得该发酵液中总酚含量为(3.54±0.11)mg/mL,多糖含量为(4.77±0.78)mg/mL。
2.4 风柜斗草发酵液抗氧化活性测定结果
2.4.1 总抗氧化能力、超氧阴离子及羟自由基清除能力的测定风柜斗草发酵液抗氧化活性测定结果见表4。由表4可知,风柜斗草发酵液原液总抗氧化能力为(71.32±0.64)μmol/mL,预测值为极显著优于0.25 mg/mL VC溶液(P<0.01);稀释3倍后,与0.25 mg/mL VC溶液无显著差异(P>0.05)。超氧阴离子自由基清除率和羟自由基清除能力检测试验中发现风柜斗草发酵液原液浓度较高,超出检测范围,故稀释后进行检测,反应稳定时结果表明,稀释3倍后超氧阴离子清除率为(44.93±1.92)%,与0.25 mg/mL VC溶液的超氧阴离子清除率无显著差异(P>0.05);稀释4倍后,羟自由基清除能力为(94.46±2.35)%,显著优于0.25 mg/mL VC溶液(P<0.05)。

表4 风柜斗草发酵液抗氧化性测定结果Table 4 Determination results of antioxidant activity of fermentation liquid of Sarcopyramis nepalensis
2.4.2 DPPH自由基清除能力的测定
试验中发现风柜斗草发酵液原液浓度较高,对发酵液分别进行10倍和30倍稀释,测定其对DPPH自由基的清除率,结果见图5。由图5可知,风柜斗草10倍稀释的发酵液DPPH自由基清除率为(89.71±0.33)%,与0.05 mg/mL VC溶液DPPH自由基清除率差异不显著(P>0.05),稀释30倍之后才与0.05 mg/mL VC的清除率间差异显著(P<0.05),说明风柜斗草发酵液具有较好的清除DPPH自由基的能力。
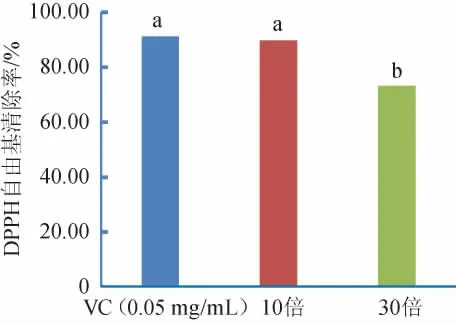
图5 风柜斗草发酵液DPPH自由基清除能力Fig.5 DPPH free radical scavenging activity of fermentation liquid of Sarcopyramis nepalensis
2.5 抑制酪氨酸酶作用结果
不同风柜斗草发酵液及熊果苷对照液对酪氨酸酶活性的抑制率影响结果见图6。由图6可知,不同添加量风柜斗草发酵液对酪氨酸酶活性的抑制率随浓度升高而增加。当添加量>40%时,风柜斗草发酵液对酪氨酸酶的抑制率开始超过熊果苷,说明添加量>40%时,风柜斗草发酵液对酪氨酸酶的抑制作用优于熊果苷溶液。酪氨酸酶能够催化L-酪氨酸,进而经过一系列反应生成黑色素,其活性与黑色素合成有密切关系[29]。目前市场上常用熊果苷作为酪氨酸酶抑制剂应用于美白化妆品,试验结果提示风柜斗草发酵液具有良好的酪氨酸酶活性抑制作用,可考虑作为酪氨酸酶抑制剂应用于化妆品中。
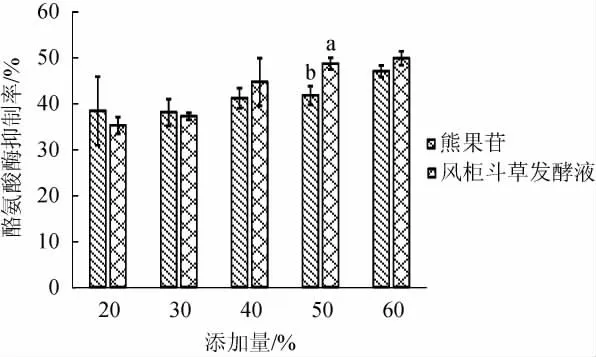
图6 风柜斗草发酵液的抑制酪氨酸酶活性Fig.6 Inhibition of tyrosinase activity of fermentation liquid of Sarcopyramis nepalensis
3 结论
本研究通过单因素试验和响应面试验,确定风柜斗草发酵液的最佳发酵工艺条件为:接种量0.5%,发酵时间14 h,发酵温度28 ℃。在此优化条件下,风柜斗草发酵液的总黄酮含量为7.28 mg/mL,总酚含量为3.54 mg/mL,多糖含量为4.78 mg/mL。抗氧化试验结果表明,风柜斗草发酵液总抗氧化能力(71.32±0.64)μmol/mL,且对超氧阴离子、羟自由基、DPPH自由基清除率能力强;酪氨酸酶活性抑制率高。表明风柜斗草经过该发酵工艺发酵后具有很好的生物活性,该研究结果为风柜斗草发酵液进一步开发应用于食品药品、化妆品提供理论依据。

