奇孢根霉强化中温大曲对糟醅发酵过程的影响
万营东,唐秋香,黄 钧,周荣清,2*,张宿义,秦 辉,董 异,王 超,张 程,李德林,王小军,张 柱
(1.四川大学 轻工科学与工程学院,四川 成都 610056;2.国家固态酿造工程技术研究中心,四川 泸州 646699;3.泸州老窖股份有限公司,四川 泸州 646699)
中国白酒是世界六大蒸馏酒之一,具有悠久的历史[1]。浓香型白酒是中国三大传统白酒之一,其生产工艺独树一帜[2-3]。浓香型白酒的发酵生产环节主要包括大曲制作和糟醅发酵过程[4]。大曲的菌系、酶系与白酒的产量和风格密切相关[5]。筛选功能菌株并应用于强化大曲,不仅可以提高大曲的酶活力,还能改善白酒的特征风味。研究表明,将Bacillus用于强化中温大曲,显著提高了其糖化力和液化力,并且改变了与糖化活性和液化活性相关的微生物群落组成,从乳杆菌属和根毛霉属变为芽孢杆菌属、魏斯氏菌属和丝孢毕赤酵母属[6]。此外,HONG L等[7]研究发现,使用功能性酵母强化大曲,代替传统大曲模拟特香型白酒发酵,提高了糟醅的酒精度和挥发性风味物质的含量,同时并未改变优势细菌属的相对丰度。
根霉(Rhizopus)是酿酒曲中的主要功能菌之一[8-9],其主要特点是水解酶谱广,如分泌α-淀粉酶、糖淀粉酶、糖苷酶、糖基转移酶等[10],且具有产酒精能力。根霉的高糖化力使其在发酵工业中得到广泛应用[9]。黄艳等[11]从酒曲中筛选出根霉,应用于米醋生产,成功地提升了米醋的风味和品质。此外,麦麸通过接种米根霉进行固态发酵后,不仅降低了不愉悦风味物质的相对含量,还提高了多种芳香挥发性成分的相对含量,从而改善了其感官品质和营养价值[12]。黄科屹等[13]的研究表明,从中高温大曲中分离的米根霉可以制成米曲,添加至白酒酿造中,显著提高了出酒率,说明出酒率与大曲体系的糖化能力呈正相关。在之前的研究中,TANG Q等[14]利用源于优质小曲的奇孢根霉(Rhizopus azygosporus)强化小曲发酵,提高了小曲的淀粉水解力和酯化活力,并改善了小曲糟醅的理化性质和风味特点。马鹏[15]通过混合根霉、米曲霉和红曲霉制备米曲,与传统大曲混合用于白酒固态发酵,提升了白酒的酒精度,丰富了白酒的风味物质。
总的来说,目前的研究主要集中在小曲和米曲中强化根霉的应用,以及将米曲与传统大曲混合用于糟醅发酵,重点关注了白酒的理化和风味改善。然而,对于在大曲制作过程引入根霉对大曲和发酵糟醅的影响规律的相关研究还相对较少。需要注意的是,大曲真菌属相对丰度可能受到微生物间竞争的影响,在高温大曲中,更耐热的嗜热真菌属和红曲霉属竞争优势更强,而根霉则生长缓慢[16]。因此,在中温大曲中引入根霉可能更为合适,且中温大曲具有较高的糖化力,与根霉的特点相辅相成。
本研究以根霉强化的中温大曲为发酵剂,通过模拟窖池发酵,多角度地探讨了根霉强化对糟醅微生物群落结构和挥发性风味成分影响的规律,旨在调控白酒酿造周期和改善风味成分,为开发固态白酒生产新工艺奠定理论基础。
1 材料与方法
1.1 材料与试剂
奇孢根霉(Rhizopus azygosporus)CGMCC 20728:由本实验室筛选自中国典型小曲酒厂,菌株保存于本实验室;Fast DNA SPIN提取试剂盒:美国MP Biomedicals公司;Q5脱氧核糖核酸(deoxyribonucleic acid,DNA)高保真聚合酶:美国New England Biolabs公司;琼脂糖、琼脂糖凝胶电泳缓冲液、Quant-iT PicoGreen dsDNA Assay Kit:美国Invitrogen公司;VAHTSTM DNA Clean Beads:南京Vazyme公司;其他化学试剂(分析纯):成都金山化学试剂有限公司。
1.2 仪器与设备
Trace 1300-TSQ 9000气相色谱-质谱联用仪:美国Thermo Fisher Electron公司;VF-WAX-MS毛细管色谱柱(30 m×0.25 mm×0.25 μm):美国Bellefonte公司;NanoDrop ND-1000分光光度计:美国Thermo Fisher Scientific公司;GL-20G-II立式高速冷冻离心机:上海安亭科学仪器有限公司;S100 TM Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc TM XR凝胶成像仪:美国Bio-Rad公司;85-2型数显恒温磁力搅拌器:上海双捷实验设备有限公司。
1.3 方法
1.3.1 样品制备与收集
大曲样品取自泸州著名酿酒企业制曲中心,参照ZHENG X等[17]所述的工艺过程及参数控制生产,根霉大曲(RQ)接种0.05%的Rhizopus azygosporusCGMCC 20728,普通大曲(NQ)作为对照不接种根霉。
模拟发酵实验采用改良的堆积糖化发酵工艺,发酵时间28 d。将RQ和NQ添加到蒸熟的高粱中(比例为干质量的15%),堆积糖化24 h,装入模拟发酵池(6 L塑料容器,内径为25 cm×17 cm×14 cm),在30 ℃条件下发酵28 d,相应的糟醅记为根霉糟醅(RZP)和普通糟醅(NZP)。两组样品各设置3个平行,在发酵的0 d、7 d、14 d、21 d和28 d采用五点法取样,每个平行样品在取样后均被分为两份,一份置于-20 ℃保藏用于理化性质和挥发性风味物质检测,另一份置于-80 ℃保藏用于微生物群落结构分析。
1.3.2 理化性质测定
大曲样品的水分含量、酸度、酯化力、糖化力、液化力和发酵力的测定:参照QB/T 4257—2011《酿酒大曲通用分析方法》所述方法;糟醅还原糖(reducing sugar,RS)含量、淀粉(starch)含量、酸度(total acidity,TA)、酒精度的测定:参照文献[18]所述方法检测。
1.3.3 挥发性风味物质的检测
挥发性物质通过顶空固相微萃取结合气相色谱-质谱法(headspace solid-phase microextraction gas chromatographymass spectrometry,HS-SPME-GC-MS)测定。
样品的预处理[19]:将1.00 g样品和10 μL内标物质(辛酸甲酯,0.007 3 g/100 mL)加入20 mL顶空瓶中,将顶空瓶置于恒温磁力搅拌器中60 ℃平衡15 min,使用50/30 μm DVB/CAR/PDMS 纤维萃取吸附挥发性组分45 min。萃取头在250 ℃解吸5 min。
气相色谱条件:进样口温度250℃,载气为流速1mL/min的高纯氦气(He)(>99.999%),不分流模式;升温程序:初始温度40 ℃,维持5 min,以4 ℃/min升温至100 ℃,以6 ℃/min升温至230 ℃,维持10 min。
质谱条件:离子源温度250 ℃,传输线温度300 ℃,电离方式为电子电离(electronic ionization,EI)源,电子能量70 eV,扫描范围35~400 amu。
定性定量分析:检测所得质谱图与美国国家标准与技术研究院(national institute of standards and technology,NIST)2017质谱库对比后,仅保留相似度>80%化合物进行进一步分析;根据内标辛酸甲酯的含量与其峰面积的比值,计算出各挥发性化合物的含量。
1.3.4 微生物群落多样性检测
依据FastDNASPIN提取试剂盒的操作说明从样品中提取总DNA。同时采用0.8%琼脂糖凝胶电泳检测DNA提取质量和用分光光度计检测DNA含量。用通用引物338F/806R和ITS5/ITS1分别扩增细菌16S rRNA V3-V4区和真菌ITS1区。
聚合酶链式反应(PCR)扩增体系:5 μL 5×Q5高保真反应缓冲液,5 μL 5×Q5高保真气相色谱缓冲液,0.25 μL Q5高保真DNA聚合酶(5 U/μL),2 μL脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)(2.5 mmol/L),正反向引物各1 μL(10 μmol/L),2 μL DNA模板和8.75 μL ddH2O。PCR扩增条件:98 ℃预热2 min,之后25个循环(包括98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min。PCR产物纯化:用VAHTSTMDNA Clean Beads纯化扩增产物,用Quant-iT PicoGreen dsDNA Assay Kit定量。样品纯化后,委托上海派森诺生物科技有限公司在Illumina Novaseq平台完成DNA片段双端(2×300 bp)测序。
原始测序数据主要通过QIIME2处理。使用demux插件对原始序列进行多路分解,使用cutadapt去除引物,接着使用DADA2对序列进行质量过滤、去噪、合并和嵌合体移除。进一步筛选仅在一个样本和单体中发现的扩增子序列(amplicon sequence variants,ASV)。最后,根据Silva(v132)和UNITE(v8.0)数据库进行比对。
1.3.5 数据统计分析
使用OriginPro 2019b对理化性质进行可视化。在派森诺基因云平台(https://www.genescloud.cn/home)进行以下分析:分析微生物群落的α多样性、β多样性,包括Chao1指数、Shannon指数等,并用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析(LDA>4,P<0.05)确定微生物群落的标志微生物。基于KEGG数据库和Metacyc数据库,利用PICRUSt2预测代谢功能。在SIMCA14.1中进行偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)和排列检验。使用TB Tools(v1.108)生成热图。在图图云平台(https://www.cloudtutu.com/#/index)和OmicShare Tools(https://www.omicshare.com/tools)分别执行冗余分析(redundancy analysis,RDA)和趋势分析。
2 结果与分析
2.1 理化性质变化
水分、酸度及水解能力是衡量大曲质量的主要参数[20],大曲的理化性质差异见表1。由表1可知,RQ的水分、酸度和酯化力略低于NQ,糖化力、液化力、发酵力高于NQ,除酯化力外的其余相关参数都因接种根霉得到改善。将两种大曲用于发酵糟醅,糟醅间理化参数的变化见图1。由图1可知,堆积糖化阶段结束时,RZP和NZP的淀粉含量分别是31.53%和34.42%,前者的水解率高于后者,发酵结束淀粉含量分别是25.07%和27.51%。发酵前中期(0~14 d)淀粉被水解,后期因代谢产物(总酸、乙醇)的抑制及淀粉底物含量的降低,降解幅度减弱。还原糖含量和酸度在RZP和NZP中均是逐渐增高的,且RZP的增幅大于NZP,这可能是因为RQ具有更高的糖化力和液化力,使RZP的底物更有效地水解为糖,同时糖发酵成酸。酒精度在前期增幅较大,在发酵14 d时,RZP的酒精度(8.57%vol)显著高于NZP(7.28%vol)(P<0.05),发酵结束时,RZP的酒精度(7.70%vol)仅略高于NZP(7.20%vol)。以上结果表明,RZP和NZP理化参数的变化趋势一致,但根霉强化降低了糟醅的淀粉含量,同时提高了糟醅的酸度、还原糖含量和酒精度。
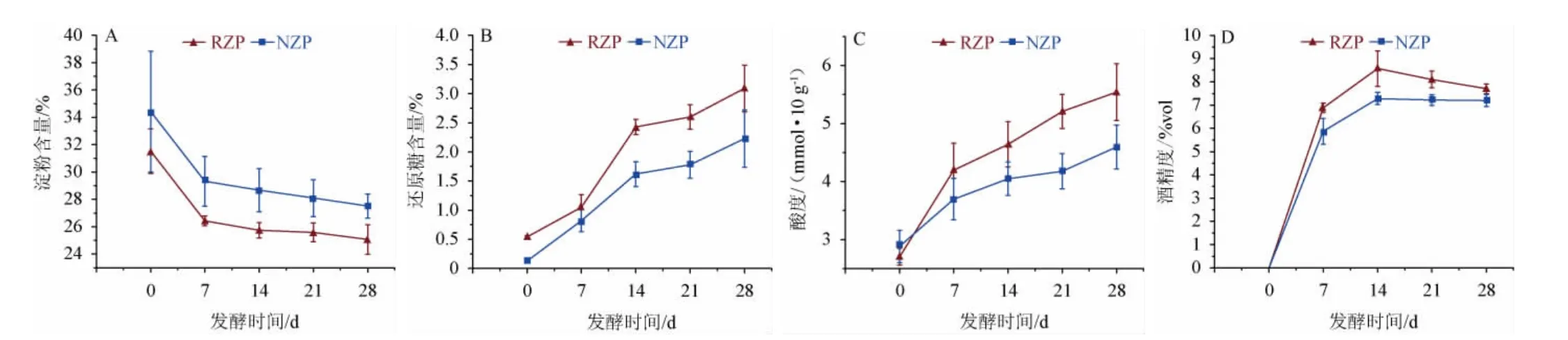
图1 糟醅理化性质的变化趋势Fig.1 Change trends in physicochemical properties of fermented grains

表1 两种大曲的理化性质测定结果Table 1 Determination results of physicochemical properties of two kinds of Daqu
2.2 挥发性风味成分的差异
2.2.1 挥发性成分含量差异
糟醅样品的挥发性风味成分测定结果见图2。由图2可知,两种样品中共检出了69种挥发性组分,包括酯类(45种)、醇类(4种)、酸类(1种)、烷类(2种)、烯类(3种)、酮类(3种)、酚类(1种)、醛类(6种)和其他类(2种)组分。
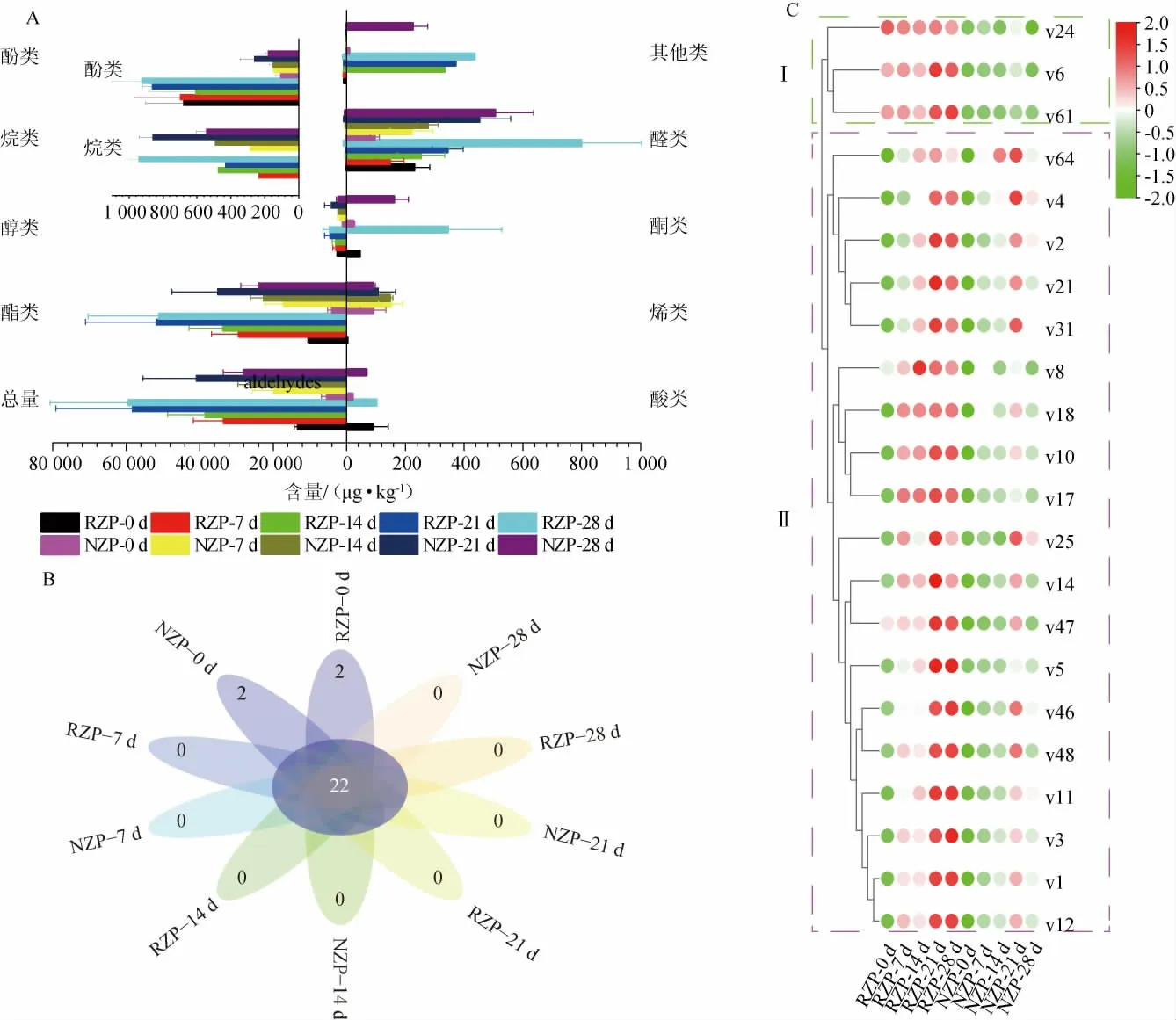
图2 糟醅挥发性风味成分含量差异及共有挥发性成分聚类分析热图Fig.2 Difference of volatile flavor component content and clustering analysis heatmap of shared volatile components in fermented grains
由图2A可知,挥发性风味成分总量随发酵时间增加而逐渐升高,且在发酵的初始阶段(0~7 d)和中后期(14~21 d)增量明显,RZP的挥发性风味成分总量增量分别是20.15 mg/kg和19.86 mg/kg,较同期NZP的总量增量高39.07%和37.05%。在发酵后期(21~28 d),RZP挥发性风味成分总量趋于稳定,NZP却降低,发酵结束时,RZP挥发性风味成分总量为59.52 mg/kg,NZP仅为28.11 mg/kg。酯类组分占总挥发性风味成分含量的74.23%~88.68%,经7 d发酵,酯类含量从74.23%~74.34%增至86.52%~87.81%,后趋于稳定。发酵结束时,RZP酯类化合物的含量为51.22 mg/kg,NZP仅为23.88 mg/kg。酯类中主要是赋予基酒果香、花香和甜味的乙酯类[21],作为骨架成分的己酸乙酯和乙酸乙酯[22]含量经发酵显著增高(P<0.05),且根霉强化也使它们的含量增加,发酵结束时,RZP中二者的含量比NZP分别增加了71.22%和44.36%。此外,糟醅中棕榈酸乙酯的含量也因根霉强化而增加,发酵结束时,其在RZP中的含量比NZP中增加了93.66%。棕榈酸乙酯呈微弱蜡香、果香和奶油香气,能赋予酒体醇厚感、降低干涩味[23]。发酵后棕榈酸甲酯等成分的比例减少。醇类物质赋予酒体醇厚绵甜风味[24-25],在0 d时比例最高,为7.88%~19.39%,且变化趋势与酯类相反,可能与参与酯类合成有关,发酵结束时,RZP醇类化合物的含量为4.75 mg/kg,NZP为2.45 mg/kg。RZP和NZP中异戊醇的比例分别从初期的10.80%和12.45%降至结束时的3.21%和3.46%。
由图2B可知,检出的挥发性代谢组分中有22种是共有的,包括酯类17种、醇类3种、酚类1种和醛类1种。这些成分的聚类分析的结果见图2C。由图2C可知,挥发性风味物质可为两个簇,簇Ⅰ的成分包括酯类2种和酚类1种,而簇Ⅱ则包括酯类15种、醇类3种和醛类1种。这些成分在RZP中的含量都高于NZP,在发酵过程中,簇I的呈相对稳态,而簇II的则逐渐增高,且在21 d时增幅最大。
2.2.2 特征挥发性成分分析
通过偏最小二乘判别分析(PLS-DA)法探讨RZP和NZP间的差异性,结果见图3。
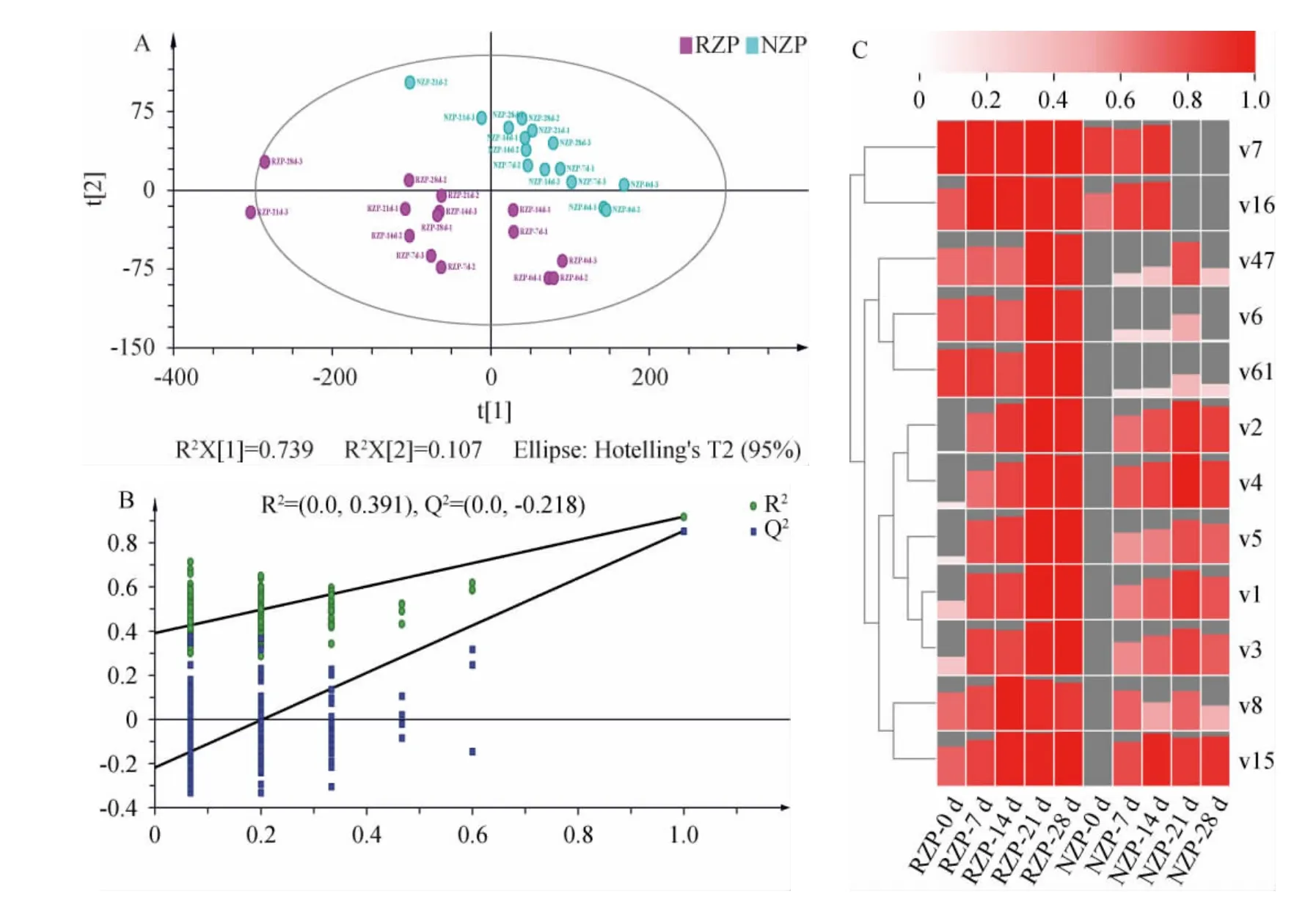
图3 糟醅挥发性风味成分的偏最小二乘判别分析结果及热图Fig.3 Partial least squares discriminant analysis results and heat map of volatile flavor components in fermented grains
由图3A可知,RZP和NZP被明显分离,而R2X(模型在X空间的拟合度)、R2Y(模型在Y空间的拟合度)、Q2(模型预测能力)分别为0.872、0.919、0.855,表明构建的模型可靠性好。由图3B可知,200次排列检验证明PLS-DA模型无过拟合,适合筛选样品间特征挥发性代谢物。基于预测变量重要性投影(variable importance in the projection,VIP)值(VIP>1.0)的结果,确定了12种成分,包括10种酯、1种醇和1种酚,其中9种是共有的。这些成分随发酵的变化如图3C所示,大部分乙酯类成分(棕榈酸乙酯、己酸乙酯、乙酸乙酯、反油酸乙酯、琥珀酸二乙酯、十七酸乙酯)的含量经发酵均有明显的增加,且在14~21 d增幅最高,而棕榈酸甲酯、辛酸乙酯、异戊醇和4-乙基愈创木酚在发酵过程中呈相对稳态,癸酸乙酯和亚油酸甲酯在NZP中前中期含量较高而后期并未检测到。绝大部分成分在RZP的含量高于NZP,表明根霉强化可以提高糟醅中特征挥发性组分的含量。
2.2.3 挥发性风味成分表达趋势分析
研究风味代谢积累表达的时间趋势,对发酵过程的挥发性成分含量进行趋势分析,并将相关系数>0.7的趋势聚为一类。在RZP和NZP中各观察到了2种趋势显著聚类,结果见图4。由图4可知,RZP和NZP分别有79.48%和77.09%的挥发性风味成分呈渐增趋势。其中,聚类1代表挥发性风味成分在发酵过程中含量一直增加,聚类2代表挥发性成分含量在21 d之前呈渐增趋势,21 d之后略降。值得注意的是,RZP和NZP分别有46.15%和66.67%的挥发性成分在发酵21 d之前含量增加,而在21 d之后含量略降,揭示了21 d是糟醅挥发性成分变化的关键时间节点。

图4 发酵过程中挥发性风味成分的趋势分析Fig.4 Trend analysis of volatile flavor components in fermentation process
2.3 微生物多样性分析
2.3.1 微生物群落Alpha多样性指数差异
微生物的Alpha多样性差异通常可以由丰富度(Chao1指数、观察物种指数)和多样性(香农指数、辛普森指数)解释。挥发性代谢成分的差异分析的结果表明,21 d是发酵系统挥发性成分变化的关键时间节点,因此仅对大曲和发酵21 d糟醅的微生物群落结构进行分析。群落的Alpha多样性指数的差异见表2。
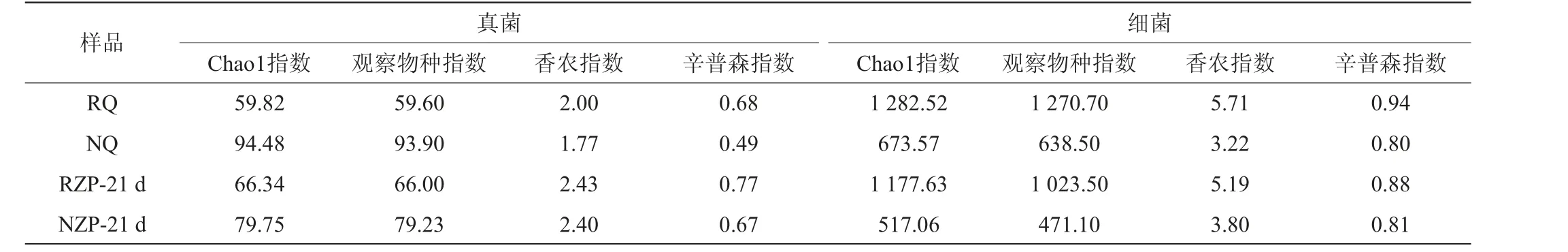
表2 大曲和发酵21 d糟醅的Alpha多样性指数Table 2 Alpha diversity indexes of Daqu and fermented grains fermented for 21 d
由表2可知,大曲和对应的发酵糟醅群落的Alpha多样性呈现一致的趋势。对于真菌群落而言,RQ的丰富度低于NQ,但多样性高于NQ,同时RZP的丰富度也低于NZP。这可能是因为根霉强化提高了RQ中根霉属(Rhizopus)的丰度,亦改变了菌群结构,尤其降低了真菌群落的丰富度。
对于细菌群落而言,RQ的丰富度和多样性均高于NQ,同样地,RZP的丰富度和多样性也高于NZP。根霉强化提高了水解底物的速率,导致在大曲制作前期和糟醅堆积糖化阶段,积累了丰富的营养物质,加快了细菌定植速率[14],从而使RQ和RZP细菌群落丰富度都高于NQ和NZP。
2.3.2 微生物群落组成差异
大曲和糟醅的微生物群落组成见图5。由图5A可知,大曲和糟醅真菌群落由6个门构成,主要为毛霉门(Mucoromycota)和子囊菌门(Ascomycota),相对丰度之和为88.08%~99.49%。Mucoromycota在RQ和NQ中的相对丰度分别为27.40%和4.73%,而在RZP和NZP中分别增至57.64%和39.54%。相反地,Ascomycota在RQ和NQ中的相对丰度分别为72.09%和93.31%,而在RZP和NZP中分别降至30.44%和53.26%。属水平的优势真菌如图5B所示,大曲的优势真菌属包括根霉属(Rhizopus)、嗜热真菌属(Thermomyces)和嗜热子囊菌属(Thermoascus),其中Rhizopus是常见真菌之一,分泌多种水解酶,具有糖化和发酵且产生乙酸乙酯等代谢成分的能力[26]。RQ中Rhizopus的相对丰度是27.35%,而NQ仅为3.86%。值得关注的是根霉强化还显著提高了大曲中Thermomyces的相对丰度(48.06%),但降低了Thermoascus的相对丰度(22.92%)。这两个真菌属在NQ中的相对丰度分别是14.64%和69.47%。Thermoascus亦能分泌多种酶,如过氧化氢酶、内切葡聚糖酶、葡萄糖苷酶等[27],且Thermomyces和Thermoascus皆具有较强的耐热性,在发酵过程中能保持稳定的催化效率[28]。发酵21 d时,RZP的优势真菌属分别是Rhizopus(57.32%)、Thermomyces(3.22%)和酵母属(Saccharomyces)(1.17%),NZP的优势真菌属则是Rhizopus(32.16%)、横梗霉属(Lichtheimia)(7.30%)、Pichia(2.26%)和Saccharomyces(1.37%)。由于根霉强化提高了Rhizopus的相对丰度,同时也占据了其余真菌的生存空间,导致真菌群落的丰富度降低。

图5 大曲和糟醅微生物群落组成差异Fig.5 Composition difference of microbial community of Daqu and fermented grains
由图5C可知,大曲和糟醅的细菌群落由12个门组成,主要为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其相对丰度之和为99.18%~99.88%。大曲中Firmicutes的相对丰度最高,在RQ和NQ中的相对丰度分别为93.58%和98.94%。Firmicutes在RZP和NZP中其相对丰度降至50.30%和44.89%,而Proteobacteria的相对丰度分别增至49.58%和54.96%。两种大曲的优势细菌属组成仅略有差异,但相对丰度差异明显(图5D)。乳杆菌属(Lactobacillus)、克罗彭斯特菌属(Kroppenstedtia)和魏斯氏菌属(Weissella)是共享的优势属,Lactobacillus和Weissella在RQ中的相对丰度(29.43%和25.53%)高于NQ(10.20%和11.37%),而NQ中Kroppenstedtia(76.68%)显著高于RQ(22.86%)。高温放线菌属(Thermoactionmyces)(13.02%)也是RQ的优势菌之一。发酵21 d时,RZP的优势细菌属包括片球菌属(Pediococcus)(28.17%)、肠杆菌属(Enterobacter)(10.46%)、Lactobacillus(10.31%)、雷尔氏菌属(Ralstonia)(22.91%)等8个属,NZP则仅包括Pediococcus(38.45%)、Ralstonia(37.39%)、鞘氨醇单胞菌属(Sphingomonas)(10.21%)等6个属。Lactobacillus、Pediococcus、Weissella等乳酸菌的主要代谢产物包括乙酸、乳酸等多种有机酸,这些代谢产物不仅是白酒的呈味成分,也是乙酸乙酯、乳酸乙酯等特征代谢物的前体[29-30]。
根霉强化显著改变了大曲和糟醅的群落结构。它增加了大曲中Rhizopus、Thermomyces、Lactobacillus、Weissella和Thermoactionmyces的相对丰度,降低了Thermomyces和Kroppenstedtia的相对丰度。对糟醅而言,根霉强化增加了Rhizopus、Thermomyces等的相对丰度,同时降低了Lichtheimia、Pichia等的相对丰度,此外,根霉强化还增加了糟醅细菌优势属的数量,并提高了Enterobacter、Lactobacillus等的相对丰度。
2.3.3 特征微生物分析
通过线性判别分析效应大小(LEfSe)(LDA>4,P<0.05)法,识别了21 d时RZP和NZP之间的特征微生物,结果见图6。由图6A可知,RZP在纲、目、科、属水平上鉴定出特征真菌,NZP在门、纲、目、科、属等五个分类水平上均鉴定出特征真菌。在属水平上,Thermomyces是RZP的特征真菌,NZP的则是Pichia和Lichtheimia。由图6B可知,RZP在界、目、科、属水平上鉴定出特征细菌,且RZP的特征细菌属是Thermoactinomyces、Lactobacillus和Enterobacter,而在各分类水平上均未识别出NZP的特征细菌。
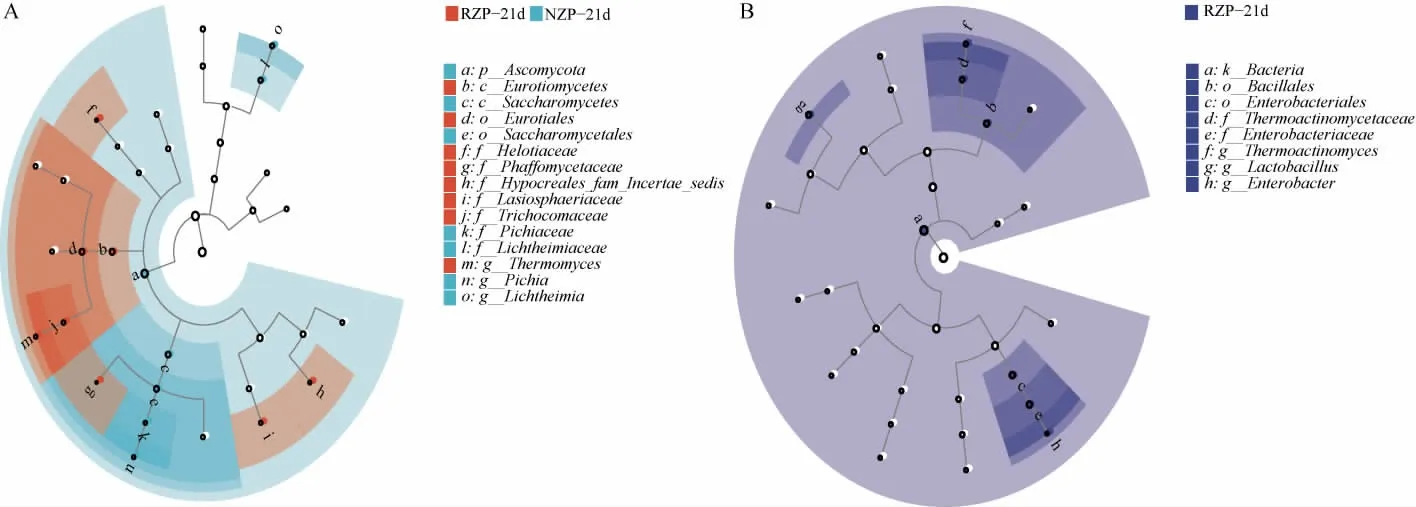
图6 微生物群落的线性判别分析效应大小结果Fig.6 Linear discriminant analysis effect size analysis results of microbial communities
2.3.4 综合代谢途径分析
对涉及糟醅原料利用、代谢产物生成以及酶的表达的代谢途径进行分析,结果见图7。由图7可知,在RZP中,由于根霉的强化,提高了Rhizopus的相对丰度,葡糖淀粉酶、糖原磷酸化酶、内切葡聚糖酶的表达显著上调(P<0.05),提高了淀粉原料的代谢速率,降低了RZP的淀粉含量,所以RZP中的RS含量高于NZP。糖酵解途径中乙醇代谢的关键酶显著下调(P<0.05),包括丙酮酸脱羧酶、乙醇脱氢酶,解释了RZP在发酵后期逐渐降低的乙醇含量。甲酸C-乙酰转移酶的显著上调(P<0.05)和乙酰辅酶A合成酶的显著下调(P<0.05)导致RZP中乙酸盐的积累增加。
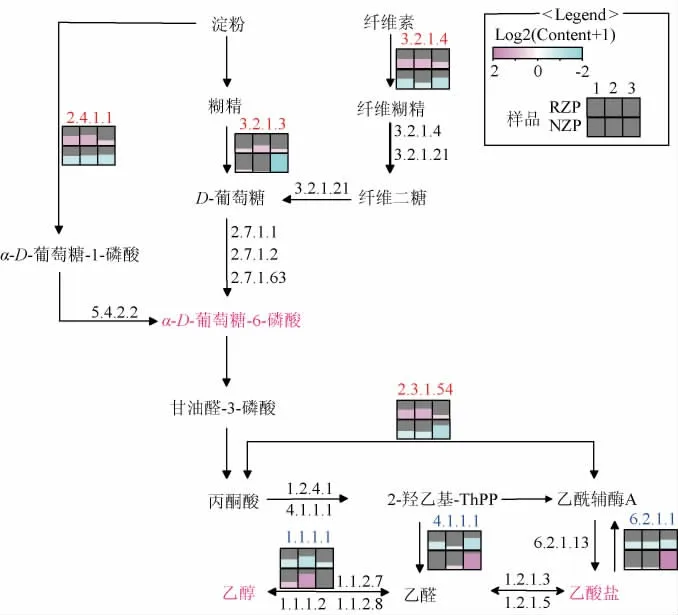
图7 涉及原料利用、代谢物生成和酶的代谢途径分析Fig.7 Metabolic pathway analysis involving raw material utilization,metabolite production and enzymes
2.4 微生物群落与挥发性组分的相关性
通过对应分析与多元回归分析相结合的冗余分析(RDA)揭示酒醅中优势微生物属与重要挥发性成分的相关性,结果见图8。由图8可知,采用Hellinger距离方法获得了19种挥发性组分与5个优势真菌属和5个优势细菌属的相关性。Rhizopus、Lactobacillus和棕榈酸乙酯、反油酸乙酯、丁酸乙酯、9-十六碳烯酸乙酯、乙酸乙酯、苯乙醇等呈正相关,这可能是因为乳酸、乙酸等多种有机酸是Lactobacillus等乳酸菌的主要代谢产物,而Rhizopus具有较强的酯化作用[31],能促进前体物质形成酯类,因此RZP中高相对丰度的Rhizopus和Lactobacillus协同作用提高了棕榈酸乙酯、反油酸乙酯、丁酸乙酯、9-十六碳烯酸乙酯、苯乙醇等成分的含量。由此可见,根霉强化有助于增加糟醅中优势挥发性组分的含量,提升其风味和香气。Thermomyces、Enterobacter和9-十六碳烯酸乙酯、乙酸乙酯、苯乙醇、肉豆蔻酸乙酯、己酸乙酯、γ-亚麻酸甲酯、异戊醇、辛酸乙酯等呈正相关,Ralstonia、Sphingomonas、Saccharomyces和γ-亚麻酸甲酯、己酸乙酯、辛酸乙酯、棕榈酸甲酯、乳酸乙酯、亚油酸甲酯、癸酸乙酯等正相关,Pichia、Lichtheimia、Pediococcus和苯乙酸乙酯、4-乙基愈创木酚、月桂酸乙酯、琥珀酸二乙酯、癸酸乙酯、亚油酸甲酯、反油酸乙酯、丁酸乙酯等呈正相关。根霉强化通过提高RZP中Rhizopus、Lactobacillus、Thermomyces、Enterobacter等的丰度,使与这些优势微生物属相关的风味代谢物含量增加,提升糟醅的风味和香气。

图8 优势微生物与主要挥发性化合物的冗余分析Fig.8 Redundancy analysis of dominant microorganisms and main volatile compounds
3 结论
本研究采用HS-SPME-GC-MS和高通量测序技术揭示了根霉强化对糟醅挥发性风味成分和微生物群落结构的影响规律。根霉强化显著改变大曲和糟醅微生物群落结构,其显著提高了RQ和RZP中Rhizopus、Thermomyces的相对丰度。Thermomyces、Thermoactinomyces、Lactobacillus、Enterobacter是RZP的标志微生物,Pichia、Lichtheimia则是NZP的标志微生物。糟醅中Rhizopus和大多数优势挥发性成分呈正相关,根霉强化提高了糟醅中优势挥发性成分的含量。发酵过程提高了乙酸乙酯和己酸乙酯的含量,并增大了酯类组分的比例,降低了醇类的比例。两种糟醅间导致差异风味成分共12种,且21 d是系统代谢变化的一个关键时间点。研究结果为调节微生物群落结构和调控风味物质奠定了方法学和理论的基础。

