两种离子型铱配合物的合成、光物理性质及对OH-的检测
赵世盛,李文豪,楚 曦,王丽华,李红岩
两种离子型铱配合物的合成、光物理性质及对OH-的检测
赵世盛,李文豪,楚 曦,王丽华,李红岩*
(河北工业大学 化工学院,天津 300401)
以两种2,2’-联吡啶衍生物为中性配体,2-(3-氟苯基)吡啶为环金属配体,合成了两种新型的离子型Ir(Ⅲ)配合物Ir1和Ir2。利用核磁、质谱和晶体结构分析确认了配合物Ir1和Ir2的结构。配合物Ir1和Ir2在CH2Cl2溶液中的最大发射波长分别为570和528 nm,为橙红光和黄光。两种配合物在无氧CH2Cl2溶液中的量子产率分别为0.88和0.57,磷光寿命分别为2.43和2.40 μs。通过理论计算详细讨论了中性配体的取代基种类对其光谱性质的影响。在配合物Ir1的DMSO/H2O溶液中加入OH-后,其发射峰强度提高了近100倍,溶液的发光颜色由红色变为明亮的绿色,检出限为8.47×10-6mol/L。机理研究表明,OH-取代了Ir1的中性配体上的溴取代基,形成了新的含有羟基的配合物,从而改变了Ir1的光谱特性,实现对OH-的高选择性和高灵敏度检测。
铱配合物;合成;表征;发光性质;检测OH-;磷光增强
光化学传感器具有操作简单、响应速度快、灵敏度高和选择性好等优点,在近几十年中得到了快速的发展[1]。相比于荧光化学传感器,磷光化学传感器由于其磷光材料发光量子效率高、发射寿命长、以及具有较大的斯托克位移等优点越来越引起人们的广泛关注,具有非常好的应用前景。相比于其他磷光金属配合物,铱配合物是研究最多的一类磷光配合物[2-5]。磷光铱配合物高的发光效率(理论上可以达到100%),大大提高了检测灵敏度;发射寿命长,可以使用时间分辨技术与背景荧光信号相区分以提高检测的信噪比和灵敏度;斯托克位移大,可以很容易区分激发和发射;而且还可以使用可见光进行激发等。近几十年来,基于磷光Ir(Ⅲ)配合物的化学传感器广泛应用于各类物质的检测,包括金属离子[6-7]、有害气体[8]、各类氨基酸[9-10]以及pH[11]等。2019年,Yu等[12]设计并合成了两种含二甲基吡啶胺基团的阳离子型Ir(Ⅲ)配合物,通过二甲基吡啶胺基团与Cu2+络合导致Ir(Ⅲ)配合物磷光强度的猝灭,实现了对Cu2+的检测,而且该配合物还实现了对活细胞中Cu2+的有效识别,表现出良好的细胞通透性。2020年,Chen等[13]报道了一种水溶性的磷光铱配合物(P-pH),利用配合物P-pH的双重发射特性,将P-pH制作成比率型磷光探针监测线粒体和溶酶体的pH变化。此外,利用配合物P-pH的长发射寿命还实现了对斑马鱼消化道中反式丁烯二酸、丁二酸和己二酸三种pH调节剂的检测。
氢氧化物是各种工业生产过程中最常见的原料之一[14],广泛应用于化学药品生产、造纸、金属冶炼和木材加工等过程[15]。但氢氧化物本身具有强烈的刺激性和腐蚀性[16],高浓度的OH-会对生物体和环境造成严重破坏。利用铱配合物对OH-进行检测的报道还相对较少。因此,本研究通过设计合成含有2,2’-联吡啶衍生物配体的铱配合物,旨在实现对OH-的高选择性和高灵敏度检测。在本文中,分别选择4,4’-二溴-2,2’-联吡啶(dBr-bpy)和4,4’-二叔丁基-2,2’-联吡啶(dtb-bpy)为中性配体,2-(3-氟苯基)吡啶(3F-ppy)为环金属配体,合成两种具有[Ir(C^N)2(N^N)](PF6) (C^N为环金属配体,N^N为中性配体)构型的离子型铱配合物[(3F-ppy)2Ir(dBr- bpy)](PF6) (Ir1)和[(3F-ppy)2Ir(dtb-bpy)](PF6) (Ir2)。利用核磁共振氢谱、质谱和单晶结构解析对配合物进行表征和结构确认,通过紫外-可见吸收光谱和光致发射光谱对配合物Ir1和Ir2进行光物理性质的研究,同时采用密度泛函理论(DFT)和含时密度泛函理论(TD-DFT)计算探究取代基对配合物发光性质的影响规律,最后利用光致发射光谱变化评价配合物Ir1在含水介质中对OH-的检测性能。
1 实验部分
1.1 试剂与仪器
IrCl3×3H2O购买于昆明铂锐金属材料有限公司,3-氟苯硼酸和2-溴吡啶购买于天津希恩斯生化科技有限公司,4,4’-二溴-2,2’-联吡啶和4,4’-二叔丁基-2,2’-联吡啶分别购买于阿拉丁试剂有限公司,二甲基亚砜(DMSO)、2-乙氧基乙醇、六氟磷酸钾(KPF6)、二氯甲烷(CH2Cl2)和甲醇(CH3OH)等购于天津化学试剂六厂。所有试剂均为分析纯,没有经过进一步的提纯。
表征仪器主要包括Bruker AM 400 MHz核磁共振仪;ESI-MS (Bruker Scientific Instruments LC-MS)质谱仪;UV-2700紫外-可见分光光度计;Hitachi F-2700荧光光谱仪;Edinburgh FLS920P光谱仪;CHI 760E电化学工作站;晶体结构测定使用Siemens (Bruker) SMART CCD单晶衍射仪,理论计算采用Gassian09程序。
1.2 合成
环金属配体2-(3-氟苯基)吡啶(3F-ppy)按照文献报道方法合成[17]。铱二氯桥[(3F-ppy)2Ir(μ-Cl)]2、配合物[(3F-ppy)2Ir(dBr-bpy)](PF6) (Ir1)和[(3F-ppy)2Ir(dtb-bpy)](PF6) (Ir2)的合成路线如图1所示。
实验具体操作为:将IrCl3×3H2O (1.0 mmol)和3F-ppy (2.5 mmol)溶于9 mL 2-乙氧基乙醇和3 mL水的混合溶剂中,在氮气保护下140 ℃反应6 h。冷却后,加水析出沉淀,减压抽滤得到的固体依次用乙醇和水洗涤,得到黄色铱二氯桥产物[(3F-ppy)2Ir(μ-Cl)]2,产率90%。
在氮气保护下,铱二氯桥(0.20 mmol)和dBr- bpy/dtb-bpy (0.50 mmol)溶于15 mL二氯甲烷和15 mL甲醇的混合溶剂中,50 ℃反应6 h,冷却后加入KPF6(1.0 mmol)继续室温反应2 h,减压除去溶剂后进行柱层析分离得到产物Ir1和Ir2。将配合物Ir1和Ir2分别溶于CH2Cl2/CH3OH(1꞉1,/)的混合溶剂中,室温下缓慢挥发获得Ir1和Ir2的单晶。
Ir1 (橙色固体,产率52%)的表征结果为:1H NMR (400 MHz, DMSO-6):9.25 (d,= 4.5 Hz, 2H), 8.26~8.08 (m, 2H), 7.84 (ddd,= 28.3, 17.6, 6.8 Hz, 6H), 7.71~7.40 (m, 4H), 7.14~6.92 (m, 3H), 6.74 (t,= 9.3 Hz, 1H), 6.52 (t,= 8.6 Hz, 1H), 6.13~5.71 (m, 1H)。MS(ESI):/850.96 [M-PF6]+。

图1 配合物Ir1和Ir2的合成路线
Ir2 (橙黄色固体,产率40%)的表征结果为:1H NMR (400 MHz, DMSO-6):8.89 (d,= 5.8 Hz, 2H), 8.40~8.18(m, 2H), 7.98 (t,= 7.8 Hz, 1H), 7.93~7.66 (m, 7H), 7.66~7.58 (m, 1H), 7.53 (t,= 8.0 Hz, 1H), 7.27~7.15 (m, 1H), 7.15~7.03 (m, 2H), 6.85 (t,= 8.9 Hz, 1H), 6.63 (t,= 8.6 Hz, 1H), 6.14~5.98 (m, 1H), 1.40 (s, 18H)。MS (ESI):/805.26 [M-PF6]+。
1.3 OH-检测实验
首先用DMSO配制浓度为5.0×10-4mol/L的配合物Ir1的储备溶液,然后将储备液稀释成5×10-5mol/L的DMSO/H2O(8:2,/,下同)溶液。将相应金属盐溶于水中制备含不同阴离子的水溶液,包括SO42-,Ac-,SO32-,PO43-,HCO3-,CO32-,Br-,Cl-,S2O32-和OH-,为避免金属离子差异产生影响,所用阴离子均为相应的钠盐。选择性实验为向配合物Ir1的溶液中分别加入100 mmol/L的不同阴离子,然后记录光致发射光谱的变化。竞争性实验为向配合物Ir1的溶液中分别加入除OH-外的其他阴离子,然后在上述混合溶液中再加入OH-,记录光致发射光谱的变化。滴定时将0~100 mmol/L的OH-按照一定的浓度梯度逐步加入配合物Ir1的溶液中,分别测试光致发射光谱,计算检出限。
2 结果与讨论
2.1 单晶结构分析
配合物Ir1和Ir2的单晶结构如图2所示,相关晶体学数据计算结果列于表1。

图2 配合物Ir1和Ir2的晶体结构示意图,氢原子已经省略
表1 配合物Ir1和Ir2的晶体学数据

Tab.1 Crystallographic data for complexes Ir1 and Ir2
注 a*:1=S||o|-|c||/So|. b*:2= [S(o2-c2)2/S(o2)]1/2。
晶体结构分析表明,配合物Ir1属于斜方晶系,P2(1)2(1)2(1)空间群,配合物Ir2属于单斜晶系,C2/c空间群。由图2可见,配合物Ir1和Ir2分子中均包含1个PF6阴离子,Ir原子被来自配体3F-ppy和dBr-bpy/dtb-bpy上的C原子和N原子包围,晶体表现出扭曲的八面体配位几何构型。对于Ir1和Ir2,Ir-C键键长处于0.2021(4)~0.2027(4) nm;Ir-N键键长处于0.2042(3)~0.2138(6) nm,其他键长键角也都处于正常范围之内[5]。晶体结构的测定和解析进一步证明了配合物Ir1和Ir2结构的正确性。配合物Ir1和Ir2的晶体数据已收录在剑桥晶体数据库,CCDC号分别为2021274和2021834。
2.2 光物理性质研究
图3(a)为Ir1和Ir2在二氯甲烷溶液(2.0×10-5mol/L)中的紫外-可见吸收光谱,相关的光物理性质数据列于表2;配合物Ir1和Ir2在二氯甲烷溶液中的光致发射光谱以及在365 nm激发光下的发光照片如图3(b)所示。
在紫外-可见吸收光谱中Ir1和Ir2的吸收峰形相似,但在不同波长范围内的吸收强度不同(图3(a))。在230~340 nm范围内的强吸收带归属于以配体为中心的自旋允许的p→p*的跃迁。在能量较低的340~450 nm范围内,Ir1和Ir2的吸收峰分别为376和371 nm,这个吸收带可以归属为金属到配体的电荷转移跃迁(MLCT)和配体到配体之间的跃迁(LLCT)吸收[18-20]。配合物Ir1的最大发射峰位于570 nm,为橙红光。配合物Ir2的最大发射峰位于528 nm,为黄光。Ir1的最大发射波长相较于Ir2红移了42 nm,这主要是因为配合物中性配体2,2’-联吡啶衍生物上溴取代基的引入减小了HOMO与LUMO的能隙差[21],造成发射波长的红移。以-(ppy)3为标准物质(em=0.97)[22],根据配合物的吸收光谱和光致发射光谱计算得到Ir1和Ir2的量子产率分别为88%和57%。此外Ir1和Ir2在除氧CH2Cl2溶液中的激发态寿命分别为2.43和2.40 μs。以上结果表明两种配合物是典型的磷光发光材料,在电致发光和化学传感等领域有潜在应用价值。

图3 配合物Ir1和Ir2的紫外-可见吸收光谱(a)和光致发射光谱(b)
表2 配合物Ir1和Ir2的光物理和电化学性质数据
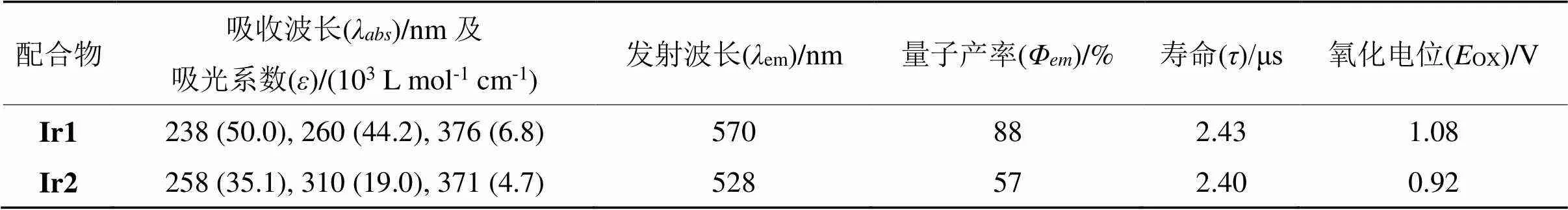
Tab.2 Photophysical and electrochemical data of complexes Ir1 and Ir2
2.3 电化学性质和理论计算
对铱(Ⅲ)配合物来说氧化还原电位能反映前线分子轨道能级的变化。采用循环伏安法研究了Ir1和Ir2的电化学性能,所得曲线及氧化电位列于图4和前表2。在阳极氧化过程中,配合物Ir1和Ir2在0.40~1.45 V (vs. Ag+/Ag)范围内均出现一组可逆的氧化还原峰,这一过程归因于以金属为中心的Ir(Ⅲ)/Ir(Ⅳ)的氧化还原过程[5]。与配合物Ir1的氧化电位(1.08 V)相比,Ir2的氧化电位向负极方向移动了0.16 V,说明配合物Ir2更容易从最高占据分子轨道(HOMO)失去电子,也说明Ir2的HOMO轨道能级高于Ir1。
利用密度泛函理论(DFT)对Ir1和Ir2进行了理论计算,其前线分子轨道的电子密度分布图及相应轨道能级见图5,HOMO和最低未占据分子轨道(LUMO)的构成列于表3。从表3可以看出,Ir1和Ir2的HOMO轨道主要由金属铱的轨道(42.77%~ 47.44%)以及环金属配体的π轨道(49.32%~54.11%)组成。配合物Ir1的HOMO轨道能级为-6.04 eV,配合物Ir2的HOMO轨道能级升高至-5.93 eV。Ir1和Ir2的LUMO轨道主要分布在中性配体(94.60%)上,因此对于中性配体的修饰,主要影响LUMO轨道能级。对于配合物Ir1和Ir2,LUMO轨道能级分别为-3.04和-2.60 eV。当中性配体的取代基由供电子取代基(-tBu)改变为吸电子基团(-Br)后,LUMO轨道能级降低了0.44 eV,HOMO和LUMO轨道的能隙由3.33 eV降低至3.00 eV,从而造成光致发射光谱的红移,很好地解释了中性配体取代基的性质对光致发射光谱的影响规律[23]。

图4 配合物Ir1和Ir2的循环伏安曲线

图5 配合物Ir1和Ir2的前线分子轨道能级图
表3 Ir1和Ir2的前线分子轨道能级和电子密度分布

Tab.3 The frontier orbital energy level and electron density distribution for Ir1 and Ir2
使用含时密度泛函理论(TD-DFT)方法进一步研究了Ir1和Ir2的激发态性质,图6为理论计算得到的配合物Ir1和Ir2的紫外-可见吸收光谱和实验光谱的对比图。

图6 理论计算得到的配合物Ir1(a)和Ir2(b)的紫外-可见吸收光谱与实验光谱对比图
从图6中可以看出,理论计算模拟得到的紫外-可见吸收光谱图和实验谱图的吻合度较好。根据理论计算结果,配合物在230~340 nm范围内的强吸收带主要由HOMO-3→LUMO+5和HOMO-2/ HOMO-3 → LUMO+2轨道跃迁产生,主要归属于环金属配体内自旋允许的π→π*的跃迁过程。在能量较低的340~450 nm范围的吸收带可以归属为MLCT和LLCT的混合跃迁吸收。计算所得HOMO→LUMO轨道跃迁的振子强度较弱,表示吸收较弱,与实验结果相吻合。
2.4 对OH-的检测性能
首先测定配合物Ir1与OH-反应的稳定时间。Ir1与OH-的混合溶液的发射强度在0~30 min内随时间增长而强度增强,而在30 min后趋于稳定,没有明显变化。因此,30 min为Ir1检测OH-的稳定时间,后续实验均反应30 min后进行测试。进一步研究了在DMSO中掺杂不同体积H2O的混合溶剂中Ir1对OH-的检测效果。结果显示在DMSO与H2O的体积比为8:2时Ir1与OH-的混合溶液有着最高的发射峰强度和最显著的发光颜色变化。因此Ir1检测OH-的测试选用体积比为8:2的DMSO和H2O的混合溶剂。此外,在相同的条件下,将OH-加入配合物Ir2的DMSO/H2O溶液中,Ir2的光谱没有明显变化。
选择9种常见的阴离子作为研究对象,探究了Ir1检测OH-的选择性,结果如图7所示。在Ir1的DMSO/H2O溶液中分别加入100 mmol/L的其他阴离子,包括SO42-、Ac-、SO32-、PO43-、HCO3-、CO32-、Br-、Cl-和S2O32-,配合物的发射强度变化很小。而在Ir1中加入100 mmol/L的OH-后,Ir1的发射峰位置由579 nm蓝移至506 nm,发光颜色由红色变为明亮的绿色,颜色变化非常明显。而且在Ir1中加入OH-后,发光强度显著提升,发射峰强度(cps)从26增强至2553,提高了近100倍(图7)。接下来通过竞争实验研究了共存阴离子(SO42-、Ac-、SO32-、PO43-、HCO3-、CO32-、Br-、Cl-和S2O32-)对OH-测定的影响,结果如图8所示。在Ir1与共存阴离子的混合溶液中再加入OH-后,混合溶液的光致发射光谱显著增强,这种变化与只加入OH-的变化一致。以上结果表明,配合物Ir1对OH-的检测具有较高的选择性和较强的抗干扰能力。
在Ir1的DMSO/H2O体系中,利用光致发射光谱进行滴定实验,结果如图9所示。随着OH-浓度的增加,Ir1的发射峰强度逐渐增强,当OH-离子的浓度达到100 mmol/L时,Ir1的发光强度增强至原来的100倍。在0~100 mmol/L浓度范围内,OH-浓度和配合物的发光强度成正比,根据公式3/[24]计算得到了Ir1对OH-的检出限为8.47×10-6mol/L,表明配合物Ir1对OH-的检测具有较高的灵敏度。
为了进一步探究配合物Ir1对OH-的响应机理,将OH-与Ir1在DMSO/H2O溶液中反应的混合溶液进行质谱分析。结果发现,在/为725.13处出现离子峰,与图10中配合物Ir1b的理论相对分子质量一致。此外,以4,4’-二叔丁基-2,2’-联吡啶为辅助配体的配合物Ir2对OH-没有磷光增强响应,说明铱配合物结构中2,2’-联吡啶衍生物配体上的溴取代基对OH-的识别起关键作用。由此推测Ir1能够选择性识别OH-的机理为,通过亲核取代反应,OH-取代了Ir1的4,4’-二溴-2,2’-联吡啶配体上的溴取代基,形成了新的含有羟基的配合物,如图10所示。根据理论计算结果中取代基对铱配合物的光谱性质的影响规律[5]可知,当中性配体的取代基由吸电子基团(-Br)变为供电子基团(-OH)时,配合物的LUMO轨道能级升高,光致发射光谱蓝移。
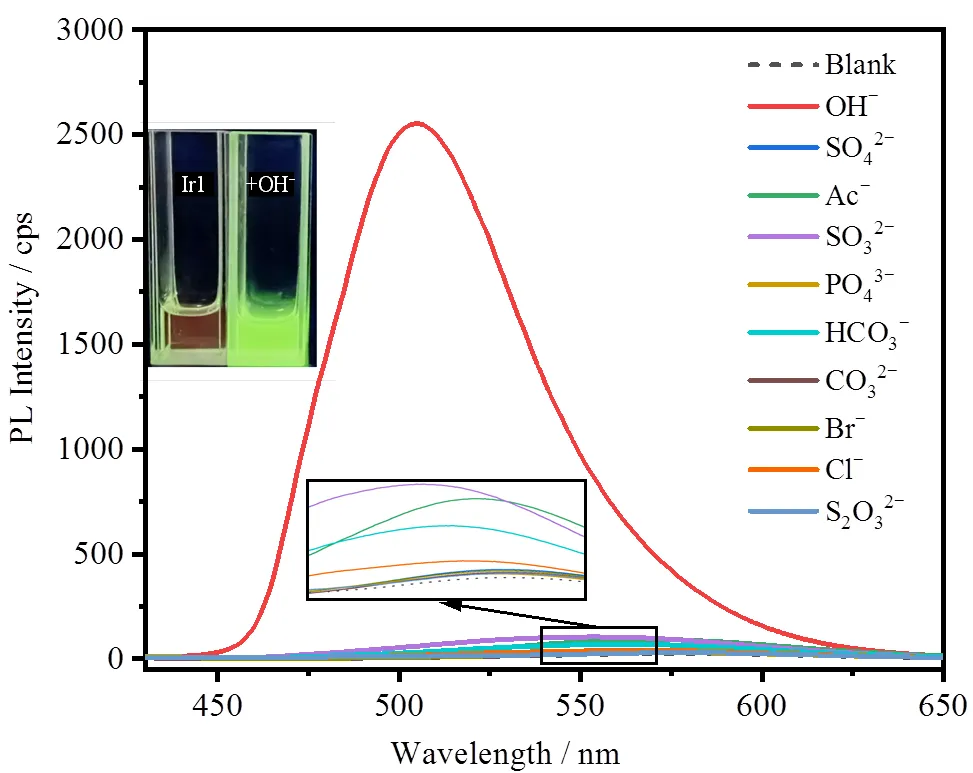
图7 加入不同阴离子后配合物Ir1的光致发射光谱

图8 在竞争阴离子存在下Ir1对OH-的磷光响应
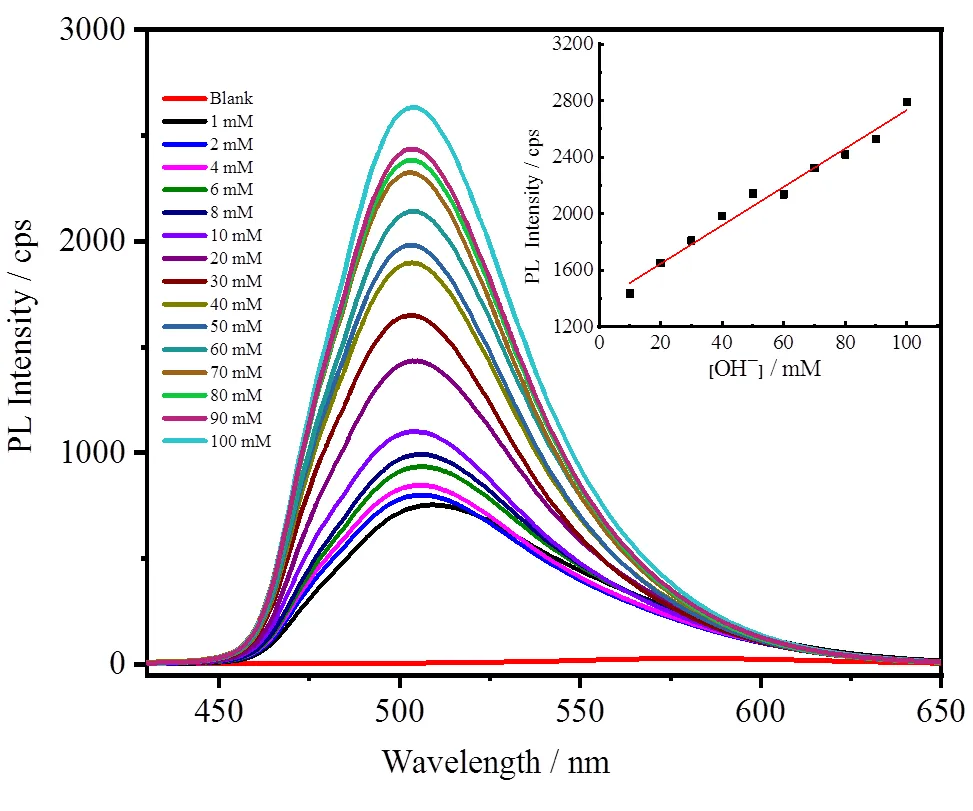
图9 随OH-浓度增加配合物Ir1的光致发射光谱变化
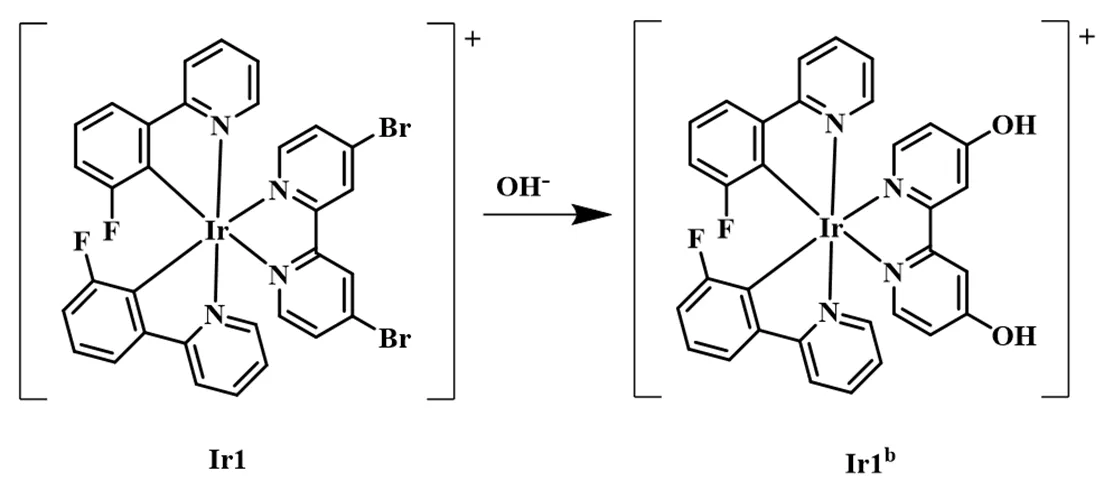
图10 配合物Ir1与OH-结合的可能机制
3 结论
1) 成功合成了两种基于2,2’-联吡啶衍生物的阳离子型Ir(Ⅲ)配合物Ir1和Ir2。利用核磁共振氢谱、质谱和单晶结构分析确认所得产物为目标配合物Ir1和Ir2。
2) 光物理性能研究表明,在光激发下,配合物Ir1和Ir2在二氯甲烷溶液中的发射峰分别位于570 nm和528 nm,发光颜色分别为橙红光和黄光,量子效率分别为88%和57%。
3) 理论计算表明,LUMO轨道主要分布在中性配体上,中性配体上供电子取代基的引入可以升高LUMO轨道能级,使铱配合物Ir2在低能量区域的吸收峰蓝移。
4) 配合物Ir1对OH-的加入表现出磷光增强型响应,发光颜色由红色变为明亮的绿色,发光强度提升约100倍,而且具有良好的选择性和抗干扰能力。配合物Ir1对OH-的响应在0~100 mmol/L范围内具有良好的线性关系,最低检测限达到8.47×10-6mol/L。该研究为设计基于铱配合物的高选择性OH-磷光探针提供了思路。
[1] 彭慧, 吴磊, 陈颜, 等. 氨基酸类铱(Ⅲ)配合物的合成、表征及对汞离子的识别[J]. 贵金属, 2019, 40(4): 7-10.
PENG H, WU L, CHEN Y, et al. Synthesis, characterization and Hg2+recognition property of iridium(Ⅲ) complex containing L-serine ligand[J]. Precious Metals, 2019, 40(4): 7-10.
[2] LAI P N, BRYSACZ C H, ALAM M K, et al. Highly efficient red-emitting bis-cyclometalated iridium complexes[J]. Journal of the American Chemical Society, 2018, 140(32): 10198-10207.
[3] MA X F, LUO X F, YAN Z P, et al. Syntheses, crystal structures, and photoluminescence of a series of iridium(Ⅲ) complexes containing the pentafluorosulfanyl group[J]. Organometallics, 2019, 38(19): 3553-3559.
[4] 张筱斌, 窦少彬, 钮智刚, 等. 两种黄绿光铱配合物的合成及光物理性质研究[J]. 贵金属, 2022, 43(1): 22-26.
ZHANG X B, DOU S B, NIU Z G, et al. Synthesis and photophysical properties of two yellow-green iridium complexes[J]. Precious Metals, 2022, 43(1): 22-26.
[5] 佟鑫, 赵世盛, 楚曦, 等. 两种含醛基的铱配合物用于半胱氨酸和OH-的识别[J]. 无机化学学报, 2022, 38(10): 1939-1947.
TONG X, ZHAO S S, CHU X, et al. Two iridium complexes containing aldehyde group for cysteine and OH-recognition[J]. Chinese Journal of Inorganic Chemistry, 2022, 38(10): 1939-1947.
[6] LI Z B, GE Z R, TONG X, et al. Phosphorescent iridium(Ⅲ) complexes bearing L-alanine ligands: Synthesis, crystal structures, photophysical properties, DFT calculations, and use as chemosensors for Cu2+ion[J]. Dyes and Pigments, 2021, 186: 109016.
[7] PONRAM M, BALIJAPALLI U, SAMBATH B, et al. Inkjet-printed phosphorescent iridium(Ⅲ) complex based paper sensor for highly selective detection of Hg2+[J]. Dyes and Pigments, 2019, 163: 176-182.
[8] LIU S J, WEI L W, GUO S, et al. Anionic iridium(Ⅲ) complexes and their conjugated polymer soft salts for time-resolved luminescent detection of intracellular oxygen levels[J]. Sensors and Actuators B: Chemical, 2018, 262: 436-443.
[9] LI Y Y, WU Y Q, WU J, et al. A near-infrared phospho- rescent iridium(Ⅲ) complex for fast and time-resolved detection of cysteine and homocysteine[J]. Analyst, 2020, 145(6): 2238-2244.
[10] ZHOU Y Y, XIE K, KONG L Y, et al. Highly selective electrochemiluminescent probe to histidine[J]. Journal of Electroanalytical Chemistry, 2017, 799: 122-125.
[11] ALAM P, KAUR G, SARMAH A, et al. Highly selective detection of H+and OH–with a single-emissive iridium(Ⅲ) complex: A mild approach to conversion of non-AIEE to AIEE complex[J]. Organometallics, 2015, 34(18): 4480-4490.
[12] YU T Z, WANG Y J, ZHU Z Y, et al. Two new phospho- rescent Ir(Ⅲ) complexes as efficient selective sensors for the Cu2+ion[J]. Dyes and Pigments, 2019, 161: 252-260.
[13] CHEN Z J, MENG X C, XIE M J, et al. A self-calibrating phosphorescent polymeric probe for measuring pH fluctuations in subcellular organelles and the zebrafish digestive tract[J]. Journal of Materials Chemistry C, 2020, 8(7): 2265-2271.
[14] UAHENGO V, NAIMHWAKA J, DANIEL L S, et al. A colorimetric probe for the real-time naked eye detection of cyanide and hydroxide ions in tap water: experimental and theoretical studies[J]. Analyst, 2019, 144(21): 6422-6431.
[15] THAKUR N, KUMAR S A, PANDEY A K, et al. Optode sensor for on-site detection and quantification of hydroxide ions in highly concentrated alkali solutions[J]. RSC Advances, 2015, 5(89): 72893-72899.
[16] HALLAM P M, KAMPOURIS D K, KADARA R O, et al. Nickel oxide screen printed electrodes for the sensing of hydroxide ions in aqueous solutions[J]. Analytical Methods, 2010, 2(8): 1152-1155.
[17] MARTÍN J, GÓMEZ B E, GENOUX A, et al. Synthesis of cyclometalated gold(Ⅲ) complexes via catalytic rhodium to gold(Ⅲ) transmetalation[J]. Angewandte Chemie International Edition, 2022, 61(20): e202116755.
[18] ZANONI K P S, VILELA R R C, SILVA I D A, et al. Photophysical properties of Ir(Ⅲ) complexes immobilized in MCM-41 via templated synthesis[J]. Inorganic Chemistry, 2019, 58(8): 4962-4971.
[19] 潘淼, 李思华, 程茂玲, 等. 辅助配体对噌啉类铱配合物光电性能的影响[J]. 无机化学学报, 2018, 34(4): 627-632.
PAN M, LI S H, CHENG M L, et al. Effect of ancillary ligand on photoelectric properties of cinnoline iridium complexes[J]. Chinese Journal of Inorganic Chemistry, 2018, 34(4): 627-632.
[20] WONG W Y, HO C L, GAO Z Q, et al. Multifunctional iridium complexes based on carbazole modules as highly efficient electrophosphors[J]. Angewandte Chemie International Edition, 2006, 45(46): 7800-7803.
[21] 常桥稳, 王姿奥, 晏彩先, 等. 铱磷光配合物的合成、颜色调控方法及应用研究现状[J]. 贵金属, 2020, 41(3): 94-114.
CHANG Q W, WANG Z A, YAN C X, et al. Synthesis, color-controlling methods and application research of iridium phosphorescent complexes[J]. Precious Metals, 2020, 41(3): 94-114.
[22] KING K A, SPELLANE P J, WATTS R J. Excited-state properties of a triply ortho-metalated iridium(Ⅲ) complex[J]. Journal of the American Chemical Society, 1985, 107(5): 1431-1432.
[23] LI G N, GAO C W, XIE H, et al. New luminescent cyclometalated iridium(Ⅲ) complexes containing fluorinated phenylisoquinoline-based ligands: Synthesis, structures, photophysical properties and DFT calculations [J]. Chinese Chemical Letters, 2016, 27(3): 428-432.
[24] DATTA B K, THIYAGARAJAN D, SAMANTA S, et al. A novel chemosensor with visible light excitability for sensing Zn2+in physiological medium and in HeLa cells[J]. Organic & Biomolecular Chemistry, 2014, 12(27): 4975-498.
Synthesis, photophysical properties and OH-recognition of two cationic iridium complexes
ZHAO Shisheng, LI Wenhao, CHU Xi, WANG Lihua, LI Hongyan*
(School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300401, China)
Two novel cationic iridium(Ⅲ) complexes, Ir1 and Ir2, were synthesized by using 2,2’-bi- pyridine derivatives as neutral ligands and 2-(3-fluorophenyl)pyridine as cyclometalated ligands. Their molecular structures were characterized via1H NMR, MS and X-ray analysis. The maximum emission peak of complexes Ir1 and Ir2 was located at 570 and 528 nm, respectively, in CH2Cl2solution, showing orange-red and yellow luminescence. The quantum yield of Ir1 and Ir2 was measured to be 0.88 and 0.57, respectively, with a lifespan of 2.40~2.43 μs in oxygen-free solution. The effect of substituents on the spectral properties of the complexes was discussed in detail by theoretical calculation. When OH-was added into the DMSO/H2O solution of Ir1, it showed a 100-fold enhanced emission and the luminescence color of the solution shifted from red to bright green, and the detection limit for OH-was 8.47×10-6mol/L. The sensing mechanism of Ir1 may be that OH-substitue the bromide groups on the neutral ligand of complex Ir1, forming a new species containing hydroxyl groups. The substitution will change the spectral properties of the complex and achieve both high selectivity and sensitivity for the detection of OH-.
iridium complex; synthesis;characterization; luminescent property; OH-sensing; phosphorescence enhancement
O641.4
A
1004-0676(2023)04-0001-08
2022-12-12
河北省自然科学基金(B2022202060);国家自然科学基金(21501042)
赵世盛,男,硕士研究生;研究方向:铱配合物的合成及应用;E-mail: 202031504016@stu.hebut.edu.cn
李红岩,女,博士,副教授;研究方向:光电功能材料;E-mail: hyli@hebut.edu.cn

