9例甲状腺未分化癌的临床病理分析
成迎迎,谢璐茜,张学梅,戴文斌
(广西柳州市人民医院病理科,广西柳州 545006)
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)是一种极罕见且致死率极高的癌症,多数病例在首诊时即出现邻近组织的侵犯或远处转移,ATC组织学形态多样,但主要以梭形细胞、上皮样细胞及多核巨细胞为主,需要与恶性纤维组织细胞瘤、上皮样血管肉瘤等软组织肉瘤相鉴别,免疫组化等可以辅助诊断,手术及放化疗等是ATC的常规治疗策略,但是患者的远期受益并不明显。近年来,随着分子检测技术的普及和靶向药物的研究,ATC的治疗方案也不断优化。本文报道9例ATC并复习相关文献,以探讨其临床病理特征及预后,提高临床医师对ATC的认识水平。
1 资料与方法
1.1 临床资料收集柳州市人民医院病理科2013年1月至2023年2月期间收治入院的ATC患者共9例。其中男性5例,女性4例,年龄53~81岁,中位年龄69岁。4例有颈前肿物史,2例就诊时出现声嘶、呛咳及呼吸困难。2例行甲状腺穿刺,2例行甲状腺部分切除,2例行甲状腺全切,3例行甲状腺根治性切除+淋巴结清扫术。术后1例自行用中医治疗(具体不详),2例行术后化疗,余6例无其他治疗。7例于术后1.3~24个月死亡,2例失访。见表1。

表1 9例ATC患者临床特征
1.2 方法9例ATC病理均由2名高年资医生复诊。标本经10%中性福尔马林固定,石蜡包埋,常规切片,HE染色。免疫组化染色采用EnVision二步法,所用抗体Vimentin、CK、TTF-1、Ki67、CK19、TG、CT、CD34、SMA、Desmin、Myogenin、HMB45等购自福州迈新生物技术开发有限公司。P53蛋白的免疫组化判读如以下3种模式:<1%,为无义突变;≥1%且<70%,为野生型;≥70%,为错义突变。无义突变和错义突变统称为突变型。
B-raf基因V600E突变检测试剂盒(批号2022050601)和K-ras基因突变检测试剂盒(批号2022070701)选用北京鑫诺美迪基因检测技术有限公司,严格按照操作说明书提取福尔马林固定石蜡包埋样本中的DNA。经聚合酶链式反应(polymerase chain reaction, PCR)扩增检测K-ras基因第2号外显子第12、13位密码子上的7种体细胞突变及B-raf基因15号外显子突变。
2 结 果
2.1 大体所见9例ATC肿物中,肿物最大径从约3 cm到大于10 cm,切面均呈灰白灰红,实性,可呈鱼肉样,部分病例可见囊性变、坏死及钙化,肿物未见明显包膜,分界不清。
2.2 镜检9例ATC的组织学主要由梭形细胞、上皮样细胞和多形性巨细胞构成,其中5例以上皮样细胞为主,上皮样细胞呈片状生长,细胞大、胞浆丰富,圆形或多边形,核大、空亮,核仁明显,瘤细胞排列为实性巢状或假腺样。3例以梭形细胞及巨细胞为主,梭形细胞呈束状或席纹状排列,瘤巨细胞散在分布其间,多少不等,部分肿瘤细胞间形成裂隙状或假血管样,似上皮样血管肉瘤。1例伴横纹肌样特征的ATC肿瘤细胞呈巢状、片状浸润性生长,瘤细胞散在分布,黏附性差,呈多边形或类圆形,胞质丰富,嗜伊红,胞质内见红染包涵体样物,核圆形、偏位,呈空泡状,核仁突出,核异型性明显,染色质不均匀,分裂象可见。ATC中多可见地图状坏死及中性粒细胞为主的炎细胞浸润(如图1)。9例中有2例以梭形细胞为主型和1例以上皮细胞为主型ATC伴经典的甲状腺乳头状癌(papillary thyroid carcinoma,PTC)成分。
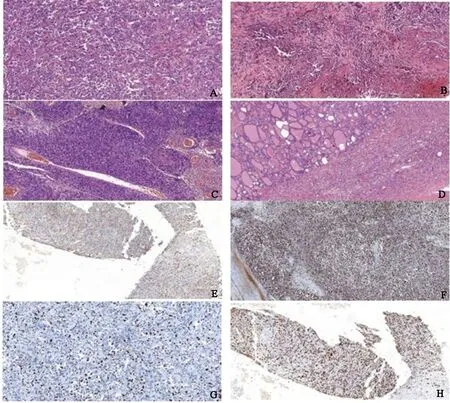
注:A为伴横纹肌样特征的ATC(HE,×200);B为上皮样ATC,可见坏死(HE,×200);C为梭形细胞为主的ATC,围血管生长,似血管肉瘤(HE,×200);D为ATC中可见PTC成分(HE,×200);E为CKpan肿瘤细胞阳性(EnVision,×200);F为Vimentin肿瘤细胞阳性(EnVision,×200);G为Ki67阳性率约30%(EnVision,×200);H为肿瘤细胞P53阳性率约80%,突变型(EnVision,×200)
2.3 免疫表型Vimentin 9例均阳性(100%),CK 4例阳性(44.4%),1例上皮样细胞为主型ATC其Vimentin、CK、TTF-1、CK19均阳性,1例伴横纹肌样特征的ATC示Vimentin、CK阳性,SMA、Desmin、Myogenin、HMB45等均阴性,CK阴性的5例ATC中3例均为上皮细胞为主型,TG、CT、TTF-1、CK19、CD34、S100、SMA、Desmin、Myogenin、HMB45等均阴性,且1例伴PTC成分,2例梭形细胞为主型ATC伴PTC成分。P53 2例错义突变、2例无义突变,突变率约44.4%,Ki67阳性率30%~80%(表2)。
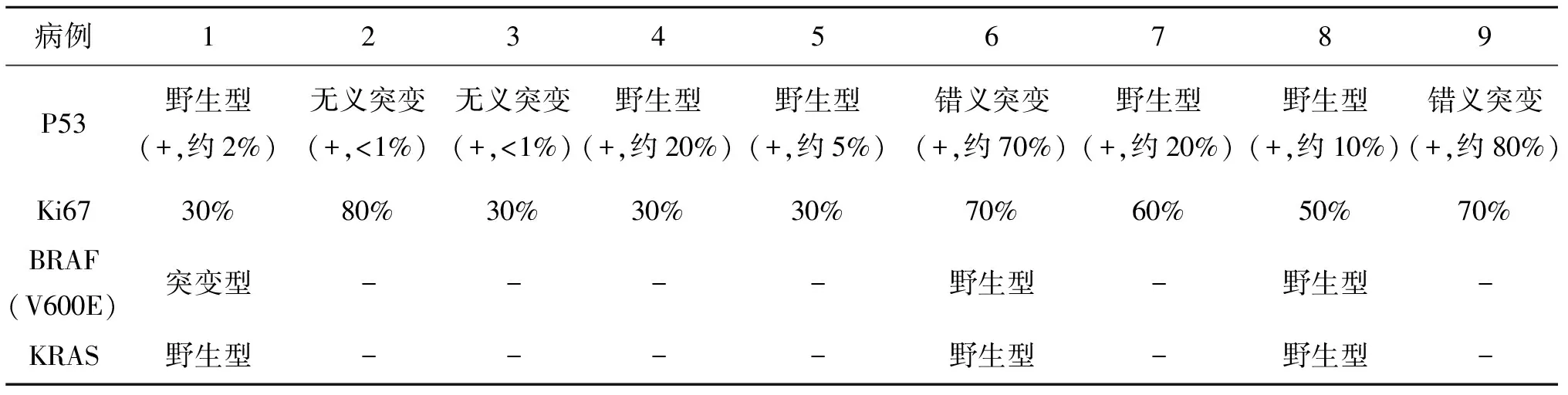
表2 9例ATC患者P53、Ki67、BRAF、KRAS的结果
2.4 RT-PCR结果对2018年4月至2022年2月收集的3例ATC样本行RT-PCR检查,BRAF V600E 1例阳性,2例阴性,KRAS 3例均为阴性。
2.5 随访9例ATC随访时间3~24个月,其中7例均出现复发,1例甚至出现骨转移。患者的生存期为1.3~24个月,2例失访。
3 讨 论
ATC是一种甲状腺滤泡上皮源性的恶性肿瘤,占甲状腺原发肿瘤的2%~5%,但其恶性程度高,致死率近乎100%。ATC多见于老年女性,中位年龄为71岁,临床多有甲状腺肿物史,主要表现为短期内迅速增大的颈部肿物,可出现声嘶、吞咽困难等症状,就诊时多已出现周围浸润、淋巴结及远处转移。本组9例病例中,女性患者4例,男性患者5例,其中一半有甲状腺肿物史,5例患者就诊时已有颈部周围浸润及淋巴结/远处转移。
ATC的镜下形态主要由梭形细胞、上皮样细胞及多核巨细胞混合组成,细胞异型性大,病理性核分裂多见,局灶见坏死。其他形态还包括小细胞型、少细胞型、破骨巨细胞型及横纹肌样多种类型。本组9例中5例以上皮样细胞为主,3例以梭形细胞及巨细胞为主型,1例伴横纹肌样特征。其中伴横纹肌样特征的ATC实为罕见,目前为止在国内仅有1例报道[1],国外也仅有少量病例[2-3]。对ATC亚型分类的认识有助于与其他疾病的鉴别诊断,而对患者的治疗预后等的临床意义有待进一步研究。ATC主要与甲状腺髓样癌、血管肉瘤、梭形细胞肉瘤、Riedel甲状腺炎等疾病相鉴别,前者Vimentin阳性、CK部分阳性,TG、TTF-1、CK19多为阴性,CD34、SMA、Desmin、Myogenin、S100、HMB45等均为阴性,结合形态学与免疫表型可以和其他病变相鉴别。研究显示Ki67表达在30%以上,本组病例中Ki67表达30%~80%,提示ATC的高增殖活性和恶性度,但未有研究显示其与ATC预后有明显相关性[4]。
ATC的危险因素包括长期的甲状腺肿、既往放化疗、PTC等分化好的癌的复发史等。ATC肿瘤发生机制尚不清楚,目前最普遍接受的理论是,大部分ATC由原有分化好的甲状腺癌(最常见的是PTC,其他如滤泡癌、低分化癌)多步骤去分化的结果,小部分ATC为原发肿瘤。本组9例ATC中有3例伴PTC,与多数研究一致,支持了上述理论。分子水平上,ATC中除了可有甲状腺分化性肿瘤常见的BRAF、KRAS基因突变外,新出现P53、TERT等基因突变[5-6],这与肿瘤去分化的晚期事件一致。ATC可以检测出BRAF突变[7-8],而且伴有PTC的ATC病例中BRAF的突变率更高。BRAF抑制剂也显示出一定的临床效果[7-9],给ATC患者带来了希望。PTC中KRAS基因突变率要低于BRAF[10],本组3例经RT-PCR检测的BRAF、KRAS突变结果中,只有1例显示BRAF突变,该例ATC无分化好的癌伴随,3例KRAS检测均为阴性。ATC与P53基因突变有显著相关性,而本组9例ATC中有2例显示错义突变,2例显示无义突变,突变率约44.4%。目前较为明确的是,ATC中TERT与PIK3CA的突变与患者的不良预后相关[6,11],有研究表明年龄也是ATC的独立危险因素,年龄>60的老年人比年轻者预后更差[12]。ATC的中位生存期为3~6个月,1年生存率为20%~60%,2年生存率为10%~15%,5年生存率不到10%[13-14]。本组ATC患者中位生存期为5个月,生存期在1.3~24个月之间,根治性手术总体上要高于局部手术的生存期[15]。BRAF基因突变等新的靶向药物(组合)通过分子水平研究的不断深入,将会给ATC患者带来更多获益[6-7,9]。

