放疗联合普瑞巴林治疗肝癌骨转移神经病理性疼痛的疗效及生存质量评价
童金龙,田小强,李英,鲁世慧,王礼学,王海玉
0 引言
神经病理性疼痛(neuropathic pain, NP)在肿瘤患者临床诊疗中较常见,研究[1-2]报道有33%的癌症患者伴有神经病理性疼痛,肿瘤侵犯骨骼浸润损伤神经,导致约20%~30.8%骨转移患者出现神经病理性疼痛,晚期肝癌患者易出现骨骼转移,转移部位多位于颈椎、胸腰椎、骶髂骨和肋骨,初诊肝癌骨转移发生率约为4.29%,骨转移确诊后3年生存率约为9.82%[3],骨转移瘤侵蚀临近组织及神经所致神经病理性疼痛,临床上表现为自发性疼痛、痛觉过敏、疼痛和感觉异常等,伴焦虑、抑郁和睡眠、肢体活动障碍,严重影响患者生存质量(quality of life, QOL)和心理状态。阿片类药物是控制癌痛的一线药物,但单用阿片类药物对于NP疗效不佳,且患者服用阿片类药物易出现恶心、呕吐、头昏、便秘等,放化疗也会增加神经病理性疼痛的发生率[4],因此癌性神经病理性疼痛仍是临床癌痛治疗的一大难题,且部分患者因达不到满意疗效而成为难治性疼痛。
肝细胞肝癌属于放疗敏感的肿瘤,α/β比值约为10,因此放疗是治疗肝癌骨转移的重要局部治疗手段,能有效抑制肿瘤增殖,缓解症状,减少骨相关不良事件。目前钙离子通道调节剂普瑞巴林已成为临床常用的治疗NP的一线止痛药物,具有镇痛、抗焦虑及抗惊厥作用[5],两者联合可以迅速控制癌痛,降低肿瘤负荷,对伴神经病理性疼痛的肝癌骨转移病灶的治疗具有显著优势。因此,南京中医药大学附属南京医院肿瘤一科采用放疗联合普瑞巴林治疗肝癌骨转移导致的神经病理性疼痛,取得快速缓解癌痛、改善情绪以及提高生存质量的效果。
1 资料与方法
1.1 入组患者
2021年1月至2022年6月期间在我院确诊为原发性肝细胞癌的患者,巴塞罗那分期C期(骨转移或伴有其他转移、门静脉浸润),原发性肝癌诊断符合2019年版我国制定的肝癌诊断规范,骨转移病灶经过CT或者MRI显像确诊,经临床讨论后决策对骨转移灶进行姑息性放疗。
1.2 入组标准及排除标准
入组标准需同时符合以下7项:(1)确诊为原发性肝细胞癌;(2)影像学证实可见的骨质破坏或骨质密度增高,伴或不伴有软组织肿块;(3)数字评定法(numerical rating scale, NRS)疼痛评分≥5(基于24 h内最严重疼痛);(4)符合国际疼痛学会神经病理性疼痛分级诊断标准:①疼痛区域符合躯体感觉神经的解剖分布;②病史提示周围感觉系统存在相关损害或疾病;③神经系统检查证实疼痛分布区域至少存在1项体征与神经损害或疾病相关;④至少1项辅助检查证实躯体感觉系统存在相关损害或疾病。同时符合上述①~④项标准,可确诊为NP;符合上述①、②、③或①、②、④标准,为很可能的神经病理性疼痛;符合上述①和②项标准,但缺乏体征及辅助检查的证据,为可能的NP[6];(5)神经病理性疼痛量表DN4(douleur neuropathique 4)评分≥4分[7];(6)预期寿命≥3月;(7)要求患者能够填写数据收集表并书面同意参加该项研究。
排除标准仅需符合以下1项:(1)骨转移病灶压迫脊髓或马尾神经;(2)待放疗区域曾经接受过放疗;(3)存在普瑞巴林的使用禁忌;(4)患者主诉神经性疼痛部位与骨转移灶不符或非骨转移引起的神经病理疼痛。
1.3 治疗方法
采用美国瓦里安Unique加速器及Eclipse计划系统实施放疗,运用热塑膜及体板固定患者体位,飞利浦Brilliance大孔径CT模拟定位,层厚5 mm,将定位CT图像传输至治疗计划系统,医生根据影像学特征勾画大体肿瘤体积(gross tumor volume, GTV)及临近危及器官,考虑肿瘤局部浸润、摆位误差及系统误差,GTV增加1.5~2 cm的边界成为计划靶区(planning target volume,PTV),对于椎骨病变,PTV包括受累椎骨和紧邻部分椎骨和脊髓。输入靶区处方剂量及危及器官限量,进行逆向调强计划,根据剂量体积直方图对计划进行优化。剂量分割方式分为常规分割和非常规分割(3~4.5 Gy/f),总剂量45~60 Gy,普瑞巴林均以初始75 mg,一天两次口服,止痛疗效欠佳,可增加至150 mg,一天两次,均辅以双磷酸盐修复骨破坏。
1.4 随访及观察指标
患者在基线、放疗后1个月、2个月进行规律随访,记录疼痛评分、止痛药摄入量,采用简明疼痛量表(brief pain inventory, BPI)行多维度疼痛评估[8],根据DN4量表内容进行问询和查体并评分,国际骨转移共识终点定义进行疼痛疗效判断,分为完全缓解(CR)、部分缓解(PR)、疼痛进展、不确定疗效[8],前两者定义为应答,后两者定义为未应答;欧洲癌症研究和治疗组织生存质量问卷EORTC QLQ-C30和QLQBM-22[9],分别评估放疗前基线和放疗后1个月、2个月的生存质量,极差化方法进行线性变换,将功能量表、症状子量表、整体健康状态初步得分(raw score,RS)转化为在0~100范围内取值的标准化得分(standard score, SS)。具体按照如下式公式计算(R为各领域或条目的得分全距),功能领域:SS=[1-(RS-1)/R]×100,症状领域和总体健康状况:SS=[(RS-1)/R]×100;中文问卷,在住院部或门诊以调查问卷书面形式完成,也可通过电话随访形式完成。
1.5 统计学方法
采用SPSS20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,多组间均数比较采用单因素方差分析,各指标治疗前后不同时间点比较采用重复测量的方差分析,两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线情况及生存质量问卷完成情况
入组32例肝癌骨转移患者,其中男26例、女6例,中位年龄54.2±10.6岁,伴神经病理性疼痛的骨转移灶共35枚,包括胸椎10枚、腰椎8枚、颈椎5枚、骨盆7枚、四肢4枚、头颅1枚;溶骨性、成骨性、混合性病灶病灶分别为14枚、6枚、15枚;伴软组织肿块24枚。32例患者中,体力状态评分≥70分为23例,<70分9例,口服靶向药物25例,接受免疫联合靶向药物治疗16例,所有患者均接受双磷酸盐修复骨质破坏,22例HBV病毒载量增高的患者接受抗病毒治疗。接受放射治疗的骨转移病灶直径为(3.8±1.5)cm,病灶体积(30.4±14.9)cm3,均行高度姑息放疗,平均剂量为50.6 Gy/2.25 Gy/24 f,生物等效剂量54.7±16.9 Gy10(α/β=10);颈胸椎及腰椎L1-3转移灶采用常规分割45~48 Gy/1.8~2 Gy/24~30 f或36 Gy/3 Gy/12 f;腰椎L4-5、骨盆、骶骨转移灶,采用60 Gy/2 Gy/30 f或60 Gy/3 Gy/20 f;颅骨及四肢转移灶,采用60 Gy/3 Gy/20 f或48 Gy/4 Gy/12 f;32例患者可供完整评估问卷,其中门诊和住院完成生存质量问卷30例,电话随访完成问卷2例。
2.2 放疗后疼痛评分变化
放疗前基线、放疗后1个月、放疗后2个月分别采用简易疼痛评估表评估24 h内最严重疼痛,数字疼痛评分均数分别为7.1±2.6、5.5±2.4、3.4±1.9,与基线比较,放疗后1个月、2个月的疼痛评分降低,组间比较差异均有统计学意义(P<0.05);基线及放疗后1个月、放疗后2个月神经病理性疼痛DN4评分均数分别为5.6±1.8、4.9±2.4、3.8±1.7,放疗前对比放疗后1个月、放疗后2个月DN4评分差异有统计学意义(P=0.016,P=0.002),见图1。
2.3 放疗后疼痛疗效评价
放疗结束后1个月评估35枚病灶,疼痛疗效评价客观缓解率为62.8%(22/35),CR为4/35(11.4%),PR为18/35(51.4%),而5枚病灶(14.3%)出现疼痛进展PD,8枚病灶(22.8%)出现疼痛不确定的响应。放疗后2个月,疼痛客观缓解率为68.6%(24/35),6枚病灶(17.1%)达到CR,18枚病灶(51.4%)PR。此时,4枚病灶(11.4%)表现出疼痛进展,7枚(20%)表现为不确定。
2.4 简易疼痛评估表评估生存质量变化
简易疼痛评估表多维度评估患者基线、放疗后1个月、放疗后2个月生存质量的七个项目,包括对日常生活、情绪、行走能力、日常工作、与他人关系、睡眠、生活兴趣的影响,见图2,其中情绪、与他人关系、正常生活三项评分改善显著(P<0.02),生活兴趣无明显改善(P=0.24),其余三项评分差异有统计学意义(P<0.05);放疗后1个月、2个月进一步多维度比较DN4评分≥4和DN4评分<4两组患者,除生活兴趣,DN4<4患者各项生存质量指标均优于DN4≥4患者,差异有统计学意义(P<0.05),放疗后2个月两组差异更显著(P<0.04)。
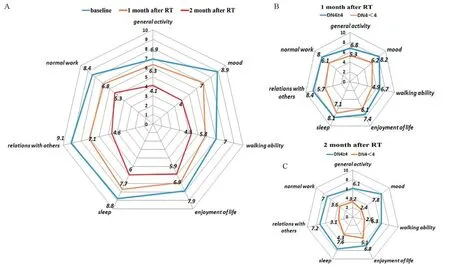
图2 简易疼痛评估表评估生存质量变化Figure 2 Changes in quality of life were assessed by brief pain inventory
2.5 放疗前后不同时间点的生存质量评价
与基线相比,在放疗后1 个月、2 个月EORTC QLQ-C30整体健康状况评分均有所增加(P=0.007),基线vs.放疗后1个月、基线vs.放疗后2个月的总体健康状况均数为40.7±16.2(0~67.9)vs.49.3±17.7(27~82.7)(P=0.035)和40.7±16.2(0~67.9)vs.66.2±22.9(34.6~90.4)(P=0.022)。放疗后第1个月功能量表中躯体、情感、社会、角色功能评分明显提高,与基线相比,差异均有统计学意义(P<0.04);症状量表疼痛,失眠、食欲降低评分均有降低,与基线比较,症状有所改善(P<0.05),疲倦症状加重(P<0.05);腹泻、便秘、经济困难与基线比较,差异无统计学意义;其次,放疗后2个月与放疗前相比,平均整体健康状况评分以及除认知功能之外的其他功能量表评分进一步升高,症状量表疼痛、失眠、食欲降低、呼吸困难评分进一步降低,提示放疗2个月后疼痛及直接相关症状进一步改善,腹泻、便秘、恶心和呕吐与放疗前比较,依旧无统计学意义,经济困难与放疗前比较评分上升,提示医疗费用支出增加,见表1。EORTC QLQ-BM22评估患者生存质量,疼痛部位、疼痛性质、功能障碍均有明显改善(P<0.05),见表2。放疗后1个月、2个月,与基线相比,疼痛部位、疼痛程度及功能障碍评分逐步增加,提示放疗联合普瑞巴林对骨转移相关的神经病理性疼痛控制有效,放疗后2个月社会心理评分降低明显,提示患者心理状态有改善的趋势(P=0.055)。
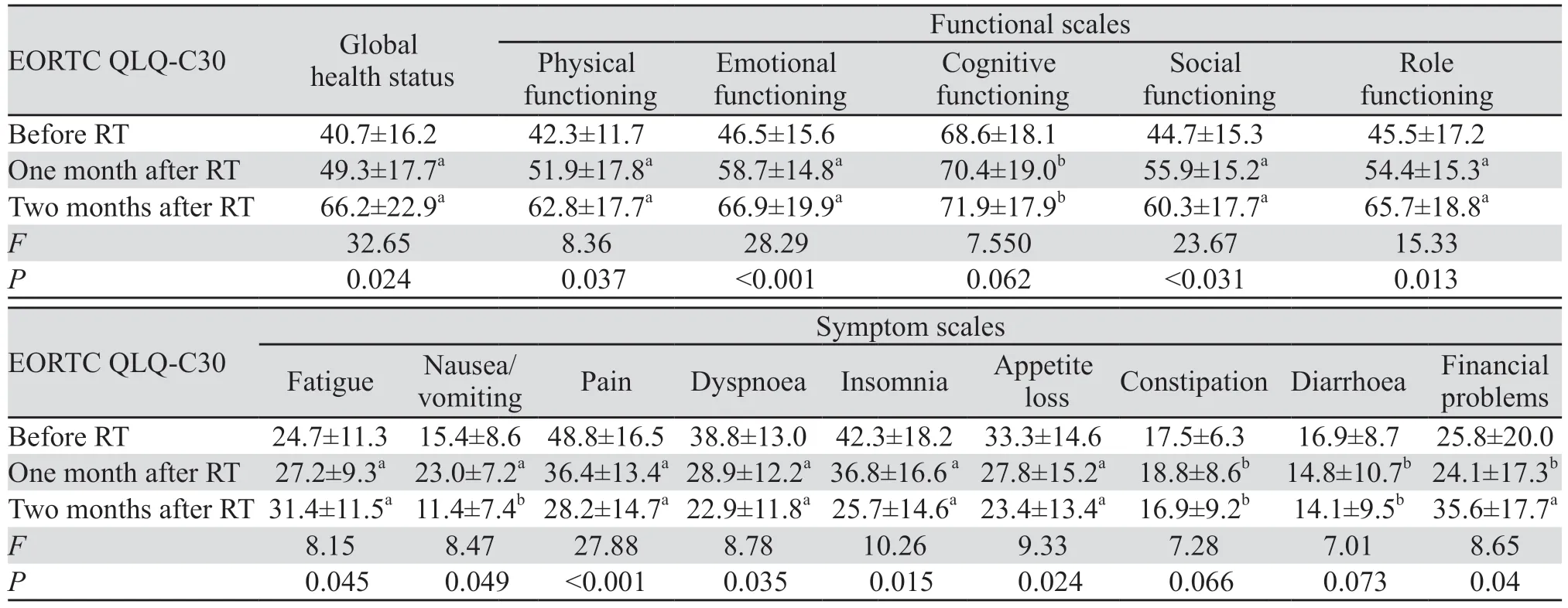
表1 放疗前后不同时间点EORTC QLQ-C30问卷评分Table 1 EORTC QLQ-C30 questionnaire score at different time points before and after radiotherapy
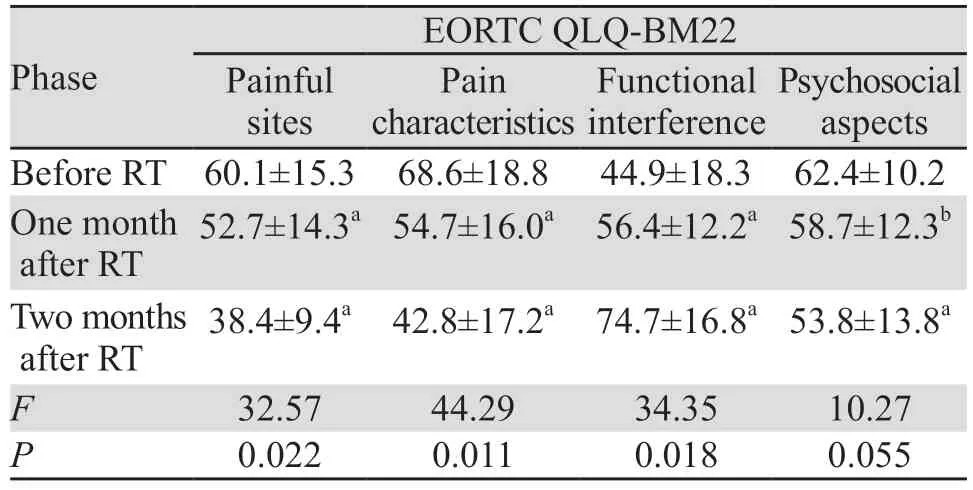
表2 放疗前后不同时间点EORTC QLQ-BM22问卷评分Table 2 EORTC QLQ-BM22 questionnaire score at different time points before and after radiotherapy
2.6 比较放疗后2个月神经病理性疼痛不同应答者生存质量评分变化
放疗后1个月,神经病理性疼痛应答者22例,包括CR 4例、PR 18例;疼痛无应答者10例;放疗后2个月,神经病理性疼痛应答者24例,包括CR 6例,PR 18例,疼痛无应答者8例。放疗后2个月,神经病理性疼痛不同应答者生存质量评分与基线的差值中位数的差异,见表3。放疗后2个月,疼痛应答患者表现出EORTC QLQ-C30情绪功能的显著改善(P=0.025)和躯体功能改善(P=0.029),症状量表中疼痛应答者表现出疼痛(P=0.014)和疲倦(P=0.035)显著改善。与疼痛无应答者相比,放疗后2个月应答者的疼痛部位(P=0.021)和疼痛程度(P=0.04)评分改善显著,社会心理方面改善无统计学意义。
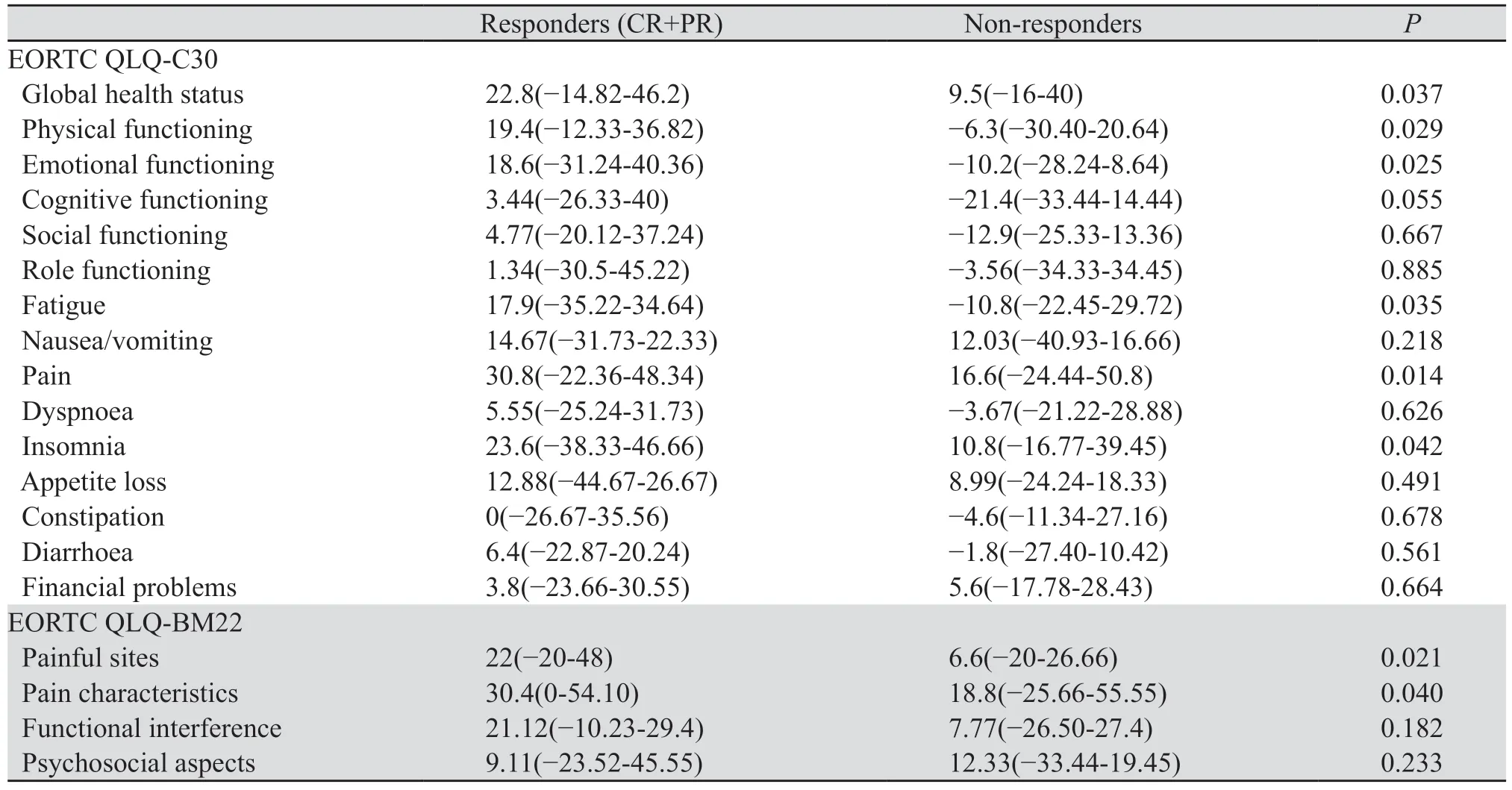
表3 放疗后2个月对疼痛不同反应患者的生存质量评分中位数比较Table 3 Comparison of median quality of life scores of patients with different pain responses two months after radiotherapy
3 讨论
骨转移是癌症相关疼痛的最常见原因,骨转移癌痛是一种复杂性疼痛,涉及伤害感受性和神经病理性疼痛,与运动和改变体位有关,强效阿片药物止痛效果欠佳。放射治疗是临床常用治疗肿瘤骨转移的有效手段,可以控制癌性疼痛,提高生存质量[10],但是采用放疗治疗骨转移神经病理性疼痛的报道不多。普瑞巴林是一种γ-氨基丁酸受体激动剂,作用于电压依赖性钙通道突触前α2-δ亚单位,抑制神经递质释放,降低痛觉敏化,提高痛觉阈值及疼痛耐受性,已为许多指南推荐为神经病理性疼痛的一线用药[11]。本研究采用姑息性放疗联合普瑞巴林治疗肝癌骨转移引起的中度至重度神经病理性疼痛,药物治疗和放射治疗优势互补,联合控制疼痛,具有良好的临床反应,本研究显示放疗后1个月神经病理性疼痛评估,CR为11.4%(4/35),PR为51.4%(18/35),NP4≥4分占比为40%(14/35),放疗后2个月疼痛评估,CR为17.1%(6/35),PR为51.4%(18/35),NP4≥4分占比为25.7%(9/35),治疗后1个月的NP缓解率为62.5%,治疗后2个月NP缓解率为68.6%,联合治疗结果略优于过往研究中单纯采用放疗控制骨转移疼痛的客观缓解率[12-13]。
对于晚期肿瘤患者,治疗目标旨在改善或维持生存质量,而不是传统的生存指标。与伤害刺激引起的疼痛相比,神经病理性疼痛对患者的身体和心理健康损害更大,因此,更加需要关注伴有神经病理性疼痛患者生存质量的改善和维持[14]。针对骨转移患者的生存质量评估,临床多采用EORTC QLQ-C30量表从功能和症状多角度评估生存质量,QLQ-BM22量表是特定针对骨转移患者生存质量评估模块,具有较高的敏感度和特异性[15]。
晚期肝癌骨转移放疗后提高生存质量是治疗的目标,针对骨转移神经性疼痛进行放疗后生存质量评估的研究不多。 Cacicedo等[16]前瞻性研究姑息性放疗联合他喷他多治疗17例骨转移患者所致中/重度神经病理性疼痛的止痛疗效和生存质量,放疗后1个月的缓解率为62.5%,18.8%达到CR,43.8%达到PR,放疗后2个月的缓解率为50%,CR率为10%,PR率为40%。疼痛应答患者在放疗1个月后EORTC QLQ-C30情绪功能(P=0.025)和疲劳症状量表评分(P=0.035)有显著改善,放疗后2个月QLQ-BM22量表疼痛部位评分改善(P=0.024),认为姑息性放疗联合他喷他多可成为骨转移伴NP的临床治疗选择。Mendez等[9]采用QLQ-BM22量表前瞻性研究治疗有效的25例疼痛性骨转移患者的生存质量变化,对比基线和放疗后2个月,疼痛部位(39降至27)、疼痛特征(61降至37)、功能干扰(49升至70)评分差异均有统计学意义(P<0.05),但心理社会方面(57升至59)无显著改善;QLQ-C30量表显示,除了疼痛评分中位值下降33分(66降至33),其他功能及症状评分差异均无统计学意义,结论显示疼痛性骨转移接受放疗2个月后,疼痛应答者在EORTC QLQ-C30和QLQ-BM22疼痛领域有所改善,QLQ-BM22量表的功能障碍也有所改善。
Koufopoulou等[17]综述多项研究结果显示,采用放疗治疗骨转移,疼痛症状和功能障碍均显著改善,其中10项研究均显示,疼痛应答者的生存质量显著提高,优于非应答者。Cañón等[18]研究结果显示,除了睡眠,放疗疗效与其他症状改善存在显著相关性。与≤75岁患者相比,>75岁的患者在日常活动、情绪和与他人的关系方面表现出更显著的改善,基线疼痛≥8分的患者在日常活动项目中表现出更好的改善(P=0.049);姑息性放疗后疼痛应答者在身体和社会心理方面,表现出更好的生存质量;本研究结果同样显示,疼痛应答者、DN4<4分患者,多维度、多指标的生存质量评分均优于疼痛无应答者及DN4≥4分患者。
综上所述,普瑞巴林作为治疗神经病理性疼痛的一线用药,对骨转移神经病理性疼痛疗效肯定,且有助于改善患者心理状态,与放疗联合,既能有效抑制肿瘤增殖,亦可以控制肿瘤或(和)放疗导致的神经病理性疼痛。单一手段治疗骨转移伴神经病理性疼痛效果尚不够满意,联合有效镇痛、抑制肿瘤是控制该类型神经病理性癌痛的趋势。本研究显示放疗联合普瑞巴林在控制骨转移神经病理性疼痛中的有效性和优势,也为肿瘤临床工作中处理骨转移神经病理性疼痛提供新的思路。
利益冲突声明:
所有作者均声明不存在利益冲突。

