基于FAERS 数据库对拉罗替尼药品不良事件信号的挖掘与分析
杨琤琤,陈慧慧,张晶敏
拉罗替尼是一种神经营养酪氨酸受体激酶(neurotrophic tyrosine receptor kinase,NTRK)的选择性抑制剂,可用于治疗携带NTRK基因融合的实体肿瘤[1]。拉罗替尼于2018 年11 月26 日获美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市。2022 年4 月13 日该药在我国上市,用于治疗携带NTRK基因融合的成人和儿童局部晚期或转移性实体瘤,对携带NTRK基因融合突变的肿瘤均有效[2-3]。药品说明书中拉罗替尼的不良反应主要是疲劳、恶心、头晕、呕吐、咳嗽、氨基转移酶升高、便秘和腹泻等[1]。该药品在我国基于替代终点获得附条件批准上市,暂未获得临床终点数据,其安全性和有效性尚待上市后进一步确证。作为我国新上市的药品,其在我国上市后的安全性数据较少,药品安全性的现状仍有待进一步挖掘与探索。本研究基于美国食品药品监督管理局不良事件报告系统(FDA Adverse Event Reporting System,FAERS)数据库对拉罗替尼相关不良事件(adverse event,AE)进行数据挖掘,分析患者的药物使用情况和AE 记录,探索真实世界应用拉罗替尼的安全性数据,为临床医生安全应用拉罗替尼提供参考。
1 资料与方法
1.1 资料来源
以“larotrectinib”“Vitrakvi”为检索词,收集FAERS 数据库(https://open.fda.gov/)2019年第1 季度~2022 年第4 季度的拉罗替尼相关AE 报告,将美国信息互换标准代码(American standard code for information interchange,ASCII)数据包导入SAS,参考FDA 的建议进行数据清洗,即依据人口统计和管理信息(DEMO)表中案例编号(CASEID)、FDA 收到报告日期(FDA_DT)和唯一主标识码(PRIMARYID)作为关键指标来删除重复记录。当CASEID 相同时选择最新的FDA_DT,当CASEID 和FDA_DT 相同时选择更大值的PRIMARYID。同时删除了每个季度FDA发布的错误报告,最大限度地保证了报告的准确性。
1.2 数据处理
采用监管活动医学词典26.0(Medical Dictionary for Regulatory Activities 26.0,MedDRA v26.0,https://tools.meddra.org/wbb)中的优选术语(preferred term,PT)和系统器官分类(system organ class,SOC)对收集到的拉罗替尼相关AE 报告进行标准化。
1.3 信号检测方法
从AE 报告中提取患者性别、年龄、拉罗替尼使用情况、AE 发生结局、报告者情况等信息进行描述性统计。采用报告比值比(reporting odds ratio,ROR)法挖掘拉罗替尼AE 风险信号[4-5],基于比值失衡测量法四格表(表1)和公式(1)进行计算,其中a 表示目标药品目标AE 报告例数,b表示目标药物其他AE 报告例数,c 表示其他药物目标AE 报告例数,d 表示其他药物其他AE 报告例数;基于公式(2)计算ROR 的95%置信区间(confidence interval,CI)。

表1 基于比例失衡测量法四格表 例
参考既往研究[6-7],本研究将AE 报告例数≥3 例、ROR 的95%CI下限>1 作为阳性信号生成条件,满足上述条件提示药品与目标AE 具有统计学关联。ROR 值越大,AE 信号越强,说明目标药品与目标AE 之间的统计学关联越强[8]。每个PT 均根据MedDRA v26.0 注明其对应的SOC,将二者合并后删除重复PT,根据最终获得的PT 分析拉罗替尼相关AE 累及SOC 以及AE 信号强度,并对照药品说明书筛选未记载的新的不良反应风险信号。
2 结果
2.1 AE 报告的基本情况
2019 年第1 季度~2022 年第4 季度 FAERS共收到AE 报告6 322 279 例(去重后数据)。经过筛选,以拉罗替尼为首要怀疑药品的AE 报告共有479 例,其中以女性患者居多;各年龄段均有病例分布,排除年龄不详的病例,平均年龄(51.43±21.65)岁;不同年龄段中报告例数以成人(18~64 岁)报告居多(124 例,25.89%);报告年份中,2021 年报告数最多;报告国家中,以美国报道居多(290 例,60.54%),我国报告例数为9 例;报告者身份中,专业人士(如医师、药师、专业健康人员、其他健康专家)占比较多(357 例,74.53%);AE 结局中,严重AE 的发生率达33.61%,包括死亡、危及生命、残疾、住院或住院时间延长(表2)。
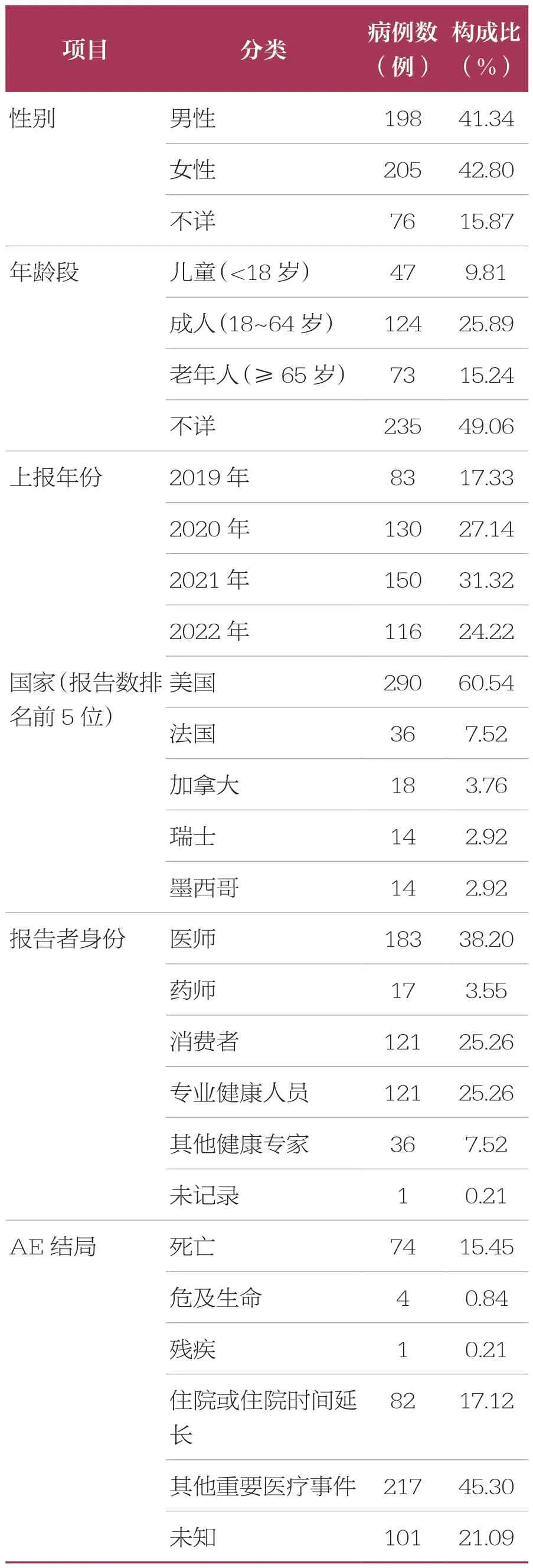
表2 拉罗替尼AE 报告的基本信息 n=479
2.2 信号挖掘结果
479 例AE 报告涉及472 个PT,累及21 个SOC。采用 ROR 法进行计算,获得38 个阳性信号PT,累及14 个SOC(表3 和表4)。其中,信号强度较高的前3 位SOC 为肝胆系统疾病(ROR=2.73,95%CI=1.86~4.00)、各类神经系统疾病(ROR=2.21,95%CI=1.89~2.58)、血液及淋巴系统疾病(ROR=1.39,95%CI=0.96~2.02)(表3)。

表3 ROR 法检测出阳性信号的拉罗替尼累及SOC 的AE 报告数及信号强度(以AE 信号强度由高到低排序)

表4 ROR 法检测出阳性信号的拉罗替尼涉及PT 的AE 报告数和信号强度(以AE 信号强度由高到低排序)
我国药品说明书中未提及的新的不良反应的PT 为耐药、肾功能损害、戒断综合征、细胞死亡、胆汁淤积、血胆红素升高和多器官功能不全综合征,其中涉及耐药、肾功能损害、戒断综合征的AE 报告共有22 例,在新的不良反应PT 中占64.7%;累及SOC 为5 个,包括全身性疾病及给药部位各种反应、肾脏及泌尿系统疾病、代谢及营养类疾病、肝胆系统疾病和各类检查。按AE 信号强度排序,居前10 位的PT 为偏侧感觉缺失、细胞死亡、耐药、周围神经病、肝功能异常、皮肤敏感、血碱性磷酸酶升高、肝酶升高、胆汁淤积和肝细胞损伤,累及SOC 包括各类神经系统疾病、代谢及营养类疾病、各类检查、全身性疾病及给药部位各种反应、皮肤及皮下组织类疾病和肝胆系统疾病。信号强度排名前10 位的PT 中,新的不良反应的PT 有3 个,分别为细胞死亡(ROR=72.81,95%CI=23.39~226.66)、耐 药(ROR=12.58,95%CI=6.27~25.21)、胆汁淤积(ROR=8.12,95%CI=2.62~25.23),累及SOC 共3 个,分别为代谢及营养类疾病、全身性疾病及给药部位各种反应和肝胆系统疾病(表4)。
3 讨论
本研究基于FAERS 数据库共筛选到以拉罗替尼为首要怀疑药品的AE 报告479 例,在治疗结局中,严重AE 结局的发生率达33.61%。根据以往研究[9-10],大多数患者对拉罗替尼耐受性较好,只有部分患者需要减少剂量以降低AE 的发生风险。目前已知的拉罗替尼相关严重AE 包括贫血、天冬氨酸转氨酶(aspartate transaminase,AST)和丙氨酸转氨酶(alanine transaminase,ALT)水平升高、体重增加和中性粒细胞计数减少。目前FAERS 数据库报告例数有限,严重AE 结局与拉罗替尼的使用相关性还需进一步证实。采用 ROR 法进行计算,共挖掘到38 个阳性信号PT,累及14 个SOC。主要累及SOC 包括各类神经系统疾病、代谢及营养类疾病、各类检查、全身性疾病及给药部位各种反应、皮肤及皮下组织类疾病和肝胆系统疾病;在SOC 中,肝胆系统疾病的信号强度(ROR=2.73,95%CI=1.86~4.00)是最高的,其次为各类神经系统疾病(ROR=2.21,95%CI=1.89~2.58);各类神经系统疾病的报告数较多(184 例,38.41%),肝胆系统疾病的报告数较少(27 例,5.64%),提取到的系统风险信号与我国说明书记载是一致的。值得注意的是,根据信号挖掘结果,38 个阳性信号PT 中,信号强度前10 位分别为偏侧感觉缺失、细胞死亡、耐药、周围神经病、肝功能异常、皮肤敏感、血碱性磷酸酶升高、肝酶升高、胆汁淤积和肝细胞损伤,其中3 个为新的不良反应,即细胞死亡(ROR=72.81,95%CI=23.39~226.66)、耐药(ROR=12.58,95%CI=6.27~25.21)、胆汁淤积(ROR=8.12,95%CI=2.62~25.23)。风险信号较强的AE 可能在一定程度上影响药品的治疗过程,因此拉罗替尼AE 的发生仍需进一步的探讨。
原肌球蛋白受体激酶(tropomyosin receptor kinase,TRK)蛋白TRKA、TRKB、TRKC 通常在神经组织中表达[9],分别由NTRK1、NTRK2、NTRK3基因编码,其相关信号通路在神经元的发育和分化中具有重要作用。TRK 蛋白可与神经营养因子结合,进而诱导TRK 受体二聚体化、磷酸化,NTRK1、NTRK2、NTRK3基因发生融合可导致TRKA、TRKB、TRKC 受体结构激活,这种融合突变导致的激活是多数肿瘤的致癌因素。拉罗替尼是NTRK基因的抑制剂,可抑制TRK 蛋白的表达,进而影响相关信号通路,这种影响可能导致头晕、体重增加、步态不稳、味觉障碍等不良反应[10-11]。本研究中,各类神经系统疾病的信号强度较高,且报告例数较多,这可能与拉罗替尼抑制NTRK基因,进而抑制TRK 蛋白表达的药理作用机制有关。
拉罗替尼主要由CYP3A4 酶代谢,该药动学特点可能是导致其肝脏系统不良反应的原因。轻度(Child-Pugh A 级)、中度(Child-Pugh B 级)和重度(Child-Pugh C 级)肝损害患者的拉罗替尼暴露可分别使血药浓度增加至健康人群的1.3、2倍和3.2 倍;对于中度至重度肝损害患者,拉罗替尼的起始剂量应降低50%。拉罗替尼最常见(频率≥20%)的不良反应为AST 升高、ALT 升高等,这也是与拉罗替尼相关的最常见的较严重的AE 之一[12]。有文献报道[13],患者一般在用药前3 个月出现AST 或ALT 升高,有部分使用拉罗替尼的患者因AST 升高(4%)和ALT 升高(6%)而调整了剂量,这与本研究结果一致。另外,本研究结果显示,肝胆系统疾病信号中的胆汁淤积、血胆红素的指标升高是我国药品说明书中未记录的AE,提示在临床使用拉罗替尼过程中,除了肝酶情况,其他的肝功能检查指标也应给予重视。
在一篇关于新药拉罗替尼的文献中提到,长期应用该药的安全性仍未知,肿瘤可能对其产生耐药[14]。根据本研究结果,耐药是所有新发现PT 中信号强度较强的,通过分析这部分患者的相关信息发现,耐药诱导时间最短28 天,最长665 天,因数据挖掘中发生耐药的报告数仅8 个,且多数未记录AE开始时间,因此耐药诱导时间的分析仍需要更多的数据支持。本研究通过对FAERS 数据库拉罗替尼AE 信号的数据挖掘和分析,还发现肾功能损害、戒断综合征等新的不良反应。根据拉罗替尼的药动学特点(即39%在尿液中被排泄,其中20%以原型排泄[13]),应用该药品可能影响患者肾功能,同时肾功能的改变可能影响血药浓度,因此在应用该药品时应关注肾功能相关指标,如尿常规、肾小球滤过率等,但这还需要进一步开展前瞻性临床研究以确定其相关性。拉罗替尼发生的其他不良反应,如细胞死亡、多发性骨折、器官衰竭等均可导致较严重的后果,在用药过程中也需要提高重视。
本研究受限于FAERS 数据库,可能存在种族偏倚的情况。但拉罗替尼导致的多数常见AE 与其作用机制及药动学特点相关,因此本研究结果对于指导我国患者应用该药仍具有参考意义。拉罗替尼在我国上市时间短,相关AE 报道较少,挖掘该药可能导致的AE 有利于保障患者安全用药,同时我国人群的真实世界研究还需要持续关注,在临床用药过程中应进一步提高不良反应上报意识,保障临床安全合理用药。

